树鼩CD4蛋白多克隆抗体的制备及检测
卢孔杰, 徐婧雯, 张雪梅, 吴忠香, 任芳芳,马 娜, 巩 蔚, 严丽蔚, 朱文兵, 董少忠(中国医学科学院/北京协和医学院医学生物学研究所,云南省重大传染病疫苗研发重点实验室, 昆明 650118)
·论 著·
树鼩CD4蛋白多克隆抗体的制备及检测
卢孔杰, 徐婧雯, 张雪梅, 吴忠香, 任芳芳,马 娜, 巩 蔚, 严丽蔚, 朱文兵, 董少忠
(中国医学科学院/北京协和医学院医学生物学研究所,云南省重大传染病疫苗研发重点实验室, 昆明 650118)
目的 原核表达、纯化树鼩CD4蛋白并制备多克隆抗体,检测树鼩体内的CD4蛋白。方法 克隆树鼩CD4基因并连接到表达载体,构建重组质粒pET30a(+)-CD4和pGEX-5X-1-CD4,表达并纯化重组蛋白His-CD4和GST-CD4,用不同佐剂[弗氏佐剂、MF59和Al(OH)3]制备多抗,用Western blot法检测血清抗体特异性。 结果 蛋白表达产物His-CD4和GST-CD4的相对分子质量分别约为53.5×103和70.0×103, 纯化后蛋白浓度分别为600 μg/mL和1 mg/mL; 三组佐剂均能诱导产生抗体,抗体几何平均滴度(Geometric Mean Titer, GMT)的比较结果为: 弗氏佐剂组(GMT:97 420)>Al(OH)3佐剂组(GMT: 67 202)>MF59佐剂组(GMT: 55 128); 其中弗氏佐剂组显著高于原蛋白组(P<0.001); Al(OH)3组显著高于原蛋白组(P<0.01); 而MF59组显著高于原蛋白组(P<0.05)。结论 制备了特异性良好的小鼠抗血清,能够特异性地结合树鼩的CD4蛋白。为下一步本实验室制备CD4单克隆抗体、CD4蛋白分子的功能研究以及树鼩的病毒感染模型等免疫相关实验的进行提供了基础。
树鼩; CD4蛋白; 表达; 纯化; 多克隆抗体
树鼩(Tree shrew,Tupaia belangeri)是一种生活在东南亚各国,外形酷似松鼠的哺乳纲攀鼩目树鼩科小型动物[1]。近几年,树鼩在肝炎病毒、肠道病毒71型、轮状病毒以及流感病毒等疾病病毒感染的动物模型中正被逐渐地重视[2,3]。
在机体的整个免疫系统中,白细胞分化抗原4(cluster of differentiation 4, CD4)分子起着重要作用。CD4分子主要表达于辅助性T淋巴细胞(T helper cells, Th)的细胞膜上,其胞外区识别、结合主要组织相容性复合体II类分子(major histocompatibility complex class II,MHCII),增强T细胞抗原受体(T cell receptor,TCR)与MHCII类分子结合的稳定性;胞内区含有酪氨酸蛋白激酶,增强白细胞分化抗原3(cluster of differentiation 3,CD3)转导的活化信号。同时C D 4分子是人类免疫缺陷病毒(human immunodeficiency virus, HIV)识别的靶点,HIV通过结合CD4分子侵入CD4+Th细胞,造成免疫系统功能损伤[4-6]。
关于人的CD4蛋白的基本分子特征已被详尽了解,同时相应的CD4蛋白的多克隆抗体和单克隆抗体已商业化并得到广泛应用。树鼩作为众多疾病的研究模型,关于树鼩CD4分子的信息鲜有报道,故本文以该CD4分子为切入点,将数据库中理论的CD4序列进行了克隆,同时表达和纯化了树鼩CD4蛋白, 验证了数据库中的序列。这对后续树鼩CD4蛋白结构功能的研究, 以及验证是否与人的CD4蛋白有一样的功能提供了重要的基础。同时。本实验用不同佐剂跟CD4蛋白组合免疫BALB/c小鼠,制备多克隆抗体,并对各组血清抗体效价进行统计来比较不同佐剂对CD4蛋白诱导的抗原特异性体液免疫应答的增强效应。CD4蛋白多克隆抗体的制备为后续单克隆的制备,CD4+T淋巴细胞的分选以及CD4分子检测提供了很大的帮助。
1 材料和方法
1.1 材料
1.1.1 菌株及质粒 大肠埃希菌BL21、BL21(DE3)、原核表达载体pGEX-5X-1和pET30a(+)由中国科学院医学生物学研究所保存。
1.1.2 主要试剂 RNA逆转录试剂盒Prime Script 1st Strand cDNA Synthesis Kit、ExTaq DNA 聚合酶、限制性内切酶EcoRI-HF、XhoI、T4 DNA连接酶和DNA marker均购自宝生物工程(大连)有限公司; Fast Start High Fidelity PCR System,dNTPack 购自昆明滇工科技有限公司; 植物血球凝集素(phytohaemagglutinin, PHA)、异丙基-β-D-硫代半乳糖苷(IPTG)和二硫苏糖醇(DTT)均购自美国Sigma公司; Glutathione Sepharose 4 Fast Flow和His trap FF 购自美国GE公司; HRP标记的山羊抗小鼠二抗购自美国Pierce公司; 酵母粉、胰蛋白胨、NaCl等均为国产试剂。
1.1.3 实验动物 清洁级BALB/c小鼠来源于中国医学科学院医学生物学研究所(花红洞)[SYXK(滇)K2013-0008];树鼩来源于医学生物学研究所树鼩种质资源中心[SCXK(滇)K2013-0001]。其中BALB/c小鼠为6~8周龄雌性小鼠, 体质量18~20 g。并分成5组, 每组7只: 对照组、MF59佐剂组、Al(OH)3铝佐剂组、原蛋白组(不加佐剂)、弗氏佐剂组。所有实验动物按实验动物使用的3R原则给予人道的关怀。
1.2 方法
1.2.1 树鼩CD4目的片段的获取 根据NCBI中已有树鼩 CD4 序列 (http://www.ncbi.nlm.nih.gov/ nuccore/JN657224.1),利用Signal P 4.1 Server 进行CD4信号肽的预测,获得不含有信号肽序列的CD4序列,并设计包含质粒[pGEX-5X-1和pET30a (+)]的EcoRI和XhoI酶切位点引物,序列如下:上游引物: 5'-CCGGAATTCAAGGAGGTCGTACTGAGCAGA-3'; 下游引物: 5'-CCGCTCGAGTCACATGAGACTACATGTCTTCTGAA-3'。采集树鼩外周血1 mL, 分离外周血单核淋巴细胞,经PHA刺激24 h后,Trizol 法提取细胞总RNA,反转录合成cDNA,以其为模板进行PCR扩增。PCR产物经TA克隆插入 pMD-19T载体后,转化大肠埃希菌DH5α感受态细胞,提取质粒进行双酶切鉴定,并送公司进行双向测序。
1.2.2 两种重组表达质粒的构建 用EcoRI和XhoI分别双酶切上述测序正确质粒、质粒pGEX-5X-1 和pET30a(+),回收目的基因片段和载体片段,分别以T4 DNA连接酶16 ℃连接过夜。将连接产物分别转化至大肠埃希菌DH5α感受态细胞,提取质粒进行双酶切鉴定并测序。测序结果正确的质粒分别命名为pGEX-5X-1-CD4和pET30a-CD4。
1.2.3 目的基因的诱导表达 将测序正确的质粒pGEX-5X-1-CD4和pET30a(+)-CD4分别转化至大肠埃希菌BL21和BL21(DE3)感受态中,分别在氨苄和卡那霉素培养平板上培养。随机挑取单菌落,接种于3 mL LB培养基中,37 ℃振荡培养过夜; 次日, 分别按1∶50和1∶100的比例接种于10 mL LB液体培养基中,培养至A600: 0.4~0.6,加入终浓度1.0 mmol/L IPTG, 20 ℃诱导3 h(pGEX-5X-1-CD4)和37 ℃诱导3 h(pET30a(+)-CD4),离心,收集菌体,超声破碎,用质量分数12%的SDS-PAGE分析目的蛋白表达情况。
1.2.4 重组蛋白的纯化
1.2.4.1 GST-CD4 重组蛋白的纯化 20 ℃, 220 r/min,诱导3 h后,收集菌体,超声破碎,离心取上清,0.45 μm过滤上清, 上柱(Glutathione Sepharose 4 Fast Flow)结合,再用谷胱甘肽洗脱液洗脱目的蛋白,收集洗脱液,用超滤管换液浓缩,测浓度并取样进行SDS-PAGE分析。
1.2.4.2 His-CD4 重组蛋白的纯化 37 ℃, 220 r/min,诱导3 h后,收集菌体,超声破碎,离心取沉淀,2 mol/L尿素清洗包涵体,利用8 mol/L尿素变性,离心取上清, 0.45 μm过滤上清, 上柱His trap FF结合, 用咪唑梯度洗脱目的片段, 收集洗脱液, 用超滤管换液浓缩,测浓度并取样进行SDS-PAGE分析。
1.2.5 小鼠抗CD4血清的制备
1.2.5.1 动物免疫 BALB/c小鼠随机分成5组:对照组、MF59佐剂组、Al(OH)3铝佐剂组、原蛋白组(不加佐剂)、弗氏佐剂组, 每组7只。以融合蛋白GST-CD4作为免疫原, 免疫剂量为20 μg/只,重组蛋白溶液与佐剂体积为1∶1。MF59佐剂组采用肌肉注射,其余组均采用背部皮下注射,分别于第0、2、4周免疫小鼠,每次免疫后2周,经尾部取血,分离血清,检测血清效价。
1.2.5.2 血清抗体效价的检测 采用间接ELISA法, 用融合蛋白His-CD4包被酶标板,每孔100 μL,每孔66 ng蛋白,4 ℃过夜;用BSA室温封闭1 h;加入梯度稀释的抗血清,室温作用1 h; 加入HRP标记的山羊抗鼠IgG (1∶5 000稀释); 加显色液、终止液,酶标仪检测A450值。
1.2.5.3 血清抗体特异性的检测 采用Western blot法: GST-CD4、His-CD4、GST标签蛋白、树鼩淋巴细胞样品、猕猴淋巴细胞样品、人淋巴细胞样品、大鼠淋巴细胞样品和小鼠淋巴细胞样品分别经SDS-PAGE分离后, 电转移至聚偏氟乙烯(Polyvinylidene fluoride,PVDF)膜上,以制备的抗血清为一抗(1∶2 000稀释), HRP标记的山羊抗鼠IgG (1∶5 000稀释)为二抗进行检测,并设定β-actin (一抗比例1∶1 000,二抗比例1∶5 000)为内参。
2 结果
2.1 目的片段的获取及其两种重组表达质粒的鉴定
如图1A、B、C所示,目的片段的扩增(泳道1)、两种重组表达质粒pGEX-5X-1-CD4双酶切产物(泳道2)和pET30a(+)-CD4双酶切产物(泳道3)经琼脂糖凝胶电泳分析,均可见约1 290 bp的特异片段,大小均与预期相符。
2.2 表达产物的鉴定
SDS-PAGE分析显示,如图2-A所示,pGEX-5X-1-CD4/BL21诱导表达的重组蛋白GST-CD4可在上清中可溶性表达(3、5、7、9、11分别对应诱导后1 h、2 h、3 h、4 h、5 h菌体超声上清;4、6、8、10、12分别对应诱导后1 h、2 h、3 h、4 h、5 h菌体超声沉淀), 并且GST-CD4蛋白的相对分子质量(Mr)约为70.0×103。如图2-B所示,pET30a(+)-CD4/BL21 (DE3)诱导表达的重组蛋白His-CD4以包涵体形式存在(16、18、20、22分别对应诱导后2 h、3 h、4 h、6 h菌体超声沉淀; 15、17、19、21分别对应诱导后2 h、3 h、4 h、6 h菌体超声上清),并且His-CD4蛋白相对分子质量约为53.5×103,大小与预期相符。
2.3 纯化产物的鉴定
如图3所示,SDS-PAGE分析显示,纯化的重组蛋白His-CD4 (泳道1)和重组蛋白GST-CD4(泳道2)相对分子质量分别约为53.5×103和70.0×103,纯化的His-CD4和GST-CD4重组蛋白大小与预期相符。
2.4 小鼠抗CD4血清的鉴定
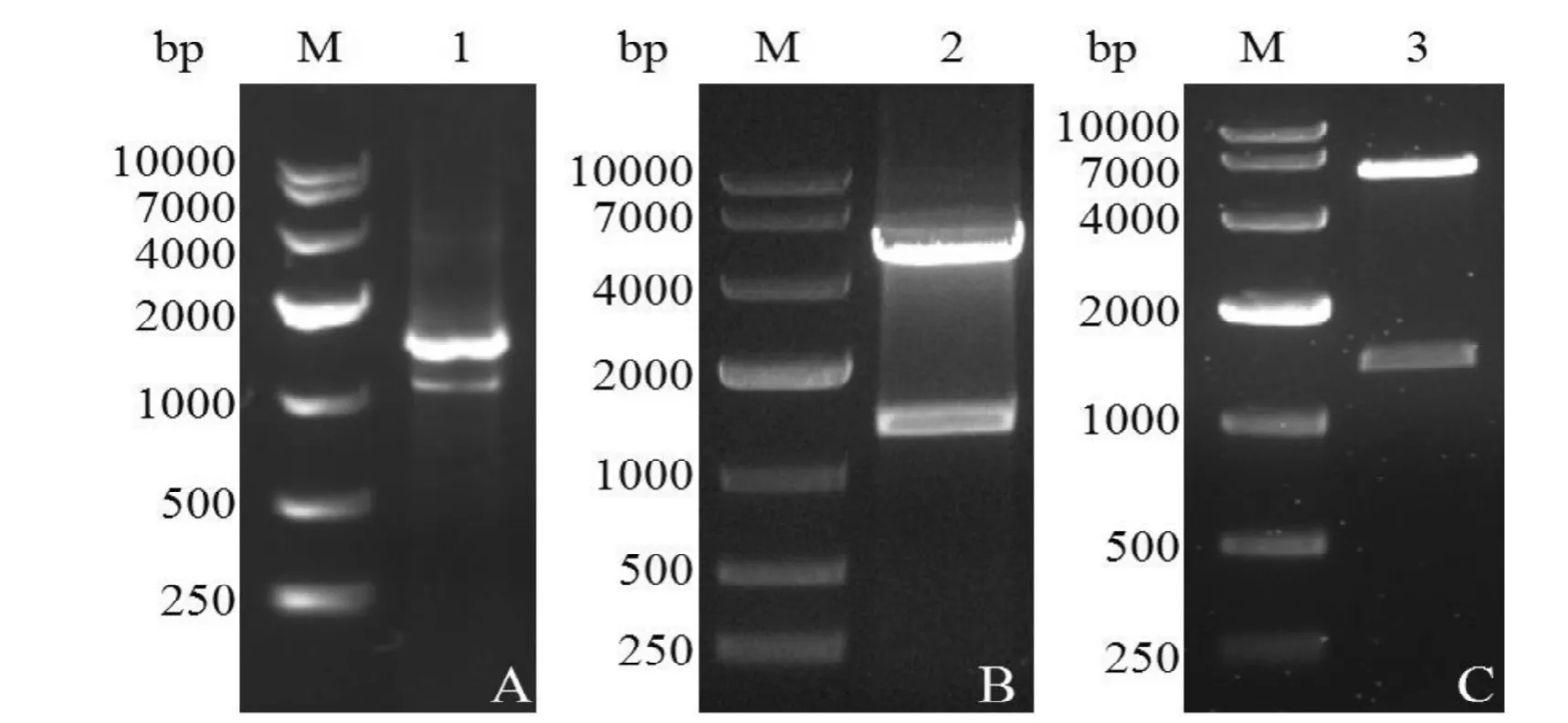
图1 CD4目的片段的PCR产物以及载体双酶切 (EcoRI/XhoI) 鉴定Figure 1 The PCR products of CD4 and double enzyme digestion analysis of recombinant plasmid (EcoRI/XhoI)
2.4.1 血清抗体效价 每次免疫后2周,经尾部取血进行效价的检测; 而在饲养过程中,原蛋白组(不加佐剂)有2只小鼠死亡,其余各组均为7只。间接ELISA法检测结果显示, 3次免疫后, 各组佐剂与CD4蛋白组合免疫小鼠所得到的抗CD4血清抗体效价达到了较高水平(图4)。而在各组CD4抗血清效价的结果比较中, 弗氏佐剂组的抗血清效价极显著高于原蛋白组的抗血清效价(P<0.001); Al(OH)3组的抗血清效价极显著高于原蛋白组的抗血清效价(P<0.01);而MF59组的抗血清效价显著高于原蛋白组(Protein)的抗血清效价(P<0.05),见图4。而三种佐剂的抗血清几何平均滴度比较结果为: 弗氏佐剂组(GMT:97 420)>Al(OH)3佐剂组(GMT: 67 202)>MF59佐剂组(GMT: 55 128)。
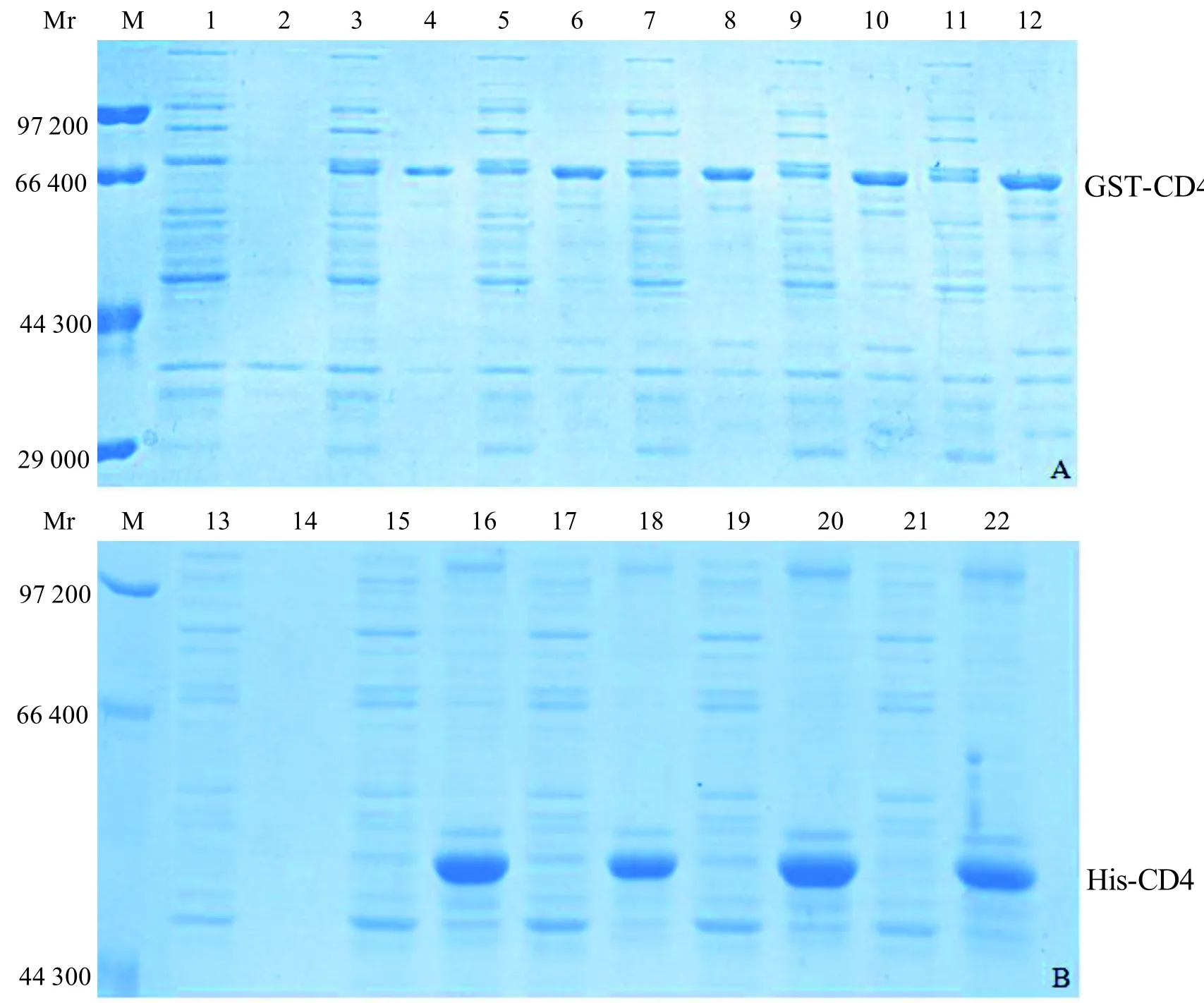
图2 诱导表达产物的SDS-PAGE分析Figure 2 SDS-PAGE profile of induced expression product

图3 纯化产物的SDS-PAGE分析Figure 3 SDS-PAGE profile of purified His-CD4 and GST-CD4
2.4.2 血清抗体的特异性 Western blot分析显示(图5-A),融合蛋白His-CD4 (泳道1)、GST-CD4(泳道2)、GST标签蛋白(泳道3)均可与抗血清反应,且出现特异性条带。同时,树鼩的淋巴细胞样品(泳道4)可以与抗血清反应,而人(泳道5)、猴(泳道6)、大鼠(泳道7)和小鼠(泳道8)的淋巴细胞样品未与抗血清反应(图5-B)。表明该血清抗体具有较好的特异性,且无物种交叉反应。

图4 各组CD4抗血清效价的结果Figure 4 Titer of mouse antiserum against CD4 of each group
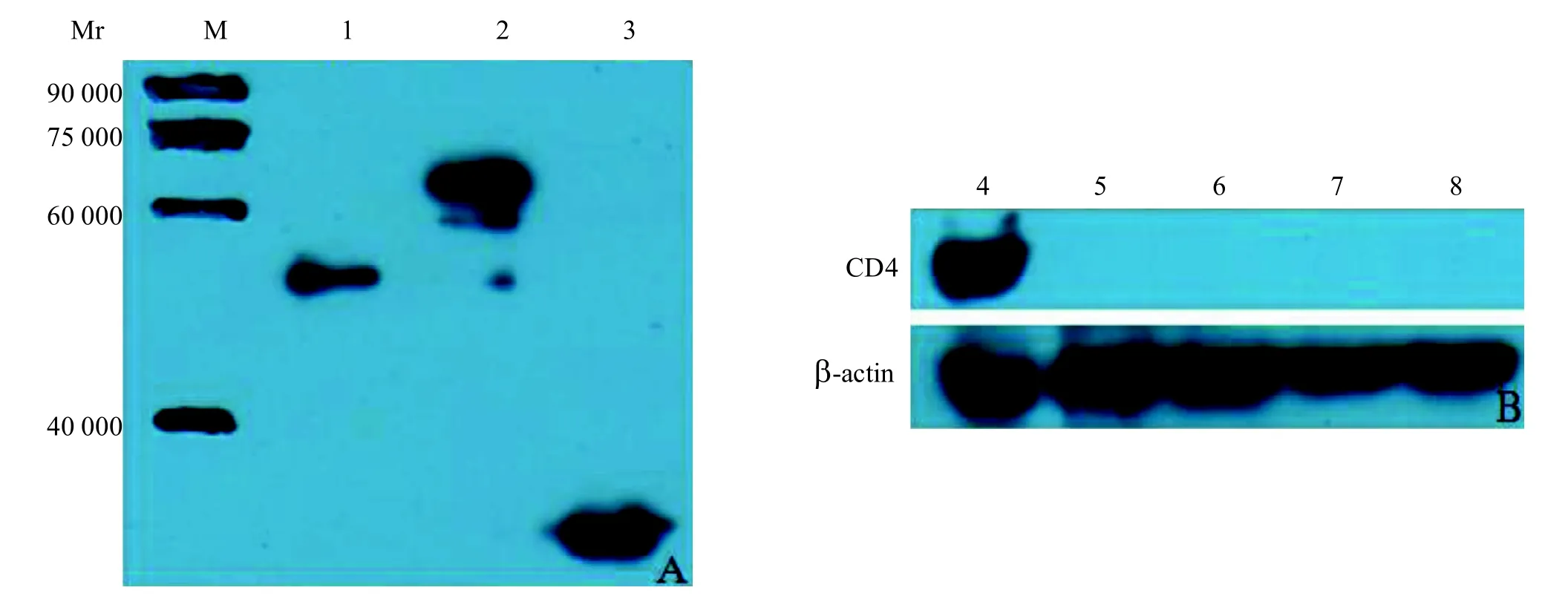
图5 小鼠抗CD4血清体外体内Western blot鉴定Figure 5 Western blotting of mouse antisera against CD4 in vitro and in vivo
3 讨论
T淋巴细胞能够介导体内的细胞免疫应答, 其中含有CD4抗原的T细胞经刺激活化后能分化成CD4+Th细胞,接着能够通过分泌大量的细胞因子参与细胞和体液免疫应答。因而检测机体内的CD4+T淋巴细胞的数量并根据其他细胞因子的水平可以评价机体内的免疫应答状态,为一些疾病免疫应答的机制以及一些抗干扰的机理提供了理论依据[6-9]。
CD4蛋白分子是免疫系统中比较重要的细胞表面分子,本实验构建了两种表达质粒pGEX-5X-1-CD4和pET30a(+)-CD4分别带有GST和His标签,这样容易通过纯化获得。在大肠杆菌中,原核表达重组蛋白及纯化整个过程相对于真核表达来说,经济、方便、易于获得,为后续CD4蛋白的相关研究提供了较为方便的基础。在本实验中,应用生物信息学软件预测的GST-CD4融合蛋白理论相对分子质量约为74.6×103, 但SDS-PAGE分析本实验获得重组蛋白的相对分子质量约为70.0×103,同时作者对纯化的融合蛋白样品进行了质谱检测,并经Western blot验证该重组融合蛋白为GST-CD4融合蛋白。其原因可能是原核表达的蛋白没有发生一些蛋白的修饰过程,所得蛋白跟真核生物中表达的蛋白构象以及大小存在一定的差异[10-12]。
本研究首次表达纯化了树鼩CD4蛋白,成功制备了树鼩CD4多克隆抗体并能特异性地检测到树鼩体内的CD4蛋白,有利于检测树鼩机体内的CD4+T淋巴细胞的数量,对于揭示树鼩各种疾病的免疫应答机制,树鼩病毒感染模型的相关指标的检测,树鼩CD4+T淋巴细胞的流式分析等研究提供了重要基础。同时本文为了比较三种不同佐剂对体液免疫抗血清效价的影响,设定了相同量的免疫原跟佐剂组合免疫小鼠,所得抗血清通过间接ELISA来测定效价。经计算,弗氏佐剂组的抗血清几何平均滴度(GMT: 97 420)高于Al(OH)3佐剂组(GMT: 67 202)和MF59佐剂组(GMT: 55 128),具有良好的免疫原性。结果显示,弗氏佐剂相对于其他两种佐剂,能够更加有效地提高抗原诱导的保护性体液免疫应答。且本文以弗氏佐剂组抗血清为一抗(稀释度1∶2 000)与融合蛋白GST-CD4、His-CD4、GST标签蛋白以及树鼩和其他物种淋巴细胞样品进行Western blot进行分析,结果显示并无交叉反应,表明抗血清具有良好的特异性。
综上所述,本实验首次成功地表达并纯化了树鼩CD4融合蛋白,并制备了特异性良好的小鼠抗血清,为下一步本实验室制备CD4单克隆抗体、CD4蛋白分子的功能研究、为建立一种检测树鼩外周血CD4+T淋巴细胞方法以及树鼩的病毒感染模型等免疫相关实验的进行提供了基础。
[1] 彭燕章, 叶智彰, 邹如金, 等.树鼩生物学[M].昆明: 云南科技出版社, 1991:1-7.
[2] 殷安国, 匡德宣, 李晓飞,等.树鼩模型在人类病毒性疾病研究中的应用进展[J].中国实验动物学报, 2014, 22(2):86-89.
[3] 陈瑾, 代解杰, 孙晓梅.树鼩肝炎动物模型的研究进展[J].中国比较医学杂志, 2008, 18(2):59-62.
[4] 曹雪涛, 何维, 熊思东, 等.医学免疫学[M].北京: 人民卫生出版社, 2015:200-201.
[5] Wang JH, Yan YW, Garrett TP, et al.Atomic structure of a fragment of human CD4 containing two immunoglobulinlike domains.[J].Nature, 1990, 348(6300):411-418.
[6] Yan L, Ling W, Xu H, et al.The activation and dynamics of cytokine expression by CD4+, T cells and AIDS progression in HIV-1-infected Chinese individuals[J].Microbial Pathogenesis, 2012, 53(5-6):189-197.
[7] Barboza L, Salmen S, Peterson DL, et al.Altered T cell costimulation during chronic hepatitis B infection[J].Cell Immunol, 2009, 257(1-2):61-68.
[8] Houman H, Hamzaoui A, Ghorbal IB, et al.Abnormal expression of chemokine receptors in Beh?et's disease: relationship to intracellular Th1/Th2 cytokines and to clinical manifestations[J].J of Autoimmun, 2004, 23(3):267-273.
[9] Belz GT, Wodarz D, Diaz G, et al.Compromised influenza virus-specific CD8(+)-T-cell memory in CD4(+)-T-celldeficient mice[J].J of Virol, 2002, 76(23):12388-12393.
[10] Garcíafruitós E, Vázquez E, Díezgil C, et al.Bacterial inclusion bodies: making gold from waste [J].Trends Biotechnol,2012, 30(2):65-70.
[11] Ventura S, Villaverde A.Protein quality in bacterial inclusion bodies[J].Trends Biotechnol, 2006, 24(4):179-185.
[12] Shi T, Zhang L, Li Z, et al.Expression, purification and renaturation of truncated human integrin β1 from inclusion bodies of Escherichia coli [J].Protein Expr Purif, 2014, 107 (4):13-19.
Preparation and Determination of CD4 Polyclonal Antibodies of Tree Shrew
LU Kong-jie, XU Jing-wen, ZHANG Xue-mei, WU Zhong-xiang, REN Fang-fang,MA Na, GONG Wei, YAN Li-wei, ZHU Wen-bing, DONG Shao-zhong
(Institute of Medical Biology, Chinese Academy of Medical Science and Peking Union Medical College, Yunnan
Key Laboratory of Vaccine Research & Development on Severe Infectious Disease, Kunming 650118, China)
Objective To express tree shrew (Tupaia belangeri) CD4 protein in prokaryotic cells,purify the expressed product and prepare its polyclonal antibodies,and determinate CD4 protein in vivo.Methods CD4 gene was cloned and inserted into express vectors.And then recombinant plasmids pET30a (+)-CD4 and pGEX-5X-1-CD4 were constructed.The expressed recombinant proteins His-CD4 and GST-CD4 were expressed and purified.The polyclonal antibodies of CD4 protein were prepared with three different adjuvants including Al (OH)3, MF59 and Freund’s.The serum antibody specificity was determined by Western blot.Results The expressed recombinant proteins His-CD4 and GST-CD4, with relative molecular masses of about 53.5×103and 70.0×103respectively.And the concentrations of proteins His-CD4 and GST-CD4 were 600 μg/ml and 1mg/ml respectively.Three groups of adjuvants all can induce antibodies.The comparison results of Geometric Mean Titer (GMT)is that the Freund’s adjuvant group (GMT: 97 420) showed the highest geometric mean of antiserum,followed by Al (OH)3adjuvant group (GMT: 67 202) and MF59 adjuvant group (GMT: 55128).The Freund’s adjuvant group was significantly higher than the original protein group (P<0.001).The Al(OH)3adjuvant group was significantly higher than the original protein group (P<0.01).The MF59 adjuvant group was higher than the original protein group (P<0.05).Conclusions Mouse antiserum with high specificity was prepared,and it could bind to CD4 protein of tree shrew in vivo, which laid a foundation of further study on the preparation of monoclonal antibody against CD4 and the research of CD4 function and immune related experiments of tree shrews as viral infection models.
Tree shrew; CD4 Protein; Expression; Purification; Polyclonal antibody
Q95-33
A
1674-5817(2016)04-0243-07
10.3969/j.issn.1674-5817.2016.04.001
2016-05-05
国家科技支撑计划项目(2014BAI01B01)
卢孔杰(1990-), 男, 硕士研究生, 专业: 生物化学与分子生物学。E-mail: lkjwyh@126.com
董少忠(1968-), 男, 研究员, 研究方向: 免疫学。Email: dsz@imbcams.com.cn

