乳糖诱导剂促进P450 BM-3在大肠杆菌中可溶性表达的研究
张彭湃, 王松廷
河南大学生命科学学院,河南 开封 475004
乳糖诱导剂促进P450 BM-3在大肠杆菌中可溶性表达的研究
张彭湃,王松廷
河南大学生命科学学院,河南 开封 475004
P450 BM-3是一种具有工业化应用潜力的单加氧酶,可催化饱和脂肪酸羟基化。为提高其在大肠杆菌宿主中的可溶性表达水平,采用乳糖作为诱导剂对P450 BM-3的诱导表达条件进行研究。结果发现:在大肠杆菌的OD600达到0.7~1.5时,添加2.0 g/L的乳糖、30 ℃诱导10 h可获得最佳诱导效果。与IPTG的诱导效果对比发现:采用乳糖作诱导剂时,菌体生物量提高1.09倍,目标蛋白量提升2.13倍,蛋白包涵体的比例则降低至10%。研究结果表明:乳糖可显著提升P450 BM-3在大肠杆菌中的重组表达水平,并且能够促进p450 BM-3的可溶性表达。
P450 BM-3; 乳糖; IPTG; 诱导剂; 可溶性表达
P450 BM-3是一种具有羟基化活性的单加氧酶,能快速催化链长为C12~C20的饱和脂肪酸的ω-1、ω-2、ω-3位羟基化、催化不饱和脂肪酸的双键环氧化[1]。通过定向进化等手段加以改造,P450 BM-3获得了能催化花生四烯酸(AA)和二十碳五烯酸(EPA)[2]、催化亚油酸[3]生成白细胞毒素B、催化多环芳烃(PAHs)羟基化[4]、催化多氯联苯[5]、催化吲哚生成靛蓝[6]等多种功能,增强了其在医药、环境、农业、香料、染料工业等领域的应用价值。
P450 BM-3催化时能独立完成电子的获得、传递和底物的羟基化,而其他来源的P450酶必须通过P450还原酶(CPR)的辅助才能完成催化作用[7]。但是P450 BM-3分子量大(119 kDa)、结构复杂,在大肠杆菌中进行重组表达时,表达量低且易于形成包涵体[8]。实验证明,添加血红素的前体物质如β-氨基酮戊酸(ALA),或添加适量FeCl3对提高P450 BM-3的表达量是有效的[9],但如何提高P450 BM-3的可溶性表达水平却一直未获得大的进展。由于乳糖作为诱导剂时可以促进某些外源蛋白的可溶性表达[10]。因此,本文考察了以乳糖为诱导剂对P450 BM-3重组表达水平及重组蛋白可溶性的影响,为P450 BM-3的大规模制备奠定基础。
1 材料与方法
1.1菌种、质粒与培养基
宿主E.coliBL21(DE3),pET28a(+)-P450 BM-3重组质粒为实验室保存。菌种培养及酶的表达采用LB培养基。
1.2方法
1.2.1IPTG诱导下的P450 BM-3表达
在含有50 μg/mL卡那霉素的100 mL LB液体培养基中培养至OD600为0.6 ~ 0.8时,加入IPTG至浓度为0.5 mmol/L,然后在30 ℃,150 r/min下继续诱导6 h后收获细胞。
1.2.2乳糖诱导P450 BM-3重组表达的条件优化
对乳糖诱导浓度、诱导温度、诱导时机及诱导持续时间等4个因素进行优化。
乳糖诱导浓度的优化:细胞在37 ℃培养至OD600为0.6~0.8,加入乳糖至终浓度为0.1 g/L、0.5 g/L、1.0 g/L、2.0 g/L、5.0 g/L和10.0 g/L,30 ℃诱导表达10 h,收集细胞、提取粗酶液,比较粗酶液中的目标蛋白浓度以确定最适乳糖诱导浓度。
诱导温度的优化:细胞在37 ℃培养至OD600为0.6~0.8,加入乳糖至最适诱导浓度,温度选择为25 ℃、30 ℃和37 ℃分别诱导表达10 h,对比粗酶液中的目标蛋白量。
诱导时机的优化:细胞在37 ℃下培养至OD600为0.3~0.5、0.6~0.8、1.0~1.2、1.4~1.6和1.8~2.1,加入乳糖至最适诱导浓度,并在最适诱导温度下诱导表达10 h,对比粗酶液中的目标蛋白量。
诱导持续时间的优化:在最适诱导时机、乳糖浓度,诱导温度下进行目标蛋白的诱导表达,每隔2 h测定目标蛋白浓度,直至目标蛋白量不再增加。
1.2.3P450 BM-3粗酶液的制备
诱导结束后收集菌体沉淀,生理盐水洗涤,用1/5发酵液体积的破胞缓冲液重悬细胞后超声破细胞。破胞缓冲液组成:100 mmol/L Tris-HCl(pH 8.2),50 mmol/L NaCl,15%甘油,1 mmol/L苯甲基磺酰氟(PMSF)。超声破胞条件为:功率300 W,工作3 s,间歇4 s,冰浴,循环90次。经破碎后的悬液于4 ℃,15 000 r/min下离心30 min,上清部分即为粗酶液。
1.2.4粗酶液中P450 BM-3含量的测定方法
采用CO-差示光谱测定粗酶液中P450 BM-3的浓度[11]。
1.2.5乳糖与IPTG诱导效果的比较
比较乳糖与IPTG在各自的最佳诱导条件下的诱导结果。比较的指标有:生长曲线、最终的菌体量、可溶性P450 BM-3浓度及可溶性重组蛋白和包涵体的比例。其中,可溶性蛋白和包涵体的比例可通过软件Quantity One 5.62对目标蛋白上清液与沉淀的SDS-PAGE分析获得。
2 结果与分析
2.1乳糖最佳诱导条件的确定
乳糖作为诱导剂时,乳糖浓度、诱导温度、诱导时机以及诱导持续时间对P450 BM-3表达的影响,分别如图1A,1B,1C和1D所示。
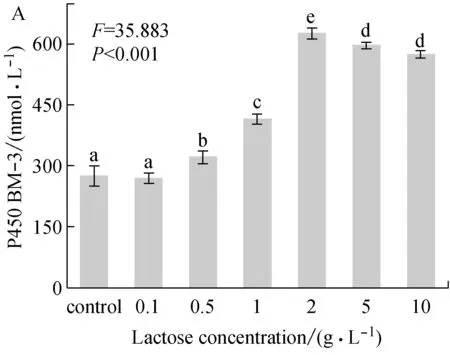
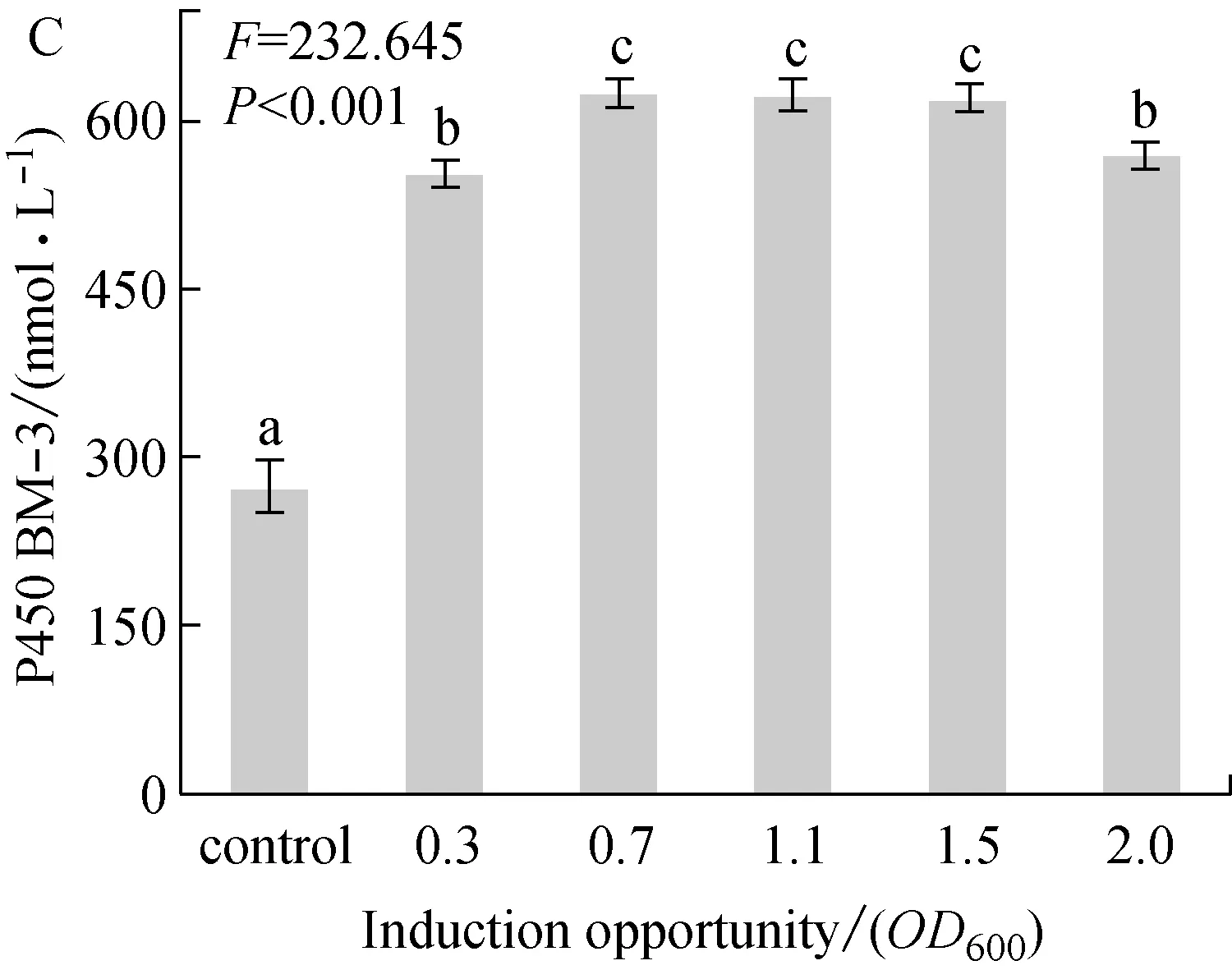
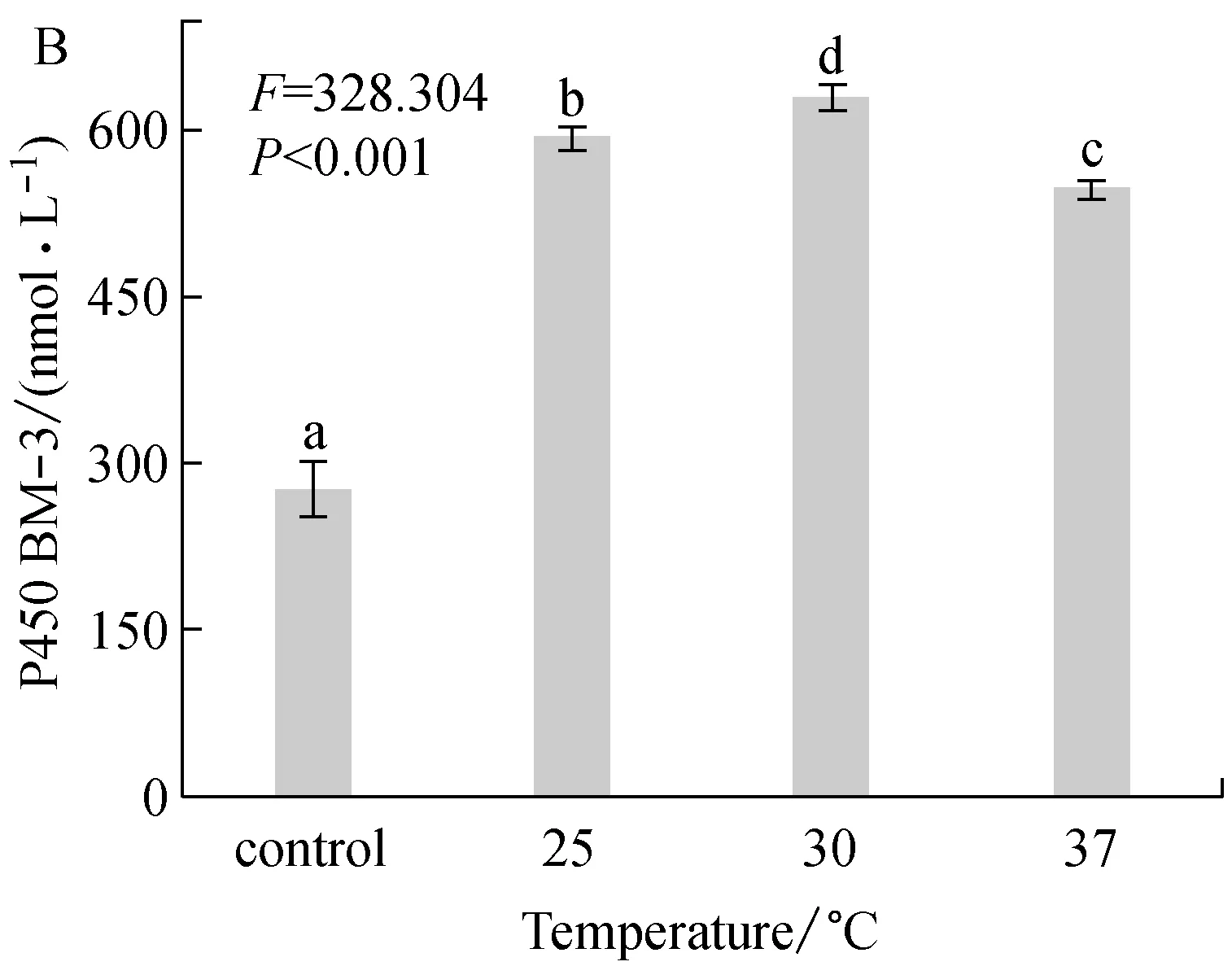
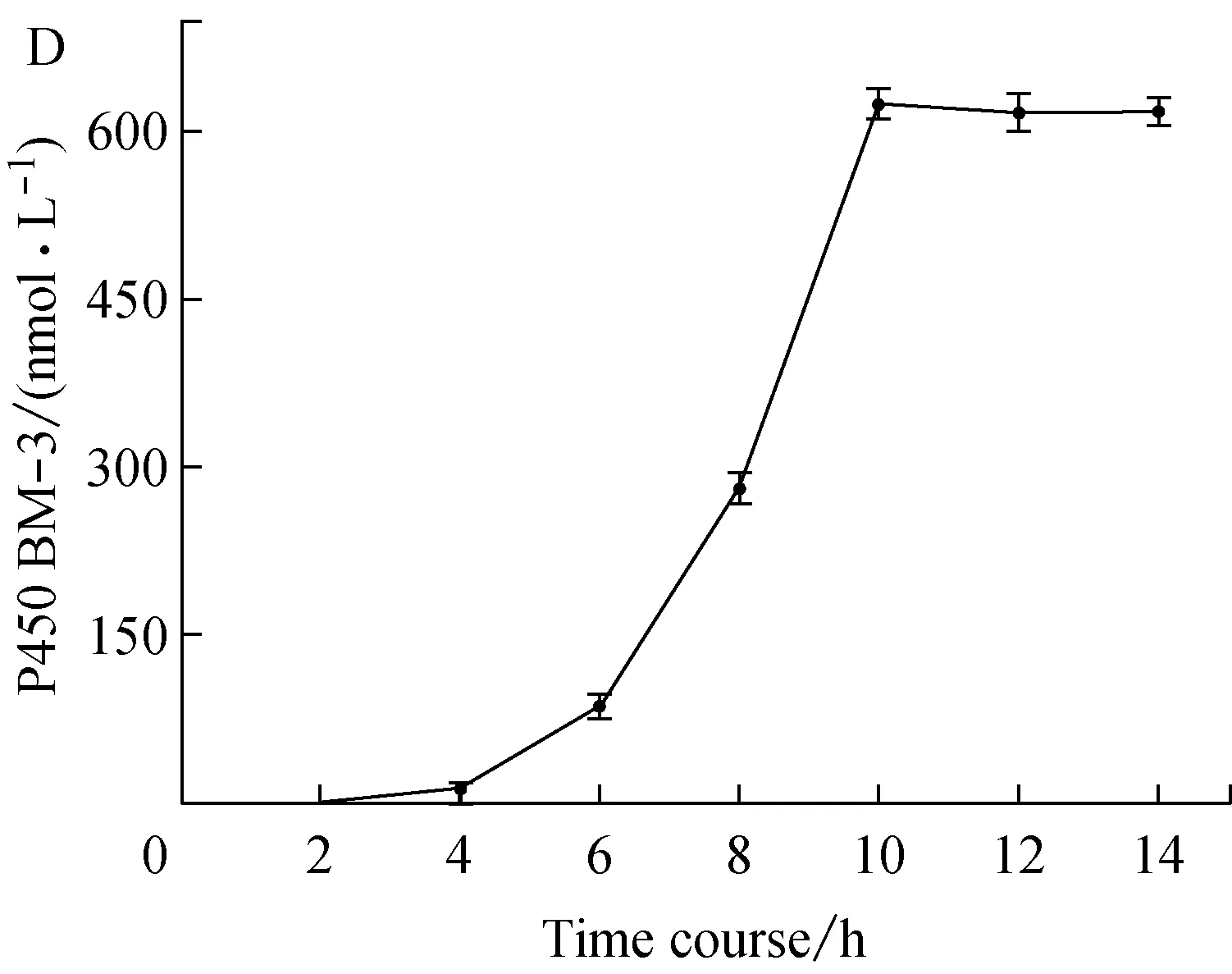
图1 乳糖诱导条件对P450 BM-3表达量的影响
采用软件SPSS 17.0对乳糖、IPTG分别为诱导剂时对P450 BM-3的表达影响进行显著性分析,计算不同考察条件下的F值及P值,结果显示:不同乳糖浓度的诱导效果之间存在着极其显著的差异(P<0.001)。
图1A显示,乳糖浓度较低时(0.1~0.5 g/L),目标蛋白即有明显表达,乳糖浓度0.1 g/L时即可获得与IPTG诱导相当的表达水平,当乳糖浓度增加时,目标蛋白量也逐渐增加,乳糖达到2.0 g/L的时候,目标蛋白表达量到最大值(626.8 nmol/L,约80 mg/L)。
诱导温度对目标蛋白表达量的影响如图1B所示。30 ℃诱导时获得的目标蛋白表达量最多(626.8 nmol/L),而37 ℃下的目标蛋白表达量较30 ℃降低13%。其原因可能是:在较高温度下,目标蛋白中相当一部分转化成包涵体,而导致可溶性的目标蛋白减少。有报道称,37 ℃下,菌体代谢旺盛,乳糖操纵子活力达到最高,目标蛋白肽链合成的速度,超过了菌体对其进行正确折叠的速度,结果导致形成包涵体,可溶性蛋白量减少[12]。有研究表明,低温(如16 ℃)有利于重组蛋白的可溶性表达[13],但是低温下菌体生长趋慢,若想得到与适宜温度下同样的蛋白量,应当适当延长诱导时间。
诱导时机对目标蛋白表达量的影响如图1C所示。结果表明:在OD600为0.7、1.1和1.5时诱导,获得的最终目标蛋白量相差不大(610~640 nmol/L),因此,在菌体生长到OD600为0.7~1.5时,添加乳糖可以获得最好的诱导效果。DUNCAN分析显示,采用乳糖,不同诱导时机下与采用IPTG相比,诱导效果均存在显著差异。而在OD600为0.7、1.1和1.5时,诱导效果处于同一水平,不存在显著性差异。
图1D为诱导持续时间对目标蛋白量的影响。结果表明:在乳糖加入后的2 h内,目标蛋白并没有出现;在诱导2 h ~4 h,目标蛋白开始出现;在4 h之后,目标蛋白大量被合成出来;诱导10 h后,所获目标蛋白积累到最大值。诱导前期,目标蛋白没有表达,是因为乳糖需经过乳糖透过酶的协助才能进入细胞,之后还需被β-半乳糖苷酶转化为异乳糖才可以发挥诱导作用[12]。细胞需要一定的时间来合成利用乳糖所需的酶系,在诱导的初始阶段,酶量较少,因此目标蛋白积累速度也较慢,待所需酶系大量合成后,目标蛋白的表达速率也随之增长。
综上所述,乳糖诱导表达的最适条件为:OD600为0.7~1.5时,加入2.0 g/L的乳糖,在30 ℃下诱导10 h。
2.2乳糖与IPTG诱导情况的比较
在最适诱导条件下分别用乳糖和IPTG对P450 BM-3进行诱导表达,结果如表1所示。
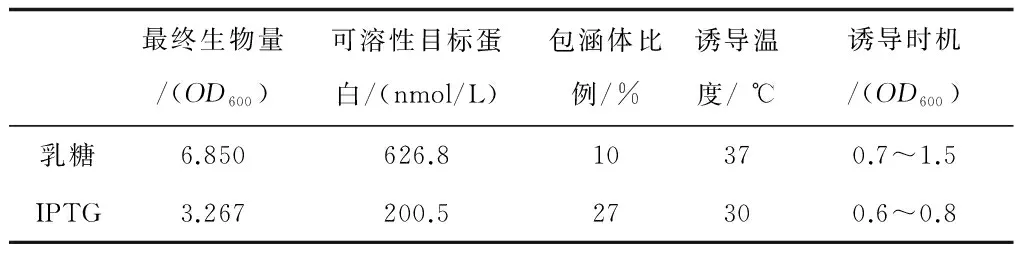
表1 乳糖与IPTG的最佳诱导条件下的诱导效果
乳糖诱导下,获得菌体量是IPTG诱导下的2.09倍,但略低于不诱导时最终菌体量(OD600为7~8,图2)。这是因为外源蛋白表达对细胞正常生长造成干扰,造成能量和营养物质的分流,因此会抑制生长[12]。IPTG不能被细胞利用,并造成代谢负担,因此这种抑制作用很明显;而乳糖对于细胞来说不仅是诱导剂,还是一种碳源,可以供给菌体生长需要。因此,乳糖的添加在一定程度上缓解了对外源蛋白的表达对菌体正常生长造成的营养物质的分流,从而使得菌体量并没有明显下降。
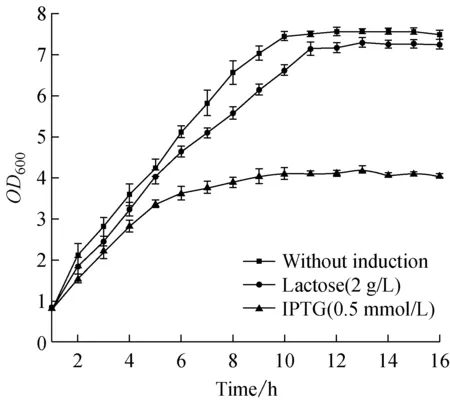
图2 乳糖和IPTG诱导下宿主菌生长曲线比较
乳糖诱导下,可溶性P450 BM-3浓度达到626.8 nmol/L,是IPTG诱导结果的3.13倍。考虑到最终的蛋白量取决于细胞总量与每个细胞的生产量,而乳糖诱导下最终菌体量是IPTG的2.09倍,所以在单个细胞的产量上,乳糖诱导效果更佳,为IPTG诱导的1.49倍。
采用IPTG诱导的时机选择在OD600在0.6~0.8之间,这是一个比较狭窄的范围。微生物生长过程中,OD600由0.6达到至0.8往往只需要十几分钟,IPTG诱导下,时间控制稍有偏差,蛋白得率往往就受到较大影响。而乳糖诱导的时机范围宽广(0.7~1.5),较为宽泛的诱导时机有利于重组P450 BM-3大规模工业化生产时对生产质量的控制。
对于乳糖是否促进P450 BM-3的可溶性表达问题,对诱导产物的上清液与沉淀进行SDS-PAGE,如图3所示。用软件Quantity One 5.62估算包涵体所占比例,结果显示:乳糖有效的降低了P450 BM-3的包涵体比例,使得这一比例由27%左右下降至10%以内。
分析乳糖有利于P450 BM-3可溶性表达的原因,可从诱导剂诱导强度及蛋白本身性质两个方面去考虑。目标蛋白的可溶性表达与诱导剂的诱导强度有关,诱导强度与目标蛋白总量(可溶部分与包涵体之和)与诱导时间的比值正相关[14,15]。乳糖诱导下可溶目标蛋白量是IPTG的1.49倍,但乳糖诱导时间是IPTG的1.67倍,且IPTG诱导时以包涵体形式存在的目标蛋白大幅高于乳糖诱导,说明IPTG的诱导强度实际是高于乳糖的。IPTG加入后,导致目标蛋白迅速表达,以至无法及时正确折叠,从而形成包涵体。而以乳糖作为诱导剂时则相反,蛋白有充足的时间进行正确的折叠,从而提高了可溶性目标蛋白所占的比例。目标蛋白的可溶性表达也与蛋白本身特性有关,如分子量,结构以及折叠的难易程度等。对于分子量小,结构简单的蛋白,其蛋白的正确折叠往往也比较容易。例如,三苯基甲烷类染料脱色酶具有较小的分子量(29.4 kDa),该蛋白在工程菌中表达时,采用乳糖或IPTG诱导,其可溶性蛋白比例相似[16]。又如来源于大肠杆菌的NMN转移酶,其分子量仅43 kDa,在IPTG诱导下也几乎全部为可溶性表达[17]。而对于分子量较大,结构复杂的蛋白而言,相比之下,进行正确折叠更加困难,使用乳糖为诱导剂,往往能够有效促进重组蛋白的可溶性表达。
3 结论
本研究以乳糖作为诱导剂,对P450 BM-3在大肠杆菌宿主中进行异源表达的效果进行考察。结果如下:(1)乳糖诱导P450 BM-3表达的最适条件为:OD600为0.7~1.5时,加入2.0 g/L的乳糖,在30 ℃下诱导10 h。(2)采用乳糖进行诱导,不仅显著提高重组蛋白的表达量,而且降低了包涵体所占的比例。(3)采用乳糖诱导时,与IPTG诱导相比,添加诱导剂的最佳时间段范围更宽,有利于P450 BM-3的大规模制备。本研究为P450 BM-3重组蛋白的大规模获取及进一步深入研究创造了良好的条件,同时也为乳糖诱导剂应用于基因工程药物研究及生产提供了有价值的参考。
[1]Miura Y, Fulco AJ. Hydroxylation of fatty acids by a soluble system fromBacillusmegaterium. The Journal of Biological Chemistry, 1974, 249(6): 1880-1888.
[2]Graham-Lorence S, Truan G, Peterson JA,etal. An active site substitution, F87V, converts cytochrome P450 BM-3 into a regio-and stereoselective (14S,15R)-arachidonic acid epoxygenase. The Journal of Biological Chemistry, 1997, 272(2): 1127-1235.
[3]Li Z, van Beilen JB, Duetz WA,etal. Oxidative biotransformations using oxygenases. Current Opinion in Chemical Biology, 2002, 6(2): 136-144.
[4]Li QS, Ogawa J, Schmid RD,etal. Engineering cytochrome P450 BM-3 for oxidation of polycyclic aromatic hydrocarbons. Applied and Environmental Microbiology, 2001, 67(12): 5735-5739.
[5]Sulistyaningdyah WT, Ogawa J, Li QS,etal. Metabolism of polychlorinated dibenzo-p-dioxins by cytochrome P450 BM-3 and its mutant. Biotechnology Letters, 2004, 26(24): 1857-1860.
[6]Li QS, Schwaneberg U, Fischer P,etal. Directed evolution of the fatty-acid hydroxylase P450 BM-3 into an indole-hydroxylating catalyst. Chemistry-A European Journal, 2000, 6(9): 1531-1536.
[7]Munro AW, Leys DG, McLean KJ,etal. P450 BM-3: the very model of a modern flavocytochrome. Trends in Biochemical Sciences, 2002, 27(5): 250-257.
[8]Park SH, Kim DH, Kim D,etal. Engineering bacterial cytochrome P450 (P450) BM-3 into a prototype with human P450 enzyme activity using indigo formation. Drug Metabolism and Disposition, 2010, 38(5): 732-739.
[9]黄俊, 梅乐和, 钟春龙等. 重组细胞色素P450 BM-3酶的表达条件及初步纯化研究. 浙江大学学报(农业与生命科学版), 2006, 32(1): 96-100.
[10]Donovan RS, Robinson CW, Glick BR. Optimizing inducer and culture conditions for expression of foreign proteins under the control of the lac promoter. Journal of industrial microbiology & biotechnology, 1996 (16): 145-154.
[11]Zhang PP, Hu S, Mei LH,etal. Improving the Activity of Cytochrome P450 BM-3 Catalyzing Indole Hydroxylation by Directed Evolution, Applied Biochemistry and Biotechnology, 2013, 171(1): 93-103.
[12]Donovan RS, Robinson CW, Glick BR. Optimizing inducer and culture conditions for expression of foreign proteins under the control of the lac promoter. Journal of industrial microbiology, 1996, 16(3): 145-154.
[13]Ding QB, Ou L, Wei DZ,etal. Optimum induction of recombinant thymidine phosphorylase and its application. Nucleosides, Nucleotides and Nucleic Acids, 2011, 30(5): 360-368.
[14]Monteiro RA, Souza EM, Yates MG,etal. Use of lactose to induce expression of soluble NifA protein domain Herbaspirillum seropedicae inEscherichiacoli. Canadian journal of microbiology, 2000, 46(11): 1087-1090.
[15]Tian H, Tang L, Wang Y,etal. Lactose induction increases production of recombinant Keratinocyte Growth Factor-2 inEscherichiacoli. International Journal of Peptide Research and Therapeutics, 2011, 17(2): 123-129.
[16]陈亮, 任随周, 许玫英等. 乳糖替代IPTG诱导脱色酶TpmD基因在大肠杆菌中的高效表达. 微生物学通报, 2009, 36(4): 551-556.
[17]段琳琳, 李红梅. 来源于大肠杆菌的NMN转移酶的克隆表达与酶学性质研究. 工业微生物, 2016, 46(2): 30-35.
Enhanced soluble expression of cytochrome P450 BM-3 inE.coliby using lactose as inducer
ZHANG Peng-pai, WANG Song-ting
College of Life Science, Henan University, Henan Kaifeng 475004, CHINA
P450 BM-3 is a monooxygenase with the potential for industrial application. It can catalyze saturated fatty acids hydroxylation. In order to enhance the expression level and the solubility of P450 BM-3 inEscherichiacoliBL21 (DE3), studies was carried out with lactose as the inducer. The expressions conditions in shake flask were optimized. It was found that while 2.0 g/L lactose was added into the culture (OD600=0.7~1.5) and incubated at 30 ℃ for 10 hours, the yield of P450 BM-3 arrived at the maximum (80 mg/L). With lactose induction, the biomass was doubled, the amount of P450 BM-3 achieved 626.8 nmol/L, which was 3.13 times of that with IPTG induction. The solubility of P450 BM3 was also improved, for the inclusion bodies decreased to 10%. These data indicated that lactose was effective to improve the expression of P450 BM-3 inE.coliand would be conducive to the soluble expression of P450 BM-3.
P450 BM-3; lactose; IPTG; inducer; soluble expression
10.3969/j.issn.1001-6678.2016.04.003
张彭湃(1978~),男,博士,副教授,研究方向:生物化工。E-mail:bio_apai@163.com。
项目名称:河南省科技厅项目(162102210025)。

