盾壳霉抗逆性菌株的筛选
金 强, 段作营, 夏森玉, 沈志松, 李华钟, 金 坚*
1. 江南大学药学院, 江苏 无锡 214122; 2. 江南大学工业微生物技术教育部重点实验室, 江苏 无锡 214122;3. 无锡楗农生物科技有限公司, 江苏 无锡 214122
盾壳霉抗逆性菌株的筛选
金强1,段作营2,夏森玉3,沈志松3,李华钟2,金坚1*
1. 江南大学药学院, 江苏 无锡 214122; 2. 江南大学工业微生物技术教育部重点实验室, 江苏 无锡 214122;3. 无锡楗农生物科技有限公司, 江苏 无锡 214122
通过测定野生型盾壳霉JN-CM菌株对所选的各种农药和化肥的耐受性,确定草甘膦、吡虫啉和磷肥对盾壳霉具有较大的抑制作用。采用紫外诱变方式分别筛选了对草甘膦、吡虫啉和磷肥具有一定耐受性的突变菌株,分别命名为UV-G(草甘膦抗性)、UV-I(吡虫啉抗性)和UV-P(磷肥抗性)。此3种抗性突变株具有良好的遗传稳定性,同时在生长繁殖能力及侵染相关酶活性方面与野生菌株无明显差异,具有良好的应用潜力。
盾壳霉; 突变菌株; 紫外诱变
菌核病是一种广泛分布的植物真菌病害,其病原菌为核盘菌(Sclerotiniasclerotriorum)[1,2]。核盘菌在生长后期形成菌核,菌核是一种抗逆性极强的休眠结构,在条件合适的情况下会继续萌发侵染植株,产生病害[3]。现在我国大量使用化学杀菌剂进行菌核病的防治,对生态环境,人类健康都会造成不利影响。生物防治是现阶段用于植物病害的另一种有效手段,其具有专一性强、作用时间久、无致病性的特点,对于菌核病的生物防治主要是利用生防菌盾壳霉(Coniothyriumminitans)进行。
盾壳霉是核盘菌的一种重寄生菌[4],研究表明盾壳霉可以寄生并破坏核盘菌的细胞壁,分泌的β-1-3葡聚糖酶和几丁质酶等可以分解和利用菌核,导致细胞壁塌陷,菌核变软,核盘菌死亡[5]。以盾壳霉为有效成分的生物农药产品已经上市,并得到广泛的应用。现有产品在实际应用过程中,为操作方便,节省人工成本,一般是和一定浓度的农药和化肥联合施用。但有些化肥和农药会对盾壳霉的生长和侵染造成影响,从而使相互共存存在问题,筛选有关耐受性菌株是解决这一问题的有效途径[6]。
本文主要研究所选化肥及农药对盾壳霉孢子萌发及菌丝生长的影响,通过紫外诱变的方式筛选对化肥、农药具有一定耐受能力的抗性菌种,并对抗性菌株的生长繁殖能力及酶学活性进行评价。
1 材料与方法
1.1材料
1.1.1菌株与培养基
盾壳霉菌株(C.minitans)JN-CM由无锡楗农生物科技有限公司提供;核盘菌(S.sclerotriorum)为本研究室从江苏省句容市某发病油菜地中分离得到。
马铃薯葡萄糖培养基(PDB):去皮马铃薯200 g,葡萄糖20 g,蒸馏水1 000 mL,自然pH。如需要配置马铃薯葡萄糖琼脂(PDA)培养基,则添加琼脂15~20 g。
明胶培养基:明胶10 g,琼脂15~20 g,蒸馏水1 000 mL,自然pH。
MCD培养基:NH4H2PO42.0 g;K2HPO41.0 g;MgSO4·7H2O 0.5 g;KCl 0.5 g; FeSO40.01 g;1% ZnSO41 mL;0.5% CuSO41 mL,加入5 g研成粉末的菌核,定容到1 000 mL[7]。
1.1.2供试农药及化肥
41%草甘膦(美国孟山都公司);10% 吡虫林(海利尔药业集团股份有限公司);5% 啶虫脒(万邦生物有限公司);1.14% 甲氨基阿维菌素苯甲酸盐(山东恒丰化学有限公司);氮肥(有效成分尿素);磷肥(有效成分过磷酸钙);钾肥(有效成分硝酸钾)来自河北省沃丰科技有限公司。
1.2菌株培养及孢子悬液制备
(1) 平板培养及孢子悬液制备:取盾壳霉试管斜面用接种针刮取后点种在PDA平板上,或吸取孢子悬液加入到PDA平板涂布后培养。培养条件为20 ℃,10 d后用无菌水洗下菌落上的分生孢子,用双层擦镜纸过滤制成孢子悬液,取样用显微镜镜检计算孢子的含量,根据使用需要稀释到相应含量。
(2) 液体培养:取100 μL的盾壳霉孢子悬液(108CFU/mL)接种到100 mL液体培养基(PDB或MCD),20 ℃,200 r/min振荡培养。
1.3盾壳霉菌株生长情况测定
1.3.1菌株萌发率测定
取100 μL的孢子悬液(107CFU/mL)涂布平板,20 ℃培养36 h后,在显微镜下测定孢子萌发率(随机转动镜头,每个镜头超过30个孢子,芽管长度大于孢子直径视为萌发,每次测量5个视野)。
1.3.2菌丝生长速度测定
取长有10 d盾壳霉菌株的PDA平板,用5 mm打孔器切取菌落边缘的菌丝块并接种到新的PDA平板中央,记录第5 d和第10 d的菌落直径,利用十字交叉法计算该平板上的菌丝生长速度[8]。
1.3.3菌体干重测定
取100 mL PDB液体培养物(20 ℃,200 r/min培养10 d)用滤纸过滤,将所得盾壳霉菌体在60 ℃烘干至恒重。
1.4农药和化肥对盾壳霉生长的影响
1.4.1盾壳霉对农药和化肥耐受性测定
根据所选农药和化肥的正常使用浓度,每种制成三个不同浓度含药平板,分别测定盾壳霉的萌发率和菌丝生长速度,以不加药剂为空白对照。按式1计算抑制率。
(1)
A:空白对照的萌发率或菌丝生长速度;Ai:各处理的萌发率或菌丝生长速度。
1.4.2农药和化肥对菌株最小全抑制浓度测定
每种供试药剂都制成7个浓度的含药平板,以不加药剂作为对照,测定各浓度下的孢子萌发率,规定孢子萌发率最先为零的浓度即为最小全抑制浓度。
1.5菌株诱变及突变株的筛选
确定对盾壳霉生长具有较强抑制作用的农药或化肥种类,采用紫外诱变的方式筛选对该农药或肥料具有一定耐受性的盾壳霉突变菌株。对盾壳霉分生孢子悬浮液进行紫外诱变[9](107CFU/mL,诱变条件:15 W,30 cm,10 min),取100 μL孢子悬液涂布PDA平板,20 ℃培养。待长出孢子后,洗下孢子涂布在加药平板上(药剂浓度为最小全抑制浓度),长出单菌落时挑出并接种到PDA平板培养到长出孢子,再次洗下涂布到加药平板上(最小全抑制浓度),测定萌发率,萌发率80%以上即为抗性菌株。
1.6抗逆性菌株的遗传稳定性评价
将挑选的抗性菌株接种到PDA平板上20 ℃培养15 d,制成孢子悬液再次转接到PDA板上培养15 d,如此重复8次,取第8次的孢子悬液涂布到含药平板(最小全抑制浓度)上。以菌株JN-CM为对照,比较各抗性株的萌发率。
1.7盾壳霉酶活的测定
1.7.1几丁质酶活测定
采用DNS法测定还原糖生成量[10],通过还原糖生成量比较酶活高低。以胶体几丁质作为底物[11],取1 mL酶液加入试管(以高温灭活的酶液作为对照),并加入1 mL 1%的胶体几丁质磷酸缓冲液,50 ℃水浴10 min,加入3 mL DNS终止反应,沸水浴5 min后迅速拿出冷却至室温。酶活力单位定义为以每小时生成1 μmol的N-乙酰葡萄糖所需的酶量。
1.7.2β-1-3葡聚糖酶活测定
以海带多糖为反应底物。取1 mL粗酶液加入试管(以高温灭活的酶液作为对照),并加入0.8 mL的醋酸缓冲液和0.2 mL的海带多糖(50 g/mL),50 ℃水浴10 min,加入3 mL DNS终止反应,沸水浴5 min后迅速冷却至室温。酶活力单位定义为测定条件下每分钟分解海带多糖生成1 μmol葡萄糖所需的酶量。
1.7.3蛋白酶酶活的测定
方法参见刘旭燕的论文[12]。
2 结果与讨论
2.1JN-CM菌株对农药和化肥的耐受性
2.1.1菌株在正常使用浓度下对农药及化肥的耐受性
将所选农药和化肥分别与PDA平板混合,按正常使用浓度(在实际种植过程中的使用浓度)配制成以下3个浓度梯度,由低到高分别设置为处理1~处理3。(1) 草甘膦(g/L):2.5、5、7.5;(2) 甲氨基阿维菌素苯甲酸盐(g/L):0.25、0.5、1;(3) 啶虫脒(g/L):0.25、0.375、0.5;(4) 吡虫林(g/L):0.5、1、1.5;(5) 氮肥、钾肥、磷肥(g/L):2.5、5、7.5。测定各药剂在不同浓度下对盾壳霉JN-CM孢子萌发和菌丝生长的影响,结果如表1、2所示。从表1、2可看出,除草剂草甘膦,杀虫剂吡虫林对盾壳霉孢子的萌发(最大抑制率分别为98.38%和80%)和菌丝生长(最大抑制率分别为100%和41.76%)均有强烈的抑制作用;化肥与农药不同,只有磷肥对孢子的萌发有一定影响(最大抑制率为18.35%),只有钾肥对菌丝生长有一定抑制(最大抑制率28.71%)。
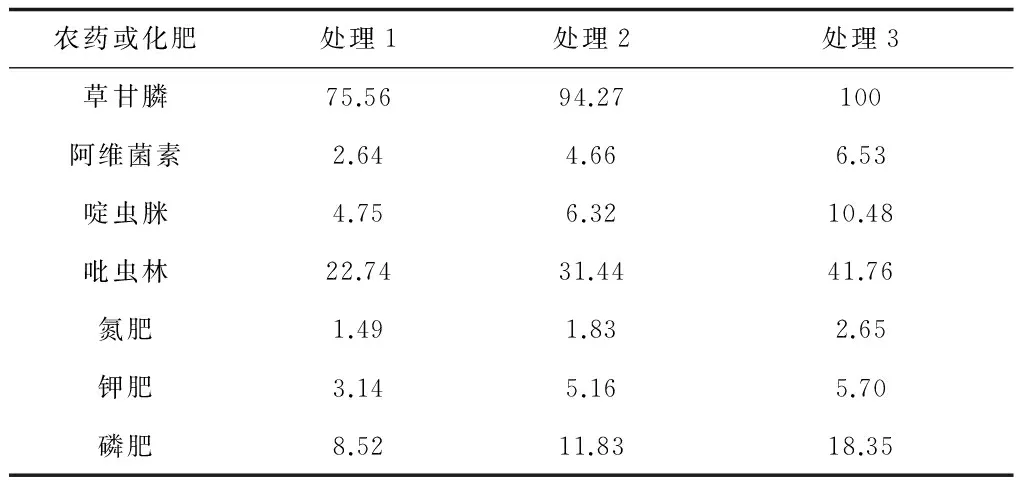
表1 盾壳霉菌丝生长的抑制率/%
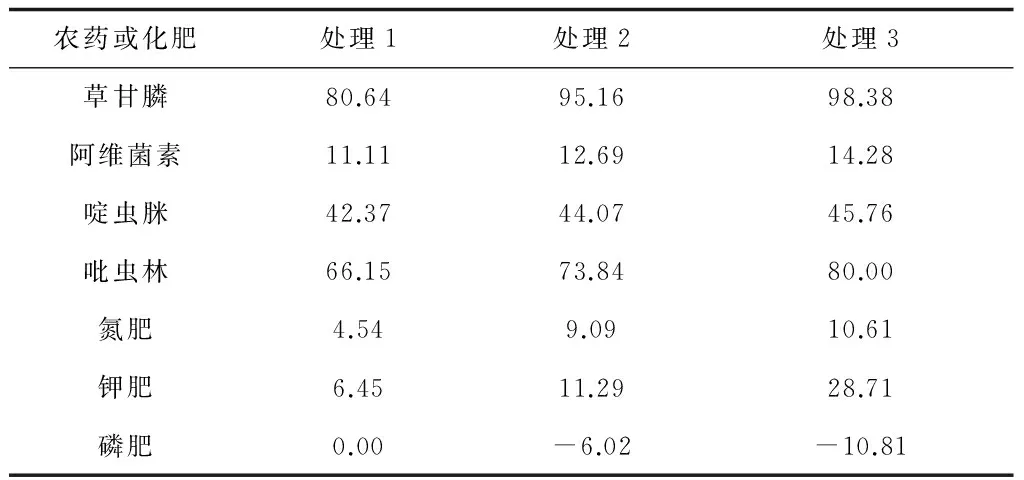
表2 盾壳霉孢子萌发的抑制率/%
2.1.2所选化肥和农药对菌株的最小全抑制浓度
提高农药与化肥的加药量,制成8个浓度梯度。(1)草甘膦:0、3、3.5、4、4.5、5、5.5、6(g/L);(2)吡虫林:0、2、2.5、3、3.5、4、4.5、5(g/L);(3)啶虫脒:0、5、5.5、6、6.5、7、7.5、8(g/L);(4)甲氨基阿维菌素苯甲酸盐:0、10、12.5、15、17.5、20、22.5、25(g/L);(5)磷肥,氮肥,钾肥:0、10、12.5、15、17.5、20、22.5、25(g/L)。提高加药量后,各处理组的孢子萌发率变化如图1所示。
从图1可以看出,氮肥和钾肥在测定浓度下对盾壳霉孢子萌发率并无较大影响,而其他各农药和化肥的最小全抑制浓度分别为:草甘膦为6 g/L、吡虫林为5 g/L、啶虫脒为7.5 g/L、阿维菌素为22.5 g/L、磷肥为25 g/L。结合2.1.1的结果,除草剂草甘膦,杀虫剂吡虫林对盾壳霉的生长抑制作用显著,需要筛选抗逆性菌株。磷肥在高浓度条件下也会对盾壳霉分生孢子的萌发造成显著抑制。化肥在实际使用中,只有追肥才会采用喷洒,基肥通常直接施用于土壤,且化肥使用常出现过量施用的情况,因此盾壳霉与高浓度化肥直接接触的概率较大,因此需要筛选对磷肥具有一定抗逆性的盾壳霉菌株。
2.2紫外诱变及JN-CM突变菌株的筛选
经过紫外诱变后,在加药平板上挑出盾壳霉单菌落接种到PDA平板,去除生长较慢,不产孢子的菌株,每种挑选一株抗逆性菌株,分别命名为UV-G(草甘膦抗性),UV-I(吡虫啉抗性),UV-P(磷肥抗性)。
2.3抗性菌株遗传稳定性
将抗性株UV-G、UV-I和UV-P在PDA平板上连续传代8次,然后涂布到含药平板(最小全抑制浓度)上,测定各菌株孢子萌发率,以菌株JN-CM为对照。结果显示,对照菌株孢子不能萌发,而各抗性株的孢子可正常萌发,且萌发率均在80%以上(数据未给出),表明抗性可以稳定遗传。
2.4抗性株和对照株JN-CM的比较
2.4.1菌丝生长情况及菌丝干重的比较
测定菌株UV-G、UV-I、UV-P和JN-CM在无选择压力条件下的生长速率和菌丝干重。如图2所示,菌株UV-P菌丝生长最快,UV-I则比对照株生长的慢。在菌丝干重方面,各菌株间差别不大。这说明在无选择压力条件下,各抗性菌株生长能力与对照株JN-CM相比无明显差异。
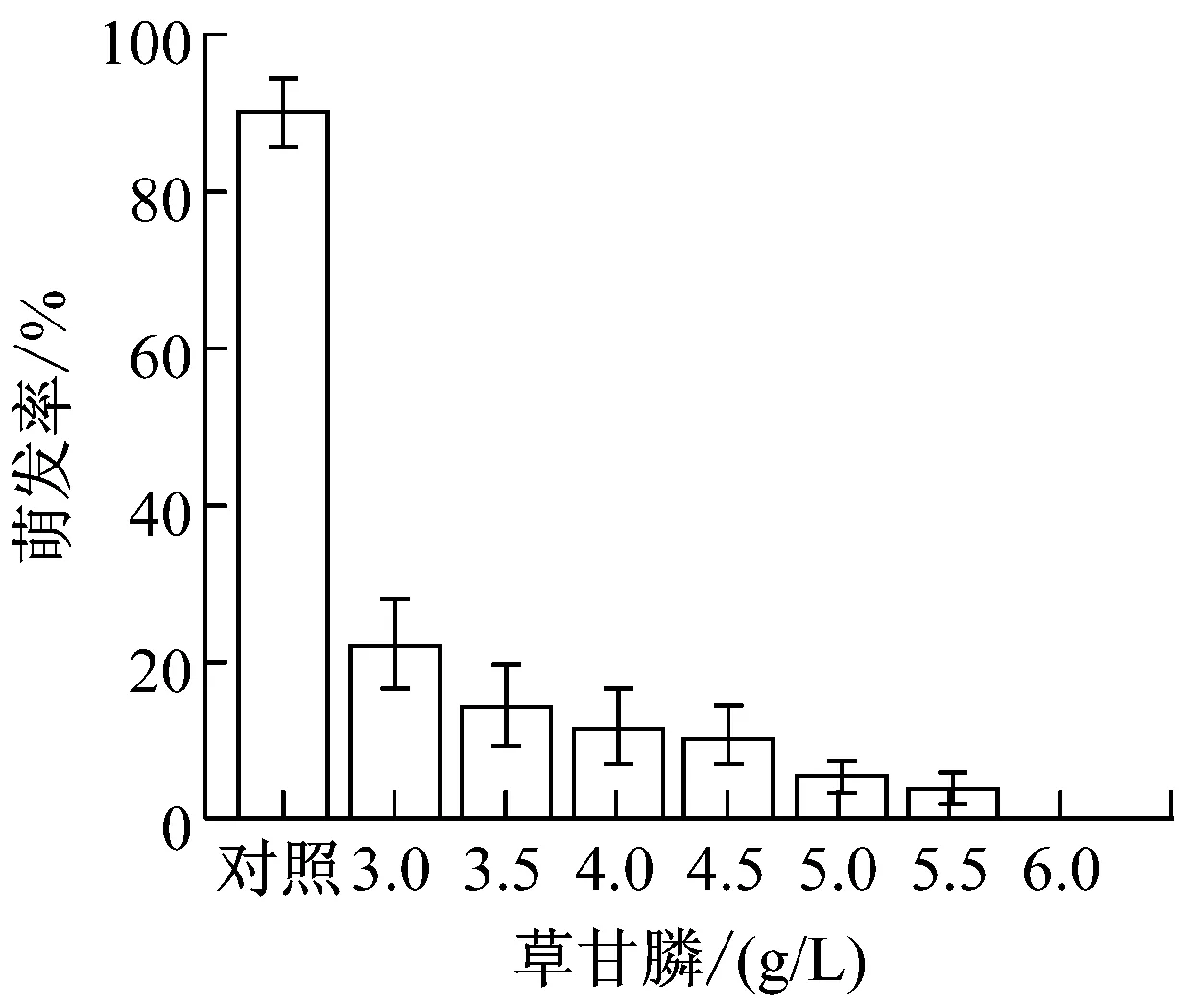
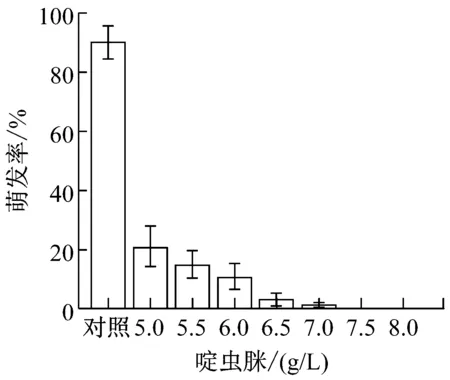
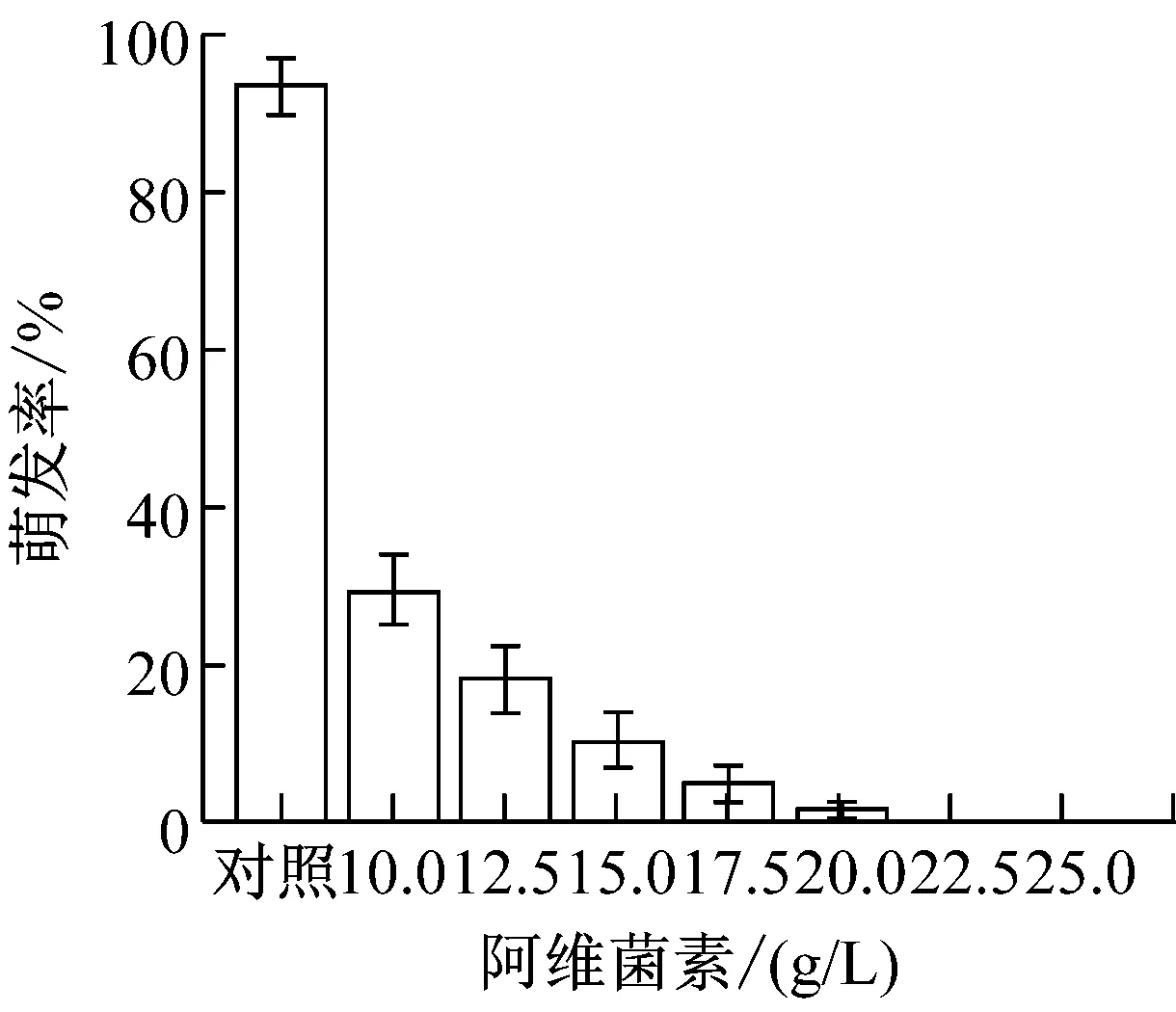
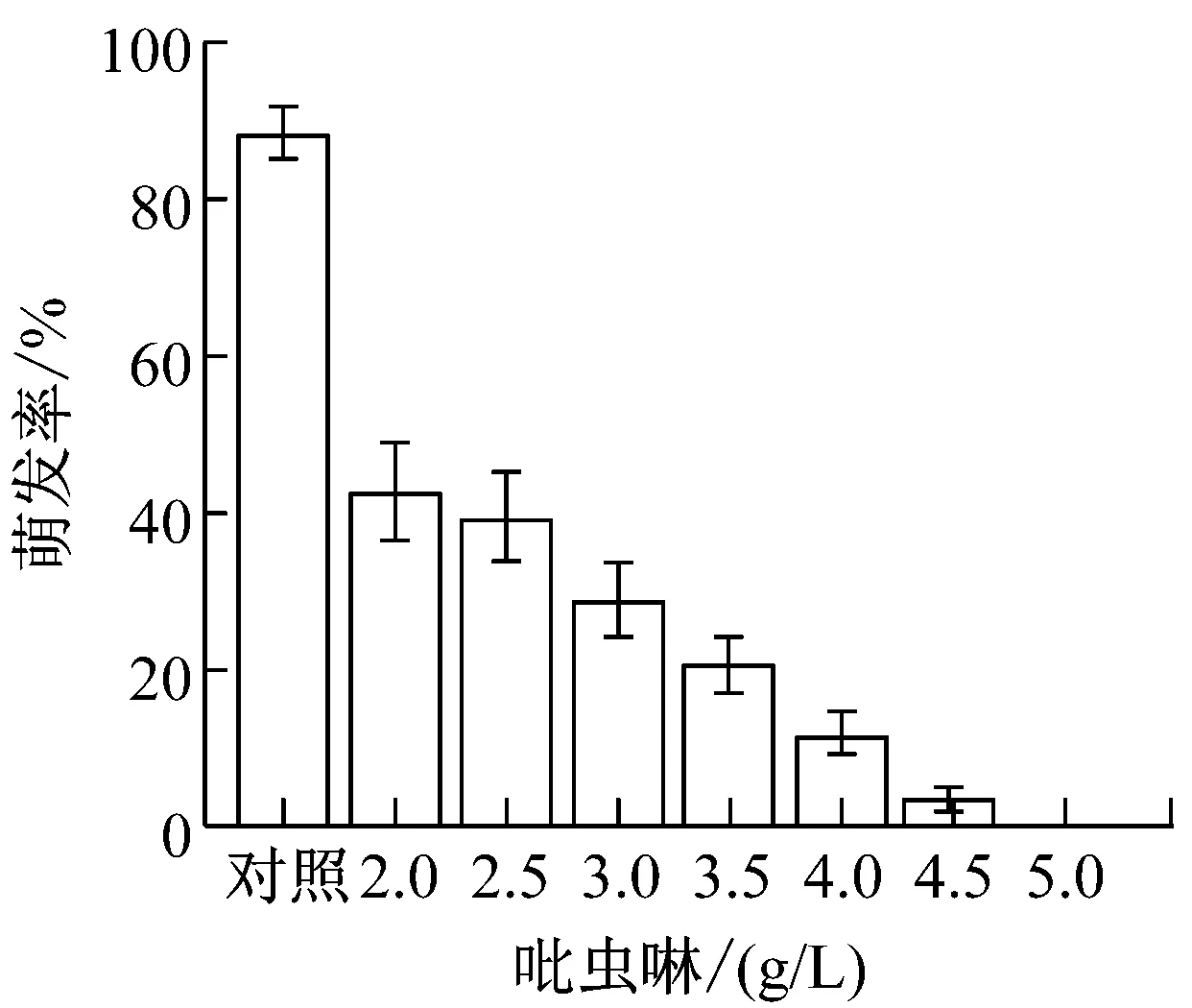
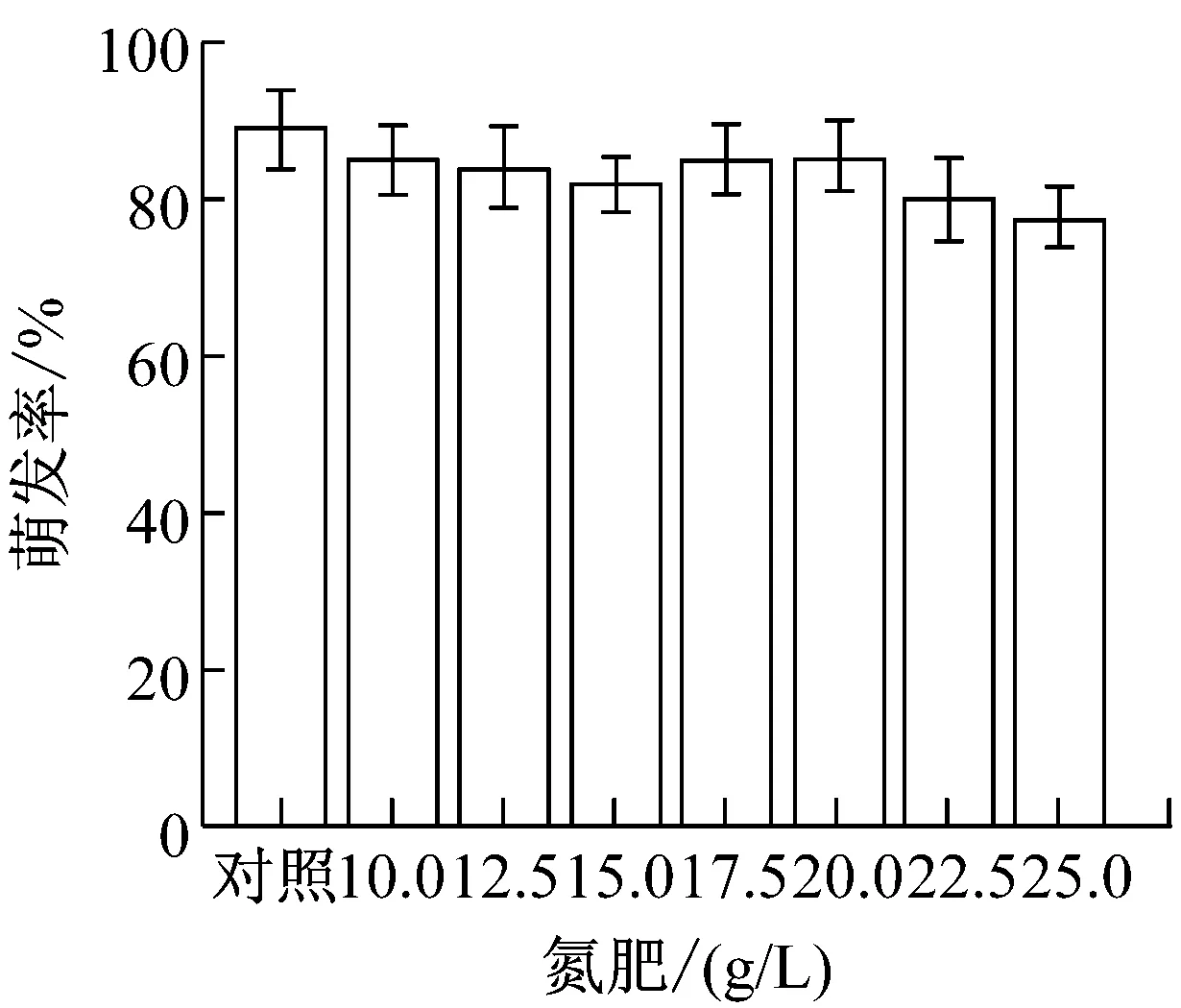
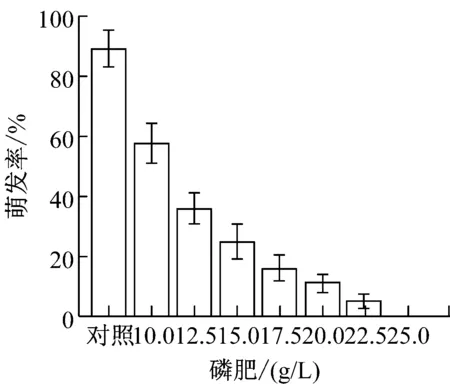
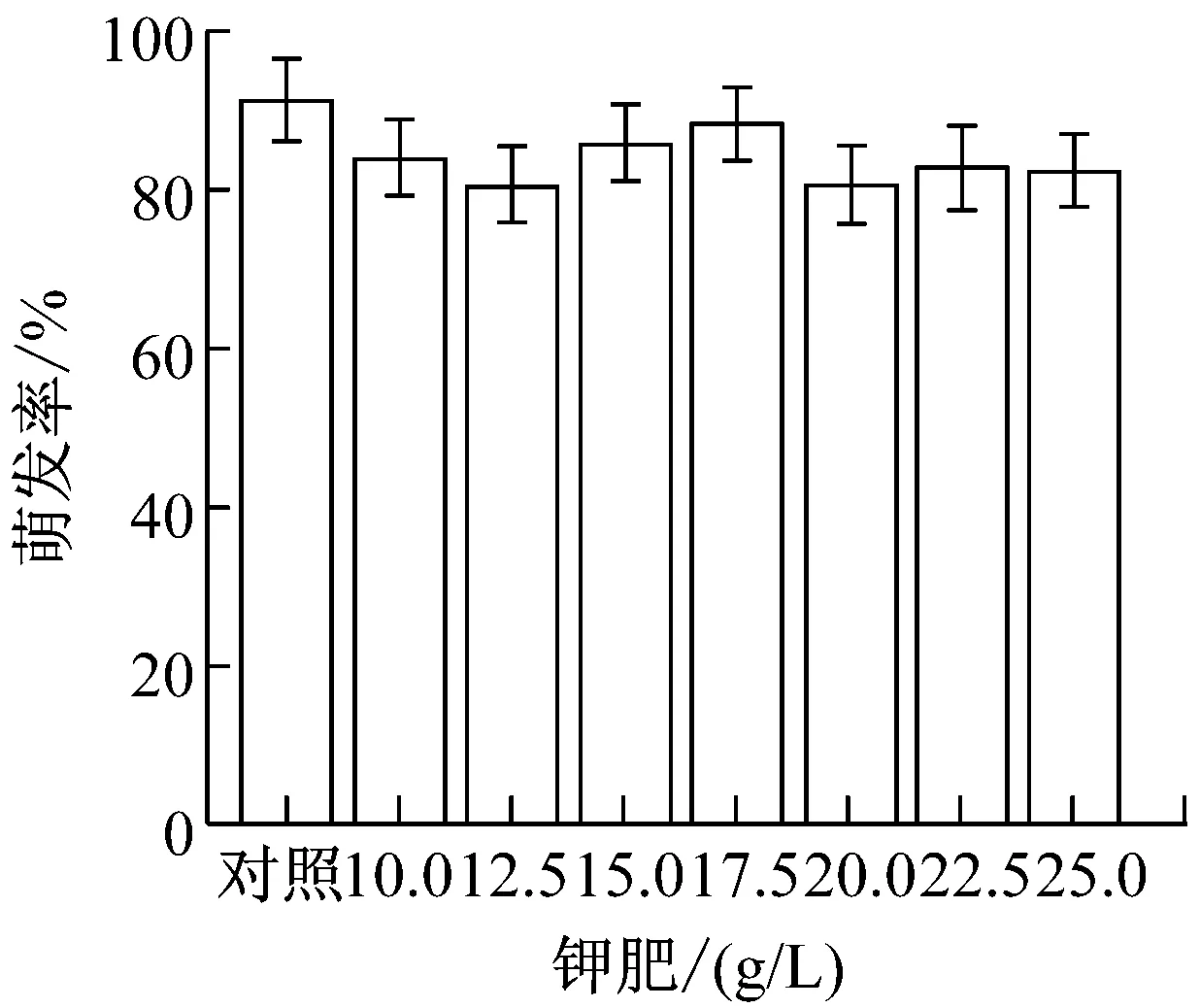
图1 各农药和化肥的最小全抑制浓度
2.4.2孢子萌发率的比较
取各抗逆性菌株的孢子悬液100 μL(106CFU/mL)涂布PDA平板,测定24 h、36 h和48 h的孢子萌发率,以菌株JN-CM作为对照。结果如图3所示,虽然在萌发初期(24 h),JN-CM的孢子萌发率要高于其他突变菌株,但到36 h时,各菌株的孢子萌发率相差不多,48 h各菌株的萌发率已经基本一致,均达到95%以上,表明各菌株在萌发上并没有明显区别。
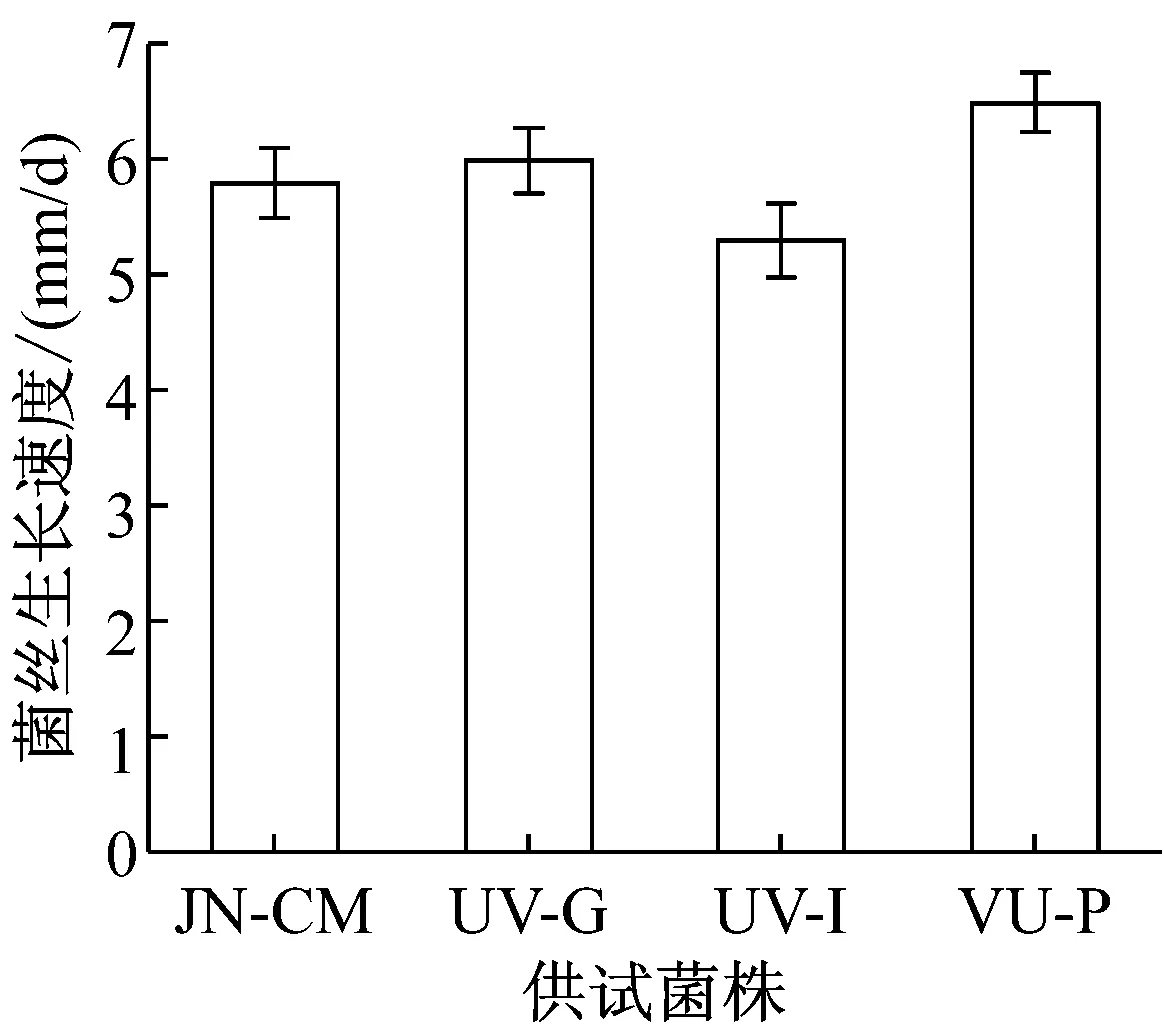
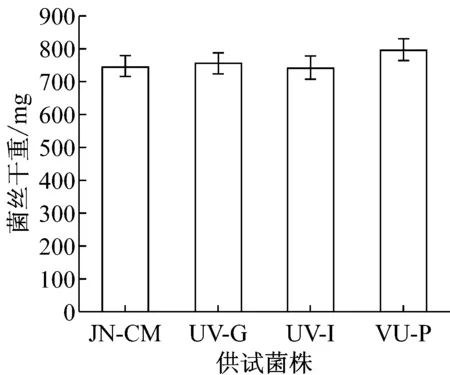
图2 各菌株生长情况比较
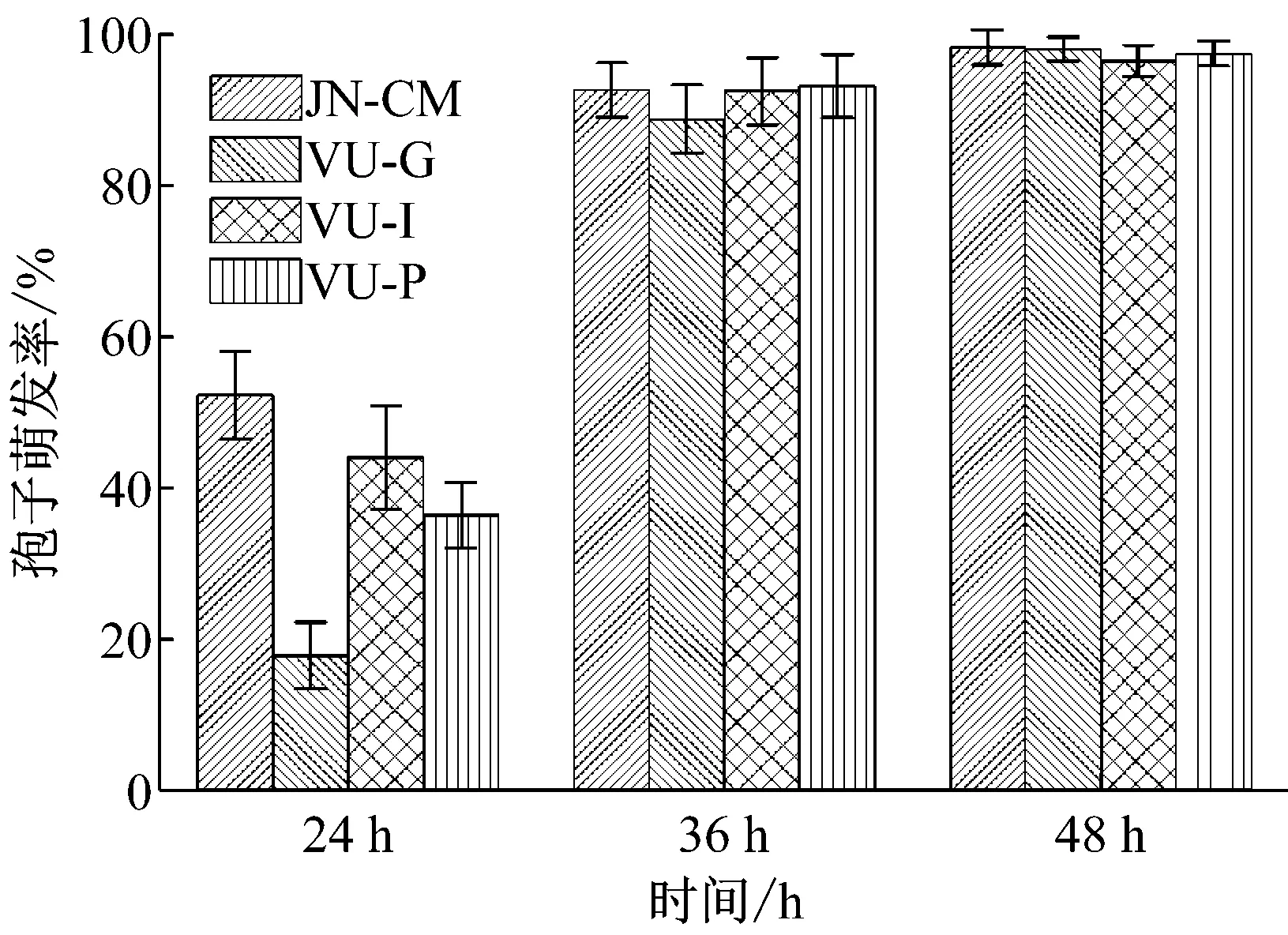
图3 各菌株的萌发率比较
2.4.3与侵染相关的酶的活性
利用MCD培养基液体培养对抗性株和对照株6 d,发酵液离心取上清为粗酶液,分别测定酶活。结果如图4所示,UV-I和UV-P菌株在各侵染相关酶活性方面都与对照菌株JN-CM相差不多,在蛋白酶和葡聚糖酶活性上甚至超过了JN-CM菌株,表现出了较高的活性。而UV-G菌株在酶的活性上都要略低于对照菌株,但是从数值上看,两者差距很小。
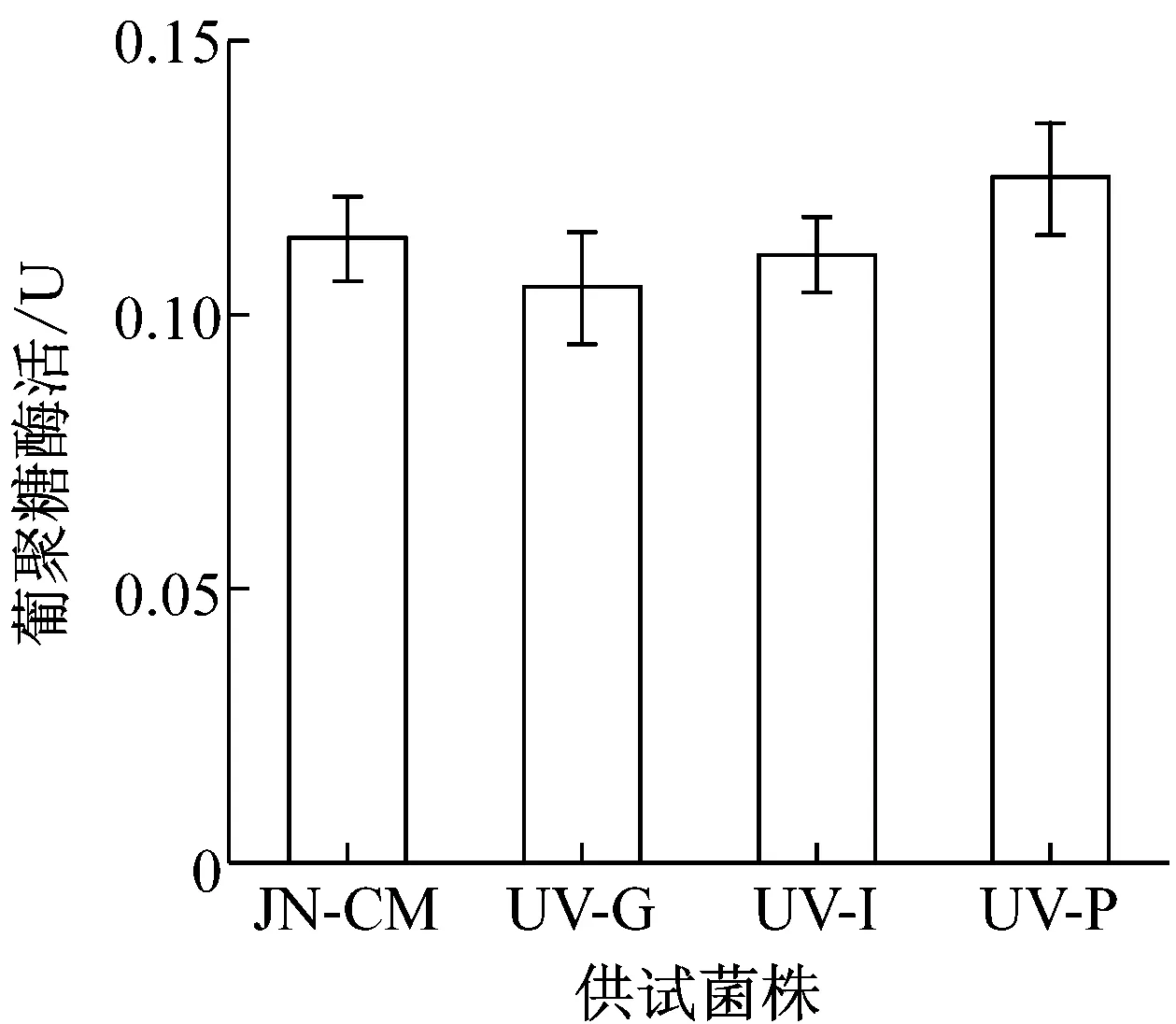
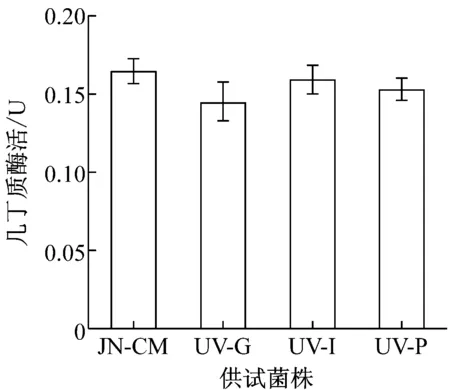
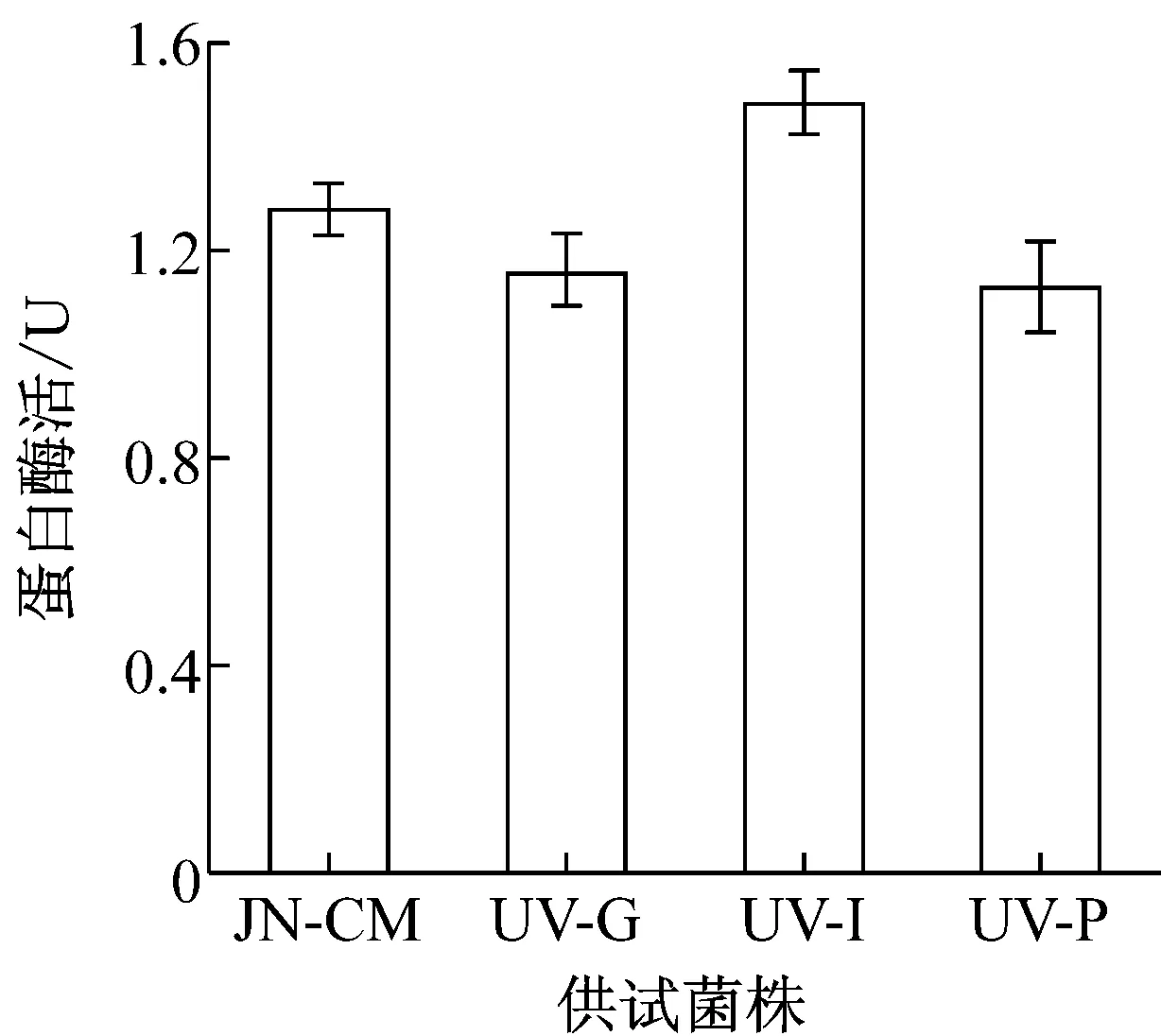
图4 各菌株与侵染相关酶的活性比较
3 结果与讨论
由于在实际应用过程中,农民往往会将盾壳霉与农药或化肥混合施用以降低使用成本,因此,考察盾壳霉对多种常用农药和化肥的耐受性,并筛选相应的抗性菌株,对盾壳霉的推广应用具有现实意义。研究表明,除草剂草甘膦,杀虫剂吡虫啉以及磷肥对盾壳霉菌株JN-CM的菌丝生长和孢子萌发有显著影响。对菌株JN-CM进行紫外诱变,筛选得到3株具有稳定抗逆性的突变菌株。UV-G、UV-I和UV-P三种菌株都具有良好的菌丝生长情况,突变并没有造成明显影响,同时在孢子萌发方面,虽然突变菌株在前期萌发上低于对照JN-CM菌株,但是在到达36 h后已经处在同一水平,萌发率均在95%以上。UV-G菌株几种侵染相关酶的活性要略低于对照,但是在数值上相差不多,仍然具有良好的活性。UV-I和UV-P菌株则具有更好的酶活性,分别在蛋白酶和葡聚糖酶活性方面要高于JN-CM菌株。
筛选得到的抗性突变株,可和上述试验中采用的农药及化肥混合施用,从而增加对菌核病的防效,并减少劳动成本,具有良好的应用前景。
[1]Bolangd GJ,Hall R.Index of plant hosts of Sclerotinia sclerotiorum[J].Canadian Journal of Plant Pathology,1994,16(2):93-108.
[2]Godoy G,Steadman JR,Dickman MB,etal.Use of mutants to demonstrate the role of oxalic acid in pathogenicity of Sclerotinia sclerotiorum on Phaseolus vulgaris [J].Physiological & Molecular Plant Pathology,1990,37(3): 179-191.
[3]王道本.核盘菌论丛[M].北京:北京农业大学出版社,1986.
[4]Campbell WA.A new species ofConiothyriumparasitc on sclerotia[J].Mycologia,1947,39(2): 90-195.
[5]Huang HC,Hoes JA.Penetration and infection of Sclerotinia sclerotiorum byConiothyriumminitans. Can[J].Canadian Journal of Botany,2011,54(5-6): 406-410.
[6]缪华军,李国庆.盾壳霉抗杀菌剂vinclozolin的诱变及突变体的生防潜力[J].中国生物防治,2006,22(1): 73-77.
[7]Giczey G,Kerenyi Z,Fulop L,etal.Expression of cmg1,an exo-beta-1,3-glucanase gene fromConiothyriumminitans,increases during sclerotial parasitism[J].Applied and environmental microbiology,2001,67(2): 865-71.
[8]杨龙.生防菌盾壳霉防治油菜菌核病的生态学基础及其应用研究[D].华中农业大学,2009.
[9]周光明,王光,王嫒等.紫外诱变育种在瘤胃厌氧真菌中的应用效果研究[J].中国草食动物科学,2013,33(4): 33-35.
[10]王庆云,韩巨才.盾壳霉寄生核盘菌过程中葡聚糖酶、几丁质酶及电导率的变化[J].山西农业大学学报,2006,26(1): 22-23.
[11]夏森玉,雷楗勇,金坚等.生防菌盾壳霉抗药性突变菌株的选育[J].工业微生物,2013,43(5): 57-62.
[12]刘旭艳.生防真菌盾壳霉抗杀菌剂菌核净的诱变及其抗性机制分析[D].武汉:华中农业大学,2009.
Breeding of stress resistance mutants about bio-control fungiConiothyriumminitans
JIN Qiang1, DUAN Zuo-ying2, XIA Sen-yu3, SHEN Zhi-song3, LI Hua-zhong2, JIN Jian1
1. School of Pharmaceutical Sciences,Jiangnan University, Wuxi, Jiangsu 214122, China; 2. Key Laboratory of Industrial Biotechnology, Ministry of Education,School of Biotechnology, Wuxi, Jiangsu 214122, China; 3. Wuxi Jiannong Biological technology co., LTD, Wuxi, Jiangsu 214122, China
Tolerance of wild-typeConiothyriumminitansstrain JN-CM were determined to selected pesticides and fertilizer. The results indicated that glyphosate, imidacloprid and phosphate fertilizer had significant inhibitory effects on the strain. Then the mutant stain with a certain degree of tolerance of glyphosate, imidacloprid and phosphate fertilizer were successfully screened through ultraviolet mutagenesis and named as glyphosate (UV-G), imidacloprid (UV-I) and phosphate fertilizer (UV-P), respectively. Three mutant strains had good genetic stability. Mutants had no significant differences between ability of growth and infection-associated enzyme activity if compared with those of wild-type strain,which showed their good application prospects.
Coniothyriumminitans; mutant strain; ultraviolet mutagenesis
10.3969/j.issn.1001-6678.2016.04.002
2015江苏省重点研发计划(现代农业)重点项目(BE2015309)。
金强(1991~),男,硕士研究生。E-mail:jinqiang19@126.com。
金坚,男,教授,博士生导师。Tel:0510-85918219,E-mail:jinjian31@126.com。

