双组份转运系统BrnFE的过表达和表面活性剂的添加对谷氨酸棒杆菌发酵生产L-异亮氨酸的影响
李忠财, 董会娜, 丛丽娜, 张大伟*
1. 大连工业大学生物工程学院, 大连 116034;2. 中国科学院天津工业生物技术研究所, 天津 300308
双组份转运系统BrnFE的过表达和表面活性剂的添加对谷氨酸棒杆菌发酵生产L-异亮氨酸的影响
李忠财1,2,董会娜2,丛丽娜1*,张大伟2*
1. 大连工业大学生物工程学院, 大连 116034;2. 中国科学院天津工业生物技术研究所, 天津 300308
为了提高L-异亮氨酸生产菌株CorynebacteriumglutamicumLD320的产酸水平,通过改善其分泌系统,在C.glutamicumLD320中分别过表达突变型和野生型的双组份转运系统BrnFE操纵子,构建了重组菌LD320/pXMJ19-brnFE和LD320/pXMJ19-brnFE1。通过对两株重组菌的L-异亮氨酸生产分析比较,发现突变型比野生型能更有效地提高L-异亮氨酸产量。同时对LD320/pXMJ19-brnFE1进行表面活性剂添加实验,发现Tween-80为最佳选择,其最佳添加量为0.5 g/L,最佳添加时间为对数期的16 h。最后通过7 L发酵罐放大实验,LD320/pXMJ19-brnFE1的L-异亮氨酸产量由18.53 g/L提高到25.45 g/L,比对照组提高了37%。
双组份转运系统BrnFE; 表面活性剂; 谷氨酸棒杆菌; L-异亮氨酸
L-异亮氨酸(L-isoleucine,ILE)又称“异白氨酸”,是八种必需的氨基酸之一[1],是人体激素、蛋白质合成和能量生成的原料[2, 3],被广泛应用在食品添加剂、药物和动物饲料等方面[4]。目前,谷氨酸棒杆菌及棒杆菌属中的相关微生物已广泛应用于包括L-异亮氨酸在内的多种氨基酸生产中[5-7]。在谷氨酸棒杆菌代谢合成L-异亮氨酸过程中,当胞内L-异亮氨酸积累到一定量时,就会反馈抑制其合成途径的一些关键酶,从而抑制L-异亮氨酸的合成[8]。因此,对于谷氨酸棒杆菌产L-异亮氨酸的发酵来说,如何提高细胞对L-异亮氨酸的外排,对进一步提高L-异亮氨酸的产量具有重要的意义。
BrnFE是谷氨酸棒杆菌(Corynebacteriumglutamicum)中负责支链氨基酸L-异亮氨酸、亮氨酸和缬氨酸转运运输的双组份转运载体[9],由brnFE基因编码。当谷氨酸棒杆菌胞内的支链氨基酸量积累到一定程度时,便会激活brnFE操纵子表达[10],使L-异亮氨酸等氨基酸外排到胞外。通过过表达brnFE基因,可以减少L-异亮氨酸在谷氨酸棒杆菌胞内的积累,削弱L-异亮氨酸在胞内对合成途径中关键酶的反馈抑制作用,从而增加其产量[11]。
同时利用表面活性剂也可以改善细胞膜通透性,在微生物发酵中经常被用来提高目标产物的产量[12]。它可加快物质传递运输,增加胞内胞外的物质平衡,从而提高了细菌对底物、产物的耐受度,解决发酵产物、副产物对微生物细胞生长和酶活性的抑制[13-15]。
本文通过在L-异亮氨酸生产菌株C.glutamciumLD320中过量表达突变型brnFE1基因,增强了胞内L-异亮氨酸到胞外的外排,使其产量增加。同时选择添加表面活性剂作进一步细胞通透性的改善,并对其添加量和添加时间进行了优化,最后在7 L发酵罐上进行了放大实验。
1 材料与方法
1.1材料
1.1.1菌株和质粒
文中所用菌株与质粒均列于表1中,所用引物均列于表2中。
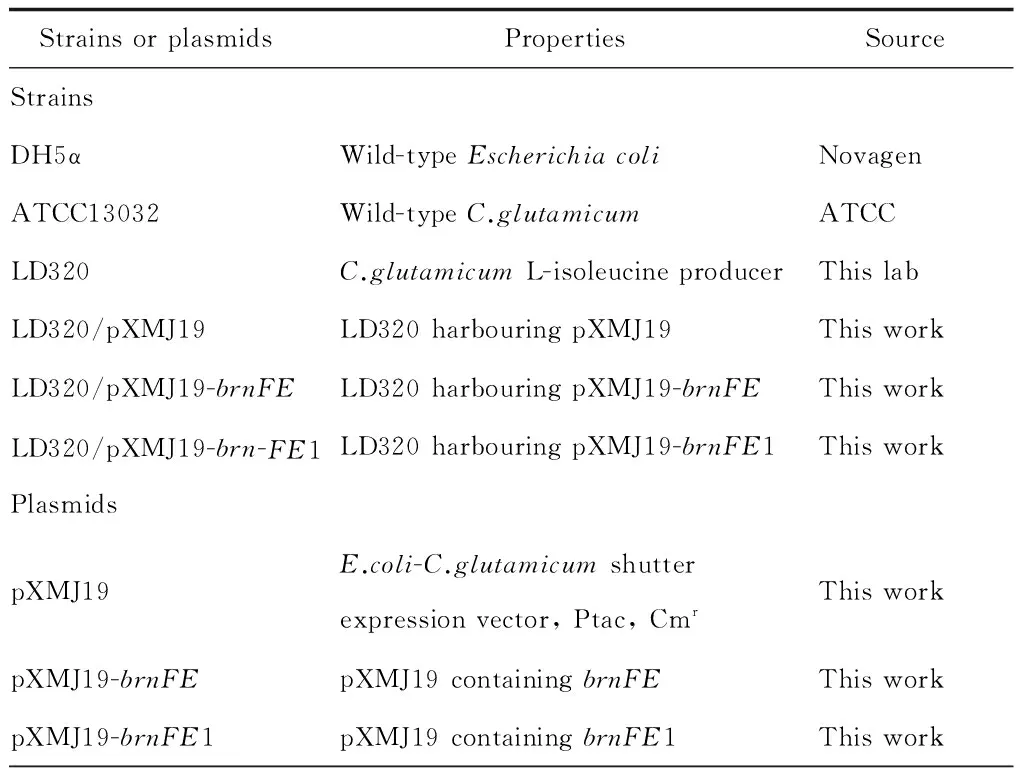
表1 菌株与质粒

表2 引物
1.1.2酶和试剂
试剂:限制性内切酶BamHI和EcoRI购自Thermo Fisher Scientific公司,DNA聚合酶PrimerSTAR Mix购自Takara,2xTaq PCR MasterMix, DNA Marker (Marker III和1 kb Marker)和细菌基因组DNA提取试剂盒(DP302-02)购于北京天根生化科技有限公司,质粒小提试剂盒(D6943-02)和柱式PCR产物纯化试剂盒(D6492-02)购自OMEGA,L-异亮氨酸标准品为Sigma公司提供,其余试剂均为进口或国产分析纯级。
仪器:HPX-9162MBE电热恒温培养箱,上海博讯实业有限公司医疗设备厂;Agilent Technologies 1 200高效液相色谱,Agilent Technologies;PTC-1148型PCR仪,美国BIO-RAD公司;V-1 600可见分光光度计,上海美谱达仪器有限公司;SBA-40E生物传感仪,山东省科学院生物研究所。
1.1.3培养基
固体培养基(g/L):葡萄糖20,酵母粉5,蛋白胨10,NaCl 5,琼脂粉20,pH 7.0。121 ℃灭菌20 min。
种子培养基(g/L):葡萄糖40.0,(NH4)2SO42.0,KH2PO4·3H2O 1.0,MgSO4·7H2O 0.6,FeSO4·7H2O 0.02,MnSO4·H2O 0.01,初始pH 7.0。115 ℃灭菌30 min。
发酵培养基(g/L):葡萄糖60.0,酵母粉3,(NH4)2SO410.0,FeSO4·7H2O 0.05,MgSO4·7H2O 0.6,MnSO4·H2O 0.015,KH2PO4·3H2O 1.0,VB10.004,VH 0.000 5, 初始pH 7.0。115 ℃灭菌30 min。
可根据需要,在各培养基中分别添加相应抗生素:氯霉素,20 μg/mL。
1.2实验方法及测定
1.2.1培养方法
(1) 斜面活化培养:从-80 ℃冰箱取出保藏菌种划线于固体培养基,30 ℃培养12 h ~18 h。
(2) 种子培养:用接种环从新鲜活化斜面上挑取2环谷氨酸棒杆菌于种子基本培养基中(500 mL三角瓶,装液量为25 mL,9层纱布封口),30 ℃,220 r/min振荡培养12 h,OD600约为1.5~1.8。
(3) 摇瓶分批发酵培养:将种子培养液按10%的接种量接入发酵基本培养基中(500 mL三角瓶,装液量为25 mL,9层纱布封口),30 ℃,220 r/min振荡培养进行L-异亮氨酸分批发酵,pH由CaCO3调节。
1.2.2pXMJ19-brnFE和pXMJ19-brnFE1表达载体的构建
分别以C.glutamicumATCC13032和C.glutamicumLD320染色体DNA为模板,使用带有BamHI酶切位点的brnFE-F和带有EcoRI酶切位点的brnFE-R为引物PCR扩增出L-异亮氨酸输出蛋白基因brnFE和brnFE1。使用限制性内切酶BamHI和EcoRI分别对PCR产物及质粒pXMJ19进行双酶切,连接产物化学转化法转入DH5α,在终浓度为20 μg/mL氯霉素的LB平板上37 ℃培养,用引物YZ-F和YZ-R鉴定长出的转化子,挑选阳性克隆,测序。
1.2.3感受态细胞的制备及转化
质粒转化谷氨酸棒杆菌采用电转化法,C.glutamicumLD320 感受态的制备及转化方法参照余秉琦等[16]和van der Rest ME等[17]的方法。
1.2.4表面活性剂的添加对L-异亮氨酸发酵的影响
精确称取各种表面活性剂,分别配置80 g/L的母液,按照实验的不同要求,在无菌条件下,吸取相应的表面活性剂母液,添加到发酵液中。继续培养直至培养结束。探讨其对L-异亮氨酸发酵产量的影响,并进一步优化其添加量和添加时间。
1.2.5菌体生长测定
发酵液用蒸馏水稀释适当倍数,测定600 nm波长下的OD值,使其数值在0.2~0.8之间。菌体干重表示为OD×稀释倍数×0.3 g (DCW)/L。
1.2.6残糖浓度测定
采用SBA-40E生物传感仪测定。取发酵液1 mL离心,取上清液10 μL,稀释100倍后,取25 μL稀释液进样直接读数。
1.2.7氨基酸含量的测定[18, 19]
L-异亮氨酸含量采用高效液相分析系统测定,色谱分离条件:Agilent C18(15 mm×4.6 mm,3.5 μm),2,4-二硝基氟苯柱前衍生测定,乙腈与NaAc溶液进行梯度洗脱,柱温33 ℃,流动相流量1 mL/min,检测波长360 nm。
2 结果与讨论
2.1brnFE在C.glutamicumATCC13032和LD320中的序列比对
在谷氨酸棒杆菌中,双组份转运系统BrnFE由基因brnFE编码,负责支链氨基酸L-异亮氨酸、亮氨酸和缬氨酸的转运运输,brnFE基因来源于野生型菌株C.glutamicumATCC13032,brnFE1基因来源于L-异亮氨酸生产菌株C.glutamicumLD320。通过序列比对发现,在brnF1基因上有一个突变位点(C419T),导致了一个氨基酸(Thr140Ile)的改变,在brnE1基因上有一个突变位点(C110G),导致一个氨基酸(Gln32Arg)的改变。由于LD320是L-异亮氨酸生产菌株,因此brnFE1基因位点的突变可能会加大L-异亮氨酸的外排,进而增加其产量。
2.2LD320/pXMJ19-brnFE和LD320/pXMJ19-brnFE1重组菌株的构建
以L-异亮氨酸生产菌C.glutamicumLD320和C.glutamicumATCC13032基因组DNA为模板克隆brnFE和brnFE1基因片段,将纯化后的PCR产物双酶切后连接到表达载体pXMJ19上,构建出重组质粒pXMJ19-brnFE和pXMJ19-brnFE1,如图1所示。

图1 重组质粒pXMJ19-brnFE 和pXMJ19-brnFE1的构建
将测序验证正确的重组质粒pXMJ19-brnFE、pXMJ19-brnFE1和对照质粒pXMJ19分别电转法转化LD320感受态细胞,用含有氯霉素20 μg/mL的LB平板进行筛选并用引物YZ-F和YZ-R鉴定阳性转化子,所得阳性转化子即为工程菌LD320/pXMJ19-brnFE和LD320/pXMJ19-brnFE1,保存菌株。
2.3不同菌株发酵生产L-异亮氨酸的比较
将构建好的LD320/pXMJ19,LD320/pXMJ19-brnFE和LD320/pXMJ19-brnFE1菌株分别进行摇瓶发酵,以LD320为对照。发酵65 h后,分别取样比较发酵液中不同菌株发酵过程中L-异亮氨酸及副产物积累的差异情况,如图2所示。

1.LD320; 2. LD320/pXMJ19; 3. LD320/pXMJ19-brnFE; 4. LD320/pXMJ19-brnFE1;
图2不同菌株发酵生产氨基酸产量
由图可2知,出发菌株LD320可累积L-异亮氨酸3.66 g/L,亮氨酸0.35 g/L,缬氨酸0.56 g/L。
LD320/pXMJ19中的氨基酸产量有所下降,L-异亮氨酸、亮氨酸和缬氨酸的产量分别为3.47 g/L、0.31 g/L和0.50 g/L,分别较出发菌株下降5.2%、11.4%和9.7%,表明空质粒的转入对于菌体合成氨基酸有一定的影响,这可能是由于菌体代谢负担加重的原故。在LD320/pXMJ19-brnFE菌株中的氨基酸产量较出发菌株LD320都只有少许增加,这与Yin等[11]的研究结果相一致。而LD320/pXMJ19-brnFE1菌中L-异亮氨酸、亮氨酸和缬氨酸的产量分别为4.44 g/L、0.41 g/L和0.68 g/L,分别较出发菌株提高21%、17.1%和21.8%。可以看出,与野生型brnFE基因相比,过量表达brnFE1基因可以有效增加L-异亮氨酸、亮氨酸和缬氨酸的外排量。说明在突变型brnFE1基因上发生的两个位点(C419T)和(C110G)突变有利于L-异亮氨酸等支链氨基酸的外排,减少了其在胞内的积累,从而削弱了代谢途径中的反馈抑制,使其产量增加。
2.4添加表面活性剂
2.4.1不同表面活性剂对L-异亮氨酸发酵的影响
为进一步增加LD320/pXMJ19-brnFE1工程菌的细胞膜通透性,选择添加阴离子表面活性剂SDS、阳离子表面活性剂NP-10、非离子表面活性剂Tween-20、Tween-40、Tween-80和Triton X-100进行摇瓶发酵实验,采用相同初始浓度0.1 g/L,分别在LD320/pXMJ19-brnFE1发酵0 h添加,发酵65 h后,分别取样测定发酵液中菌体生物量及L-异亮氨酸产量,考察不同表面活性剂对生物量和L-异亮氨酸产量的影响。结果如图3所示。
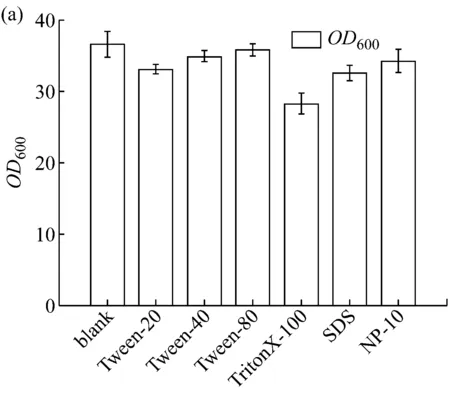

图3 几种表面活性剂对(a)菌体OD600及(b)L-异亮氨酸产量的影响
由图可知,Tween-80效果最好,对菌体生物量影响不大,同时能够提高L-异亮氨酸的产量,而Tween-20、Tween-40和Triton X-100的添加对L-异亮氨酸产量和生物量都有少许的抑制作用,SDS和NP-10对L-异亮氨酸的产量有明显的抑制作用。因此添加的表面活性剂选定为Tween-80,并对其添加量和添加时间作进一步优化。
2.4.2Tween-80最优添加浓度的确定
将表面活性剂Tween-80设置不同的浓度梯度,在LD320/pXMJ19-brnFE1发酵0 h添加进行摇瓶发酵实验,发酵65 h后,分别取样测定发酵液中菌体生物量及L-异亮氨酸产量,考察其对菌体生物量和L-异亮氨酸产量的影响。结果如图4所示。
由图4可知,在发酵初始阶段(0 h),较低浓度表面活性剂Tween-80的添加,并不影响菌体生长,且有助于L-异亮氨酸产量的提高。当其浓度达到0.5 g/L时L-异亮氨酸的产量达到最大值,继续增加Tween-80的浓度则对菌体的生长及L-异亮氨酸的产量出现了明显的抑制。当发酵液中Tween-80浓度超过2.0 g/L时细胞干重下降近26%。因此选取0.5 g/L为最优添加浓度。
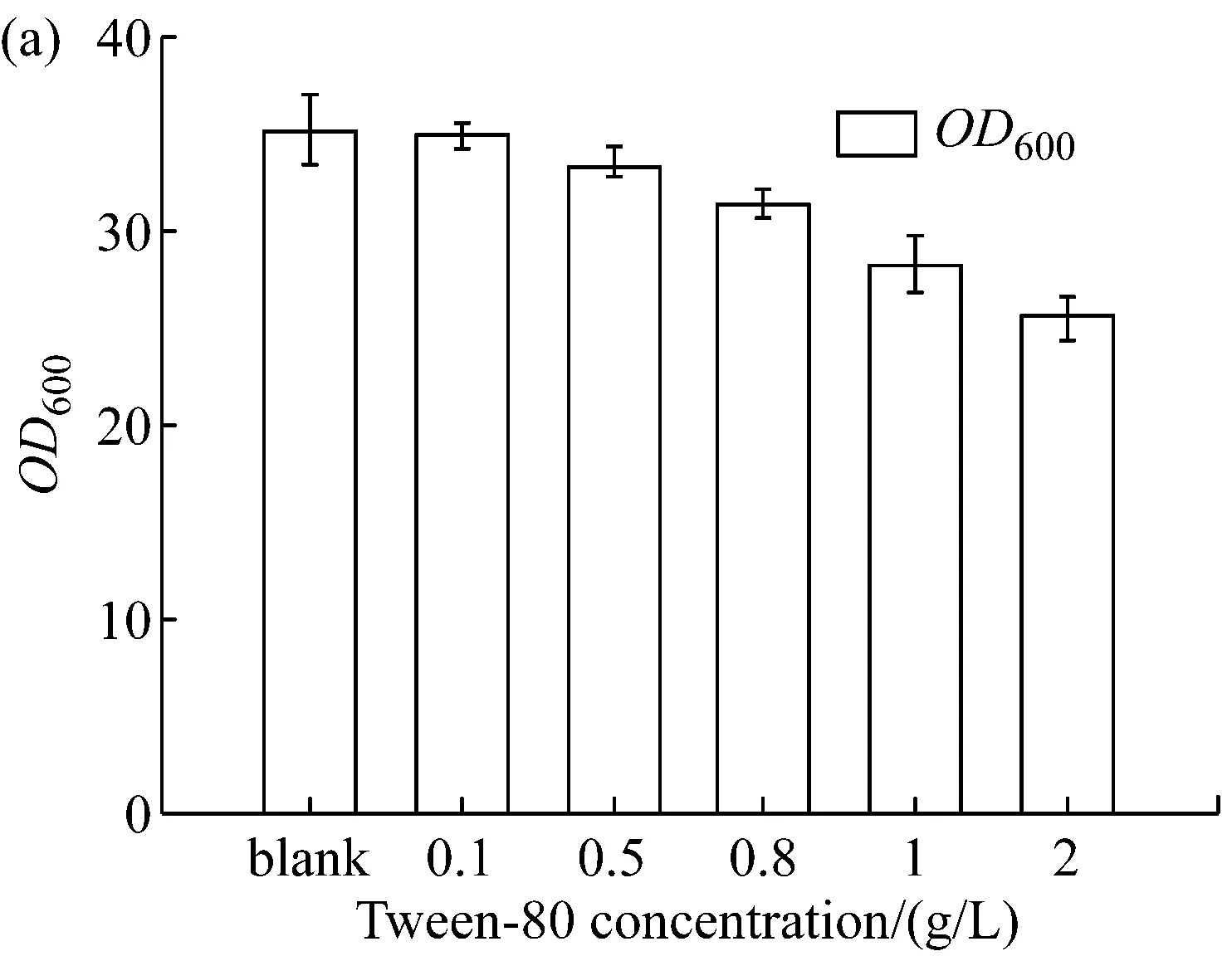
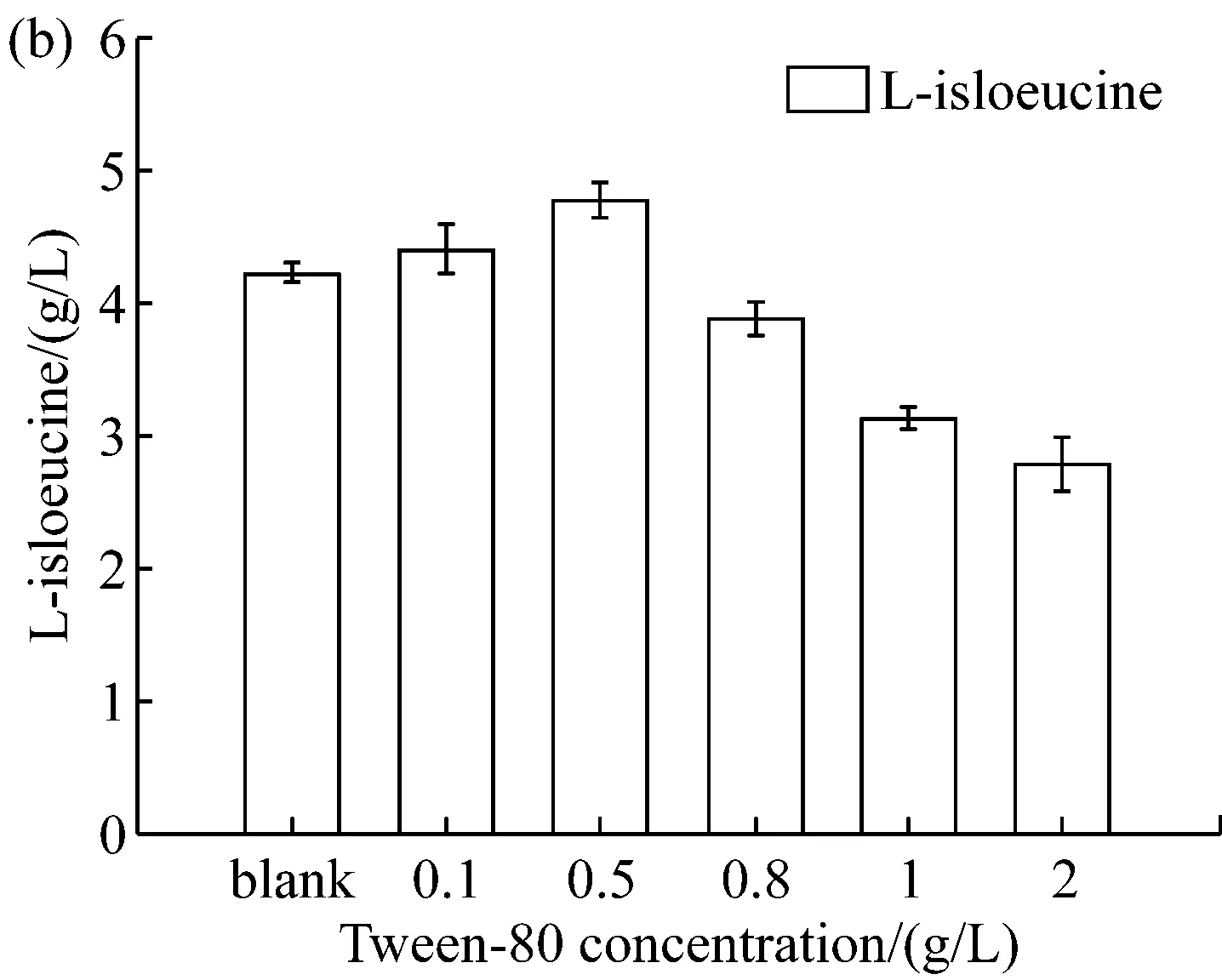
图4 不同浓度的Tween-80对(a)菌体OD600及(b)L-异亮氨酸产量的影响
2.4.3Tween-80最优添加时间的确定
因为表面活性剂具有改变细胞膜通透性和杀菌作用,不同的加入时间会直接影响细菌的生长和代谢[20]。因此通过改变Tween-80不同的添加时间,寻找最优的添加时间对LD320/pXMJ19-brnFE1发酵产L-异亮氨酸产量有重要意义。选择分别在对数期后的12 h、14 h、16 h和18 h加入终浓度为0.5 g/L的Tween-80进行摇瓶发酵,发酵65 h后分别取样测定L-异亮氨酸产量和生物量,结果见图5。
图5(a)所示为摇瓶中LD320/pXMJ19-brnFE1的生长曲线及Tween-80的添加时间。图5(b)为不同时间点添加Tween-80后L-异亮氨酸产量、菌体生物量及单位细胞产酸量(ILE/DCW=异亮氨酸与菌体干重的比值)。从结果中可以发现,在16 h添加Tween-80时,菌体量为10.31 g/L,L-异亮氨酸产量达到最高点4.71 g/L。LD320/pXMJ19-brnFE1单位细胞合成L-异亮氨酸的能力也达到最高0.46。与对照相比,添加Tween-80使得单位细胞合成L-异亮氨酸的能力得到提高。这可能由于在不影响细胞正常生长的条件下,添加Tween-80提高了细胞膜的通透性,加大了细胞分泌L-异亮氨酸的能力。
2.5发酵罐评价
根据摇瓶优化的结果,在7 L发酵罐上进行了一次性添加Tween-80对LD320/pXMJ19-brnFE1产L-异亮氨酸发酵影响的放大实验。选择添加时间为发酵对数期(16 h),添加浓度为0.5 g/L,将未加表面活性剂Tween-80的LD320作为对照组。发酵结果如图6。图6(a)所示为LD320对照组的菌体生物量、L-异亮氨酸产量和葡萄糖消耗的曲线,图6(b)为LD320/pXMJ19-brnFE1的菌体生物量、L-异亮氨酸产量和葡萄糖消耗的曲线。
从图中可以看出,在发酵周期内,葡萄糖消耗方面LD320/pXMJ19-brnFE1和对照组的情况几乎一致。菌体生物量方面,由于LD320/pXMJ19-brnFE1菌内携带的质粒和表面活性剂Tween-80的添加使得其生物量始终低于对照组。L-异亮氨酸产量方面,LD320/pXMJ19-brnFE1的产量为25.45 g/L,与对照组的18.53 g/L相比,产量提高了37%左右。
图5 不同时间添加表面活性剂对L-异亮氨酸分批发酵的影响(a)摇瓶分批发酵生长曲线;(b)不同添加时间下的生物量、单细胞产酸、异亮氨酸产量

(a) LD320; (b) LD320/pXMJ19-brnFE1
3 结论
本实验通过在L-异亮氨酸生产菌株C.glutamicumLD320中过表达突变型brnFE1基因和野生型brnFE基因的比较发现,突变型的brnFE1基因能有效加强L-异亮氨酸的外排能力,其摇瓶产量可达到4.44 g/L,较出发菌株提高了21%,而野生型brnFE基因只少量的提高了L-异亮氨酸产量,这表明发生在brnFE1基因上的两个突变位点(C419T)和(C110G) 有利于L-异亮氨酸的外排。
为进一步增加LD320/pXMJ19-brnFE1细胞膜的通透性,本实验通过比较Tween-20、Tween-40、Tween-80、Triton X-100、SDS和NP-10六种表面活性剂发现,Tween-80能够在不影响菌体生长的情况下增加细胞膜的通透性,促进L-异亮氨酸分泌到胞外。对其添加量及添加时间优化后发现,在LD320/pXMJ19-brnFE1对数期16 h加入终浓度0.5 g/L的Tween-80能有效增加L-异亮氨酸的产量。
最后结合brnFE1基因过表达和添加表面活性剂Tween-80优化后的实验结果,在7 L发酵罐上进行了放大实验,在发酵65 h后,LD320/pXMJ19-brnFE1的L-异亮氨酸产量由18.53 g/L到25.45 g/L,相比对照组提高了37%。本研究对于进一步提高谷氨酸棒杆菌的L-异亮氨酸生产能力具有一定指导意义。
[1]Ikeda S,Fujita I,Yoshinaga F.Screening of L-isoleucine producers among ethionine resistant mutants of L-threonine producing Bacteria[J].Agricultural and Biological Chemistry,1976,40(3):511-516.
[2]Rose WC,Haines WJ,Johnson JE.The role of the amino acids in human nutrition[J].Journal of Biological Chemistry,1942,146(2):683-684.
[3]Blomstrand E.A role for branched-chain amino acids in reducing central fatigue[J].Journal of Nutrition[J].Journal of Nutrition,2006,136(2):544-547.
[4]Park JH,Lee SY. Metabolic pathways and fermentative production of L-aspartate family amino acids[J].Biotechnology Journal,2010,5(6):560-577.
[5]Kind S,Jeong WK,Schröder H,etal.Systems-wide metabolic pathway engineering inCorynebacteriumglutamicumfor bio-based production of diaminopentane[J].Metabolic Engineering,2010,12(4):341-351.
[6]Kind S,Kreye S,Wittmann C.Metabolic engineering of cellular transport for overproduction of the platform chemical 1,5-diaminopentane inCorynebacteriumglutamicum[J].Metabolic Engineering,2011,13(5):617-627.
[7]Park SD,Lee JY,Sim SY,etal.Characteristics of methionine production by an engineeredCorynebacteriumglutamicumstrain[J].Metabolic Engineering,2007,9(4):327-336.
[8]Morbach S,Sahm H,Eggeling L.Use of feedback-resistant threonine dehydratases ofCorynebacteriumglutamicumto increase carbon flux towards L-isoleucine[J].Appl Environ Microbiol,1995,61(12):4315-4320.
[9]Kennerknecht N, Sahm H, Yen MR,etal.Export of L-Isoleucine fromCorynebacteriumglutamicum: a two-gene-encoded member of a new translocator family[J].Journal of Bacteriology,2002,184(14):3947-3956.
[10]Trotschel C,Deutenberg D,Bathe B,etal.Characterization of methionine export inCorynebacteriumglutamicum[J].Journal of Bacteriology,2005,187(11):3786-3794.
[11]Yin L,Shi F,Hu X,etal.Increasing L-isoleucine production inCorynebacteriumglutamicumby overexpressing global regulator Lrp and two-component export system BrnFE[J].Journal of Applied Microbiology,2013,114(5):1369-1377.
[12]梅建凤,航闵.生物表面活性剂及其应用[J].工业微生物,2001,31(1):54-57.
[13]Nemec T,Jernejc K.Influence of Tween 80 on lipid metabolism of anAspergillusnigerstrain [J].Applied Biochemistry and Biotechnology,2002,101(3):229-238.
[14]朱艳,袁其朋,王航.添加氧载体及表面活性剂对番茄红素发酵的影响[J].微生物学通报,2006,33(1):90-94.
[15]韦祎,张淑荣,刘春巧等.添加表面活性剂对α-熊果苷发酵的影响[J].化工学报,2007,58(9):2352-2356.
[16]余秉琦,沈微,诸葛健.适于异源DNA高效率整合转化的谷氨酸棒杆菌电转化法[J].中国生物工程杂志,2005,25(2):78-81.
[17]van der Rest ME,Lange C,Molenaar D.A heat shock following electroporation induces highly effcient transformation ofCorynebacteriumglutamicumwith xenogeneic plasmid DNA[J].Appl Microbiol Biotechnol,1999,52(4):541-545.
[18]许彦芳,许新民,王永利.高效液相色谱柱前自动衍生法测定氨基酸含量[J].河北医科大学学报,1996,17(3):132-134.
[19]何晨光,马雷,徐庆阳等.用高效液相色谱定量分析分支链氨基酸[[J].生物技术通讯,2009,20(4):556-558.
[20]卫云路,宁正祥,郑成.新型表面活性剂在谷氨酸发酵中的应用[J].现代食品科技,2009,25(3):289-295.
Effects of overexpressing two-component export system BrnFE and adding surfactants on L-isoleucine production byCorynebacteriumglutamicum
LI Zhong-cai1,2, DONG Hui-na2, CONG Li-na1, ZHANG Da-wei2
1. School of Biological Engineering, Dalian Polytechnic University, Dalian 116034, China; 2. Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China
In order to increase L-isoleucine productivity inCorynebacteriumglutamicumLD320, the L-isoleucine secretion system was improved. Both the mutatedbrnFEoperon and the wild typebrnFEoperon were cloned into the shutter expression vector pXMJ19 individually, and the resultant plasmids pXMJ19-brnFEand pXMJ19-brnFE1 were transformed into LD320. Then the L-isoleucine production by these two strains was compared and analyzed. More L-isoleucine was produced by LD320/pXMJ19-brnFEthan that by LD320/pXMJ19-brnFE1. In addition, the effects of several surfactants on growth and L-isoleucine production by LD320/pXMJ19-brnFE1 were investigated. The shaking flask results revealed that Tween-80 played a key role in cell growth and L-isoleucine production. The suitable concentration of Tween-80 was 0.5 g/L and the optimal adding time was 16 h. Furthermore, the effects of Tween-80 on cell growth and L-isoleucine production by LD320/pXMJ19-brnFE1 was also investigated in a 7 L fermentor. The concentration of L-isoleucine increased from 18.53 g/L to 25.45 g/L, which was 37% higher than that of the control strain.
BrnFE; surfactants;Corynebacteriumglutamicum; L-isoleucine
10.3969/j.issn.1001-6678.2016.04.001
国家自然基金(31370089),天津市科技支撑计划重点项目(14ZCZDSY00065),天津市自然科学基金(16JCYBJC23500,15JCQNJC09500)。
李忠财(1989~),男,硕士研究生。E-mail:li_zhc@tib.cas.cn。
丛丽娜(1962~),女,教授。E-mail:linacong@163.com;张大伟(1978~),男,研究员。E-mail:zhang_dw@tib.cas.cn。

