一株耐高温纤维素酶产生菌的分离和鉴定
任世英, 邵 奎, 李 雯, 张 威, 刘 飞
1. 淮阴工学院生命科学与食品工程学院, 江苏 淮安 223003;2. 淮阴工学院化学工程学院, 江苏 淮安 223003;3. 江苏省生物质转化与过程集成工程实验室, 江苏 淮安 223003
一株耐高温纤维素酶产生菌的分离和鉴定
任世英1,3,邵奎1,李雯1,张威1,刘飞2*
1. 淮阴工学院生命科学与食品工程学院, 江苏 淮安 223003;2. 淮阴工学院化学工程学院, 江苏 淮安 223003;3. 江苏省生物质转化与过程集成工程实验室, 江苏 淮安 223003
为获得耐高温的纤维素酶产生菌,从农田旁稻草堆底取样,采用液体滤纸条试管法和纤维素刚果红平板法,分离到6株能够在45 ℃生长良好且降解纤维素的耐高温菌株,分别标为A1-A6,其中菌株A1透明圈直径和菌落直径比值为4,DNS法测定还原糖浓度较高,确定为实验菌株。菌体呈短杆状,G+,易褪色,具有运动性,过氧化氢酶、淀粉水解、明胶液化、甲基红试验、硫化氢、葡萄糖氧化发酵、PHB类脂粒、异染粒、纤维素分解、反硝化试验呈阳性,乙酰甲基甲醇试验、吲哚试验、硝酸盐还原试验、卵磷脂酶实验呈阴性,以FPA酶活为主,羧甲基纤维素酶活为辅。根据细菌形态、生理生化特征,参照《伯杰氏细菌系统鉴定手册》初步鉴定为纤维单胞菌属,即Cellulomonas。
纤维素酶产生菌; 纤维素; 耐高温; 纤维单胞菌属
纤维素是地球上最丰富的有机物质,是木材、纸张、棉、麻和农副产品的主要成份,是人类最经济、最广泛的自然资源[1,2]。纤维素酶(cellulase)又称纤维素酶系,是一类复杂的复合物,是所有参与降解纤维素并将其最终转化为葡萄糖的各种酶的总称[3]。纤维素酶最初是在蜗牛的消化液中发现的,除了已知的许多微生物能分泌纤维素酶外,一些高等动植物也能分泌[4]。微生物产纤维素酶研究较多,已发现许多真菌和细菌都能分解利用纤维素,目前用于研究生产纤维素酶的微生物大多属于真菌,其中研究较多的是木霉属、曲霉属、青霉属、根霉属和漆斑霉属。细菌、放线菌由于分泌的纤维素酶活性较低且胞外分泌型较少相对研究不多[5]。
纤维素酶在工业中有很大的实用价值。可催化纤维素水解,成为低聚合度纤维素和葡萄糖。可利用它把纤维素发酵制糖、酒精和食品。用于饲料添加剂,可破解植物细胞壁,提高饲料利用率。在纺织工业中用于牛仔服的生物水洗,代替传统的石磨工艺;用于棉布的酶减量处理,使织物手感厚实柔软;用于棉麻织物可除去织物表面的毛羽,使外观光洁,减少刺痒感;可增大纤维素无定形区,提供良好的染色条件[6,7]。用于中草药可提高其有效成分的提取。可以提高酒和其他酿造产品的产率。还可用于蔬菜汁或果汁的生产[8]。开发新型的耐高温纤维素酶产生菌,并揭示其所产酶的催化特性和热稳定性机制等,具有重要的理论意义和潜在的应用价值。
本文从稻草堆肥中筛选出6株耐高温纤维素酶产生菌,通过酶活力比较,选定其中1株作为实验菌株,并对其生长特性、生理生化特性进行研究,最后进行菌种鉴定,为耐高温纤维素酶产生菌的研究提供新材料,为耐高温纤维素酶的工业应用提供理论基础。
1 材料与方法
1.1材料
1.1.1样品来源
农田旁陈旧性稻草堆底。
1.1.2培养基[6]
刚果红纤维素培养基(纤维素酶产生菌初筛):KH2PO40.5 g、MgSO40.25 g、琼脂粉20 g、纤维素粉1.88 g、刚果红0.20 g、蒸馏水1 000 mL、pH 7.0。
种子培养基:复合蛋白胨10 g、葡萄糖10 g、酵母膏10 g、pH 7.0、蒸馏水1 000 mL,121 ℃灭菌20 min。
液态发酵培养基:稻草4 g、麸皮l g、(NH4)3PO4营养液((NH4)3PO42.06%、MgSO4·7H2O 0.05%、KH2PO40.01%) 200%(V/W))12.5 mL、调pH至6.0~7.0、蒸馏水1 000 mL,121 ℃灭菌20 min。
保藏培养基:羧甲基纤维素钠(CMC-Na)5 g、蛋白胨5 g、KH2PO41 g、MgSO4·7H2O 0.5 g、酵母粉0.5 g、琼脂粉20 g、pH自然、蒸馏水1 000 mL,121 ℃灭菌20 min。
滤纸条培养基:于10 mL试管中加入无机盐溶液5 mL,加1条定量滤纸条(9 cm×1 cm),垂直立于试管中,并使一部分露出液面,加棉塞,于121 ℃灭菌20 min备用。
高氏1号培养基:可溶性淀粉20 g、KNO31 g、NaCl 0.5 g、K2HPO40.5 g、MgSO40.5 g、FeSO40.01 g、琼脂20 g、水1 000 mL、pH 7.2~7.4,于121 ℃灭菌20 min。
1.2方法
1.2.1耐高温纤维素酶产生菌株的筛选
1.2.1.1菌株的初筛
将采集的含菌样品放入三角瓶,加入50 mL无菌水和少量无菌玻璃珠,振荡混匀后静置,吸取上清液进行10-1、10-2、10-3、10-4、10-5和10-6梯度稀释,取10-5和10-6稀释液各100 μL涂布于刚果红纤维素培养基平板,45 ℃恒温培养2 d,挑取透明圈明显的菌落,再于平板上划线分离,重复3次,挑单菌落接种于滤纸条培养基,45 ℃恒温培养2 d,选出透明圈直径与菌落直径比值大的菌株进行复筛。
1.2.1.2菌株的复筛
将初筛得到的单菌落接种于种子培养基,测定发酵液中还原糖含量,将还原糖浓度高的菌株接种于液态发酵培养基,三个平行,45 ℃,130 r/min,摇床振荡培养48 h,测定粗酶液的CMC酶活力和滤纸酶活力,选择CMC酶活力和滤纸酶活力较高的菌株为实验菌株。
1.2.2酶活测定[8]
1.2.2.1葡萄糖标准曲线的绘制
原理:3,5-二硝基水杨酸(DNS)与还原糖共热后被还原成棕红色的氨基化合物,在一定范围内还原糖的量和反应液的强度成比例关系,利用分光光度计测出其在540 nm处的吸光度,得出还原糖的量。
葡萄糖标准溶液的配制:将葡萄糖置于110 ℃烘箱中烘2 h至恒重,称取0.108 g,溶解并定容至100 mL。
取14支具塞试管,依次编号为0,1,2,3,4,5和6并作平行实验。由于反应体系总体积不同,所以需作不同标准曲线,所加的量也有所不同,现以总体积为9 mL体系为例:
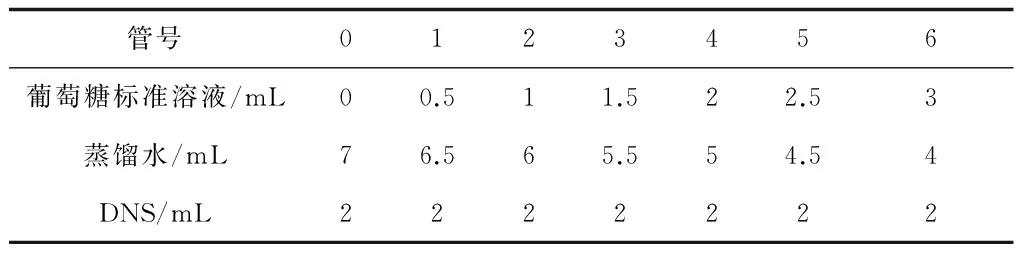
表1 葡萄糖标准曲线绘制
摇匀后置于沸水浴中加热5 min,冷却定容至25 mL,摇匀后以0号管为对照,测定OD540值,以葡萄糖含量(μmol/mL)为横坐标,OD540值为纵坐标,绘制标准曲线[9]。
1.2.2.2粗酶液制备
将菌种由培养斜面接种到50 mL(装于250 mL锥形瓶)种子培养基,45 ℃,130 r/min摇床振荡培养24 h,按2%的接种量加入到100 mL发酵培养基(装于500 mL锥形瓶),45 ℃,130 r/min摇床振荡培养48 h,5 000 r/min离心10 min,所得上清液即为粗酶液。
1.2.2.3羧甲基纤维素钠盐(CMC-Na)酶活性测定
原理:纤维素酶对CMC-Na有降解能力,生成葡萄糖等还原糖,再用DNS法显色,用标准葡萄糖溶液作标准液,在540 nm处测其吸光度,以每分钟生成相当于1 μmol的葡萄糖为一个酶活单位(1 U/mL)[10]。
取3支带有20 mL刻度的试管,1支管作空白对照,2支管作平行样品管。每支样品管中加1 mL粗酶液,置于50 ℃水浴锅中预热2 min,然后在3支试管中分别加入4 mL已预热至50 ℃的底物溶液,反应5 min取出,每管立即分别加入1 mL 2 mol/L氢氧化钠溶液和2 mL DNS显色液,摇匀后在对照管中再加入1 mL粗酶液。将3支试管放入沸水浴中,5 min后立即取出,流水冷却,用蒸馏水定容至20 mL,于540 nm处测OD值。
酶活力计算:从标准曲线中查出葡萄糖μmol数。

其中:5为酶与底物作用时间(min);Ew为粗酶液的体积(mL);U是指在特定条件下,每分钟催化纤维素水解成1 μmol葡萄糖的酶量[6]。
1.2.2.4滤纸酶活力(FPA)的测定[11]
滤纸是聚合度和结晶度都居“中等”的纤维性材料,以其为底物经纤维素酶水解后生成还原糖的量来表征纤维素酶系总的糖化能力的方法,此方法应用广泛,它反映了三类酶组分的协同作用,统称滤纸酶活[10-12]。
取1 mL稀释10倍的粗酶液,加入l mg滤纸条、1 mL pH 5.0的柠檬酸缓冲溶液于55 ℃保温60 min,再加入3 mL DNS试剂,于沸水中煮15 min,采用DNS法测定OD540,对查葡萄糖标准曲线,以每分钟酶液产生1 μmol还原糖所需的酶量为一个酶活单位(1 U/mL)。
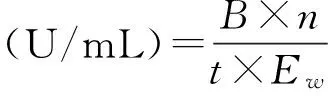
其中:B为从标准曲线中查得的净葡萄糖量(μmol);n为粗酶液稀释倍数;Ew为测定时吸取稀释粗酶液毫升数(mL);t为酶与底物作用时间(min)。
1.2.3生长曲线绘制
发酵培养过程中,每隔2 h取培养液,测定其OD600,绘制生长曲线。
1.2.4菌种鉴定
对分离纯化的菌株进行形态观察和生理生化测试,参照《伯杰氏细菌系统鉴定手册》第八版及相关文献,初步对菌株进行鉴定。
2 结果与讨论
2.1耐高温纤维素酶产生菌株的筛选
通过初筛,挑出6株能在纤维素-刚果红琼脂培养基上产生明显透明圈的菌株,标记为A1-A6,透明圈直径、菌落直径和其比值见表2,由表2可知A1菌株的透明圈直径和菌落直径比最大,一般认为具有较高纤维素酶活性的菌株在平板上能较快地产生较大的透明圈。6株耐高温纤维素酶产生菌,其菌落特征、细胞形态和革兰氏染色结果见表3,菌落多为白色、不透明,杆状居多,全部为革兰氏阳性菌。通过测定发酵液中还原糖含量(表4)进行复筛,得知菌株A1的酶活力最高,达到0.0914 U/mL。结合其他特征最终确定菌株A1为实验菌株[13,14]。
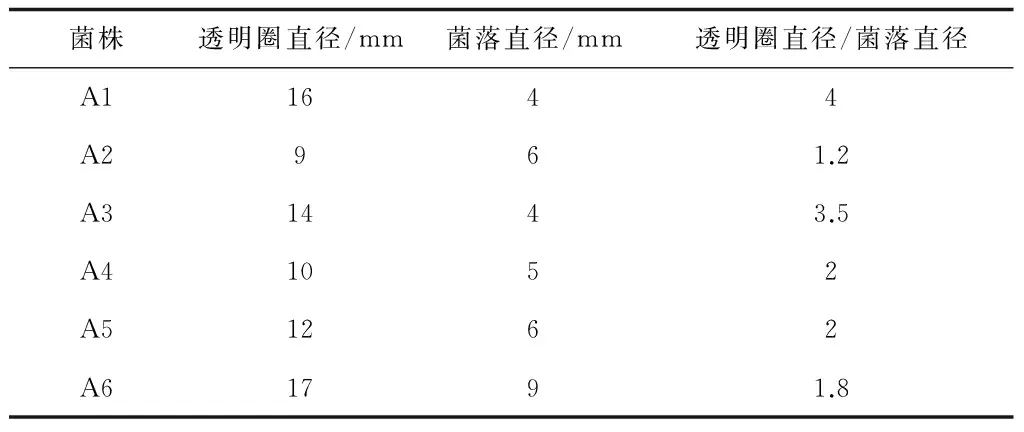
表2 6株耐高温纤维素酶产生菌透明圈直径和菌落直径比

表3 6株耐高温纤维素酶产生菌的菌落和个体形态特征
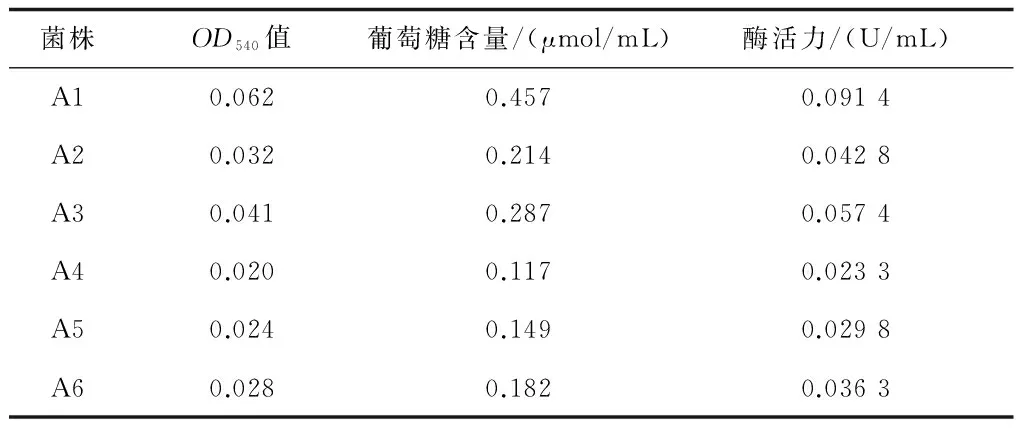
表4 还原糖浓度测定
2.2菌株A1生长曲线
由菌株A1的生长曲线(图1)可见,0 h ~12 h处于停滞期,12 h ~20 h处于对数生长期,22 h菌株达到最大生长量,OD600约为1.2,随后进入稳定期,维持较长稳定期,对于纤维素酶的产生有利。
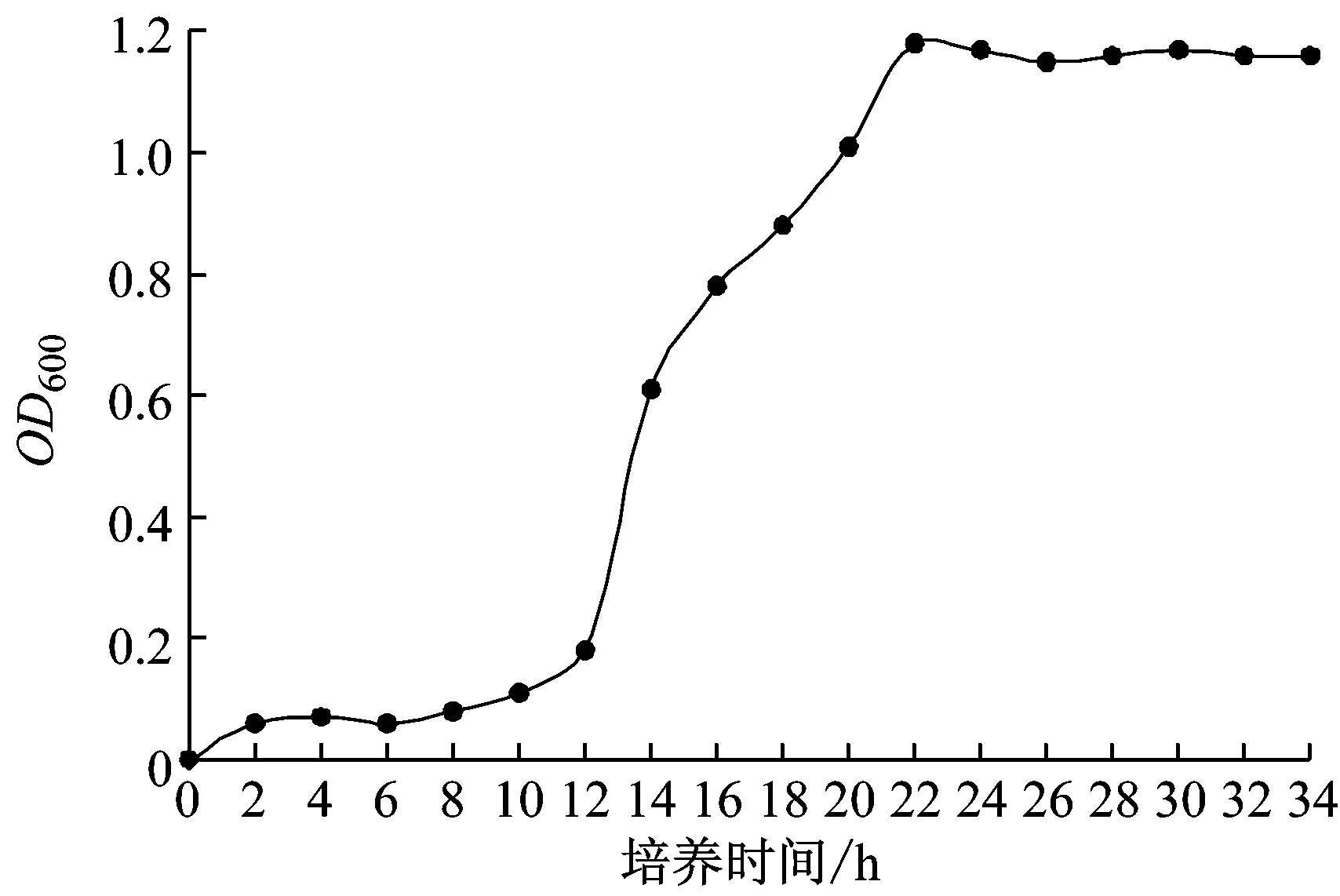
图1 菌株A1的生长曲线
2.3菌株A1产酶活性测定
2.3.1葡萄糖标准曲线绘制
通过配置一系列不同浓度的葡萄糖标准溶液,利用DNS法对其在540 nm下的吸光度进行测量,绘制标准曲线,得到方程为:y=0.123 4x+0.005 6,R2=0.995,表明OD540和葡萄糖浓度之间呈很好的线性关系,通过该方程可计算出溶液中葡萄糖的浓度。
2.3.2菌株A1产酶活性特点
通过CMC-Na和FPA两种方法测定菌株A1所产纤维素酶活性(图2)。在CMC-Na方法中,4 h有酶产生,可测到酶活,24 h酶活达到最高,随后酶活缓慢下降;FPA方法中,4 h可测到酶活,16 h达到最高,随后下降,到20 h后几乎保持不变。FPA法测得酶活比CMC法测得酶活高,因为纤维素酶是由多种酶组成的混合酶系,不同组分的酶相互协同有利于提高纤维素酶的活力,推测A1产生的纤维素酶一般以FPA酶活为主,CMC酶活为辅[15]。
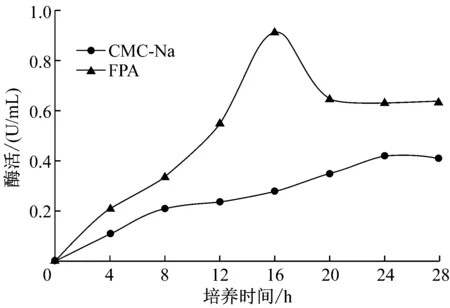
图2 菌株A1产酶特性
2.4菌种鉴定
2.4.1形态观察
在高氏1号培养基中插片取样,经显微镜观察,菌丝呈绿色丝状分枝。菌株A1在刚果红纤维素培养基表面气生菌丝呈白色蔓延,菌落呈灰白色同心圆形、边缘不整齐、齿状、表面光滑湿润、不透明。在高氏1号培养基表面菌株周围呈黄绿色,菌落背面呈黄褐色。在显微镜下菌体呈短杆状,革兰氏染色呈阳性,但易褪色。
2.4.2生理生化鉴定
菌株A1的生理生化特性如表5所示。

表5 菌株A1的生理生化特征
注:“+”表示为阳性,“-”表示为阴性
根据菌落及菌体形态,结合生理生化鉴定结果,查阅《伯杰氏细菌系统鉴定手册》(第八版)将菌株A1初步鉴定为纤维单胞菌属,即Cellulomonas。
3 结论
细菌纤维素酶产量较低,而且其所产纤维素酶主要为葡聚糖内切酶,大多数对结晶纤维素没有降解活性,且所产生的酶是胞内酶或吸附在细胞壁上,不分泌到培养液中,增加了提取纯化的难度,所以工业上很少采用细菌作为生产菌种[16,17]。但是细菌产生的纤维素酶除了传统的内切、外切纤维素酶外,还会分泌一种纤维小体到胞外,这种纤维小体由多种纤维素酶和半纤维素酶组成,具有较高的水解纤维素的能力,在纤维素废弃物的处理上具有很大的应用潜力。
本研究同时采用液体滤纸条试管法和纤维素刚果红平板法,从稻草堆底筛选到耐高温纤维素酶产生菌株A1,通过其产酶特点、细菌形态、生理生化特征初步鉴定为纤维单胞菌属,即Cellulomonas。该属中的菌为革兰氏阳性,易褪色。常以一根或少数鞭毛运动。不生孢子,不抗酸。兼性厌氧,有的菌株在厌氧条件下可生长但很差。在蛋白胨-酵母膏琼脂上的菌落通常凸起,淡黄色。化能异养菌,可呼吸代谢也可发酵代谢。从葡萄糖和其他碳水化合物在好氧和厌氧条件下都产酸。接触酶阳性。能分解纤维素。还原硝酸盐到亚硝酸盐。最适生长温度30 ℃。广泛分布于土壤和腐败的蔬菜[18,19]。模式菌株为产黄纤维单胞菌(Cellulomonasflavigena)。菌株A1的透明圈直径与菌落直径比为4,对纤维素有很好的降解能力,能够在45 ℃环境以上生长,推测它在堆肥的高温阶段分解纤维素等复杂化合物,对堆肥的最终成熟起关键作用[20,21]。菌株A1能够在45 ℃的高温下生长,同时产生纤维素酶,为其在高温条件下进行应用提供了可能。可以通过分子生物学手段对其进行鉴定,应用基因工程技术来改造菌种,克隆表达高活性、高稳定性、高产量的纤维素酶也是一个研究的热点趋势。
[1]魏志文,赵艳霞,张梅梅等. 1株纤维素分解菌的初步鉴定及酶活检测[J]. 江苏农业科学,2010,2010(1):329-331.
[2]刘丹,王红英,吴星等. 纤维素酶产生菌及其发酵条件优化[J]. 工业微生物,2015,45(4):19-25.
[3]宋俊洲. 大麦芽过程中酶和淀粉特性的研究[学位论文]. 辽宁:大连工业大学,2010.
[4]张强,杨岩. 一株纤维素酶产生菌的筛选鉴定[J]. 四川理工学院学报(自然科学版),2008,21(5):67-70.
[5]陈源源,沈微,石贵阳等. 微生物资源库中产纤维素酶菌株的筛选及其酶学性质研究[J]. 工业微生物,2011,41(6):15-19.
[6]王亮,尚会建,杨立彦等. 纤维素酶的应用研究进展[J]. 河北工业科技,2010,27(6):22-26.
[7]韩峰,孙彩云,宋小焱等. 拟康氏木霉(Trichodermapseudokoningii)UV Ⅲ纤维素酶合成的诱导与阻遏[J]. 工业微生物,2003,33(1):23-26.
[8]刘国栋. 纤维素酶水解纤维素的方法[学位论文]. 重庆:重庆理工大学,2010.
[9]王开胜. 野油菜黄单胞杆菌纤维素酶基因原核表达及其固定化研究[学位论文]. 上海:上海交通大学,2012.
[10]王冠,徐丽,丁皓等. 饲用纤维素酶检测方法的研究[J]. 饲料工业,2012,33(6):38-40.
[11]颜霞,柳晓东,杨俊杰. 高温纤维素酶产生菌的筛选鉴定及其酶性质研究[J].太阳能学报,2011,32(6):35-39.
[12]胡蓉,张姝,吴建伟等. 家蝇纤维素酶的检测及酶活性与其发育的关系[J]. 应用与环境生物学报,2013,19(3):444-448.
[13]鲁雄. 高温纤维素酶产生菌的筛选鉴定及其酶性质研究[学位论文]. 福建:福建农林大学,2012.
[14]耿冰,郭美锦,张嗣良等. pH控制下绿色木霉(Trichodermaviride)流加发酵生产纤维素酶[J]. 工业微生物,2009,39(4):21-26.
[15]徐杨. 纤维素酶高产菌的诱变选育及其酶学性质的研究[学位论文]. 吉林:吉林农业大学,2011.
[16]张伟,石丽娜,付宁等. 耐高温纤维素酶产生菌的筛选鉴定及酶谱分析[J]. 湖北农业科学,2012,51(9):12-16.
[17]胡佳俊,朱仁懿,高旻天.Acremonium纤维素酶在玉米芯糖化中的应用[J]. 工业微生物,2015,45(5):1-6.
[18]张楠,杨兴明,徐春阳等. 高温纤维素降解菌的筛选和酶活性测定及鉴定[J].南京农业大学学报,2010,33(3):82-87.
[19]金伟. 耐高温产纤维素酶真菌的筛选及产酶特性研究[学位论文]. 武汉:武汉工业学院,2012.
[20]张楠,刘东阳,杨兴明等. 分解纤维素的高温真菌筛选及其对烟杆的降解效果[J]. 环境科学学报,2010,30(3):549-555.
[21]Hendrick CW, Doyle JD, Hugley B. A new solid medium for enumerating cellulose utilizing bacteria in soid[J]. Applied and Environmental Microbiology, 1995, 61(5):2016-2019.
Isolation and identification of high temperature resistant bacterium for producing cellulase
REN Shi-ying1, 3, SHAO Kui1, LI Wen1, ZHANG Wei1, LIU Fei2
1. School of Life Science and Food Engineering, Huaiyin Institute of Technology, Huaian 223003, Jiangsu, China; 2. Faculty of Chemical Engineering, Huaiyin Institute of Technology, Huaian 223003, Jiangsu, China; 3. Jiangsu Provincial Engineering Laboratory for Biomass Conversion and Process Integration, Huaiyin Institute of Technology, Huaian 223007, Jiangsu, China
In order to obtain high temperature resistant strains producing cellulase for the application in the high-temperature industrial cellulose degrading field, filter paper disintegration and CMC-Congo red staining were used to initially screen the cellulose-degrading strains at 45 ℃. 6 target strains were isolated from piles of rice straw in farmland and temporarily marked as A1~A6. A1 was chosen as experimental strain owning to its higher ratio with 4 of clear circle diameter to colony diameter and higher reducing sugar concentration, which was short rod, G+and easily fade, motile. Test results such as catalase, amylolysis, gelatin liquefaction, methyl red test, hydrogen sulfide production, glucose fermentation, PHB, metachromatic granule staining, cellulose degradation, denitrification test were positive. Test results such as Voges-Proskauer test, indole test, nitrate reduction test, lecithinase were negative. The enzyme property produced by strain A1 showed its major enzymatic activity was CMC and secondary FPA. According to its enzymatic activity, cell and colony morphology, physiological and biochemical properties, strain A1 was preliminarily classified as genusCellulomonas.
cellulase-producing bacterium; cellulose; high temperature resistant;Cellulomonas
10.3969/j.issn.1001-6678.2016.04.004
国家自然科学基金项目(51308245);江苏省淮安市科技计划项目(HAN2015026);江苏省生物质转化与过程集成工程实验室开放课题(JPELBCPL2013004和JPELBCPL2014006)。
任世英(1980~),女,博士。E-mail:rsy1314@163.com。
刘飞,男,博士。E-mail:hyitliu@163.com。

