锌指转录因子1与风湿性心脏病心房颤动患者心房纤维化的关系
郭芙蓉 黎明江 李莎 夏军 刘化刚
临床研究
锌指转录因子1与风湿性心脏病心房颤动患者心房纤维化的关系
郭芙蓉 黎明江 李莎 夏军 刘化刚
目的 探讨锌指转录因子1(Snail1)及上皮间质转化(EMT)机制在风湿性心脏病心房颤动患者心房纤维化中可能发挥的作用。方法 选择2015年9月至2016年3月入住我院心外科并确诊为风湿性心脏病准备行换瓣手术的19例患者,在换瓣术中取约200 mg的右心房肌肉组织,按术前心律分为窦律(SR)组9例和房颤(AF)组10例。观察心肌细胞的形态变化采用HE染色,心房纤维化的程度比较使用Masson染色观察,western blot和RT-PCR测定心房肌组织中Snail1的表达水平。结果 房颤组和窦律组之间性别、年龄、左室射血分数、心功能分级、吸烟情况比较无统计学差异(P<0.05);左心房内径(LAD)窦律组为(44.441±7.13)mm,房颤组为(54.50±5.02)mm,两者比较差异有统计学意义(P<0.05);心房胶原容积分数(CVF)窦律组为0.123,房颤组为0.407,两组比较差异具有统计学意义(P<0.01)。Snail1的mRNA表达水平及蛋白表达水平窦律组分别为1.001和0.341,房颤组分别为1.566和0.579,两者分别比较差异均具有统计学意义(P<0.01)。结论 风湿性心脏病心房颤动患者心房肌组织中Snail1表达增加,EMT可能被激活,从而促进房颤患者的心房纤维化,在房颤的发生和维持中发挥重要作用。
锌指转录因子1; 上皮间质转化; 心房颤动; 心肌纤维化
心房颤动(atrial fibrillation,AF)是目前临床上导致心力衰竭、脑卒中及心源性猝死的心律失常之一,严重威胁着人类的健康。大量的基础与临床研究证实,房颤与心房肌纤维化之间存在着密不可分的联系,且房颤的发生发展主要取决于两大机制——电重构及结构重构,而心房成纤维细胞(CFs)介导的心肌纤维化是心房颤动中心房结构重构的主要机制[1]。上皮间质转化(EMT)机制是目前学术界的研究热点之一,即成纤维细胞的来源除了由局部静止的成纤维细胞活化而来外,还可由上皮细胞、内皮细胞等转化而来[2]。研究发现EMT机制参与了肺纤维化、肾脏纤维化及心梗后小鼠的心肌纤维化[3-5]。而锌指转录因子1(Snail1)作为EMT机制的关键转录因子,是否参与了风湿性心脏病房颤患者的心房纤维化,本研究就此进行了探讨。
1 对象与方法
1.1 研究对象 申报武汉大学人民医院伦理委员会并获批准后,在入住我院心外科并明确诊断为风湿性心脏病准备行心脏瓣膜置换术的患者中,选择年龄在30~60岁,心功能为Ⅱ~Ⅲ级的19例患者为本试验的研究对象。排除既往有明确的冠状动脉粥样硬化性心脏病病史,入院心脏彩超提示感染性心内膜炎、肺源性心脏病,既往有甲状腺功能亢进或低下病史,肝、肾功能异常病史,恶性肿瘤病史者;同时若近期服用ACEI、ARB、β受体阻滞剂或醛固酮受体拮抗剂,并处于药物半衰期内的患者也排除在外。制作表格统计患者的一般临床资料,包括年龄、性别、心脏彩超指标(左心房内径值、射血分数)、心功能分级(纽约心脏病协会心功能分级)。每位患者均知情同意并签署知情同意书。
1.2 方法
1.2.1 标本的收集及保存 在心外科心脏换瓣手术过程中,成功插管建立体外循环后,在心脏停跳前右心房切开时钳取右心房肌组织约200 mg,用4%多聚甲醛清洗掉血液,并用眼科剪及眼科镊除去脂肪组织并修改组织边缘后将组织分为两部分。2/3的组织立即置入液氮罐中,并转至-125℃深低温冰箱中保存,留作Western blot及RT-PCR检测用;1/3的组织放入4%多聚甲醛溶液中固定,留存病理学分析。
1.2.2 病理学分析 将4%多聚甲醛溶液中保存的右心房肌组织进行石蜡切片,HE染色观察心肌细胞形态变化,Masson染色观察心房心肌纤维化程度。
HE染色:石钠切片脱钠后放入Harris氏苏木素染液染色5~7 min→自来水浸洗返蓝→1%盐酸乙醇分化2~5 s→自来水浸洗返蓝→1%的水溶性伊红染液染色约2 min→自来水浸洗30 s→无水乙醇脱水→二甲苯透明→中性树胶封片。染色完成后用正置光学显微镜观察心房肌细胞的形态变化。
Masson染色:石蜡切片脱蜡→Weigert铁苏木精染液中染核5~7 min→流水冲洗3~5 min→1%盐酸乙醇分化5~7 s→流水连续冲洗3 min左右→丽春红酸性的品红染液染色3~4 min→流水稍加冲洗→1%磷钼酸溶液中分化约5 min后甩干→不水洗直接苯胺蓝染液复染5 min→1%冰醋酸冲洗切片1 min→切片快速水洗→95%乙醇及无水乙醇脱水,二甲苯透明→风干后用中性树胶封片。染色完成后用光学显微镜观察心房肌纤维化的程度,用Image-pro Plus 6.0软件计算Masson染色切片中胶原的面积(切片中胶原纤维呈现为蓝色),每张切片在高倍视野下随机选择6个视野,测量出每个视野面积内的胶原总面积。胶原容积分数(collagen volume fraction,CVF)=胶原总面积/图像总面积。取所有视野的平均值[6]。
1.2.3 Western blot技术 Snail1在心房肌组织中的蛋白表达情况采用Western blot技术测定。根据蛋白提取试剂盒(武汉市碧云天生物技术研究所)提供的操作方法提取出组织的总蛋白(蛋白的浓度由Bradford方法测出,使各组组织样品的蛋白浓度保持一致)→按50 μg总蛋白/泳道的方法进行上样→统一行SDS-PAGE电泳→电泳结束后的凝胶中的蛋白转移至PVDF膜→含5%脱脂奶粉的TBST(封闭液)浸泡PVDF膜→室温摇床上封闭2 h→洗膜后加 Snail1 抗体(gentex,工作浓度 1∶3000)4℃孵育过夜→HRP标记羊抗兔二抗(武汉博士德生物工程有限公司,工作浓度1∶50 000)37℃摇床孵育2 h→暗室内DAB定影、显色→晾干胶片,扫描胶片→用BandScan分析胶片灰度值。
1.2.4 RT-PCR技术 采用RT-PCR技术测定心房肌组织中Snail1的mRNA表达水平。使用Trizol(Aidlab)法提取总RNA,并用RT-PCR试剂盒检测Snail1的表达。试验中所用引物序列为:Homo Snail1(226 bp):上游 5′-GCACATCCGAAGCCACA-3′,下游:5′-GGAGAAGGTCCGAGCACA-3′。
1.3 统计学方法 数据统计分析采用SPSS 22.0软件进行。计量资料均采用±s表示,组间比较采用两独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般临床资料 风湿性心脏病患者心脏换瓣术中取得的心房肌组织分为窦律(SR)组9例和房颤(AF)组10例。两组间性别、年龄、左室射血分数、心功能分级、吸烟情况比较未见统计学差异(P<0.05);左心房内径(LAD)窦律组为(44.441±7.13)mm,与房颤组(54.50±5.02)mm 比较,差异有统计学意义(P<0.05)。见表1。
2.2 心房肌细胞形态变化及纤维化程度 HE染色显微镜下观察,房颤组心肌细胞排列紊乱,细胞间距增加,心肌纤维肥大与萎缩并存,伴空泡变性空泡增多(见图1)。Masson染色显微镜下观察心房纤维化程度,可见房颤组和窦律组均存在不同程度的心肌纤维化,但房颤组纤维化更明显。窦律组心肌细胞排列较规则呈车轮状或圆盘状,胶原纤维较少呈散在分布;而房颤组细胞形态不规整,心肌间质的胶原纤维增粗,呈弥漫性分布,排列紊乱呈网格状(图2)。使用Image-pro Plus 6.0图像分析软件分析显示,房颤组胶原容积分数(CVF)较窦律组明显增加,差异有统计学意义(P<0.01)。见图3。
2.3 Snail1的mRNA表达水平 RT-PCR结果显示,与窦律组相比,房颤组 Snail1的mRNA表达水平明显升高,差异有统计学意义(P<0.01),见图4。
2.4 Snail1的Western blot表达水平 Western blot结果显示,房颤组Snail1的蛋白表达水平明显高于窦律组,差异有统计学意义(P<0.01),见图5。
表1 风湿性心脏病患者的一般临床资料(±s)
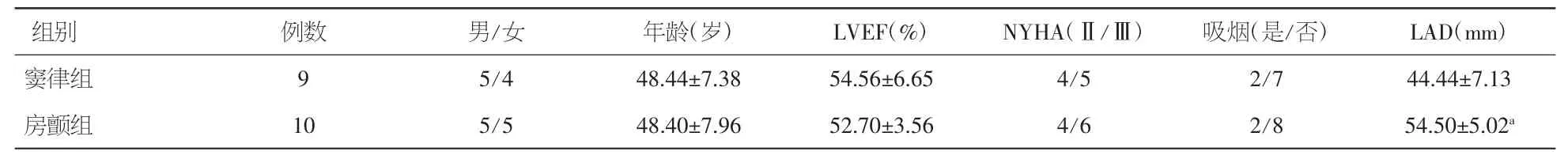
表1 风湿性心脏病患者的一般临床资料(±s)
注:LVEF:左心室射血分数;NYHA:纽约心脏病协会心功能分级;LAD:左心房内径。与窦律组比较,aP<0.05
组别 例数 男/女 年龄(岁) LVEF(%) NYHA(Ⅱ/Ⅲ) 吸烟(是/否) LAD(mm)窦律组 9 5/4 48.44±7.38 54.56±6.65 4/5 2/7 44.44±7.13房颤组 10 5/5 48.40±7.96 52.70±3.56 4/6 2/8 54.50±5.02a
3 讨论
本研究中观察到房颤组心房肌组织中胶原纤维明显增多、增粗呈弥漫性分布,排列紊乱呈网格状,胶原容积分数(CVF)比窦律组明显增加。大量房颤的动物模型及临床房颤患者的研究[6,7]均证实,房颤患者存在不同程度的心房纤维化,与本试验观察到的现象一致,提示心房肌纤维化是在心房颤动的发生及维持中发挥重要作用的因素之一。
各种细胞外因子刺激心脏成纤维细胞(CFs)后使其细胞膜上Ca2+内流增加,引起成纤维细胞的病理性增殖、分化,使胶原蛋白等细胞外基质合成明显增加,从而发生心肌纤维化[8]。目前关于纤维化的研究已不只局限于原位成纤维细胞,由上皮细胞、内皮细胞等转化而来的成纤维细胞即上皮间质转化机制(EMT)已发展为研究纤维化机制的新热点。在一定病理条件(炎症、组织重构等)下上皮细胞被激活,通过EMT,产生大量的成纤维细胞,从而使细胞外基质增多,这是器官纤维化发生的重要病理生理机制[9]。近年来发现,多因素诱导的EMT是糖尿病心肌病发展的重要机制之一[10],而内皮素1诱导的EMT能够促进糖尿病小鼠心脏纤维化,内皮素1在糖尿病小鼠心脏中表达增加并通过EMT而加快心脏纤维化和心力衰竭[11]。以上研究均提示,EMT可能为房颤心房纤维化的重要机制之一。
Snail家族在损伤修复的内皮间质转化中发挥协同作用。关于Snail家族中Slug、twist、Snail1的相关研究发现,Snail1因子的活性是EMT事件的特异标志[12]。研究发现,Snail1在肾脏组织中的表达增加在肾间质纤维化的发生中发挥了重要作用,Snail1的表达增加与肾间质纤维化明显相关[13]。另一项关于肾移植后患者的研究发现,Snail1水平与EMT的发生明显相关[14]。同时Snail1还参与了肝脏和腹膜的纤维化[15,16]。在胚胎发育过程中,Snail1的激活促进了心肌成纤维细胞、血管平滑肌和心肌细胞的形成[17]。Zhou等[18]在研究心肌梗死后成年大鼠的心外膜细胞通过分泌旁分泌因子来调节心肌损伤时发现,心脏损伤后在心外膜发现了Snail1 mRNA的再激活。另一项Liu等[12]关于Snail1在心梗后小鼠中的研究显示,Snail1在心梗后被激活。心梗后第一天,在冠脉内皮细胞及其周边区域发现了Snail1的激活,之后,Snail1在梗死区的间质细胞中高表达,但是在心梗的周边区域表达下降,直接反映了小鼠心梗后内皮间质转化的进展,提示Snail1的激活诱导了EMT从而参与小鼠心肌梗死后的心脏纤维化进程。体外研究发现,TGF-β可促进EMT的发生发展,而Snail1参与了TGF-β诱导的上皮间质转化的过程,且对Snail1基因进行沉默后,TGF-β2促进EMT的作用减弱了[19]。本研究发现,房颤组Snail1的mRNA表达水平较窦律组明显增加,且房颤组CVF与窦律组相比也明显增加,提示Snail1在风湿性房颤患者心房纤维化过程中可能发挥了一定作用,即心房颤动患者Snail1被激活而诱导了EMT机制从而参与了心房颤动心肌纤维化的过程。而对房颤组Snail1的蛋白表达水平进行检测同样发现,Snail1的蛋白表达水平明显高于窦律组,再一次证实了上述发现。
关于Snail1诱导EMT机制从而参与组织或器官纤维化的发生发展的相关机制目前仍不十分清楚。有研究发现,Snail1诱导的EMT的发生可能是因为其直接抑制了钙黏蛋白(E-cadherin)的转录,而钙黏蛋白的减少使上皮细胞间的连接变得松散,从而发生迁移、转化,具有黏附和极性性质的上皮表型的细胞逐渐变成宽松的、激活的能产生细胞基质参与纤维化的间质细胞[12]。Snail1作为一个细胞核内转录因子是通过哪一条信号通路来诱导EMT从而参与到房颤患者的心肌纤维化中的呢?以往关于Wnt信号通路的研究发现,Wnt信号转导通路参于调控细胞的黏附、迁移及生长、分化、凋亡等过程,且在胚胎的发育、器官的发生和维持内环境稳定中均发挥着重要作用[20]。正常机体肾脏中的Wnt信号是“静止”的,胞质中仅有少量游离态的βcatenin使同型细胞黏附在一起,防止细胞迁移。在肾脏纤维化的动物模型中发现,Wnt信号通路的相关蛋白及靶基因的表达均有不同程度的升高,使用相应的抑制剂阻断Wnt通路后蛋白尿和肾脏纤维化程度较前减轻[21]。另有研究证实了Wnt信号通路在肺纤维化中的重要作用。目前研究比较多的是经典的 Wnt-β-连环蛋白(β-catenin)通路,其通过E-cad/β-cat复合体调控细胞间的黏附。β-catenin发生磷酸化时,E-cad/β-catenin复合物被破坏分离,细胞间黏附力下降,细胞迁移,从而诱导EMT的发生[22]。由此我们推测,Snail1很有可能是通过Wnt信号通路来参与心房颤动患者的心肌纤维化。而另一项关于Wnt1/bcatenin在心脏损伤后变化的研究[23]发现,Wnt介导的EndMT参与了心肌梗死后组织的修复过程,抑制Wnt信号激活可通过抑制EndMT减轻损伤后心肌的负性重构。由此我们推测,Snail1可能是通过经典型Wnt信号通路来诱导EMT机制,从而参与风湿性心脏病房颤患者心房纤维化进程,但仍需进一步的研究证实。
(本文图片后插二)
[1]Tan AY,Zimetbaum P.Atrial fibrillation and atrial fibrosis.J Cardiovasc Pharmacol,2011,57:625-629.
[2]Hills CE,Squires PE.TGF-beta1-induced epithelial-to-mesenchymaltransition and therapeutic intervention in diabetic nephropathy.Am J Nephrol,2010,31:68-74.
[3]Hashimoto N,Phan SH,Imizumi K,et al.Endothelial-mesenchymal transition in bleomycin-induced pulmonary fibrosis.Am J Respir Cell Mol Biol,2010,43:161-172.
[4]Malekar P,Hagenmueller M,Anyanwu A,et al.Wnt signaling is critical for maladaptive cardiac hypertrophy and accelerates myocardial remodeling.Hypertension,2010,55:939-945.
[5]Saraswati S,Alfaro MP,Thorne CA,et al.Pyrvinium,a potent small molecule Wnt inhibitor,promotes wound repair and post-MI cardiac remodeling.PLoS One,2010,5:e15521.
[6]衣少雷.血管紧张素1-9和小窝蛋白-1对心房重构影响及相关机制研究.山东大学,2014.
[7]易欣,黎明江,马乐乐,等.结缔组织生长因子、肝细胞生长因子与风湿性心脏病心房颤动患者心房纤维化的关系.武汉大学学报(医学版),2012,33:824-828.
[8]Zeisberg EM,Tarnavski O,Zeisberg M,et al.Endothelial-tomesenchymal transition contributes to cardiac fibrosis.Nat Med,2007,13:952-961.
[9]Lin RJ,Su ZZ,Liang SM,et al.Role of Circulating Fibrocytes in Cardiac Fibrosis.Chin Med J(Engl),2016,129:326-331.
[10]Tang RN,Lv LL,Zhang JD,et al.Effects of angiotensin Ⅱreceptorblockeron myocardialendothelial-to-mesenchymal transition in diabetic rats.Int J Cardiol,2013,162:92-99.
[11]Widyantoro B,Emoto N,Nakayama K,et al.Endothelial cellderived endothelin-1 promotes cardiac fibrosis in diabetic hearts through stimulation of endothelial-to-mesenchymal transition.Circulation,2010,121:2407-2418.
[12]Liu Y,Du J,Zhang J,et al.Snail1 is involved in de novo cardiac fibrosis aftermyocardialinfarction in mice.Acta Biochim Biophys Sin(Shanghai),2012,44:902-910.
[13]Boutet A,De Frutos CA,Maxwell PH,et al.Snail activation disrupts tissue homeostasis and induces fibrosis in the adult kidney.EMBO J,2006,25:5603-5613.
[14]Xu-Dubois YC,Galichon P,Brocheriou I,et al.Expression of the transcriptionalRegulatorsnail1 in kidney transplants displaying epithelial -to-mesenchymal transition features.Nephrol Dial Transplant,2014,29:2136-2144.
[15]Rowe RG,Lin Y,Hanada S,et al.Hepatocyte-derived Snail1 propagates liver fibrosis progression.Mol Cell Biol,2011,31:2392-2403.
[16]段绍斌,于洁,刘庆,等.氧化应激在腹膜纤维化大鼠模型腹膜间皮细胞转分化中的作用.中南大学学报(医学版),2011,36:34-43.
[17] OhnukiK, UmezonoT, AbeM, etal.Expression of transcription factorSnai1 and tubulointerstitialfibrosis in progressive nephropathy.J Nephrol,2012,25:233-239.
[18]Zhou B,Honor LB,He H,et al.Adult mouse epicardium modulates myocardial injury by secreting paracrine factors.J Clin Invest,2011,121:1894-1904.
[19]Medici D,Potenta S,Kalluri R.Transforming growth factor-β2 promotes Snail-mediated endothelial-mesenchymal transition through convergence of Smad-dependent and Smadindependent signalling.Biochem J,2011,437:515-520.
[20]Marti′nez-Estrada OM,Lettice LA,Essafi A,et al.Wt1 is required for cardiovascular progenitor cell formation through transcriptional control of Snail and E-cadherin.Nat Genet,2010,42:89-93.
[21]Dang Y,Liu B,Xu P,et al.Gpr48 deficiency induces polycystic kidney lesions and renal fibrosis in mice by activating Wnt signal pathway.PLoS One,2014,9:e89835.
[22]Kim TH,Kim SH,Seo JY,et al.Blockade of the Wnt/βcatenin pathway attenuates bleomycin-induced pulmonary fibrosis.Tohoku J Exp Med,2011,223:45-54.
[23]Duan J,Gherghe C,Liu D,et al.Wnt1/betacatenin injury response activates the epicardium and cardiac fibroblasts to promote cardiac repair.EMBO J,2012,31:429-442.
Relationship of Snail1 and atrial fibrosis in rheumatic heart disease patients with atrial fibrillation
GUO Fu-rong*,LI Ming-jiang,LI Sha,et al.*Department of Cardiology,Renmin Hospital of Wuhan University,Wuhan 430060,China
Objective To investigate the alteration of the levels of Snail1 in rheumatic heart disease patients with atrial fibrillation and to probe the possible role of Snail1 and epithelial-to-mesenchymal transition(EMT) in atrial fibrosis of atrial fibrillation.Methods About 200 mg right arterial tissue was taken from 19 rheumatic heart disease patients[9 sinus rhythm(SR)10 atrial fibrillation(AF)]during heart valve replacement surgery between September 2015 and March 2016.HE staining was used to observe the Morphological changes of Myocardial cells.Masson staining was used to observe the degree of atrial fibrosis,the expression of Snail1 was measured by Western blot and RT-PCR.Results There was no significant difference between the AF group and the SR group in the sex,age,left ventricular ejection fraction(LVEF),heart function grade of NYHA and smoking.The left atrial diameter of SR group and AF group was respectively(44.441±7.13)mm and(54.50±5.02)mm.The collagen volume fraction of right arterial tissue of SR group and AF group was respectively 0.123 and 0.407.The expression level of Snail1-mRNA and Snail1 protein SR group and AF group were respectively 1.001,0.341,1.566 and 0.579.Compared with that respectively in SR group,the expression of Snail1,the left atrial diameter and the collagen volume fraction of right arterial tissue were significantly increased in AF group(P<0.01).Conclusion In the right arterial tissue of rheumatic heart disease patients,the increased level of Snail1 may contribute to activate the EMT.It may promote the atrial fibrosis of atrial fibrillation and then play an important role in the occurrence and maintain of atrial fibrillation.
Snail1; Epithelial-to-mesenchymal transition; Atrial fibrillation; Myocardial fibrosis
LI Ming-jiang,E-mail:754851539@qq.com
国家自然科学基金面上项目(项目编号:81170085)
430060 湖北省武汉市,武汉大学人民医院心内科(郭芙蓉、黎明江、李莎),心外科(夏军、刘化刚)
黎明江,E-mail:754851539@qq.com
10.3969/j.issn.1672-5301.2016.11.009
R541.2
A
1672-5301(2016)11-0993-05
2016-06-07)

