聚肌胞增强肝癌细胞HepG2对甲氨蝶呤化学敏感性的机制
王丽(河南科技大学第一附属医院,河南洛阳471003)
聚肌胞增强肝癌细胞HepG2对甲氨蝶呤化学敏感性的机制
王丽
(河南科技大学第一附属医院,河南洛阳471003)
目的 探讨聚肌胞(PolyI:C)增强肝癌细胞对甲氨蝶呤(MTX)化学敏感性的机制。方法 体外培养肝癌细胞HepG2,并随机分成对照组、MTX组、联合组,对照组加入生理盐水,MTX组加入MTX至20 μg/mL,联合组加入MTX至20 μg/mL和PolyI:C至50 μg/mL。MTT法检测各组细胞增殖抑制率,流式细胞术检测各组细胞凋亡率,PCR法检测各组细胞中维甲酸诱导基因1(RIG-1)、干扰素β(IFN-β)和半胱胺酸天冬胺酸转移酶3(Caspase-3)mRNA表达,蛋白免疫印迹法检测RIG-1、IFN-β和Caspase-3蛋白表达。结果 联合组与MTX组相比,细胞增殖抑制率和凋亡率均显著升高,而RIG-1、IFN-β和Caspase-3 mRNA及蛋白表达水平亦显著提高两组比较差异有统计学意义(P均<0.05)。结论 PolyI:C通过上调RIG-1、IFN-β和Caspase-3 mRNA及蛋白表达,促进肝癌细胞的抑制和凋亡,从而增强MTX对肝癌细胞的化学敏感性。
肝肿瘤;聚肌胞;甲氨蝶呤;化学敏感性
肝细胞肝癌(HCC)是一种起源于肝细胞的恶性肿瘤,仅有小部分可进行切除或进行肝移植,大部分患者需行药物治疗[1]。甲氨蝶呤(MTX)是肝细胞癌的化疗药物之一,但长期大剂量使用MTX,正常肝细胞会引起损伤,肝癌细胞亦可产生耐药性[2]。聚肌胞(PolyI:C)是一种人工合成双链RNA,可于体内诱导不同细胞产生干扰素α和干扰素β(IFN-β)[3]。研究表明,PolyI:C在诱导干扰素产生的同时,可抑制肿瘤细胞生长[4]。2014年3月~2015年4月,我们通过PolyI:C联合MTX作用于肝癌细胞株HepG2,观察肝癌细胞HepG2对MTX化学敏感性的变化并探讨其机制。
1 材料与方法
1.1 材料 胎牛血清、DMEM细胞培养基购自Gibico公司;胰酶购自Amresco公司;TRIzol试剂和转染脂质体Lipofectamin2000均购于Invitrogen公司;RT-PCR试剂盒购自Thermo公司。注射用MTX购自齐鲁制药公司;聚肌胞购自广东邦民制药厂。鼠抗人RIG-1单克隆抗体、鼠抗人IFN-β单克隆抗体、鼠抗人Caspase-3单克隆抗体、鼠抗人β-actin单克隆抗体和HRP标记的羊抗鼠IgG均购自Santa Cruz公司;肝癌细胞株HepG2细胞为本实验室保存。
1.2 细胞培养及分组 肝癌细胞HepG2使用含10%FBS的高糖DMEM,置于37℃、5%CO2的培养箱内培养,细胞生长至90%融合,用0.25%胰酶消化细胞,将HepG2细胞浓度调整为5×104/mL,种入6孔培养板和96孔培养板,细胞过夜贴壁后换液,并分成三组,即对照组、MTX组和联合组,对照组加入生理盐水,MTX组加入MTX至20 μg/mL,联合组加入MTX至20 μg/mL和PolyI:C至50 μg/ mL;6孔板每组设3个平行孔,96孔板每组设12个平行孔,加药后继续培养72 h。
1.3 细胞增殖抑制率测算 采用MTT法。将分组加药处理的96孔板细胞拿出培养箱,每孔加入5 mg/mL的MTT试剂20 μL,置37℃、5%CO2培养箱继续培养4 h,弃上清液,加入二甲基亚砜(DMSO)150 μL/孔,于振荡器上振荡5 min,用酶标仪检测每孔570 nm波长处的OD值。根据公式计算出HeLa细胞增殖抑制率:抑制率(IR)=(对照组OD值均数-实验组OD值均数)/对照组OD值均数。实验重复进行3次。
1.4 细胞凋亡率测算 采用流式细胞术。将分组处理的6孔板细胞用0.25%的胰酶将细胞消化后,分别加入完全培养基终止消化,吹打混匀,2 000 r/ min离心5 min,用PBS洗涤细胞1次,2 000 r/min离心5 min收集细胞沉淀,重悬细胞,分别加入PI染色液避光静置5 min,最后用75%乙醇固定,流式细胞仪检测。
1.5 细胞维甲酸诱导基因1(RIG-1)、IFN-β和半胱胺酸天冬胺酸转移酶3(Caspase-3)mRNA表达检测 采用实时荧光定量PCR法。将分组加药处理72 h的6孔板细胞按照一步法提取细胞中总RNA,准确定量2 μg RNA,使用逆转录试剂盒逆转录合成cDNA。各取等量基因使用SYBGreen染料进行实时定量细胞RIG-1、IFN-β和Caspase-3 mRNA表达检测。PCR条件:95℃预变性5 min进入循环,95℃变性15 s,60℃退火延伸60 s并读取荧光值,共45个循环,获取Ct值,计算mRNA相对表达量。
1.6 细胞RIG-1、IFN-β和Caspase-3蛋白表达检测采用蛋白免疫印迹法。收集6孔板处理的三组细胞,加入细胞裂解液,混匀后置冰上15 min,13 000 r/min,离心5 min,收集上清液用BCA蛋白定量法测定蛋白浓度。分别取等量蛋白电泳,湿式电转移法将蛋白转移至硝酸纤维素膜上,再用3%脱脂牛奶室温封闭2 h。分别加鼠抗RIG-1单克隆抗体、鼠抗IFN-β单克隆抗体和鼠抗Caspase-3单克隆抗体为一抗(1∶1 000),以鼠抗人β-actin单克隆抗体为内参抗体(1∶2 000)。4℃孵育过夜,PBST洗膜3次。加入HRP标记的羊抗鼠IgG为二抗(1∶2 000),37℃孵育2 h,PBST洗膜3次。于暗室滴加ECL化学发光液,然后压片、显影、定影。实验重复3次。应用Scion Image软件分析灰度值,蛋白相对定量值=目的基因灰度值/内参基因灰度值。
1.7 统计学方法 采用SPSS16.0统计软件。以One-Way ANOVA模块对各组检测指标进行两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞增殖抑制率及凋亡率比较 与对照组比较,MTX组和联合组对HepG2细胞增殖均具有明显抑制作用(P均<0.05);而联合组与MTX组比较,HepG2细胞增殖抑制更明显(P<0.05)。与对照组相比,MTX组和联合组细胞凋亡率均升高(P均<0.05),联合组细胞凋亡率比MTX组更高(P<0.05)。见图1。
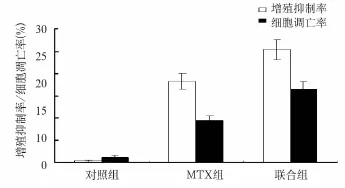
图1 各组细胞增殖抑制率和凋亡率比较
2.2 各组细胞RIG-1、IFN-β和Caspase-3 mRNA表达比较 联合组细胞RIG-1、IFN-β mRNA水平高于对照组和MTX组(P均<0.05),对照组和MTX组比较无统计学差异(P>0.05)。MTX组和联合组细胞中Caspase-3 mRNA水平均高于对照组(P均<0.05),而联合组Caspase-3 mRNA水平比MTX组更高(P<0.05)。见图2。
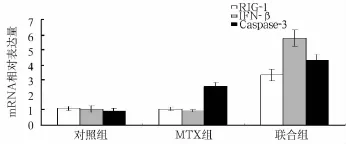
图2 各组细胞RIG-1、IFN-β和Caspase-3 mRNA表达比较
2.3 各组细胞RIG-1、IFN-β和Caspase-3蛋白水平比较 联合组细胞RIG-1、IFN-β蛋白水平高于对照组和MTX组(P均<0.05),MTX组和对照组差异无统计学意义(P>0.05)。而MTX组和联合组细胞Caspase-3蛋白水平均高于对照组(P均<0.05),联合组中水平比MTX组更高(P<0.05)。见图3。
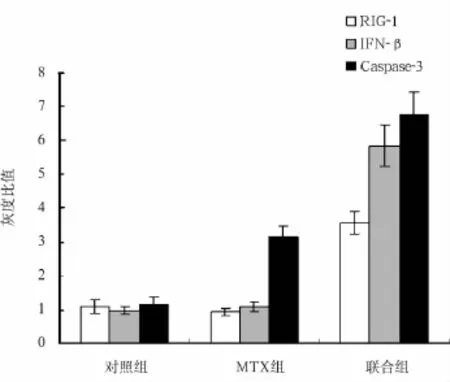
图3 各组细胞RIG-1、IFN-β和Caspase-3蛋白表达比较
3 讨论
肝癌传统治疗包括手术、放疗和化疗等多种方法[5]。手术和放疗仅在肿瘤早期、部位局限时应用,中晚期肝癌患者多数需药物化疗。但多数中晚期肝癌对MTX、氟尿嘧啶、顺铂等化疗药物敏感性不高,尤其是单药治疗有效率更低[6]。
PolyI:C是一种病毒双链RNA的模拟物。有文献报道,其不仅对免疫细胞(如自然杀伤细胞)具有激活作用,而且还可直接诱导肿瘤细胞凋亡[7]。其一方面可与Toll受体3(TLR3)结合,激活TLR3通路,发挥天然免疫和抗肿瘤免疫作用;另一方面,PolyI:C于体内诱导不同细胞产生干扰素。干扰素是体内多种细胞释放的一种糖蛋白,具有抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡的作用。因此PolyI:C已作为一种有效的抗肿瘤免疫佐剂被广泛研究,既可单独用作免疫治疗,亦可结合其他免疫药物及细胞毒药物而应用。
Caspases活性变化是细胞凋亡的重要调节机制,Caspases是所有凋亡信号传导的共同通路[8]。目前已发现在人体内的Caspases共有14种,其中起核心作用的是Caspase-3[9]。Caspase-3与肝癌亦有密切关系[10],Caspase-3是抗肿瘤药物作用的极好靶点[11]。研究表明,细胞对MTX反应性很大程度上依赖于细胞p53和Caspases的功能[12]。本研究显示,联合组、MTX组与对照组相比,RIG-1、IFN-β 和Caspase-3表达均显著上调;同时联合组的细胞增殖抑制率、细胞凋亡率明显高于MTX组和对照组。证实PolyI:C能增强肝癌细胞对MTX的化学敏感性,其机制可能为PolyI:C通过激活TLR3通路,上调RIG-1,诱导IFN-β表达,同时激活Caspase-3抑制了肝癌细胞的增殖,促进了肝癌细胞的凋亡,增强了化疗效果。
综上所述,PolyI:C通过上调RIG-1、IFN-β和Caspase-3 mRNA及蛋白表达,促进肝癌细胞的抑制和凋亡,从而增强MTX对肝癌细胞的化学敏感性。
[1]Greten TF,Manns MP,Korangy F.Immunotherapy of HCC[J]. Rev Recent Clin Trials,2008,3(1):31-39.
[2]崔茹龙.原发性肝癌的体外化疗药物敏感性探析[J].中国医药指南,2011,9(34):107-108.
[3]Alexopoulou L,Holt AC,Medzhitov R,et al.Recognition of double-stranded RNA and activation of NF-kappaB by Toll-like receptor 3[J].Nature,2001,413(6857):732-738.
[4]Yu L,Chen S.Toll-like receptors expressed in tumor cells:targets for therapy[J].Cancer Immunol Immunother,2008,57(9):1271-1278.
[5]王珂,汪爱勤,尹文,等.原发性肝癌的治疗进展[J].山东医药,2014,54(43):88-90.
[6]Farazi PA,DePinho RA.Hepatocellular carcinoma pathogenesis:from genes to environment[J].Nat Rev Cancer,2006,6(9):674-687.
[7]Bruno S,Isabelle C,Rissoan MC,et al.TLR3 can directly trigger apoptosis in human cancer cells[J].J Immunol,2006,176(8):4894-4901.
[8]李敏,林俊.细胞凋亡途径及其机制[J].国际妇产科学杂志,2014,41(2):103-107.
[9]Fan TJ,Han LH,Cong RS,et al.Caspase family proteases and apoptosis[J].Acta BiochimBiophys Sin,2005,37(11):719-727.
[10]郭晓东,杨美,郭超楠,等.肝癌组织中凋亡调控因子Fas、FasL 及caspase-3的表达及意义[J].肝脏,2014,19(4):250-253.
[11]郑志难,罗丽娜,丁劲松.基于半胱天冬酶-3调节的抗肿瘤药物研究进展[J].中南药学,2012,10(5):368-372.
[12]Hattangadi DK,DeMasters GA,Walker TD,et al.Influence of p53 and caspase 3 activity on cell death and senescence in response to methotrexate in the breast tumor cell[J].Biochem Pharmacol,2004,68(9):1699-1708.
10.3969/j.issn.1002-266X.2016.25.009
R735.7
A
1002-266X(2016)25-0030-03
2016-04-06)

