响应面优化超声波提取血橙皮多糖工艺
廖立敏,邹 宁,黄 茜,李建凤
(1.“果类废弃物资源化”四川省高等学校重点实验室,四川内江 641100;2.内江师范学院 化学化工学院,四川内江 641100)
响应面优化超声波提取血橙皮多糖工艺
廖立敏1,2,邹宁2,黄茜2,李建凤1,2
(1.“果类废弃物资源化”四川省高等学校重点实验室,四川内江 641100;2.内江师范学院 化学化工学院,四川内江 641100)
采用响应面实验对超声波提取血橙皮中的粗多糖提取工艺进行了优化,通过对各影响因素的分析得到最优提取工艺,即超声波功率为320 W、液固比为30 mL/g,提取温度为60 ℃,提取时间为30 min,此时多糖得率可达24.7%,实验重现性好,工艺稳定可行,对于开发利用血橙皮渣中的多糖类物质具有一定的参考价值。
血橙,多糖,超声波提取,响应面实验
血橙(blood orange)是橙的变种,俗称红橙。血橙首次出现在1850年的欧洲,主要被种植在西班牙、意大利和北美。在中国,血橙主要分布在四川内江资中县、广东平远县,内江资中县被称为“塔罗科血橙之乡”。每年在血橙成熟的季节,四川内江一些果汁企业将大量的榨汁后的血橙皮渣抛弃于环境,造成资源浪费和环境污染。
柑橘类果皮渣中含有丰富的精油[1]、多糖[2]、果胶[3],此外还含有苦素[4]、色素[5]、黄酮[6]、橙皮苷[7-9]等诸多有效成分。对于血橙皮渣的研究主要集中在花色苷[10]、香气成分[11]、黄酮类化合物[12]等方面,而对血橙皮中多糖类物质的研究甚少。植物多糖具有抗氧化和防癌、抗过敏、降血压等多种生理功效,可开发成功能食品、药品、保健品、化妆品等产品。
已有采用溶剂浸提法[13]、超声波法[14]、微波法[15]、酶法[16]等提取植物多糖的研究。溶剂浸提耗时长、产率低;微波法提取时间短,但提取过程反应剧烈,热不稳定物质极易在提取过程中遭到破坏,并且微波的泄露也会对操作者造成极大的伤害;酶法提取条件温和、得率高,但对提取温度较为敏感;超声波提取具有条件温和、杂质易除和得率高等优点,广泛应用于植物有效成分的提取。本文采用超声波法对血橙皮中的多糖类物质进行了提取研究,以期得到稳定可行的提取工艺,为大量开发利用血橙皮渣提供参考。
1 材料与方法
1.1材料与仪器
无水乙醇,石油醚,α-萘酚,苯酚,浓硫酸,葡萄糖等均为分析纯;血橙购于四川省内江市卓尔超市,产自四川内江。
T6型新世纪紫外可见分光光度计北京普析通用仪器有限责任公司;TJ270-30红外分光光度计天津市光学仪器厂;DFT-100手提式高速粉碎机温岭市林大机械有限公司;烘箱;CP2202S电子分析天平赛特利斯(北京)有限公司;离心沉淀器江苏省金坛市医疗仪器厂;超声波清洗器昆山市超声仪器有限公司;恒温鼓风干燥箱上海申贤恒温设备厂;恒温水浴锅。
1.2实验方法
1.2.1提取工艺优化主要考察液固比、超声波功率、提取温度和提取时间对多糖得率的影响。首先以液固比30 mL/g、超声波功率240 W、提取温度60 ℃、提取时间30 min为基础,在固定其中3个实验条件下,改变其中1个实验因素,按提取方法进行单因素实验。然后在单因素实验的基础上,选定其中3个影响因素进行优化,在确定的最佳条件附近进一步设计选点,应用Design Expert 7.0.0软件中的Box-Behnken安排实验,因素及水平见表1。
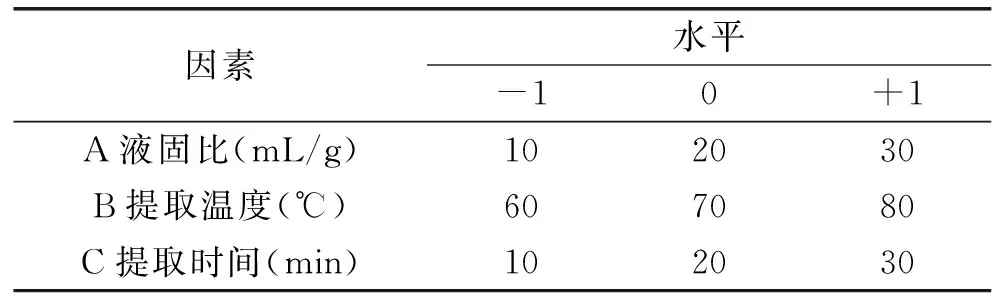
表1 因素及水平
血橙皮多糖的提取:市售血橙,取皮,自然晾干(或60 ℃下烘干),粉碎,取40~60目血橙皮粉末,以体积大于等于固体体积2倍的石油醚回流2 h以脱去脂肪,抽滤,风干备用。取5 g血橙皮粉,加入一定体积的去离子水,于一定的功率和温度下超声波提取一定时间,离心,上清液减压浓缩至一定体积后加入95%乙醇至乙醇最终浓度为60%(v/v)以上,室温下醇沉24 h,过滤,60 ℃下烘干得多糖粗品。
多糖的测定及得率计算:采用苯酚-硫酸法[17-18]。精密移取0.148 g/L的葡萄糖标准溶液0、0.4、0.6、0.8、1.0 mL,加蒸馏稀释至2.0 mL,加5%苯酚溶液1 mL,迅速加入浓硫酸5 mL,摇匀,静置20 min冷却至室温,以蒸馏水为空白,在波长为490 nm处测定吸光度,以葡萄糖质量浓度为横坐标,吸光值为纵坐标,得标准曲线回归方程为:Y=1.005X-0.1208,R2=0.99272。准确称取少量多糖粗品,加水溶解并显色后测定吸光度值,以标准曲线计算多糖含量。多糖得率(%)=(多糖质量/原料质量)×100。
1.2.2多糖的鉴定α-萘酚实验(Molish实验)[19]:在试管中加入0.5 mL 5%多糖粗品溶液,滴入2滴10%α-萘酚的乙醇溶液,混合均匀后把试管倾斜45°,沿着试管壁慢慢加入1 mL浓硫酸(勿摇动),观察结果。
紫外光谱及红外光谱:将少许所得多糖粗品以蒸馏水为溶剂配制成1 mg/mL的溶液,在190~400 nm波长下扫描,得紫外吸收图谱;少许多糖粗品用KBr压片后在400~4000 cm-1之间用红外光谱仪扫描,得红外吸收图谱。
2 结果与讨论
2.1多糖提取工艺的优化
2.1.1单因素实验
2.1.1.1液固比对得率的影响多糖实际得率随液固比变化情况见图1,从图可以看出起初提取溶剂体积的增加使得多糖的实际得率迅速上升,液固比为20 mL/g时,多糖的实际得率接近最大值。液固比太小,细胞内外浓度差不大,多糖不易溶出。液固比过大可能导致其他物质也过多溶出,从而影响多糖的溶出。另外液固比太大,增加了后续浓缩操作的困难,浪费能源。从实验结果可以基本确定最佳液料比为20 mL/g左右。
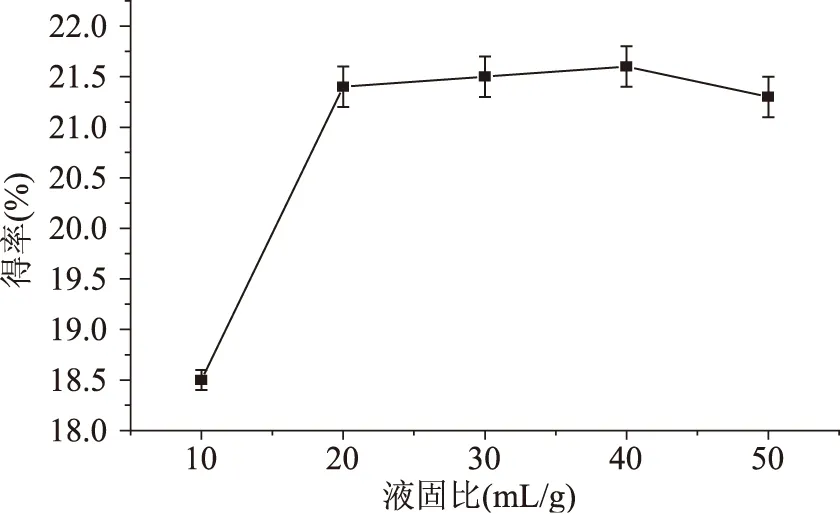
图1 液固比对提取的影响Fig.1 Effect of liquid solid ratio on extraction
2.1.1.2超声波功率对得率的影响多糖实际得率随超声波功率变化情况见图2,超声波作为提取能量,功率越大物料在单位时间内接受的超声波辐射量越大,越有利于提取。但是当在一定的功率下,多糖扩散已经达到平衡,继续增大功率,得率也不会明显增大。从图可以看出起初超声波功率的增大使得多糖的实际得率迅速上升,当超声波功率达到240 W时多糖的实际得率接近最大。另外超声波功率太大,对周围环境造成影响,还会造成能源浪费。从实验结果可以基本确定最佳超声波功率为320 W左右。
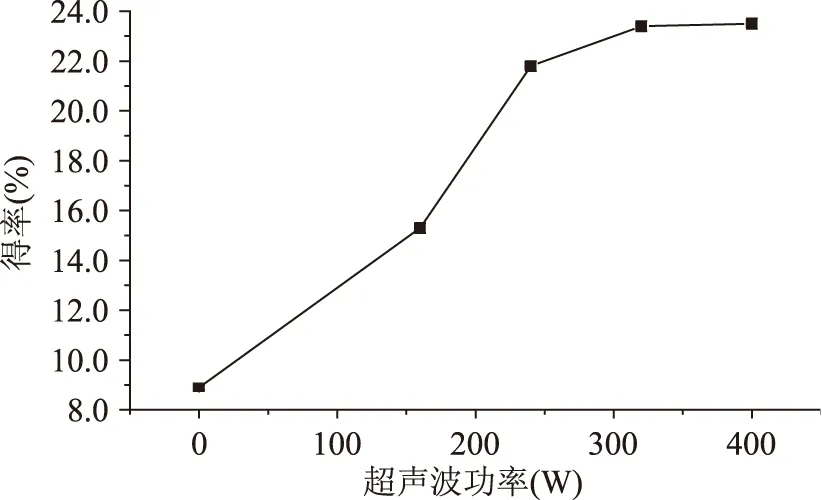
图2 超声波功率对提取的影响Fig.2 Effect of ultrasonic power on extraction
2.1.1.3提取温度对得率的影响多糖实际得率随提取温度变化情况见图3,温度影响分子运动速率,浸提温度低,多糖水化溶出不完全,提取速率慢;温度高可以加快分子运动,加速多糖从植物组织内部向溶剂中扩散,适当提高提取温度对提取是有利的;但是浸提温度过高不利于实验操作,而且还可能会使多糖降解,影响多糖得率,增大能耗。从图可以看出在低温区多糖得率随温度的升高而增大,当超过70 ℃后继续升高温度多糖实际得率没有明显变化,从实验结果可以基本确定最佳提取温度为70 ℃左右。
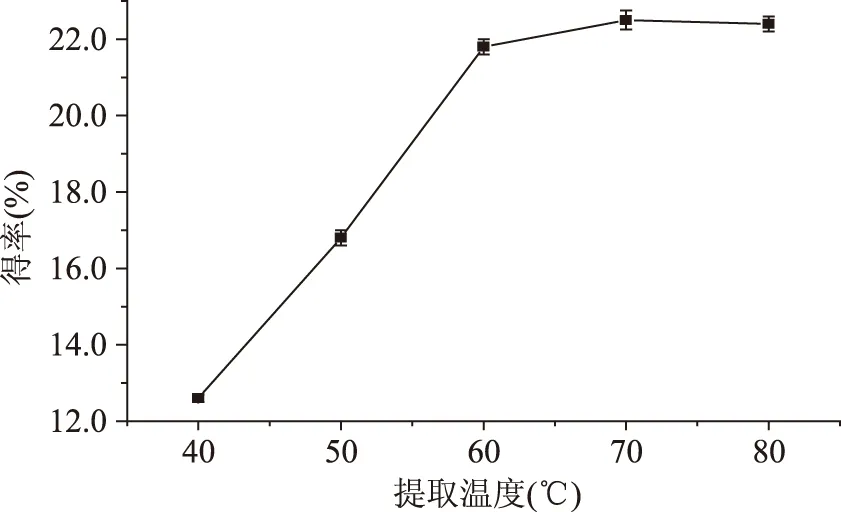
图3 提取温度对提取的影响Fig.3 Effect of temperature on extraction
2.1.1.4提取时间对得率的影响多糖实际得率随提取时间变化情况见图4,多糖由植物组织内部扩散到溶剂中需要一定的时间,当扩散达到平衡即使继续延长时间多糖得率也不会增大。从实验结果可以看出,时间太长,多糖得率没有明显增加,但由于时间长,植物组织溶胀厉害,反而影响后续离心操作;另外,时间长也可能导致部分多糖被溶胀的植物组织吸附,从而降低多糖的实际得率;从节约时间、降低能耗方面讲,在保证一定的多糖得率的情况下,提取时间应该尽可能短。从图可以看出提取时间为20 min时多糖实际得率接近最大,基本确定最佳提取时间为20 min左右。

表3 回归模型方差分析
注:p<0.001,高度显著;0.001
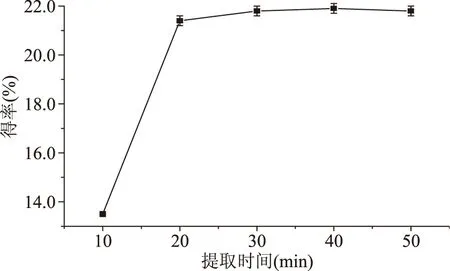
图4 提取时间对提取的影响Fig.4 Effect of extraction time on extractio
2.1.2响应面实验由于使用的超声波发生器的功率只有4档可调,因此在响应面实验中将其功率固定为320 W,考察其它三个影响因素,以进一步优化。共设立了17个处理组(共5组全“0”水平处理组,用于估计实验误差),具体实验安排及实验结果见表2。
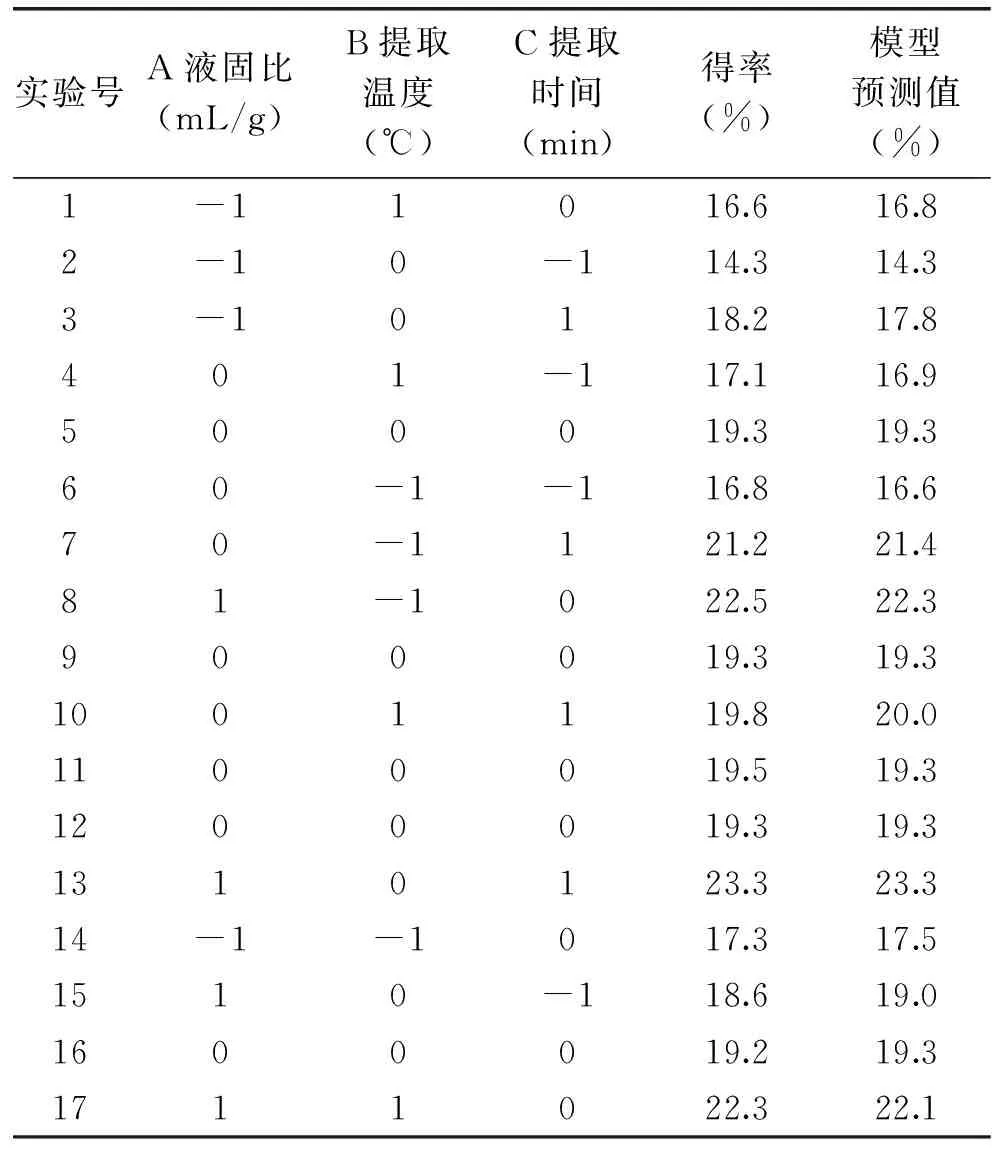
表2 Box-Behnken设计方案及响应值
用Design Expert 7.0.0 软件将表2中实验数据进行多元回归拟合,得到以得率为因变量Y,液固比(A)、提取温度(B)、提取时间(C)为自变量X的二次多项式回归模型:得率=17.5500+0.08025×A-0.3010×B+0.78775×C+1.2500×10-3×AB+2.0000×10-3×AC-4.2500E×10-3×BC+1.1500×10-3×A2+2.4000×10-3×B2-8.3500×10-3×C2。对所建立的响应模型进行方差分析,结果见表3。由表3可知,实验选用的模型高度显著;相关系数R=0.986,说明该模型拟合程度良好,实验误差较小,可以用此模型来分析以水为溶剂采用超声波对血橙皮渣多糖的提取。
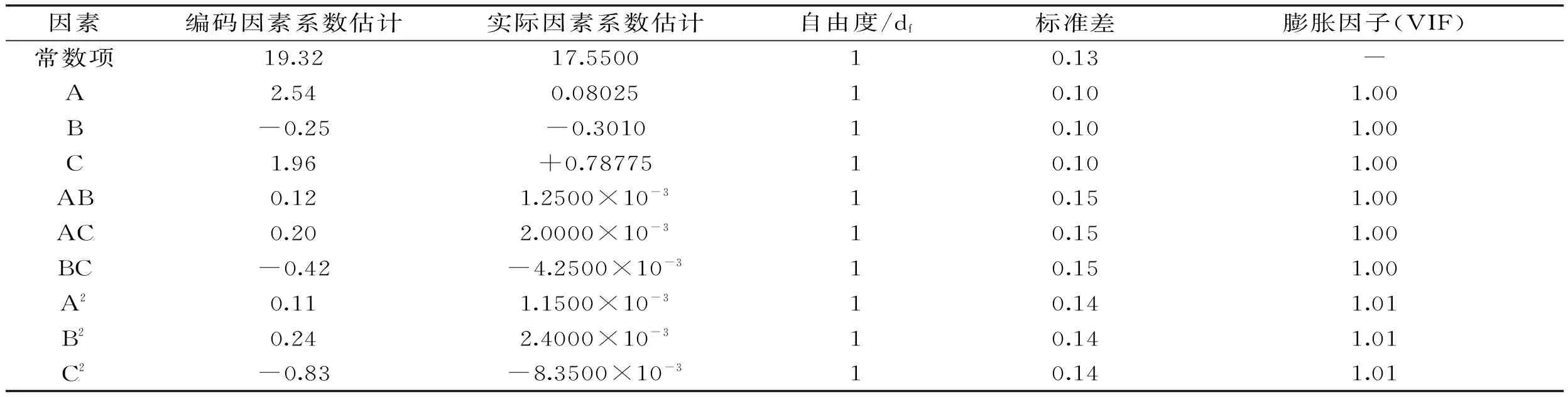
表4 各因素系数估计
回归模型系数显著性检验结果可知,模型一次项A高度显著(p<0.001)、C高度显著(p<0.001),B较显著(p<0.1);二次项C2高度显著、交互项BC较显著,其他不显著。所选择的考察因素A和B对多糖得率有高度显著的影响,因素C也有较显著的影响,因此选择这些因素进行考察和优化是合理的。
模型的各变量的系数估计值见表4,另外对各变量的膨胀因子VIF[20]进行了计算,VIF的定义式为:VIF=(1-r2)-1,式中r为某自变量与其它变量的相关程度(判断标准:VIF值大于5.0,变量间共线性严重,相关方程不可靠),如诊断发现模型某变量VIF值过大,则继续减少变量建模。从表4中可以发现,各变量的膨胀因子VIF值中最大的才1.01,说明各变量间基本上不存在共线性,模型是有效的。
响应面图形是响应值对各因素所构成的三维空间的曲面图,图5、图6和图7为液固比(A)、提取温度(B)、提取时间(C)在其中一个固定时,另外两个对多糖得率的交互影响曲面图。
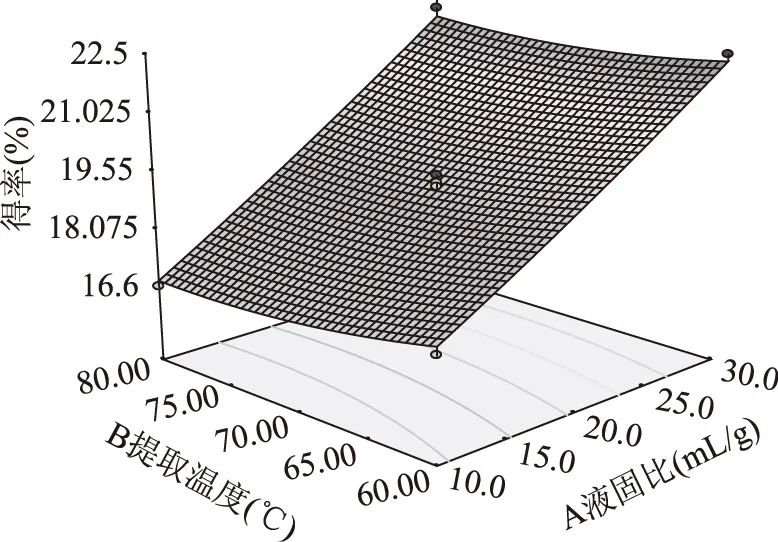
图5 液固比、提取温度及其交互作用Fig.5 Liquid-solid ratio,temperatureand their interaction
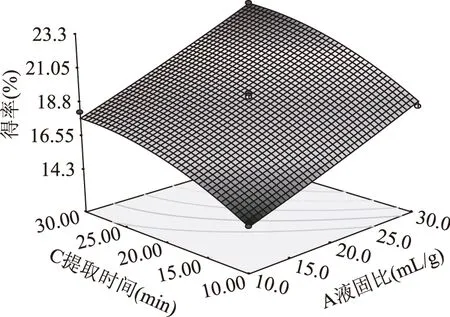
图6 液固比、提取时间及其交互作用Fig.6 Liquid-solid ratio,timeand their interaction
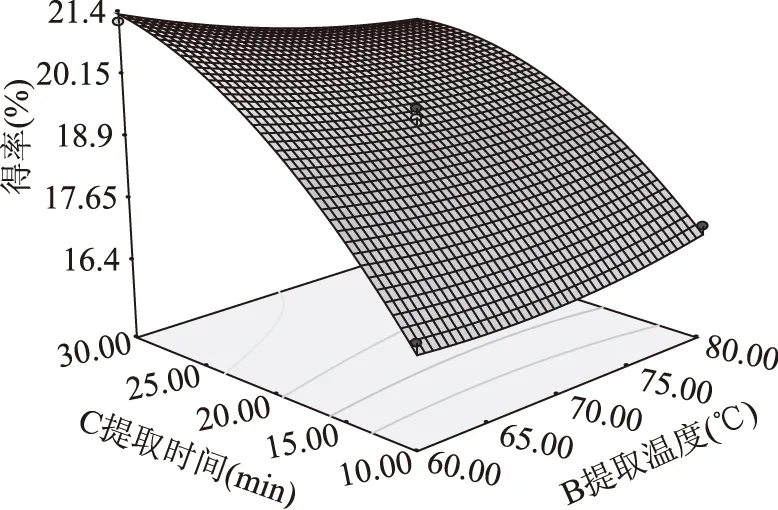
图7 提取温度、提取时间及其交互作用Fig.7 Temperature,time and their interaction
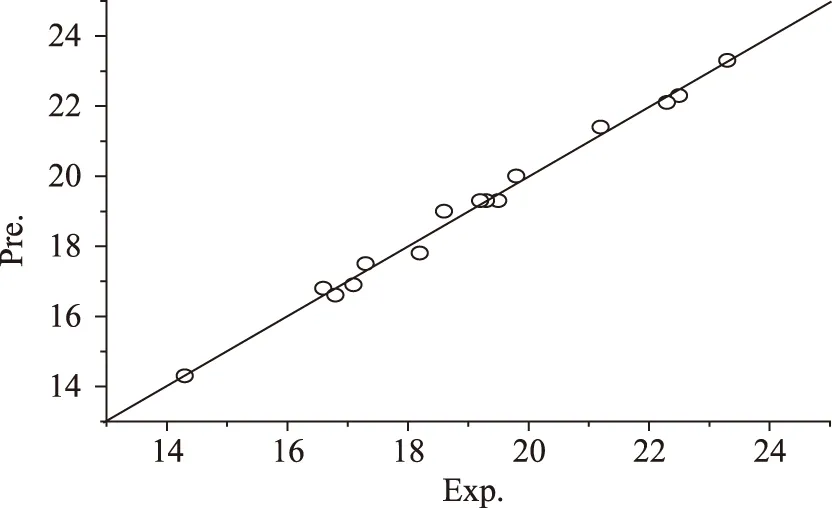
图8 预测值与实验值相关图Fig.8 Calculated vs. experimental value
比较图5、图6和图7的曲面图可知,液固比(A)和提取时间(C)对多糖得率的影响最为显著,表现为曲线较陡,而提取温度(B)次之,表现为曲线相对平滑。可能是多糖在考察的温度范围内溶出速度都较大,故提取温度(B)的变化对多糖得率影响不是特别显著。比较图5、图6和图7的等高线图可以看出液固比(A)与提取温度(B)的交互影响、液固比(A)与提取时间(C)的交互影响不显著,表现为等高线走向趋于一致并有共圆心的趋势。而提取温度(B)与提取时间(C)的交互影响显著,表现为等高线走向不一致并不具有共圆心的趋势,结果与方差分析相似。
上述模型对各处理条件下的多糖得率的预测值列于表2,为便于观察将模型预测值与实验值相关绘于图8,误差分布绘于图9。从图8可以发现绝大多数样本点都落在斜率为1的对角线附近,说明模型的预测值与实验值接近。图9可以看出各实验条件下多糖的模型预测误差都处在±0.5范围以内,说明模型预测误差小。总的来说,模型能较好地预测各实验条件下多糖的得率,该模型可以用于对血橙皮多糖的超声波提取工艺分析和参数优化。
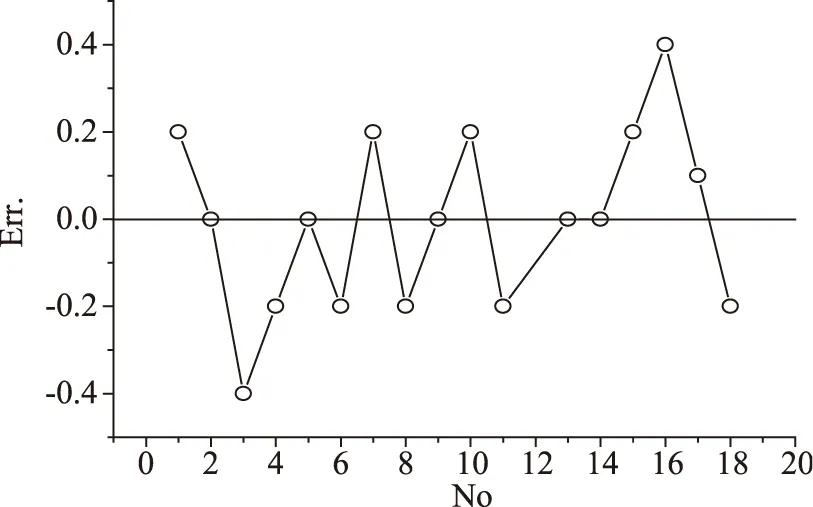
图9 误差分布Fig.9 Error distribution
通过对多糖得率的回归模型进行二次多项试数学解逆矩阵以及相关数学分析,得到液固比(A)为30 mL/g、提取温度(C)为60 ℃、提取时间(D)为30 min时,多糖得率可以取得最大值24.1%。将超声功率设定为320 W、液固比为30 mL/g、提取温度为60 ℃、提取时间为30 min,重复实验3次,得多糖得率分别为25.2%、24.3%和24.5%,平均值为24.7%。三次验证实验多糖平均得率24.7%,与模型预测值24.1%接近,多糖得率高、质量好,本研究所得血橙皮多糖超声波提取最优条件是正确可靠的。
2.2多糖的鉴定
最佳提取条件下所得多糖粗品为灰白色、絮状、松散、易碎的固体,见图10。取少许粗品进行α-萘酚实验(Molish实验),实验中观察到硫酸在下层,试液在上层,在两层交界处出现紫色环,表示溶液含有糖类化合物。多糖粗品的紫外光谱及红外光谱如图11、图12所示。由图11可见,在260 nm和280~290 nm处无紫外吸收,表明多糖粗品中不含蛋白质、多肽及核酸。但在220 nm附近有强的吸收,表明含有糖类物质。

图10 血橙皮多糖粗品外貌Fig.10 Appearance of blood orangepeel polysaccharide products
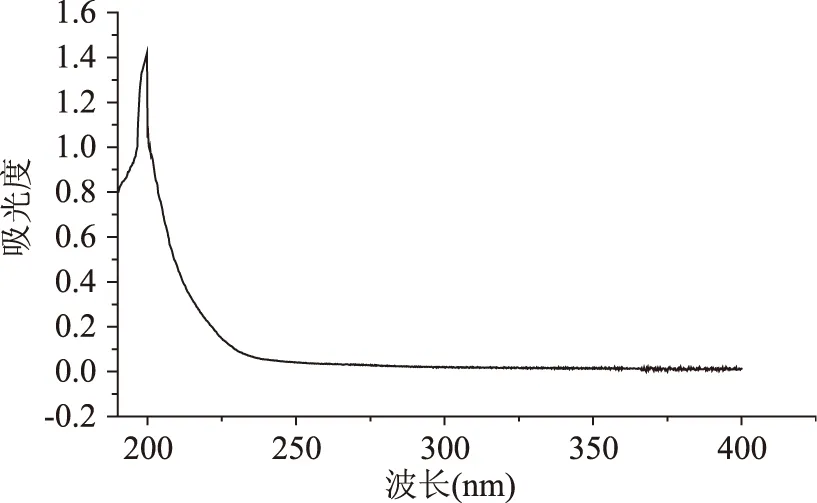
图11 血橙皮多糖紫外光谱Fig.11 UV spectrum of blood orange peel polysaccharide
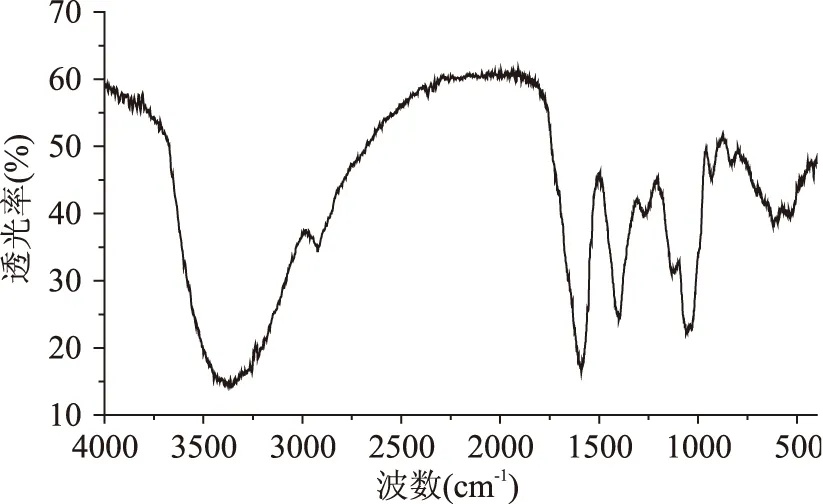
图12 血橙皮多糖红外光谱Fig.12 Infrared spectral of blood orange peel polysaccharide
在图12中,3420 cm-1为O-H伸缩振动吸收峰,2937 cm-1为C-H伸缩振动吸收峰,1610 cm-1为C=O的伸缩振动吸收峰,1485~1445 cm-1为C-H弯曲振动吸收峰,1110 cm-1为吡喃环结构的C-O伸缩振动吸收峰,以上均为糖类化合物的特征吸收,同样表明样品中主要为多糖类物质。
3 结论
本文采用超声波对血橙皮中的多糖进行了提取研究,对影响多糖得率的各因素进行了讨论,得到了超声波提取血橙皮多糖的最佳提取工艺参数,即超声波功率为320 W、液固比为30 mL/g,提取温度为60 ℃,提取时间为30 min,此时多糖得率可达24.7%,实验重现性好。通过Molish实验、紫外光谱及红外光谱对提取所得多糖粗品进行了检验,结果表明多糖粗品中主要为多糖类物质,不含蛋白质、多肽及核酸。本研究对于开发利用血橙皮中的多糖类物质具有一定的参考价值。
[1]赵文红,黄贵颖,陈悦娇,等.柠檬果皮精油挥发性成分的GC-MS分析[J].食品工业科技,2009,30(12):113-114.
[2]梁绍兰,覃冬,黄连秋,等.柑橘皮多糖抗氧化性研究[J].
安徽农业科学,2012,40(5):2624-2625.
[3]李建凤,任磊,王真,等.响应曲面法用于超声波提取柠檬皮渣果胶研究[J].食品工业科技,2013,34(4):267-269.
[4]黎继烈,张慧,曾超珍,等.超声波辅助提取金橘柠檬苦素工艺研究[J].中国食品学报,2009,9(4):97-103.
[5]钟岩,李泽鸿,周丹.桔皮黄色素提取方法的研究[J].北方园艺,2008(3):30-31.
[6]徐红宇.柑橘皮中黄酮提取工艺研究[J].食品安全导刊,2015,8(18):93-95.
[7]李雪谊,邹宁,李建凤.超声波提取柑橘皮橙皮苷研究[J].食品研究与开发,2015,36(15):55-58.
[8]黄利华.微波辅助法提取橙皮苷工艺研究[J].广州城市职业学院学报,2012,6(1):53-55.
[9]贾亚伟,丁玉.纤维素酶辅助提取橙皮苷的工艺研究[J].江苏农业科学,2011,39(4):335-338.
[10]曹少谦,胡晓燕,潘思轶.血橙花色苷稳定性研究[J].食品科技,2010,35(12):242-249.
[11]乔宇,谢笔钧,柴倩,等.血橙果实香气成分的气相色谱-质谱分析[J].质谱学报,2008,29(1):1-5,9.
[12]刘蓉,周正勇,罗南芳,等.超声波法提取塔罗科血橙皮黄酮类化合物工艺的优化[J].湖北农业科学,2013,52(17):4182-4185.
[13]周浓,刘亚,解万翠,等.牛蒡多糖提取工艺及其体外抗氧化活性的研究[J].食品研究与开发,2015,36(16):44-48.
[14]向鸣,王晓君,王维香.超声波提取川芎多糖的工艺优选[J].中成药,2008,30(11):1621-1623.
[15]董航,陈瑞战,李世哲,等.橘皮粗多糖的提取工艺优化及抗氧化活性评价[J].食品工业科技,2012,33(5):215-219.
[16]李建凤,黄辉,周强,等.复合酶法提取洋葱多糖的研究[J].分析科学学报,2014,30(4):493-496.
[17]张惟杰.复合多糖生化研究技术[M].上海:上海科学技术出版社,1987.
[18]李顺风,刘兴华,张丽华,等.真姬菇子实体多糖的提取工艺优化[J].农业工程学报,2008,24(2):281-284.
[19]兰州大学、复旦大学化学系有机化学教研室.有机化学实验第2版[M].北京:高等教育出版社,1978.08,304-305.
[20]冯长君.手性有机酸保留指数的手性指数及原子类型电拓扑指数模型[J].物理化学学报,2010,26(1):193-198.
Optimization of ultrasonic extraction technology of blood orange peel polysaccharide by response surface
LIAO Li-min1,2,ZOU Ning2,HUANG Xi2,LI Jian-feng1,2
(1.Key Laboratory of Fruit Waste Treatment and Resource Recycling of Sichuan Provincial College,Neijiang 641100,China;2.College of Chemistry and Chemical Engineering,Neijiang Normal University,Neijiang 641100,China)
The process of ultrasonic extraction of polysaccharide from blood orange peel was optimized by response surface tests. The optimum ultrasonic extraction conditions were obtained through the analysis of each factor:ultrasonic power was 320 W,liquid-solid ratio was 30 mL·g-1,extraction temperature was 60 ℃ and extraction time was 20 min. With this process,the relatively higher yields of polysaccharide reached 24.7%. The reproducibility of the experiments was good and the extraction process was stable and feasible. This study showed a certain reference value for the development and utilization of polysaccharide from blood orange peel residues.
blood orange;polysaccharide;ultrasonic extraction;response surface tests
2015-11-19
廖立敏(1981-),男,硕士,副教授,研究方向:果类废弃物资源化研究工作,E-mail:liaolimin523@126.com。
四川省教育厅青年基金项目(13ZB0003)。
TS224.2
B
1002-0306(2016)11-0212-06
10.13386/j.issn1002-0306.2016.11.035

