甾体糖苷抗肿瘤活性构效关系研究
赵雪淞,李盛钰,杨 旭,周义发
(1.辽宁工程技术大学矿业学院,辽宁阜新 123000;2.吉林省农业科学院农产品加工研究所/国家乳品加工技术研发分中心,吉林长春 130033;3.东北师范大学生命科学学院,吉林长春 130024)
甾体糖苷抗肿瘤活性构效关系研究
赵雪淞1,李盛钰2,杨旭3,周义发3
(1.辽宁工程技术大学矿业学院,辽宁阜新 123000;2.吉林省农业科学院农产品加工研究所/国家乳品加工技术研发分中心,吉林长春 130033;3.东北师范大学生命科学学院,吉林长春 130024)
为研究甾体糖苷的苷元和糖链结构对其抗肿瘤活性的影响,采用噻唑蓝(MTT)比色法测定了五种结构相关的甾体糖苷薯蓣皂苷、纤细皂苷、边缘茄碱、澳洲茄碱和查茄碱对人宫颈癌细胞(Hela细胞)、人肝癌细胞(H7402细胞)和小鼠成纤维细胞(L929细胞)增殖的影响,随后测定了化学修饰的6-O-双硫酸茄碱、6-O-硫酸查茄碱和全乙酰化查茄碱对人结肠癌细胞(HCT-8细胞)增殖的影响。结果发现,以查茄三糖为糖链的薯蓣皂苷、边缘茄碱和查茄碱抗增殖活性明显高于以其它三糖为糖链的纤细皂苷和澳洲茄碱;甾体糖苷对人源癌细胞的抑制作用更强;6-O-双硫酸茄碱、6-O-硫酸查茄碱和全乙酰化查茄碱无抗增殖活性。构效关系分析表明,苷元“F”环结构对活性有一定影响,糖链的单糖组成和结构对抗肿瘤活性有显著影响;糖链上的羟基在甾体糖苷的抗肿瘤活性中发挥关键作用。
甾体糖苷,抗肿瘤活性,化学修饰,构效关系
甾体糖苷是存在于许多植物中的次生代谢产物。研究显示,甾体糖苷具很好的抗肿瘤活性[1-2],例如边缘茄碱能有效抑制人胸腺癌细胞(MCF-7)、人肝癌细胞(Hep3B)等多种人类恶性肿瘤细胞生长[3-6],薯蓣皂苷能显著抑制肿瘤细胞增殖并诱导细胞凋亡[7-12]。进一步研究显示,甾体糖苷糖链的长短以及结构等对糖苷的活性有重要影响,例如查茄碱、茄碱和番茄碱对人结肠癌细胞(HT29)和人肝癌细胞(HepG2)具有明显的抑制作用,而它们的水解产物活性明显降低[13],边缘茄碱和澳洲茄碱能够抑制人结肠癌细胞(HCT-8)的增殖,它们的水解产物对HCT-8细胞的抑制活性显著下降,而6-O-硫酸边缘茄碱对HCT-8细胞无抑制活性[14]。
经过多年研究,已经证实甾体糖苷有很高的药用价值和开发潜力,但是其结构与活性的关系研究还停留在初步阶段,其抗肿瘤活性的构效关系并不十分清楚,阻碍了甾体糖苷开发利用。为深入探讨甾体糖苷结构与其抗肿瘤活性的关系,本文首次比较了五种结构相关的甾体糖苷薯蓣皂苷、纤细皂苷、边缘茄碱、澳洲茄碱和查茄碱(图1)的抗肿瘤活性特点,分析了构效关系。此外,马铃薯糖苷生物碱查茄碱和茄碱及其-OH硫酸化和乙酰化修饰产物6-O-硫酸查茄碱、6-O-双硫酸茄碱和全乙酰化查茄碱(图2)也被首次比较了抗肿瘤活性。本研究将为甾体糖苷类抗肿瘤药物的开发奠定理论基础,并具有指导意义。
1 材料与方法
1.1材料与仪器
人宫颈癌上皮细胞Hela、人肝癌细胞H7402、小鼠成纤维细胞L929和人结肠癌细胞HCT-8吉林省肿瘤医院赠送;RPMI-1640培养基、小牛血清 GIBCO公司;胰蛋白酶、EDTASIGMA公司;MTT、二甲基亚砜(DMSO,生物级)和HEPESAMRESCO公司;其余试剂均为国产分析纯。
边缘茄碱、澳洲茄碱提取自龙葵未成熟果实;茄碱、查茄碱提取自马铃薯皮;制备方法均为0. 5 硫酸室温浸提、硅胶柱层析分离纯化、NMR鉴定,具体参见文献[15-16];薯蓣皂苷、纤细皂苷 提取自穿龙薯蓣的干燥根茎,制备方法为70%乙醇室温浸提、硅胶柱层析分离纯化、NMR鉴定,具体参见文献[17];6-O-硫酸查茄碱、6-O-双硫酸茄碱 制备方法为4,4′-双甲氧基三苯甲基氯对C-6位羟基进行选择性保护,然后将剩余羟基进行全乙酰化保护,使用三氟乙酸的二氯甲烷液将C-6位伯醇羟基的保护基脱去,然后对C-6位羟基进行定位硫酸化修饰,最后脱去乙酰化保护获得产物,具体方法参见文献[17-18];全乙酰化查茄碱采用乙酸酐-吡啶法合成,具体方法参见文献[17]。上述样品以 DMSO(生物使用级)为溶剂,配制储备液(15 μmol/mL),保存于-4 ℃下。
MCO-15AC型二氧化碳恒温培养箱SANYO公司;BCN-B60B型生物超净工作台北京东联哈尔滨仪器制造有限公司;LD4-2/4000r型低速离心机北京医用离心机;MDF-U32V型超低温冰箱SANYO公司;YOS-30B型液氮罐成都液氮容器厂;XDS-1B型倒置生物显微镜重庆光电仪器有限公司;YXQ-LS-30S型立式压力蒸汽灭菌器上海博讯实业有限公司;酶标仪BIO-RAD公司。
1.2实验方法
人宫颈癌上皮细胞Hela、人肝癌细胞H7402、小鼠成纤维细胞L929和人结肠癌细胞HCT-8的生长抑制检测采用MTT比色法[14,25]。取对数生长期细胞以每孔100 μL细胞悬液(1×104个/孔)接种于 96 孔培养板,5% CO2、37 ℃孵箱培养24 h后,每孔加入不同浓度的药物,每个浓度设3个平行孔,另设溶剂对照组;继续培养48 h,然后甩弃孔内液体,重新向每孔加入100 μL培养基与 MTT 的混合液(9∶1,MTT浓度为5 mg/mL),再培养4 h后弃去孔内培养液,每孔加入150 μL DMSO,振荡10 min,使结晶物充分溶解,用酶标仪在570 nm波长处测定各孔光吸收度值(A),按下式计算细胞增殖抑制率。
抑制率(%)=(1-实验组吸光度值/对照组吸光度值)×100
半数抑制浓度 IC50为抑制率达到50%时的药物浓度。
1.3统计方法
组间比较和不同浓度条件下抑制率的比较均采用t检验,用软件SPSS 16.0进行统计学处理。
2 结果与讨论
2.1糖苷结构对甾体糖苷抗肿瘤活性的影响
为了解糖苷结构对其抗肿瘤活性的影响,五种结构相关的糖苷α-边缘茄碱、α-澳洲茄碱、α-查茄碱、薯蓣皂苷和纤细皂苷对人宫颈癌上皮细胞(Hela细胞)、人肝癌细胞(H7402细胞)和小鼠成纤维细胞(L929细胞)增殖的影响被检测了(表1,图1)。结果表明,薯蓣皂苷、查茄碱和边缘茄碱对三种肿瘤细胞均有显著的抑制作用,其中对人源癌细胞的抑制作用更强;薯蓣皂苷的抑制活性与查茄碱相近,略高于边缘茄碱;澳洲茄碱和纤细皂苷对三种肿瘤细胞的抑制作用较弱。
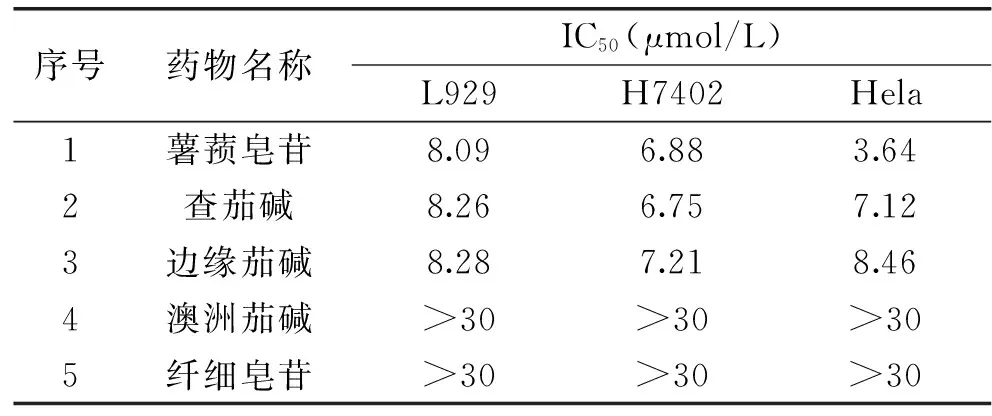
表1 边缘茄碱、澳洲茄碱、查茄碱、薯蓣皂苷和纤细皂苷对H7402、
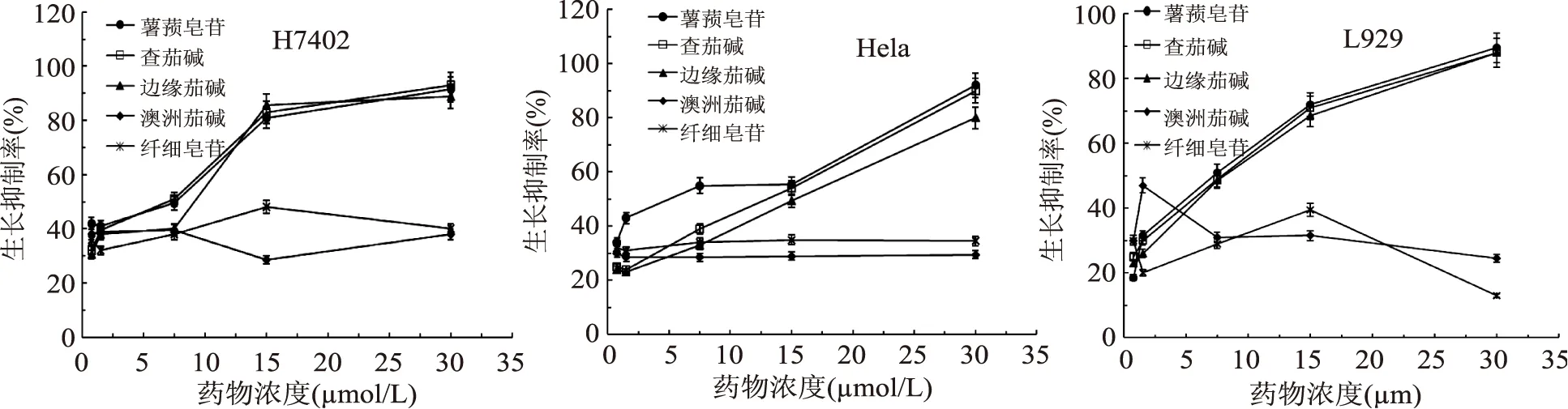
图1 边缘茄碱、澳洲茄碱、查茄碱、薯蓣皂苷和纤细皂苷对H7402、Hela和L929细胞的抑制作用Fig.1 Inhibitory effect of solamargine,solasonine,chaconine,dioscin and gracillin on the growth of L929,H7402 and Hela cells
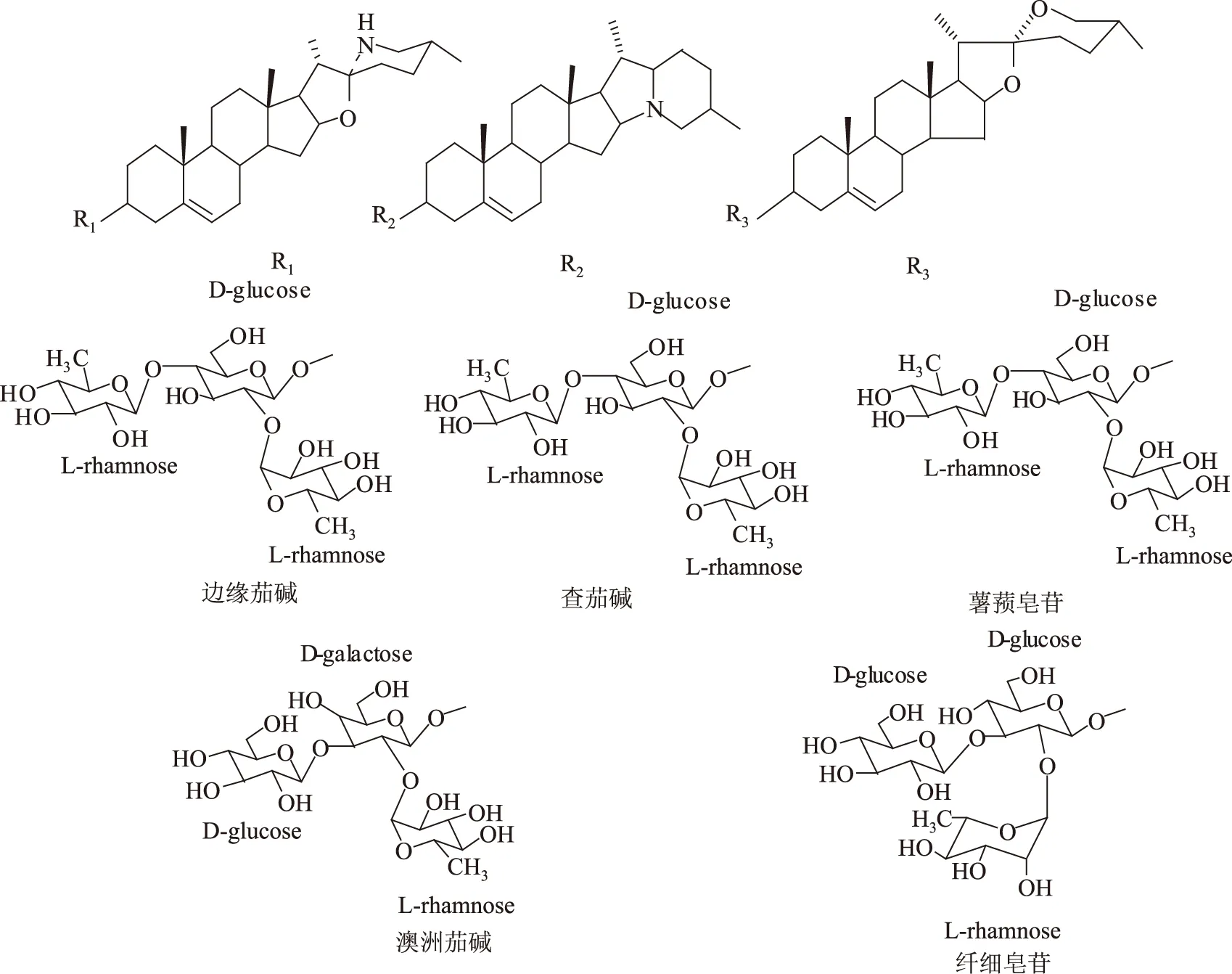
图2 边缘茄碱、澳洲茄碱、查茄碱、薯蓣皂苷和纤细皂苷的化学结构Fig.2 Chemical structure of solamargine,solasonine,chaconine,dioscin and gracillin
边缘茄碱和澳洲茄碱、薯蓣皂苷和纤细皂苷分别为苷元部分结构相同,糖链结构不同;边缘茄碱、查茄碱和薯蓣皂苷的糖链结构相同(均为由一个葡萄糖和二个鼠李糖组成的查茄三糖),苷元结构不同(图2)。以查茄三糖为糖链的三种甾体糖苷抗肿瘤活性明显高于其它糖链的二种甾体糖苷,说明糖链的单糖组成和结构显著影响甾体糖苷的生物活性。该结果符合甾体糖苷的膜破坏作用机制。一些甾体糖苷对肿瘤细胞的抑制作用是由于其能与生物膜上的甾醇类物质专一性结合,形成复合物,从而改变细胞膜的组织结构,最后造成膜的破裂。膜破坏作用是甾体糖苷最重要的活性作用机制[19-21]。甾体糖苷分子糖基之间的相互作用可能介导了糖苷-甾醇复合体在膜上的聚集[20]。一些研究证实以查茄三糖为糖链的糖苷对生物膜的溶解、破坏作用明显强于以茄三糖为糖链的糖苷,并且发现查茄三糖糖链比茄三糖糖链能更有效的与细胞上的受体位点结合[20],细胞膜上可能存在与甾体糖苷的糖链部分特异性结合的不同受体[22]。
除了上述细胞毒作用,甾体糖苷对肿瘤细胞的生长抑制作用还与其对细胞信号的调节有关。一些研究证实,甾体糖苷能够降低基质金属蛋白酶和端粒酶水平,通过对凋亡蛋白的调节诱导细胞凋亡,抑制肿瘤血管生长因子的信号传导途径等[6,23-25]。研究表明,边缘茄碱的2-位鼠李糖在其诱导细胞凋亡中起至关重要的作用[26],这进一步解释了含有查茄三糖的甾体糖苷的良好的抗肿瘤活性的作用机制。
薯蓣皂苷和边缘茄碱的结构极为相似,二者糖链部分结构相同,苷元部分仅“F”环有差别,薯蓣皂苷为含“O”环,而边缘茄碱为含“N”环,薯蓣皂苷的活性略高于边缘茄碱,说明苷元的“F”环结构对活性有一定影响。
2.2糖链结构对甾体糖苷抗肿瘤活性的影响
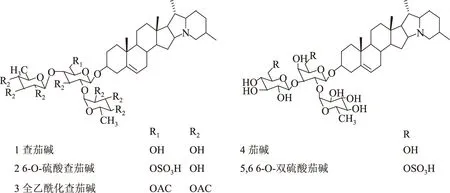
图3 查茄碱、茄碱、6-O-硫酸查茄碱、6-O-双硫酸茄碱和全乙酰化查茄碱的化学结构Fig.3 Chemical structure of chaconine,solanine,6-O-sulfated chaconine,6,6′-di-O-sulfated solanine and per-O-acetyled chaconine
上述研究发现,甾体糖苷的糖链组成和结构显著影响甾体糖苷的抗肿瘤活性。为了进一步评估甾体糖苷的糖链部分对其抗肿瘤活性的影响,我们对茄碱和查茄碱糖链上的羟基进行了化学修饰,制备了6-O-双硫酸茄碱、6-O-硫酸查茄碱和全乙酰化查茄碱(图3),采用MTT比色法检测了它们对人结肠癌细胞(HCT-8)的抗肿瘤活性(图4)。结果表明,查茄碱和茄碱对人结肠癌细胞增殖有明显的抑制作用,呈剂量依赖关系;以查茄三糖(由一个葡萄糖和二个鼠李糖组成)为糖链的查茄碱的抗肿瘤活性高于以茄三糖(由一个半乳糖、一个葡萄糖和一个鼠李糖组成)为糖链的茄碱,这个结果与上面的研究结果一致;二种6-O-硫酸化修饰的糖苷6-O-双硫酸茄碱和6-O-硫酸查茄碱对人结肠癌细胞均无抑制活性,说明糖链的6-OH 在甾体糖苷抗肿瘤活性中起至关重要的作用,此结果与我们以前的研究一致[14];全乙酰化查茄碱对HCT-8细胞也无抑制活性。甾体糖苷糖链上羟基的硫酸化和乙酰化修饰可能导致了糖苷脂溶性下降,从而失去了与膜甾醇结合的能力和细胞信号传导能力,导致甾体糖苷生物活性消失。

图4 查茄碱、茄碱、6-O-双硫酸茄碱、6-O-硫酸查茄碱和全乙酰化查茄碱对HCT-8细胞的抑制作用Fig.4 Inhibitory effects of chaconine,solanine,6-O-sulfated chaconine,6,6′-di-O-sulfated solanine and per-O-acetyled chaconine on the growth of HCT-8 cells
3 结论
甾体糖苷具有良好的抗肿瘤活性,有很高的药用价值和开发潜力。本文通过比较结构相关的甾体糖苷及其化学修饰物的抗肿瘤活性,发现以查茄三糖为糖链的三种甾体糖苷抗肿瘤活性明显高于其它糖链的二种甾体糖苷;同样是以查茄三糖为糖链的薯蓣皂苷和边缘茄碱,苷元“F”环为含“O”环的薯蓣皂苷抗肿瘤活性略高于苷元“F”环为含“N”环的边缘茄碱;糖链上羟基的硫酸化和乙酰化修饰使茄碱和查茄碱失去了抗肿瘤活性。构效分析表明,甾体糖苷苷元的结构、糖链的单糖组成和结构等对甾体糖苷的活性有重要的影响。
[1]Milner S E,Brunton N P,Jones P W,et al. Bioactivities of glycoalkaloids and their aglycones from Solanum species[J]. J Agric Food Chem,2011,59:3454-3484.
[2]Esteves S A,Sarmento da Silva T M,Alves C C F,et al. Cytotoxic activities against ehrlich carcinoma and human K562 leukaemia of alkaloids and flavonoid from two Solanum species[J]. J. Braz. Chem Soc,2002,13(6):838-842.
[3]Hu K,Kobayashi H,Dong A J,et al. Antineoplastic agents III:steroidal glycosides from Solanumnigrum. Planta Med. 1999,65,35-38.
[4]Liu L F,Liang C H,Shiu L Y,et al. Action of solamargine on human lung cancer cells-enhancement of the susceptibility of cancer cells to TNFs. FEBS Lett. 2004,577,67-74.
[5]Son Y O,Kim J,Lim J C,et al. Ripe fruits of solanum nigrium L. inhibits cell growth and induces apoptosis MCF-7 cells[J]. Food Chem Toxicol,2003,41(10):1421-1428.
[6]Kuo K W,Hsu S H,Li Y P,et al. Anticancer activity evaluation of the Solanum glycoalkaloid solamargine-triggering apoptosis in human hepatoma cells. Biochem Pharmacol. 2000,60,1865-1873.
[7]Chiang H C,Tseng T H,Wang C J,et al. Experimental anti-tumor agents from Solanum indicum L.[J]. Anticancer Res,1991,11(5):1911-1917.
[8]王丽娟,王岩,陈声武,等.薯蓣皂苷元体内、外的抗肿瘤作用[J]. 中国中药杂志,2002,27(10):777-779.
[9]李忌,陈俊杰,巨勇,等.天然甾体皂甙化合物的抗肿瘤活性[J]. 天然产物研究与开发,1999,11(1):14-17.
[10]Wang Z,Zhou J B,Ju Y,et al.Effects of two saponins extracted from the Polygonatum Zanlan-scianense pamp on the human leukemia(HL-60)cells[J]. Biol Pharm Bull,2001,24(2):l59-l62.
[11]Hibasami H,Moteki H,Ishikawa K,et al. Protodioscin isolated from fenugreek(Trigonella foenumgraecum L.)induces cell death and morphological change indicative of apoptosis in leukemic cell line HL-60,but not in gastric cancer cell line KATO III[J]. Int J Mol Med,2003,11(1):23-26.
[12]Cai J,Liu M,Wang Z,et al. Apoptosis induced by dioscin in Hela cells. Biol Pharm Bull,2002,25(2):19-196.
[13]Lee K R,Kozukue N,Han J S,et al. Glycoalkaloids and metabolites inhibit the growth of human colon(HT29)and liver(HepG2)cancer cells[J]. J Agric Food Chem,2004,52:2832-2839.
[14]Li S Y,He D J,Zhang X,et al. Modification of sugar chains in glycoalkaloids and variation of anticancer activity[J]. Chem Res Chinese Univ,2007,23:303-309.
[15]赵雪淞,高聆,王娟,等. 五种茄科糖苷生物碱及其混合物的抗真菌活性研究[J]. 天然产物研究与开发,2009,21(1):36-43.
[16]何大俊. 糖苷生物碱的结构和抗肿瘤活性研究[D]. 长春:东北师范大学,2006:22-38。
[17]李盛钰. 甾体皂苷糖链结构修饰及抗肿瘤构效关系研究[D]. 长春:东北师范大学2007:46-54。
[18]Zhao J M,Li S Y,Zhou Y F,et al. 6-O-Sulfated modification of natural glycoalkaloids chaconine and solanine[J]. Chem Res Chinese Univ,2006,22:189-192.
[19]Roddick J G,Rijnenberg A L. Effect of steroidal glycoalkaloids of the potato on the permeability of liposome membranes[J]. Physiol Plantarum,1986,68:436-440.
[20]Keukens E A J,Vrije T,Boom C,et al. Molecular basis of glycoalkaloid induced membrane disruption. Biochim Biophys Acta,1995,1240:216-228.
[21]Roddick J G,Weissenberg M,Leonard A L. Membrane disruption and enzyme inhibition by naturally-occurring and modified chacotriose-containing Solanum steroidal glycoalkaloids[J]. Pytochemistry,2001,56(6):603-610.
[22]Cham B E,Daunter B. Solasodine glycosides. Selective cytotoxicity for cancer cells and inhibition of cytotoxicity by rhamnose in mice with sarcoma 180[J]. Cancer Lett,1990,55(3):221-227.
[23]Shiu L Y,Chang L C,Liang C H,et al. Solamargine induces apoptosis and sensitizes breast
cancer cells to cisplatin. Food Chem Toxicol,2007,45,2155-2164.
[24]Hsu S H,Tsai T R,Lin C N,et al. Solamargine purified from Solanum incanum Chinese herb triggers gene expression of human TNFR I which may lead to cell apoptosis[J]. Biochem. and Biophysi. Research Communications,1996,229(1):1-5.
[25]Choi S H,Ahn J-B,Kozukue N,et al. Structure-activity relationships ofα-,β1-,γ-,and δ-tomatine and tomatidine against human breast(MDA-MB-231),gastric(KATO-III)and prostate(PC3)cancer Cells. J Agric Food Chem,2012,60,3891-3899.
[26]Chang L C,Tsai T R,Wang J J,et al. The rhamnose moiety of solamargine plays a crucial role in triggering cell death by apoptosis[J].Biochemical and Biophysical Research Communications,1998,242(1):21-25.
Structure-antineoplastic activity relationships of steroid glycosides
ZHAO Xue-song1,LI Sheng-yu2,YANG Xu3,ZHOU Yi-fa3
(1.College of Mining Industry,Liaoning Technical University,Fuxin 123000,China;2.Institute of Agro-food Technology,Jilin Academy of Agricultural Sciences/National R&D Branch Centre for Milk Processing,Changchun 130033;3.School of Life Sciences,Northeast Normal University,Changchun 130024,China)
In order to assess the roles of the carbohydrate side chain and aglycon part of steroid glycosides in influencing antineoplastic activities of these compounds,the antiproliferative activities against human cervical carcinoma(Hela),liver cancer(H7402)and mouse fibroblast(L929)cells of a series of structurally related individual compounds including dioscin,gracillin,solamargine,solasonine and chaconine,were examined using a microculture tetrazolium(MTT)assay. And then,the antiproliferative activities against human colonic cancer(HCT-8)cells of a series of chemically modified steroid glycosides including 6-O-sulfated chaconine,6,6′-di-O-sulfated solanine and per-O-acetyled chaconine were examined using a MTT assay. The results showed that the antiproliferative activity of the chacotriose-containing steroid glycosides dioscin,chaconine and solamargine was higher significantly than other trisaccharide-containing steroid glycosides solasonine and gracillin. The effectiveness against the human carcinoma cells was greater than against the mouse fibroblast cells. 6-O-sulfated chaconine,6,6′-di-O-sulfated solanine and per-O-acetyled chaconine shown no antiproliferative activity against human HCT-8 cells. Structure-activity relationship studies indicated that the F ring structure of the aglycon unit influence biological activity;the composition,nature and the order of attachment of the sugars in the oligosaccharide associated with the steroid glycosides,were important in the antineoplastic properties;the-OH group of the sugar molecules seem to be an vital factor related to antineoplastic activity.
steroid glycosides,antineoplastic activities,chemical modification,structure-activity relationship
2015-10-12
赵雪淞(1971-),女,博士,教授,研究方向:植物化学,E-mail:zhaoxs210@163.com。
高等学校博士学科点专项科研基金(20070200004)。
TS201.6
A
1002-0306(2016)11-0345-05
10.13386/j.issn1002-0306.2016.11.063

