响应面法优化盐酸降解小麦麸皮中植酸研究
赵孝先,高 玲,吴丽雅,赵 凯,3,*
(1.河北医科大学第四医院,河北石家庄 050011; 2.河北凯盛医药科技有限公司,河北石家庄 050035; 3.江西欧氏药业有限责任公司,江西新余 338004)
响应面法优化盐酸降解小麦麸皮中植酸研究
赵孝先1,高玲1,吴丽雅2,赵凯2,3,*
(1.河北医科大学第四医院,河北石家庄 050011; 2.河北凯盛医药科技有限公司,河北石家庄 050035; 3.江西欧氏药业有限责任公司,江西新余 338004)
本文旨在优化降解小麦麸皮中残留植酸的工艺。以麦麸为原料,植酸残余率为响应值,采用盐酸降解麸皮中植酸方法,分别研究了盐酸溶液浓度,料液比,时间和温度的影响,依据单因素的实验结果,进行了Box-benhnken响应面优化实验,得到了最佳的工艺条件:时间为2.5 h,温度为52 ℃,盐酸浓度为1.2 mol/L,料液比为1∶21 g/mL,此时,植酸残余率仅为0.625%。表明此法可以较好的降解植酸。
麦麸,植酸,降解,响应面分析
我国是小麦主要的产地和消费国,其中小麦颗粒质量的14%~17%是小麦麸皮,而麸皮中植酸含量可达2.5%~5.8%[1-2]。植酸(Phytic acid)化学名为环己六醇-六磷酸酯,即肌醇六磷酸,含有六个磷酸基和十二个羟基[3-4],具有强酸性和强螯合能力,被认为是一种天然的抗营养因子,降低了人体对钙铁锌等营养素的吸收[5]。目前药用小麦纤维素颗粒已被批准进口并在我国上市销售,但国内对小麦纤维素的研究相对较少。本研究旨在降低小麦麸皮中的植酸,为后续制备小麦纤维素保健品和药品提供一定的数据参考,实现小麦麸皮利用最大化。
目前,对于降解小麦麸皮中植酸的研究较少,其主要有沉淀法[6]、超声波提取法[7]、内源植酸法[8]和加速溶剂法[9]等,但因其成本高、耗时长等缺点导致难以实现工业化生产。本研究以盐酸降解小麦麸皮中植酸,采用响应面法优化不同条件(盐酸浓度、料液比、时间和温度)对植酸残余率的影响,确定最佳优化工艺。
1 材料与方法
1.1材料与仪器
小麦麸皮(河北)由石家庄益海粮油工业有限公司提供;植酸钠标准溶液美国Sigma公司;浓盐酸、磺基水杨酸钠、三氯化铁等试剂均为国产分析纯。
TU-1800S紫外可见分光光度计北京普析通用仪器有限公司;KQ-250超声波清洗器昆山市超声波仪器有限责任公司;TGL-15B离心机上海安亭科学仪器厂。
1.2实验方法
1.2.1盐酸浸提小麦麸皮中植酸称取清洗干燥后的小麦麸皮5 g,加入一定体积,一定浓度的盐酸溶液,置于预设温度的水浴锅中,保温磁力搅拌一定时间[7,10]。然后将提取后的混合液全部转移到离心管中,10000 r/min离心10 min。对浸提后小麦麸皮渣清洗至中性,干燥,称重,待分析检测。以小麦麸皮中植酸的残余率为实验检测指标。
1.2.2植酸的分析检测方法超声作用可产生各种效应,这些效应能够提高传质速度,增大传质面积和物质的活化能,从而促进分离过程[11]。虽然超声波被应用在工业生产中有一定难度,但可采用超声波辅助方法分析检测植酸,以提高数据的准确性[12]。将上述处理得到的样品置于100 mL锥形瓶中,料液比1∶20,添加2 mol/L稀盐酸溶液、在250 W、50~60 kHz超声波处理1 h后,50 ℃水浴浸提2 h,1000 r/min,离心20 min,取上清液,待分析[8,10]。
1.2.3标准曲线的绘制实验采用比色法测定小麦麸皮中植酸的残留含量,详细方法参考国家标准(GB/T 5009.153-2003 植物性食品中植酸的测定)。
1.2.4植酸残余率的计算
1.2.5单因素的实验设计在盐酸降解小麦麸皮中植酸的实验过程中发现,盐酸溶液的浓度(0.2、0.5、0.8、1.1和1.4 mol/L)和麸皮与盐酸溶液的料液比(1∶5、1∶10、1∶15、1∶20和1∶25 g/mL),降解时间(0.5、1.0、2.0、3.0和4.0 h)和降解温度(20、30、40、50和60 ℃)影响植酸的降解效果,以小麦麸皮植酸的残余率为指标,分析研究这4个因素的影响。
1.2.6响应面实验设计依据单因素的实验结果,以植酸的残余率为响应值,分别选取盐酸溶液的浓度1.1 mol/L、麸皮与盐酸溶液的料液比1∶20、降解时间3 h和温度50 ℃作为中心点,进行4因素3水平的响应面优化实验设计,采用回归方程拟合因素与响应值之间的函数关系,通过回归方程优化工艺参数,预测响应值,获得最佳的工艺条件,水平设计见表1。

表1 响应面分析因素与水平
1.3数据处理方法
响应面分析法是将该体系的响应值作为一个或多个因素的函数,通过图形将这种函数关系表现出来,用于选择实验设计中最优方法。本实验采用Design-Expert软件中Box-benhnken中心组合实验设计,每组实验做3个重复,取平均值,对实验数据进行回归分析,确定该模型的可靠性以及平方效应、线性效应和交互效应的显著性[13]。
2 结果与分析
2.1植酸溶液标准曲线绘制
如图1所示,该标准曲线R2=0.9997,线性关系良好,能够分析样品中植酸的含量。
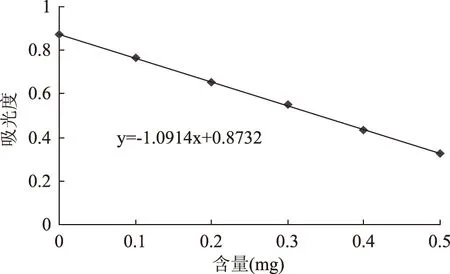
图1 植酸含量的标准曲线Fig.1 Standard curve for phytic acid content determination
2.2单因素实验结果分析
2.2.1降解时间对植酸残余率的影响固定降解温度为50 ℃,盐酸浓度为1.1 mol/L,麸皮与盐酸溶液的料液比为1∶20(g/mL),研究降解时间对植酸残余率的影响,结果见图2。
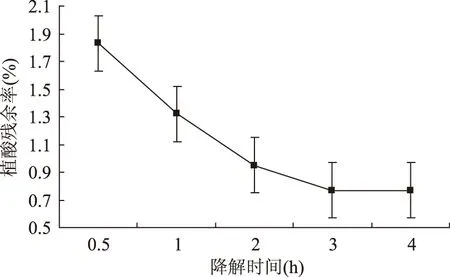
图2 降解时间对植酸残余率的影响Fig.2 Effect of degradation time on the residual amount of phytic acid
由图2可知,在0.5~4 h时间范围内,小麦麸皮中植酸的残余率在逐渐下降,最后趋于平缓。因为植酸的降解是一个动态的过程,随着时间的推移,植酸在逐渐降解,于此同时,麸皮中其它成分也会溶出,当反应一定时间时,达到平衡状态。所以,选择3 h为最适宜降解时间。
2.2.2降解温度对植酸残余率的影响固定降解时间为3 h,盐酸浓度为1.1 mol/L,麸皮与盐酸溶液的料液比为1∶20(g/mL),研究降解温度对植酸残余率的影响,结果见图3。
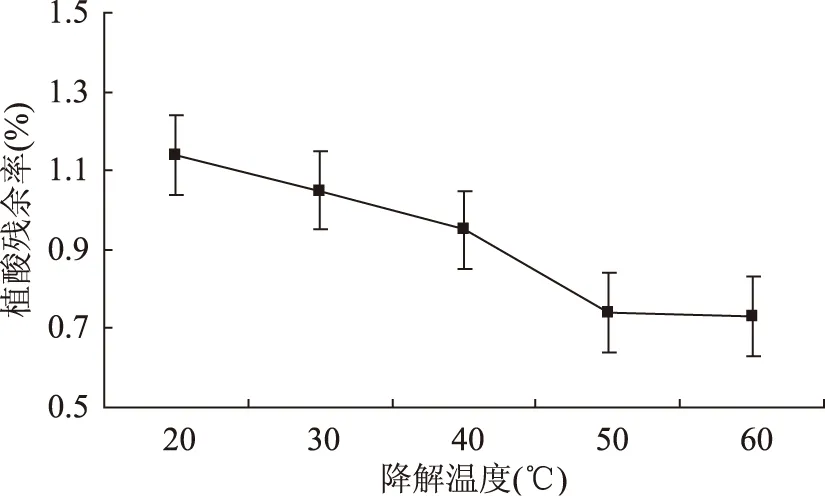
图3 降解温度对植酸残余率的影响Fig.3 Effect of degradation temperature on the residual amount of phytic acid
由图3可知,在20~60 ℃温度范围内,小麦麸皮中植酸的残余率在逐渐下降趋于平缓。因为随着温度的增高,溶液中分子动能在提高,有利于植酸的降解,同时植酸较强的螯合能力容易与溶出蛋白质的等组分形成螯合物,因此,最后趋于平缓。所以,选择50 ℃为最适宜降解温度。
2.2.3盐酸溶液浓度对植酸残余率的影响固定降解温度和时间分别为50 ℃,3 h,麸皮与盐酸溶液的料液比为1∶20(g/mL),研究盐酸浓度对植酸残余率的影响,结果见图4。
由图4可知,在0.2~1.4 mol/L盐酸溶液浓度范围内,小麦麸皮中植酸的残余率在逐渐下降趋于平缓。因为随着浓度的提高,植酸的螯合能力也会逐渐下降,故会有更多的植酸降解,但由于在酸性条件下,麸皮中的蛋白质和糖类等组分也会溶出,从而影响植酸的降解,所以,选择1.1 mol/L为最适宜盐酸溶液浓度。

图4 盐酸溶液浓度对植酸残余率的影响Fig.4 Effect of concentration of hydrochloric acid on the residual amount of phytic acid
2.2.4料液比对植酸残余率的影响固定降解温度和时间分别为50 ℃,3 h,盐酸浓度为1.1 mol/L,研究麸皮与盐酸溶液料液比对植酸残余率的影响,结果见图5。
由图5可知,在1∶5~1∶25料液比范围内,小麦麸皮中植酸的残余率在逐渐下降,最后趋于平缓。因为当料液比较小时,麸皮不能够完全被浸湿,从而影响植酸的残余率,而当料液比较大时,植酸已经完全被浸提出来,因此,残余率趋于平缓。所以,选择1∶20为最适宜料液比。

图5 料液比对植酸残余率的影响Fig.5 Effect of ratio of solid to liquid on the residual amount of phytic acid
2.3响应面优化实验结果分析
根据单因素的实验结果,采用Design-Expert 8软件中Box-Behnken 实验设计,对表2中实验数据进行了拟合,得到了回归方程:Y=0.64-0.083X1-0.089X2-0.059X3-0.043X4+0.027X1X2+0.051X1X3+0.019X1X4+0.072X2X3+0.076X2X4-0.038X3X4+0.18X12+0.19X22+0.13X32+0.12X42
实验设计共29组实验,其中用于评判实验误差的零点实验重复5次,其它是析因实验。
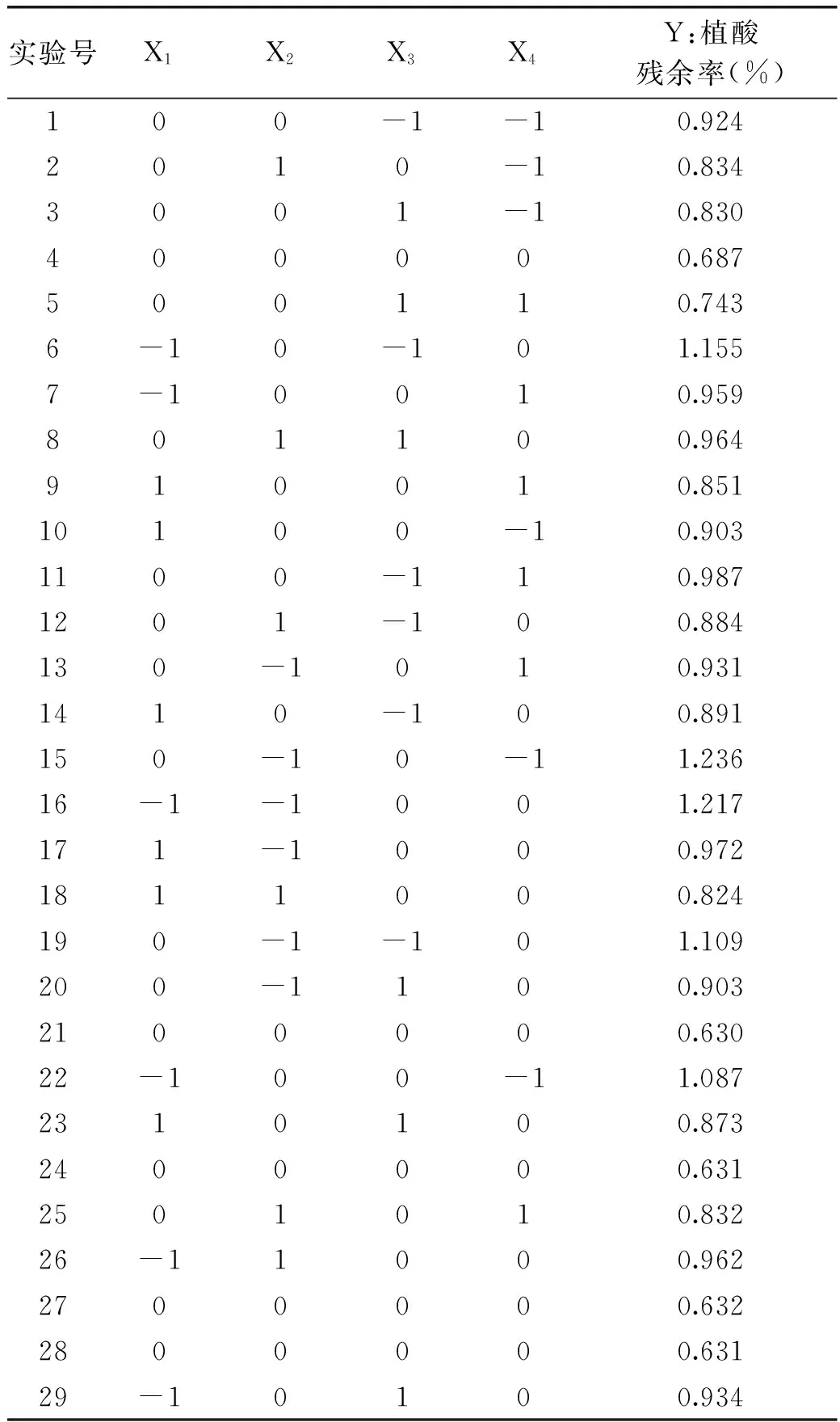
表2 响应面实验设计及结果


表3 方差分析表
注:*表示显著(p<0.05),**表示极显著(p<0.01)。
从方差分析表可知,一次项X1、X2和二次项 X12、X22、X32、X42影响较大,极显著,交互项X2X3和X2X4影响显著。其中各个因素对植酸残余率影响的大小顺序是:X2>X1>X3>X4。
2.3.2响应面分析图6直观的反应了交互作用显著的两个因素的影响,响应面图的陡峭是否椭圆表明交互作用大小,响应面图的底端所标示的最低点是最小值,说明存在极值,因此从响应曲面图可以看出X2X4的曲面较X2X3陡,说明X2X4对响应值的影响大于X2X3。
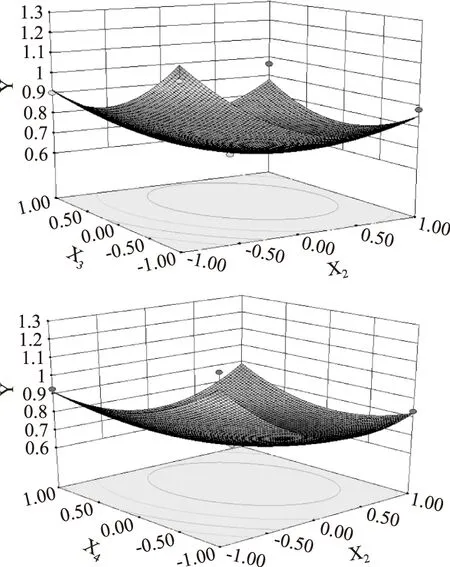
图6 交互显著的因素相应曲面图Fig.6 Response surface plot for the residual amount of phytic acid at notable interacting factor
2.3.3响应面条件的确定根据回归方程,依据Design-Expert 8软件进行分析,得到理预测的理论值:X1=-0.66,X2=0.17,X3=0.34,X4=0.23,即降解时间为2.34 h,降解温度51.7 ℃,盐酸浓度1.202 mol/L,料液比1∶21.15 g/mL,此时,植酸的残余率为0.627%。但是考虑到实际情况,条件修改为:时间为2.5 h,温度为52 ℃,盐酸浓度为1.2 mol/L,料液比为1∶21 g/mL,在此条件下,实验三次,植酸残余率平均值为0.625%,与理论值相差不大,因此采用响应面法优化盐酸降解麦麸中植酸的实验条件可靠,具有实际意义。
3 结论
本实验以麦麸为原料,以麦麸中植酸的残余率为响应值,在单因素的基础上,分别探讨了时间,温度,盐酸浓度和料液比对响应值的影响,并进行优化,得到最佳的工艺条件:时间为2.5 h,温度为52 ℃,盐酸浓度为1.2 mol/L,料液比为1∶21 g/mL,此时,植酸残余率仅为0.625%。本文为小麦麸皮系列产品的制备提供了理论依据。
[1]Akhtar M,Tariq AF,Awais MM,et al. Studies on wheat bran arabinoxylan for its immunostimulatory and protective effects against avian coccidiosis[J]. Carbohydrate Polymers,2012,90(1):333-339.
[2]郭娜.小麦麸皮纤维降解糖化与分层利用[D].合肥:合肥工业大学,2013.
[3]JR Zhou,JW Erdman Jr. Phytic acid in health and disease[J].Critical Reviewsin Food Science and Nutrition,1995,35(6):495-508.
[4]李健秀,王建刚,王文涛.植酸的制备及应用进展[J].化工进展,2006,25(6):629-633.
[5]张正磊,周惠明.酶法降解糙米中植酸初探(一)——糙米中植酸提取或降解方法选择[J]. 食品工业科技,1999,2(2):33-34.
[6]田玉珍,赵有贵.用麦麸制取植酸钙的研究[J].河北化工,1996(1):34-35.
[7]余安.花生粕中植酸的提取与纯化研究[D].武汉:华中农业大学,2010.
[8]杨武,汤锋,王丽,等.内源植酸酶降解麦麸中植酸的研究[J].粮食与饲料业,2009,7(6):20-21.
[9]曾雪灵,陈永欣,叶明立,等.加速溶剂萃取离子色谱测定油菜籽饼中的植酸[J].浙江大学学报:理学版,2006,33(6):667-670.
[10]袁建,王艳,范哲,等.响应面法优化小麦麸皮中植酸的提取工艺[J].粮食与饲料工业,2013(12):13-17.
[11]胡松青,丘泰球,张喜梅. 功率超声在分离纯化中的应用[J]. 声学技术,1999,18(4):180-184.
[12]张奶玲.植酸提取技术改进及其在果蔬保鲜中的应用研究[D].吉林:吉林农业大学,2008.
[13]王明艳,张小杰,王涛,等.响应面法优化香椿叶多糖的提取条件[J].食品科学,2010,31(4):106-110.
[14]秦德利,贾坤,窦珺荣,等.茶树花多糖超声波辅助热水浸提工艺优化[J].食品工业科技,2015,36(4):215-219.
[15]许远,魏和平,吴彦,等.响应面优化襄荷总黄酮提取及抗氧化研究[J].食品工业科技,2015,24(5):233-239.
Optimization of degradation phytic acid for wheat bran by hydrochloric acid using response surface methodlogy
ZHAO Xiao-xian1,GAO Ling1,WU Li-ya2,ZHAO Kai2,3,*
(1.The Fourth Hospital of Hebei Medical University,Shijiazhuang 050011,China; 2.Hebei Kingsci Pharmaceutical Technology Co.,Ltd.,Shijiazhuang 050035,China; 3.Jiangxi Ourshi Pharmaceutical Co.,Ltd.,Xinyu 338004,China)
The aim was to optimize the degradation of phytic acid of wheat bran. Hydrochloric acid degradation of phytic acid was used to investigate the concentration of hydrochloric acid,ratio of solid to liquid,time and temperature were studied. According to single factor experiment,the optimum conditions showed that when the time of 2.5 h,temperature of 52 ℃,the concentration of hydrochloric acid of 1.2 mol/L,the ratio of solid to liquid 1∶21 g/mL,the residual amount of phytic acid reduced to 0.625% by Box-benhnken.It showed that the method of hydrochloric acid degradation was a better method.
wheat bran;phytic acid;degradation;response surface methodlogy
2015-09-08
赵孝先(1968-),男,大学本科,主治医师,主要从事药物研发与临床应用,E-mail:hbydsyzhxx@163.com。
赵凯(1965-),男,博士,正高级工程师,主要从事药物研究与开发工作,E-mail:zhkaihx@163.com。
TS210.1
A
1002-0306(2016)10-0311-05
10.13386/j.issn1002-0306.2016.10.055

