低温碱性脂肪酶型时间-温度指示剂的研究
任兴晨,茅林春,苑佳佳,卢文静
(浙江大学生物系统工程与食品科学学院,浙江杭州 310058)
低温碱性脂肪酶型时间-温度指示剂的研究
任兴晨,茅林春*,苑佳佳,卢文静
(浙江大学生物系统工程与食品科学学院,浙江杭州 310058)
利用碱性脂肪酶催化三乙酸甘油酯分解导致pH降低,以酸碱指示剂显示颜色变化,研究并确定低温环境的TTI(时间温度指示剂)的反应体系及基本特性。该时间温度指示剂(25 mL)的反应体系为:5 mL三乙酸甘油酯∶20 g/L聚乙烯醇乳化液(v∶v=1∶19,均质10000 r/min,每次3 min,间隔5 min,共两次)、19.50 mL 0.05 mol/L pH10.60 Gly-NaOH缓冲液、0.05 mL 1 g/L碱性脂肪酶液、0.25 mL 0.10 mol/L CaCl2溶液、0.20 mL百里香酚蓝-酚酞-百里酚酞混合指示剂。通过测定反应体系在不同温度下的pH下降速率,最终确定该反应体系的Ea为60.14 kJ/mol。该反应体系可应用于监测低温环境下食品中酶反应或脂肪分解的程度,间接判断对应食品的品质状况。
时间温度指示剂,碱性脂肪酶,反应体系,活化能
食品质量的变化程度在很大程度上取决于食品贮运时间的长短和所处环境温度的高低[1]。时间温度指示剂(time-temperature indicator,简称TTI)贴附在食品包装上,和食品经历了相同的温度历史效应,通过产生简单的机械形变或颜色变化来指示食品在流通过程中经历的时间和实际温度的双重效应,从而监测食品质量变化和剩余货架期[2-3]。它可以应用于易变质食品的物流中,监测食品从生产到销售全部或部分温度历史,以确保食品品质安全。
国际上已开展TTI的研制,并在牛奶[4]、冷冻鱼[5]、冷冻肉[6]、冷冻汉堡[7]、冷藏水果及蔬菜[8]上进行了应用性研究。根据TTI的工作原理可以分为:酶型、微生物型、聚合物型、电子型、扩散型等[9]。其中酶型TTI原理简单,易于控制[3]。脂肪酶为甘油三酯水解酶,能够逐步将甘油三酯水解成甘油二酯、甘油单酯、甘油和脂肪酸[10],使反应体系pH降低,其来源广泛,价格低廉。
现有报道的脂肪酶型TTI反应体系是在20 ℃条件下研究确定的[11],其反应体系在冷藏温度下的适用性还无法确定。为了确保TTI在食品冷藏温度下的适用性,本实验研究了4 ℃条件下的碱性脂肪酶TTI反应体系,基本确定了底物种类、乳化处理、金属离子、底物浓度、pH指示剂等关键组分。
1 材料与方法
1.1材料与仪器
LVK-F100型碱性脂肪酶(20000 U/g)深圳市绿微康生物工程有限公司;三乙酸甘油酯、三丁酸甘油酯、三油酸甘油酯、聚乙烯醇124、氯化钠、氯化钙、氯化钾、氯化镁、酚酞、百里酚酞、酚红、百里香酚蓝、氢氧化钠、甘氨酸国药集团化学试剂有限公司。
FSH-2A FS-2型可调分散器金坛市科析仪器有限公司;MIR-254型培养箱日本SANYO公司;CR-200型色差计日本KONICA MINOLTA公司;FE20型实验室pH计瑞士METTLER TOLEDO公司。
1.2反应体系的确定
1 g/L碱性脂肪酶液:称取0.10 g碱性脂肪酶,用Gly-NaOH缓冲液定容至100 mL,静置1 h,过滤取滤液,4 ℃下保存。
酚红-酚酞-百里酚酞混合指示剂:称取0.10 g酚红,0.50 g酚酞,0.20 g百里酚酞,溶于100 mL 60%乙醇中,静置12 h后抽滤。
百里香酚蓝-酚酞-百里酚酞混合指示剂:称取0.10 g百里香酚蓝,0.30 g酚酞,0.10 g百里酚酞,溶于100 mL 50%乙醇中,静置12 h后抽滤。
1.2.2反应底物的确定分别取0.25 mL三乙酸甘油酯、三丁酸甘油酯、三油酸甘油酯,与4.75 mL 20 g/L聚乙烯醇(PVA)混合,用可调分散器乳化两次,转速10000 r/min,每次3 min,间隔5 min[12]。分别在三种乳化液中加入19.50 mL 0.05 mol/L pH10.60 Gly-NaOH缓冲液,在4 ℃下预冷10 min,加入0.05 mL 1 g/L碱性脂肪酶液,放置在4 ℃恒温箱,每隔4 h用pH计测pH。
1.2.3乳化处理参数的确定底物和乳化剂分3组处理:第1组0.25 mL三乙酸甘油酯加入4.75 mL 20 g/L PVA混合,10000 r/min均质,每次3 min,间隔5 min,共两次;第2组0.25 mL三乙酸甘油酯加入4.75 mL 20 g/L PVA,不均质;第3组0.25 mL三乙酸甘油酯加入4.75 mL 0.05 mol/L pH10.60 Gly-NaOH缓冲液[11]。反应体系同1.2.2,放置在4 ℃恒温箱中,每隔4 h测pH。
1.2.4金属离子对TTI反应体系的影响 三乙酸甘油酯与PVA按1∶19(v∶v)混合后均质(10000 r/min,每次3 min,间隔5 min,共两次),取5 mL乳化液分别加入到五组19.50 mL 0.05 mol/L pH10.60 Gly-NaOH缓冲液中,对照组中加入0.25 mL 0.05 mol/L pH10.60 Gly-NaOH缓冲液,4个实验组中分别加入0.25 mL 0.10 mol/L CaCl2、NaCl、KCl、MgCl2溶液,其余反应条件同1.2.2,每隔4 h测pH。
1.2.5底物浓度的选择底物含量配比见表1,反应条件同1.2.2,每隔4 h测pH。

表1 底物含量配比
1.2.6pH指示剂的确定0.25 mL三乙酸甘油酯与4.75 mL PVA混合均质(10000 r/min,每次3 min,间隔5 min,共两次),再加入19.50 mL缓冲液,0.05 mL酶液,0.25 mL 0.10 mol/L CaCl2溶液,分别加入0.20 mL酚红-酚酞-百里酚酞混合指示剂、百里香酚蓝-酚酞-百里酚酞混合指示剂。4 ℃下每隔4 h测pH,并用色差计测定反应液色泽。
第二,医护人员全面了解抗菌药物的相关知识,如药效、药动力学、适应症、禁忌症、使用方法、可能出现的不良反应等,掌握不同抗菌药物的药理作用,根据患者实际病情,选择性用药。
1.3TTI反应体系动力学参数的测定
目前对时间温度指示剂的动力学参数Ea研究报道的只有Arrenhenius模型,即lnK=lnKA-Ea/(R×T)[13-14]。本实验通过在不同温度下测量体系的pH,得到pH下降速率K进而求得Ea值。25 mL反应体系:0.25 mL三乙酸甘油酯与4.75 mL 20 g/L PVA混合均质(10000 r/min,每次3 min,间隔5 min,共两次)、19.50 mL 0.05 mol/L pH10.60 Gly-NaOH缓冲液、0.05 mL 1 g/L碱性脂肪酶液、0.25 mL 0.10 mol/L CaCl2溶液、0.20 mL百里香酚蓝-酚酞-百里酚酞混合指示剂。将反应体系分别置于4、10、15、20、25 ℃下,每隔4 h测pH。
1.4数据处理
全部实验数据用Origin 8.1进行统计处理,计算标准偏差;并使用SPSS 19.0进行差异显著性分析。
2 结果与讨论
2.1TTI反应体系的确定
2.1.1底物的选择脂肪酶为甘油三酯酶[10],因此本实验底物从三种常见的甘油三酯中选择。三丁酸甘油酯和三油酸甘油酯乳化后溶液呈白色,上层漂浮微小油滴。与三乙酸甘油酯组pH变化(100%)相比,三丁酸甘油酯和三油酸甘油酯pH相对变化幅度分别为29.30%、16.28%,这两种反应体系pH下降幅度小、速度慢;三乙酸甘油酯乳化后为透明均一液体,pH从10.46下降到8.31,pH跨度广(图1)。三乙酸甘油酯反应体系pH呈现出指数变化规律,将曲线用指数函数拟合,拟合系数为0.9635,pH呈现出良好的时间相关性。因此,选择三乙酸甘油酯作为TTI反应体系的底物。
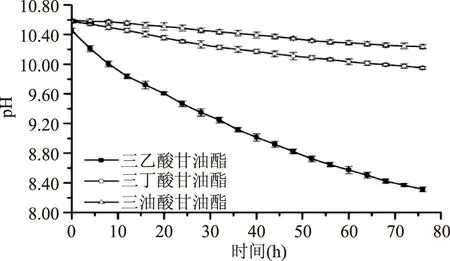
图1 三乙酸甘油酯反应体系pH-时间关系图Fig.1 pH-time relationship of triacetin reaction system
2.1.2乳化处理的效果各反应体系pH均呈现指数变化的规律,将各曲线用指数函数拟合,不加乳化剂不均质组、加乳化剂不均质组、加乳化剂并均质组的拟合系数分别为:0.9449、0.9410、0.9624,不加乳化剂不均质组与加乳化剂不均质组的拟合系数无显著差异(p=0.066),加乳化剂并均质组与其他两组的拟合系数具有显著差异(p<0.01),加乳化剂并均质组的拟合程度显著高于其他组,pH与时间相关性好。因此,本实验选择加乳化剂并均质处理,处理参数为10000 r/min,每次3 min,间隔5 min,共两次。
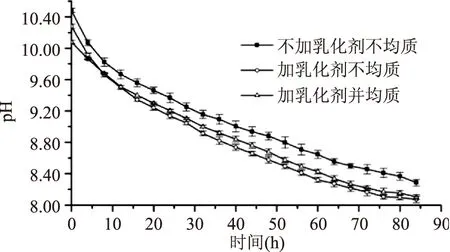
图2 乳化处理对反应体系pH的影响Fig.2 Effect of emulsification on pH value of reaction system
2.1.3金属离子的选择有文献报道[15],Na+能降低反应体系界面电荷效应的抑制作用,提高酶活力。1 mmol/L K+、Mg2+、Ca2+可以增强脂肪酶活力[16]。实验结果显示,各实验组pH差别较小,根据图像无法判断金属离子对反应体系的影响(图3)。
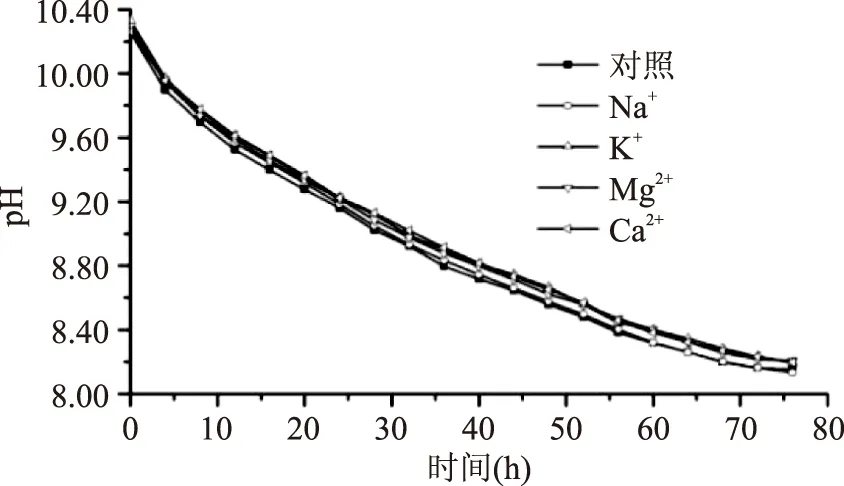
图3 金属离子对反应体系pH的影响Fig.3 Effect of metal ions on pH value of reaction system
反应60 h内,pH随时间的变化呈现出指数变化的规律,将各曲线用指数函数进行拟合[17]。对照、Na+、K+、Mg2+、Ca2+反应体系拟合系数分别为0.9683、0.9669、0.9679、0.9673、0.9838。对照组、Na+、K+、Mg2+实验组的拟合系数两两之间无显著差异,Ca2+实验组与其他各组均有显著差异(p<0.01),Ca2+实验组的拟合程度显著高于其余实验组,所以金属离子选择Ca2+。
2.1.4底物浓度的确定如图4所示,五组不同底物浓度的反应体系中e组pH变化最大。与e组(100%)比较,a、b、c、d组的相对变化幅度分别为59.38%、75.45%、90.63%、95.98%(图4)。a组和b组pH相对变化幅度较小,加入pH指示剂后指示剂的颜色变化不明显。c、d、e组pH相对变化幅度大,但d、e反应速率太快,导致时间温度指示剂的指示时间较短,适合在4 ℃下储存时间特别短的食品。从水产品实际保存时间来考虑,c组的底物含量最优。c组反应曲线的指数函数的拟合系数为0.9834,pH与时间的相关性好,因此底物浓度选择c组。
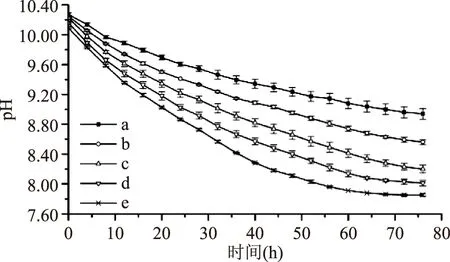
图4 底物浓度对反应体系pH的影响Fig.4 Effect of substrate concentration on pH value of reaction system
2.1.5pH指示剂的确定 酚红-酚酞-百里酚酞混合指示剂体系L*随时间先升高后趋于平缓,a*先升高后下降,b*基本呈上升趋势(图5)。与酚红-酚酞-百里酚酞混合指示剂(L*、a*、b*与时间的线性拟合系数分别为0.8080、0.3624、0.6219)相比,百里香酚蓝-酚酞-百里酚酞混合指示剂体系的L*、a*、b*有较好的时间相关性(L*、a*、b*与时间的线性拟合系数分别为0.9943、0.9565、0.9689),随时间增加,L*增大,a*由正值趋于0,b*由负值趋于0(图6),说明反应体系颜色逐渐变浅,最终呈现无色透明溶液。本实验选择百里香酚蓝-酚酞-百里酚酞混合指示剂,反应液的颜色变化顺序为蓝色-深紫-浅紫-无色,无色时即为反应终点,反应终点辨识度高(图7)。
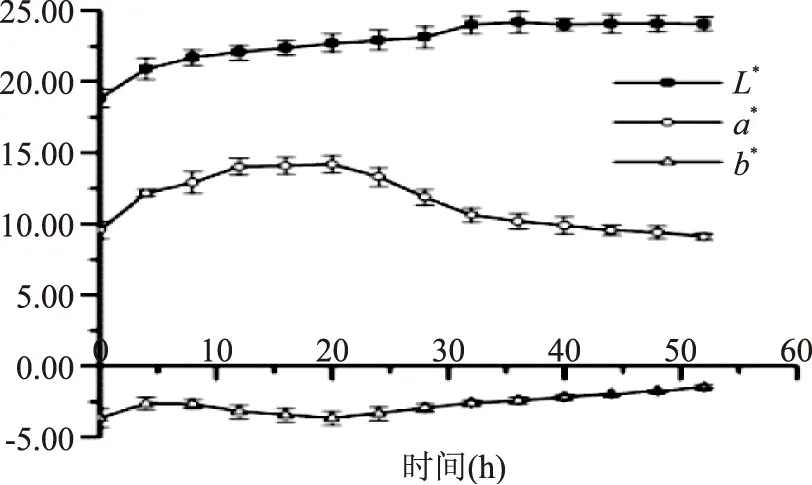
图5 酚红-酚酞-百里酚酞混合指示剂反应体系L*,a*,b*值与时间关系图Fig.5 Relationship of L*,a*,b* value and time in Phenol red-phenolphthalein-thymophthalein indicator reaction system

图6 百里香酚蓝-酚酞-百里酚酞混合指示剂反应体系L*a*b*值与时间关系图Fig.6 Relationship of L*a*b* value and time in Thymol blue-phenolphthalein-thymolphthalein indicator reaction system

图7反应体系颜色变化
Fig.7The color change of reaction system
2.2TTI反应体系动力学参数的测定
随着温度的升高,反应速率加快。在各温度下,反应的初期pH的变化呈现指数变化的趋势(图8),对各反应曲线进行指数函数的拟合,得到反应速率和决定系数R2(表2)。
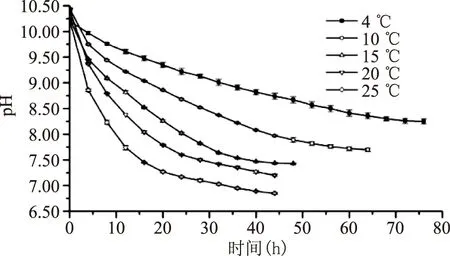
图8 温度对反应体系pH的影响Fig.8 Effect of temperature on pH value of reaction system

表2 不同温度下反应体系的反应速率和拟合曲线决定系数
根据Arrenhenius方程,lnK=lnKA-Ea/(R×T),以lnK对1/T×1000作线性图,则斜率为-Ea/(R×1000),得到回归方程y=-7.23x+20.34,R2为0.9985(图9),因此Ea/(R×1000)=7.23,求得Ea为60.14 kJ/mol。根据TTI应用于食品的匹配原则,以及引起食品质量下降的主要反应的活化能,可以判断该TTI可以指示因酶反应(典型活化能值:41.84~62.76 kJ/mol)或脂肪氧化(典型活化能值:41.84~104.60 kJ/mol)导致品质下降的食品质量变化[18],应用范围较广。但该TTI具体应用于哪种食品,需要进一步测定特定食品的Ea值和反应终点Ea值才能确定。

图9 不同温度条件下TTI速率常数与1/T半对数图Fig.9 Relationship of response rate constant and temperature
3 结论
研究确定了适用于低温(4 ℃)环境的碱性脂肪酶型TTI反应体系。反应体系总体积25 mL,包括5 mL三乙酸甘油酯∶20 g/L聚乙烯醇乳化液(v∶v=1∶19,均质10000 r/min,每次3 min,间隔5 min,共两次)、19.50 mL 0.05 mol/L pH10.60 Gly-NaOH缓冲液、0.05 mL 1 g/L碱性脂肪酶液、0.25 mL 0.10 mol/L CaCl2溶液、0.20 mL百里香酚蓝-酚酞-百里酚酞混合指示剂。反应体系的pH与时间相关性好,颜色变化为蓝色-深紫-浅紫-无色,变化显著,辨识度高,反应体系无色时即为反应终点。通过测定不同温度下的反应速率,确定了反应体系的活化能为60.14 kJ/mol,该时间指示剂可以指示因酶反应或脂肪氧化导致品质下降的食品质量变化。
[1]蔡华伟,任发政,张恒涛,等. 淀粉酶型时间-温度指示卡的研制[J]. 食品科学,2006,27(11):60-62.
[2]Taoukis P S,Labuza T P. Applicability of time-temperature indicators as shelf life monitors of food products[J]. Food Science,1989,54(4):783-788.
[3]贾增芹,卢立新. 商业化时间-温度指示器的研究进展及应用[J]. 食品与机械,2012,28(1):250-253.
[4]Wells J H,Singh R P. Application of time-temperature indicators in monitoring changes in quality attributes of perishable and semiperishable foods[J]. Journal of Food Science,1988(53):148-152.
[5]Mendoza T F,Weit B A,Otweii S,et al. Kinetic parameter stimation of time-temperature integrators intended for use with packaged fresh seafood[J]. Journal of Food Science,2004,69(3):90-96.
[6]Yoon S H,Lee C H,Kim D Y,et al. Time-temperature indicator using phospholipid-phospholipase system and application to storage of frozen pork[J]. Journal of Food Science,1994,59(3):490-493.
[7]Wells J H,Singh R P,Noble A. A graphical interpretation of time-temperature related quality changes in frozen food[J]. Journal of Food Science,2006,52(2):435-439.
[8]Giannakourou M C,Taoukis P S. Systematic application of time temperature integrators as tools for control of frozen vegetable quality[J]. Journal of Food Science,2006,67(6):2221-2228.
[9]成欢,朱光明,宋蕊. 时间温度指示剂研究进展[J]. 化工进展,2013,32(4):885-890.
[10]龚福生,施巧琴,吴松刚. 不同微生物碱性脂肪酶对底物水解能力的比较[J]. 福建轻纺,2000(1):1-4.
[11]宁鹏,费英,徐幸莲,等. 碱性脂肪酶型时间-温度指示卡反应体系的研究[J]. 南京农业大学学报,2009,32(1):115-120.
[12]吴丹. 碱性脂肪酶货架寿命指示体系的开发[D]. 杭州:
浙江大学,2005.
[13]Dan Wu,Yajun Wang,Jianchu Chen,et al. Preliminary study on time-temperature indicator(TTI)system based on urease[J]. Food Control,2013(34):230-234.
[14]Chahattuche Wanihsuksombat,Vipa Hongtrakul,Panuwat Suppakul. Development and characterization of a prototype of a lactic acid-based time-temperature indicator for monitoring food product quality[J]. Journal of Food Engineering,2010(100):427-434.
[15]Rathi P,Saxena R K,Gupta R. A novel alkaline lipase from Burkholderia cepacia for detergent formulation[J]. Process Biochemistry,2001,37(2):187-192.
[16]周晶. 一株脂肪酶产生菌的筛选鉴定、发酵条件优化及其酶学性质研究[D]. 杭州:中国计量学院,2012.
[17]宁鹏. 碱性脂肪酶型时间-温度指示卡的研制[D]. 南京:南京农业大学,2008.
[18]郑光临,钱静,冯钦. 糖化酶型时间-温度指示器反应体系的制备[J]. 食品科学,2013,34(12):82-85.
Research on low-temperature TTI based on lipase
REN Xing-chen,MAO Lin-chun*,YUAN Jia-jia,LU Wen-jing
(College of Biosystems Engineering and Food Science,Zhejiang University,Hangzhou 310058,China)
The reaction system and basic characteristic of low-temperature TTI(time-temperature indicator)was determined. The TTI was based on the color change of pH indicator resulted from the hydrolysis of triacetin by alkaline lipase. Finally,parameters of 25 mL reaction system was determined:5 mL triacetin∶20 g/L polyvinyl alcohol emulsion(v∶v=1∶19,10000 r/min,every time 3 min,5 min intervals,a total of 2 times),19.50 mL 0.05 mol/L pH10.60 Gly-NaOH buffer,0.05 mL 1 g/L alkaline lipase,0.25 mL 0.10 mol/L CaCl2solution,0.20 mL Thymol blue-phenolphthalein-thymolphthalein mixture indicator. The activation energy of TTI was determined to be 60.14 kJ/mol by measuring pH descending rate at different temperature. The TTI can be applied to monitor enzyme reaction or steatolysis of low-temperature food,and further to indicate the quality of corresponding food.
time-temperature indicator;alkaline lipase;reaction system;activation energy
2015-09-29
任兴晨(1991-),女,硕士研究生,主要从事水产品保鲜方面的研究,E-mail:xingchen5624@163.com。
茅林春(1962-),男,博士,教授,主要从事果蔬及水产品保鲜方面的研究,E-mail:linchun@zju.edu.cn。
国家科技支撑计划课题(2015BAD17B03)。
TS254.4
A
1002-0306(2016)10-0251-05
10.13386/j.issn1002-0306.2016.10.042

