云南松松针中原花青素的含量测定研究
刘 嘉,肖培云,刘光明,杨永寿
(1.大理大学药学与化学学院,云南大理 671000;2.云南省昆虫生物医药研发重点实验室,云南大理 671000)
云南松松针中原花青素的含量测定研究
刘嘉1,肖培云1,刘光明1,杨永寿2*
(1.大理大学药学与化学学院,云南大理671000;2.云南省昆虫生物医药研发重点实验室,云南大理671000)
目的:建立云南松松针中原花青素的含量测定方法,并研究不同月份云南松松针中原花青素的动态变化。方法:通过单因素试验和正交试验考察提取溶剂,溶剂pH值,提取温度,提取时间等因素对原花青素提取的影响;并以儿茶素为对照,采用紫外-可见分光光度法,在500 nm处测定原花青素的含量。结果:云南松松针中原花青素的最佳提取工艺为:采用pH 4.0的50%乙醇沸水浴回流3.0 h。结论:该法操作简便、结果准确,可用于云南松松针中原花青素的含量测定。
云南松松针;原花青素;含量测定
[DOI]10.3969/j.issn.2096-2266.2016.08.007
原花青素(proanthocyanidin)是广泛存在于植物的叶、花、果、皮中的天然多酚化合物,是目前国际上公认的天然抗氧化剂,具有较强的抗氧化活性,并能预防心血管疾病,抗肿瘤、抗辐射〔1〕等多种生物活性,且高效、低毒、生物利用度高等,已广泛应用于食品、药品、化妆品等领域,与原花青素相关的植物学和农学性状的研究、利用和改良正日益受到重视〔2〕。由于原花青素在自然界中总是以复杂混合物的形式存在,目前原花青素检测方法主要有:酸-丁醇法、对二甲氨基肉桂醛法、香草醛-盐酸法、花色素原法和Tannoid法〔3〕。其中香草醛-盐酸法对原花青素(缩合单宁)的测定具有特异性,特别是对于黄烷醇类物质测定效果较好〔4〕。
云南松(Pinus yunnanensis Franch)为常绿针叶乔木,又名青松,飞松,属松科松属植物。分布于云南、贵州西部、西藏东南部、四川西南部、广西西部等海拔多为600~2 800 m的广大地区〔5〕,资源十分丰富。松针(pine needle)是松树的叶,别名猪鬃松叶、松毛,性温,味苦,涩〔6〕。研究表明,其主要化学成分为多糖、植物蛋白、挥发油、原花青素、氨基酸、维生素、黄酮等〔7〕,具有镇静催眠、抗衰老、抗疲劳、抗氧化、抑菌、调血脂、保肝、抗肿瘤等药理作用〔8〕。经查阅文献可知,云南松松针中原花青素的含量测定尚未见报道,本文通过研究,建立其含量测定的方法,在此基础上进一步研究云南松松针中原花青素的提取工艺,为该资源的开发利用提供依据。
1 仪器与材料
1.1仪器UV-2550紫外可见分光光度计(日本岛津);AL204-IC电子天平(梅特勒-托利多仪器有限公司);SSY-4电子恒温水浴锅(上海科析试验仪器厂);SHZ-D(III)循环水式真空泵(巩义市予华仪器有限责任公司);SK8200超声波清洗器(上海科导超声仪器有限公司,300 W,50 KHz);101A-3B型电热鼓风恒温干燥箱(上海一恒)。
1.2材料云南松松针(采自云南省大理市巍山县者嬷山,海拔约2 500 m,由大理大学生药与药用植物学教研室杨月娥老师鉴定),儿茶素(中国食品药品检定研究院,批号:110721-201039);水为超纯水,其他试剂均为分析纯。
2 实验方法与结果
2.1溶液的制备
2.1.1对照品溶液的制备精密称取儿茶素对照品4.03 mg,置10 mL棕色量瓶中,加甲醇溶解,并定容至刻度,摇匀,即得,冷藏放置,备用。
2.1.2供试品溶液的制备精密称取云南松松针供试品(干燥、粉碎后过2号筛)0.5 g,置50 mL圆底烧瓶中,精密加入用盐酸调至pH 4.0的50%乙醇溶液25 mL,密塞,称重,水浴回流提取3.0 h,用pH 4.0 的50%乙醇溶液补重,混匀,用0.45 μm滤膜过滤,即得供试品溶液。
2.1.34.0%的香草醛-甲醇溶液的制备精密称取香草醛4.00 g,置100 mL量瓶中,甲醇溶解,定容至刻度,摇匀,于暗处放置,备用〔4-9〕。
2.2单因素考察
2.2.1测量波长的选择分别精密移取“2.1.1”、“2.1.2”项配制的供试品溶液、对照品溶液及50%乙醇各0.5 mL于10 mL棕色量瓶中,依次加入6 mL浓度为4.0%的香草醛-甲醇溶液,3 mL浓盐酸,再加甲醇定容至10 mL,密塞、摇匀,避光反应15 min,于400~600 nm波长范围内进行紫外扫描。结果表明,对照品溶液和供试品溶液都在500 nm波长处有最大吸收,与文献报道一致〔9-10〕,故选500 nm作为测量波长。见图1。

图1 标准品-供试品紫外组合光谱
2.2.2提取方法考察精密称取供试品6份,每份约0.5 g,按“2.1.2”项下,以pH 4.0的50%乙醇为提取溶剂,提取时间2.5 h,制备供试品溶液,分别考察回流、超声(300 W,50 KHz)2种提取方法,按“2.2.1”项下显色测定,以外标对照法计算原花青素的含量,结果表明,回流提取所得的原花青素含量最高,故采用回流提取法进行提取。见表1。
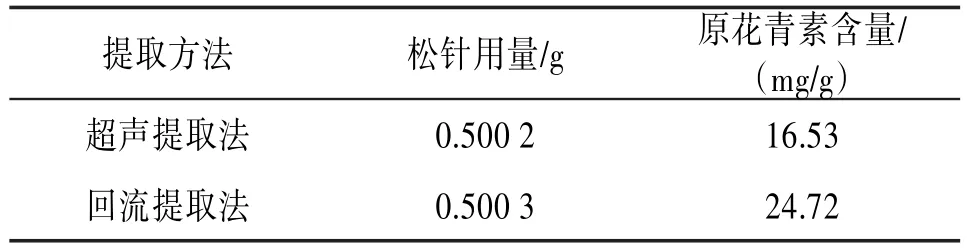
表1 提取方法考察结果(n=3)
2.2.3提取溶剂的考察精密称取供试品8份,每份约0.5 g,分别精密加入30%、40%、50%、60%、70%、80%、95%的乙醇及水溶液25 mL,80℃水浴回流2.5 h,提取液按“2.2.1”项下显色测定,并计算含量。见图2。蒸馏水所提的松针原花青素含量最低;且乙醇浓度为30%~50%时,原花青素的含量随乙醇浓度的增大而提高;但当乙醇浓度大于50%以后,原花青素的含量开始下降,故可选择50%乙醇溶液为提取溶剂。
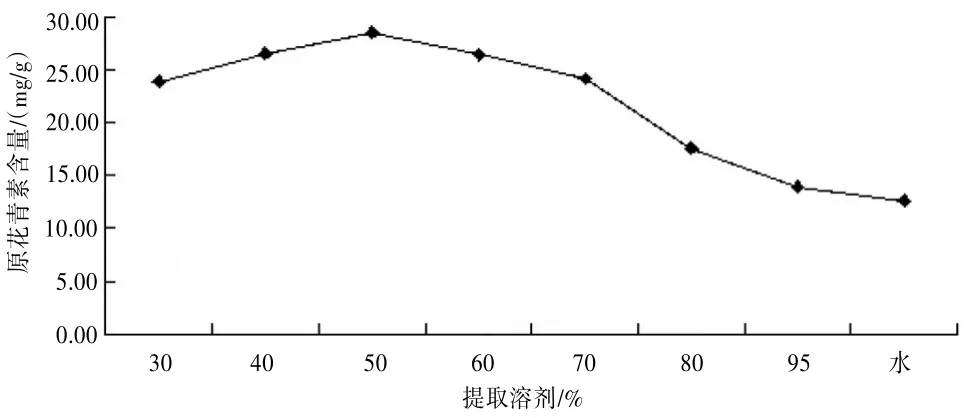
图2 不同含量乙醇溶液对原花青素提取的影响
2.2.4pH值的考察精密称取供试品7份,每份约
0.5 g,分别加入pH值为2、3、4、5、6、7、8的50%乙醇溶液25 mL,80℃水浴回流2.5 h,提取液按“2.2.1”
项下显色测定,并计算含量。原花青素的含量随pH
的改变而改变,pH 4.0时最高,这与文献〔11〕报道一致。见图3。

图3 pH对原花青素提取的影响
2.2.5提取温度考察精密称取供试品5份,每份约0.5 g,精密加入pH 4.0的50%乙醇溶液25 mL,分别在50、60、70、80℃及沸水下提取2.5 h,提取液按“2.2.1”项下显色测定,并计算含量。随着提取温度的升高,原花青素的含量呈增加的趋势。故选择用沸水浴提取。见图4。
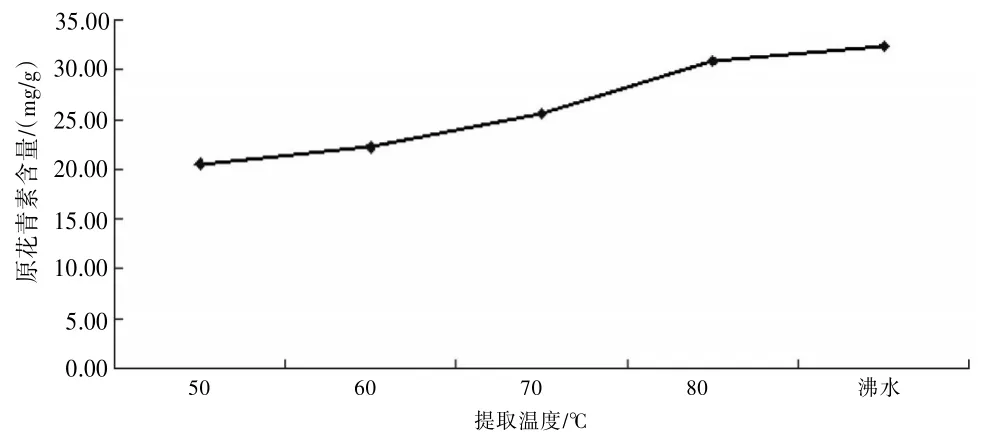
图4 提取温度对原花青素提取的影响
2.2.6提取时间的考察精密称取供试品7份,每份约0.5 g,精密加入pH 4.0的50%乙醇溶液25 mL,分别提取0.5、1.0、1.5、2.0、2.5、3.0、3.5 h,提取液按“2.2.1”项下显色测定,并计算含量。随着提取时间的增加,原花青素的含量呈增加的趋势,3.0 h后含量降低。故可选择3.0 h为提取时间。见图5。
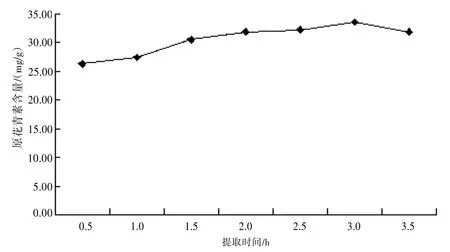
图5 提取时间对原花青素提取的影响
2.3正交试验在单因素试验的基础上,以原花青素含量为指标,采用正交试验L9(34)进行优化,因素水平见表2,正交试验结果见表3。
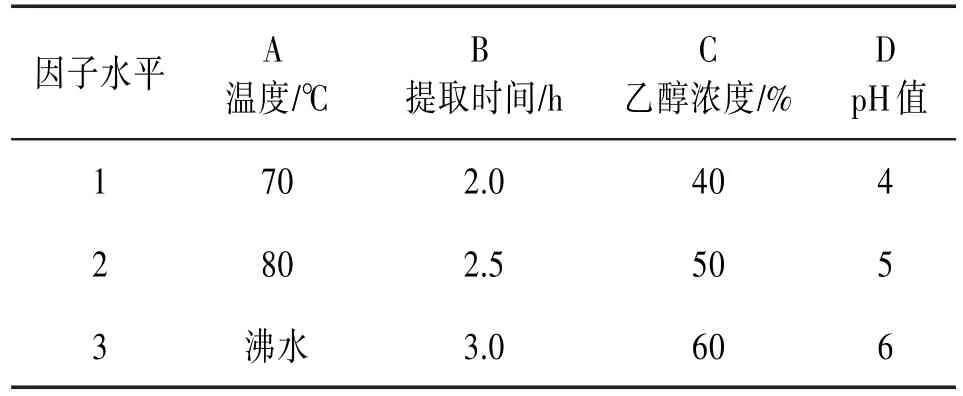
表2 正交试验因素和水平表

表3 松针原花青素提取正交试验结果(n=3)
由正交试验极差分析可知,4个影响因素对原花青素的影响顺序是A>D>B>C,即提取温度>pH值>提取时间>乙醇浓度,影响最大的为提取温度。最佳工艺条件为A3B3C2D1,即:提取溶剂为pH 4.0的50%乙醇,提取温度为沸水浴,提取时间3.0 h。
2.4方法学考察
2.4.1线性关系的考察分别精密吸取“2.1.1”项下的对照品溶液0.1、0.2、0.4、0.5、0.6、0.8、1.0 mL于10 mL棕色量瓶中,按“2.2.1”项下显色测定,绘制标准曲线,线性方程为:Y=34.595X+0.005 0,r=0.999 6,线性范围为4.03~40.30 μg/mL。
2.4.2精密度试验精密移取儿茶素对照品0.5 mL,按“2.2.1”项下显色测定,重复测定6次,RSD为0.18%,表明仪器精密度良好。
2.4.3稳定性试验精密称取供试品适量,按“2.1.2”制备供试品溶液,再按“2.2.1”项显色,每隔10 min测定1次,实验结果表明供试品溶液在90 min内稳定,RSD为1.1%。
2.4.4重复性试验精密称取供试品6份,每份约0.5 g,按“2.1.2”项制备供试品溶液,按“2.2.1”项下显色测定吸光度值,并计算含量。实验所得原花青素的平均含量为33.45 mg/g,RSD为2.6%,结果表明本实验重复性良好。见表4。
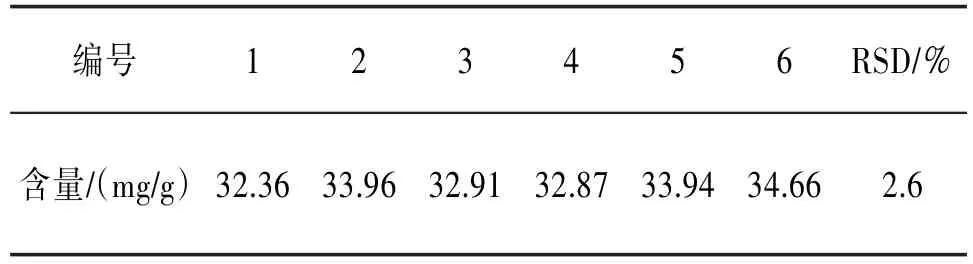
表4 重复性试验表
2.4.5加样回收率试验精密称取供试品6份,每份约0.24 g,按表5精密加入儿茶素对照品溶液,按“2.1.2”项制备供试品溶液,再按“2.2.1”项显色后测定,计算回收率。见表5。
2.5松针干燥方法的考察分别精密称取不同干燥方法所得的云南松松针供试品各3份,每份约0.5 g,按“2.1.2”项制备供试品溶液,再按“2.2.1”项显色后测定吸光度值,并计算含量。烘箱烘干的云南松松针中原花青素含量显著高于自然晒干和自然晾干的,故以烘箱烘干作为松针的干燥方法。见表6。
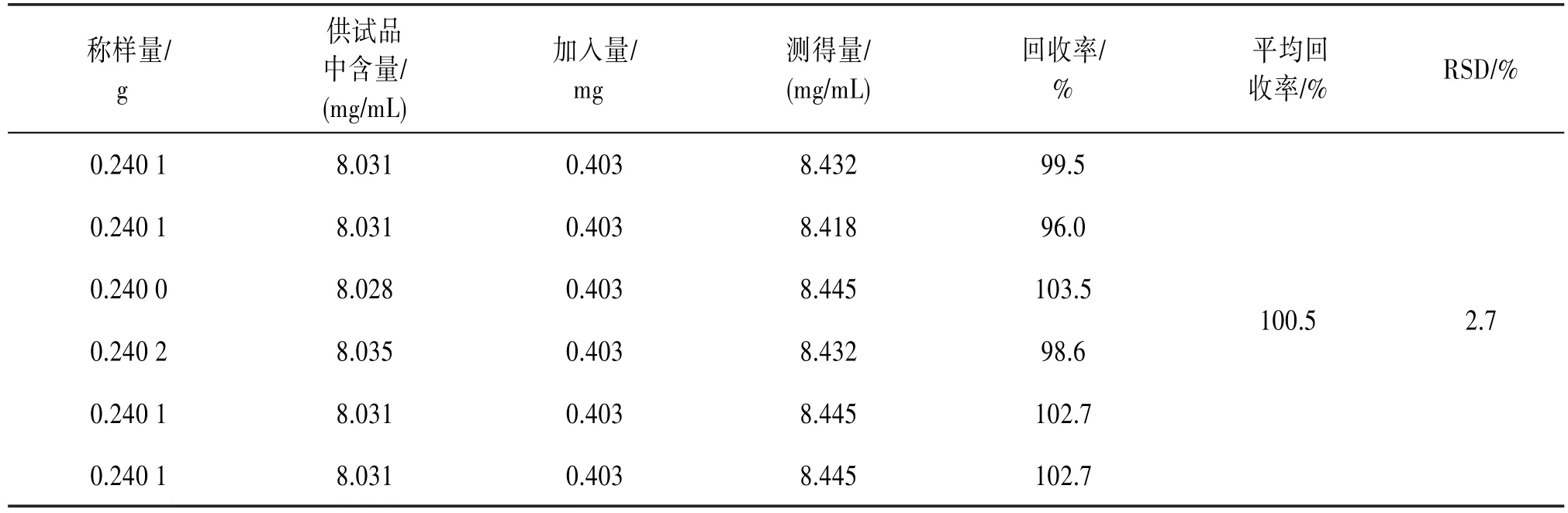
表5 加样回收率试验结果(n=6)

表6 不同干燥方法的考察(n=3)
2.6不同月份云南松松针中原花青素的含量测定由于药材不同生长时期其主要成分的含量有所不同,因此实验考察了不同生长时期云南松松针中原花青素的含量。见图6。由图6可知:10月份的云南松松针中原花青素的含量最高,故云南松的采摘应选择在10月份左右。
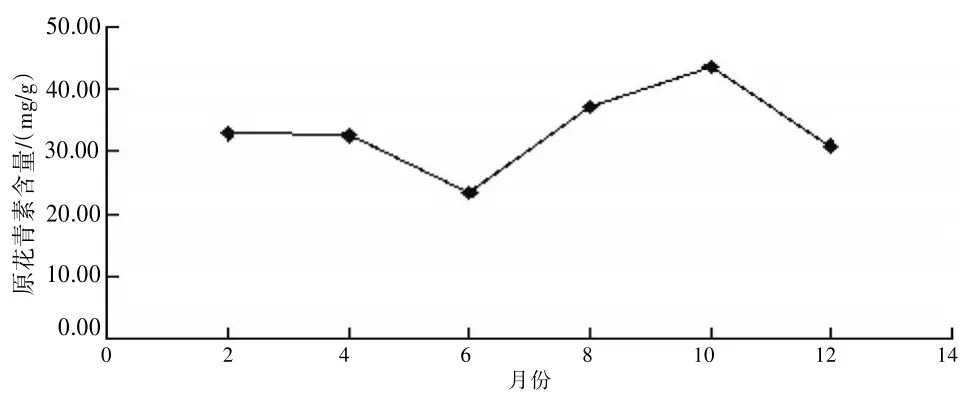
图6 不同月份松针中原花青素的含量
3 讨论
采用香草醛-盐酸法测定原花青素的质量浓度,其原理是利用在醇体系中的原花青素各种黄烷-3-醇单元间的酚醛缩合反应来测定原花青素的质量浓度,是一种比较准确的原花青素质量浓度测定方法。
从提取所得原花青素的含量上看,采用回流提取法优于超声提取法;比较了晒干、晾干、烘干3种干燥方式,结果表明烘干的松针中原花青素的含量最高;通过单因素试验和正交优化试验确定了云南松松针中原花青素的最佳提取工艺条件:采用pH 4.0的50%乙醇溶液进行水浴回流提取3.0 h。
本实验通过研究,得到云南松松针中原花青素的提取和含量测定方法,该方法操作简便,结果准确、可靠,可作为云南松松针中原花青素的含量测定方法。
〔1〕徐丽珊,黄启亮,吴振珍.松针中原花青素的提取工艺研究〔J〕.浙江师范大学学报(自然科学版),2011,34(2):197-201.
〔2〕张迪,赵文军,马丽娟,等.原花青素的性质、功能、纯化和利用〔J〕.安徽农学通报,2009,15(1):35-39.
〔3〕单岩,李永仙,郑飞云,等.原花青素对照品组份的UPLC-MS及RP-HPLC分析〔J〕.分析实验室,2012,31 (5):76-79.
〔4〕李春阳,许时婴,王璋.香草醛-盐酸法测定葡萄籽、梗中原花青素含量的研究〔J〕.食品科学,2004,5(2):157-160.
〔5〕杨燕,杨茂发,杨再华,等.云南松松针的挥发性化学成分〔J〕.林业科学,2009,45(5):173-177.
〔6〕江苏新医学院.中药大辞典:上册〔M〕.上海:上海科学技术出版社,1986:1254.
〔7〕杨天明,夏德超,朱景申,等.松针的研究进展〔J〕.中国药师,2002,5(12):748-749.
〔8〕赵桂芝,寿旦,俞忠明,等.松针提取物的药理学研究进展〔J〕.现代医院,2010,10(10):14-16.
〔9〕李童,张加研,秦永剑,等.思茅松树皮原花青素的化学降度提取工艺〔J〕.西南林业大学学报,2012,32(3):92-96.
〔10〕秦涛,王兴涛,刘军海.雪松树皮及树叶原花青素的提取工艺研究〔J〕.精油食品科技,2009,5(17):44-46.
〔11〕张海晖,李金凤,段玉清,等.板栗壳原花青素提取及其稳定性研究〔J〕.食品科学,2011,32(8):5-9.
〔Abstract〕Objective:To establish a method for determining proanthocyanidins in Yunnan pine needles and comparing their dynamic changes in different months.Methods:The influence of the extraction solvent,the pH of solvent,the temperature and the duration for the extraction proanthocyanidins were studied through single factor and orthogonal experiment.Taking catechin as controls,proanthocyanidins was determined on 500 nm by Ultraviolet-Visible Spectrophotometry.Results:The optimal parameters for the extraction of proanthocyanidins from Yunnan pine needles were 50%ethanol of pH 4.0 in the boiling water with reflux extraction,and each extraction time duration was 3.0 h.Conclusions:The method was simple and accurate,which could be used to measure the content of proanthocyanidins in Yunnan pine needles.
〔Key words〕Yunnan pine needles;proanthocyanidin;content determination
(责任编辑李杨)
Study on a Method for Determination of Proanthocyanidins in Yunnan Pine Needles
Liu Jia1,Xiao Peiyun1,Liu Guangming1,Yang Yongshou2*
(1.College of Pharmacy and Chemistry,Dali University,Dali,Yunnan 671000,China;2.Yunnan Provincial Key Laboratory of Entomological Biopharmaceutical R&D,Dali,Yunnan 671000,China)
R284
A
2096-2266(2016)08-0024-05
国家自然科学基金资助项目(81260632)
2015-08-04
2015-10-24
刘嘉,硕士研究生,主要从事药物分析研究.
杨永寿,高级实验师.

