云南省部分兰科植物中总氨基酸的含量测定
俞向东,伏孟瑜,陈路琼,杨盛春*
(1.大理市环保局,云南大理 671000;2.大理大学药学与化学学院,云南大理 671000)
云南省部分兰科植物中总氨基酸的含量测定
俞向东1,伏孟瑜2,陈路琼2,杨盛春2*
(1.大理市环保局,云南大理671000;2.大理大学药学与化学学院,云南大理671000)
目的:对云南省部分兰科植物中总氨基酸的提取条件进行优化,并测定其含量。方法:通过正交试验法优化最佳提取条件,茚三酮显色法在568 nm处测定总氨基酸的含量。结果:最佳提取条件为加入20 mL 75%乙醇,回流提取3次,每次60 min。甘氨酸对照品的浓度与吸光度在0.5~10 μg/mL范围内线性关系良好(r=0.999 8)。结论:茚三酮显色法操作简便,定量准确,适用于兰科植物中总氨基酸的含量测定。
兰科植物;总氨基酸;含量测定
[DOI]10.3969/j.issn.2096-2266.2016.08.006
兰科植物(Orchidaceae),是高等植物中分布最广、种类最多的一个大家族,为单子叶植物第一大科,全球约700属20 000余种,我国现已查明的兰科植物为170余属13 000余种〔1〕。兰科植物具有很高的药用价值,如天麻(Gastrodia elata)、铁皮石斛(Dendrobium offcinale)、金线莲(Anoectochilus formosanus)等〔2〕。兰科植物中主要含有菲类、联苄、甾体、黄酮类、多糖、氨基酸等成分〔3〕。目前对兰科植物中总氨基酸含量测定的研究报道很少,本文利用溶剂加热回流提取法〔4-5〕提取兰科植物中的总氨基酸,并优化提取工艺条件〔6〕,利用茚三酮显色法〔7-9〕在568 nm处测定不同品种兰科植物中总氨基酸的含量〔10-12〕,为兰科植物中氨基酸的开发利用提供依据。
1 仪器与材料
1.1仪器TU-1901双光束紫外分光光度计(北京普析通用仪器有限责任公司);722N可见分光光度计(上海菁华科技仪器有限公司);T6紫外可见分光光度计(北京普析通仪器有限责任公司);SB超声波清洗机(宁波新枝生物科技股份有限公司)。
1.2试剂与材料甘氨酸对照品(中国新兴化工试剂研究所,批号:130218);茚三酮(分析纯);无水乙醇(分析纯);兰科属植物,经昆明植物所胡江苗副研究员鉴定为兰科植物属芳香石豆兰(Bulbophyllum ambrosia(Hance)Schltr.)、岩生石仙桃(Pholidota rupestrisHand-Mazz)、叠鞘石斛(Dendrobiumaurantiacum Rchb.f.var.denneanum(kerv)Z.H.Tsi)、岩笋(Thunia alba(Lindl.)Reichb.F),将新鲜的样品晾干粉碎后,过60目筛备用。
2 方法与结果
2.1溶液的制备
2.1.12%茚三酮溶液的制备精密称取茚三酮约1.0 g置于50 mL量瓶中,加适量无水乙醇溶解后定容,冷藏备用。
2.1.2对照品溶液的制备精密称取甘氨酸对照品0.100 0 g,加蒸馏水溶解后定容至100 mL。
2.1.3供试品溶液的制备精密称取样约1.0 g,置于圆底烧瓶中,加入20 mL 65%的乙醇,加热回流提取3次,每次60 min。过滤,合并滤液,将滤液定容至100 mL,冷藏备用。
2.2最大吸收波长的选择分别精密量取对照品溶液、供试品溶液各2 mL,置10 mL量瓶中,加入茚三酮溶液0.4 mL,摇匀,水浴加热15 min,冷却,蒸馏水定容,以试剂空白作参比,于400~600 nm扫描,对照品溶液和供试品溶液均在568nm处均有最大吸收。
2.3标准曲线的绘制精密移取对照品溶液0.05、0.10、0.20、0.40、0.60、0.80、1.00 mL于10 mL量瓶中,按“2.2”项下方法显色后,在568 nm处测定吸光度值。以甘氨酸对照品溶液的浓度(C)为横坐标,吸光度(A)为纵坐标,得线性回归方程A=0.118 2 C-0.001 5,r=0.999 8,对照品溶液浓度与吸光度在0.5~10 μg/mL范围内线性关系良好。
2.4单因素考察试验
2.4.1乙醇浓度精密称取叠鞘石斛样品5份,每份约1.0 g,置于圆底烧瓶中,分别加入55%、65%、75%、85%、95%的乙醇20 mL,加热回流提取60 min,过滤,用相应质量分数的提取溶剂将滤液定容至100 mL,精密移取2 mL提取液于10 mL量瓶,按“2.2”项下方法显色。结果显示随着乙醇浓度的增加,样品中氨基酸的提取效率逐渐降低,在乙醇浓度为65%时,吸光度值最大。因此选择65%的乙醇为提取剂。
2.4.2乙醇用量精密称取叠鞘石斛样品5份,每份约1.0 g,置于圆底烧瓶中,分别加入10、15、20、25、30 mL的65%乙醇,加热回流提取60 min,过滤,用65%的乙醇将滤液定容至100 mL,精密移取2 mL提取液于10 mL量瓶中,按“2.2”项下方法显色。结果显示随着提取剂用量的增加,样品中氨基酸的提取效率先增加再减小,当乙醇用量为20 mL时,吸光度值最大。因此乙醇最佳用量为20 mL。
2.4.3提取时间精密称取叠鞘石斛样品3份,每份约1.0 g,置于圆底烧瓶中,加入65%的乙醇20 mL,分别加热回流提取30、60、90 min,过滤,用65%的乙醇将滤液定容至100 mL,精密移取2 mL提取液于10 mL量瓶中,按“2.2”项下方法显色。结果显示随着提取次数的增加,样品中氨基酸的提取效率先增加再减小,当提取时间为60 min时,吸光度值最大。因此最佳提取时间为60 min。
2.4.4提取次数精密称取叠鞘石斛样品3份,每份约1.0 g,置于圆底烧瓶中,加入65%的乙醇20 mL,分别加热回流提取1、2、3次、每次60 min,过滤,用65%的乙醇将滤液定容至100 mL,精密移取2 mL提取液于10 mL容量瓶中,按“2.2”项下方法显色。结果显示随着提取时间的增加,样品中氨基酸的提取效率逐渐降低,当提取次数为2次时,吸光度值最大。因此提取2次为最佳提取次数。
2.5正交试验在单因素实验基础上,选择乙醇浓度(A)、乙醇用量(B)、提取时间(C)、提取次数(D)为考察因素,每个因素分别设定3个水平,建立因素水平表。采用L9(34)进行试验,优选最佳提取条件。见表1。

表1 正交试验因素水平
各因素对叠鞘石斛中总氨基酸的提取率影响的主次顺序为A>C>D>B,即乙醇浓度>提取时间>提取次数>乙醇用量。由极差分析可知,最佳提取条件为A3B2C2D3,即乙醇浓度为75%,乙醇用量为20 mL,提取时间为60 min,提取次数为3次。见表2。
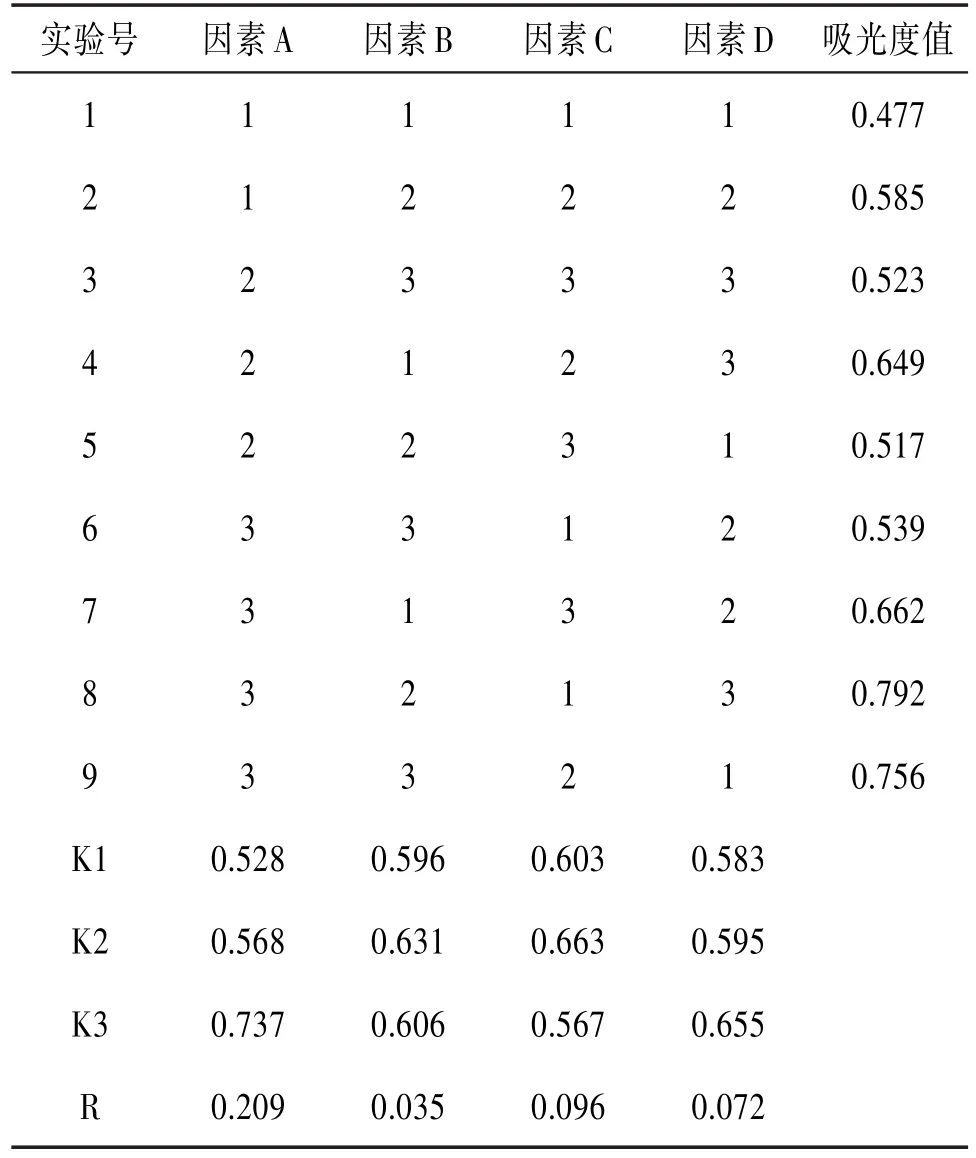
表2 正交表L9(34)及试验结果
2.6验证实验精密称取叠鞘石斛样品6份,每份约1.0 g,置于圆底烧瓶中,在最佳提取条件下,按“2.2”项下方法显色后,测定吸光度值。结果总氨基酸RSD为1.4%(n=6)。
2.7方法学考察
2.7.1精密度试验精密移取2 mL叠鞘石斛样品溶液于10 mL量瓶中,按“2.2”项下方法显色后,连续测定6次,计算RSD为1.9%(n=6)。
2.7.2稳定性试验精密移取2 mL叠鞘石斛样品溶液于10 mL量瓶中,按“2.2”项下方法显色后,分别在0.25、0.5、1、2、4、8 h测定其吸收度值,样品溶液显色后在8 h内稳定,RSD为1.5%。
2.7.3重复性试验精密称取叠鞘石斛样品6份,每份约1.0 g,按“2.1.3”项下方法制备样品溶液,按“2.2”项下方法显色后,测定吸光度A,计算RSD值。见表3。

表3 重复性试验结果(n=6)
2.7.4加样回收率试验精密称取叠鞘石斛样品9份,每份约2.8 g,设高、中、低3个浓度,每个浓度各3份,按“2.1.3”项下方法制备叠鞘石斛样品溶液,按“2.2”项下方法显色后,测定吸光度A,计算回收率。见表4。
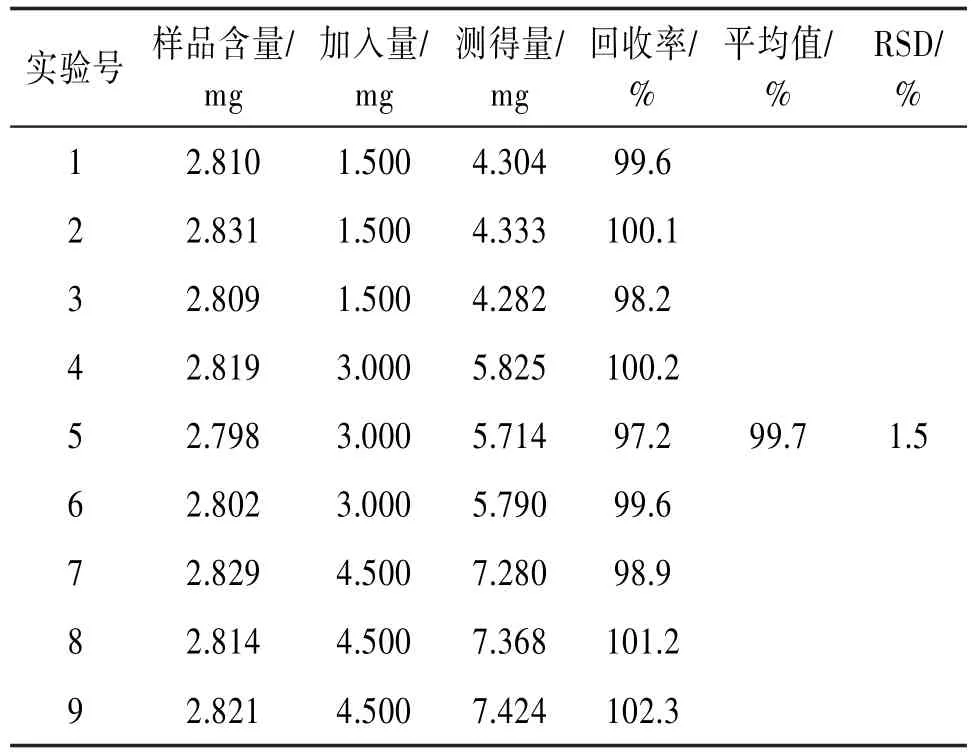
表4 加标回收率试验结果(n=9)
2.8样品含量测定取不同兰科植物各3份,每份约1.0 g,按“2.1.3”项下制备供试品溶液,精密移取各供试品溶液2 mL于10 mL量瓶中,按“2.2”项下方法显色后,分别测定吸光度,计算总氨基酸的含量。总氨基酸含量的计算公式为:总氨基酸含量,其中C为氨基酸样品液浓度,D为样品液配制过程的稀释倍数,1.599为转换系数,W为样品质量。
不同兰科植物总氨基酸含量差异很大,其中盐笋全株中的总氨基酸的含量是最高的,而芳香石豆兰全株中的总氨基酸的含量是最低的。见表5。

表5 不同兰科植物总氨基酸含量测定
3 讨论
预实验中,比较了溶剂加热回流与超声提取2种提取方法,溶剂加热回流方法提取效率高,所以采用溶剂加热回流提取法。根据所查文献可知,测定氨基酸的方法有:化学法、分光光度法、色谱法和电化学法。对比这4种方法,分光光度法操作简单,定量准确,灵敏度高,相对误差较小,实验成本低,所以本文采用分光光度法来测定兰科植物中的总氨基酸含量。
氨基酸广泛应用于食品行业、医药行业、农业、化妆行业,本文所用的甘氨酸对照品也有很多的用途,例如可以作抗菌剂、食品添加剂、调味剂、保鲜剂,此外还有调节人体胃液,延缓皮肤衰老等作用。随着生活水平的提高,人们对氨基酸类物质的需求越来越多,研究氨基酸是十分有意义的。本文研究兰科植物中的总氨基酸提取工艺条件和含量,可为开发利用兰科植物中的氨基酸提供依据。
〔1〕常森有,杨耀海.文山州药用兰科植物资源调查初报〔J〕.林业调查规划,2013,38(3):61-67.
〔2〕罗毅波,贾建生,王春玲.中国兰科植物保育的现状和展望〔J〕.生物多样性,2003,11(1):70-77.
〔3〕陈业高,王红艳.金石斛属植物化学成分及药理活性研究进展〔J〕.时珍国医国药,2005,16(8):725-727.
〔4〕刘荣森,杨虹琦,黄郁维,等.植物中游离氨基酸的提取、纯化及分析方法〔J〕.河南科技大学学报(自然科学版),2007,28(3):76-79.
〔5〕于艳,毛佳宁,时维静,等.菊花氨基酸提取方法的比较〔J〕.安徽科技学院学报,2014,28(4):30-33.
〔6〕王培培,鲁芹飞,李婧,等.铁皮石斛中总氨基酸的含量测定及提取工艺优选〔J〕.中国实验方剂学杂志,2013,19(14):31-33.
〔7〕杨远帆,倪辉,吴黎明.茚三酮法测定蜂蜜及果葡糖浆中的氨基酸含量〔J〕.中国食品学报,2013,13(2):171-176.
〔8〕朱瑾,李新霞,陈坚.茚三酮比色法测定蒜氨酸原料药中总氨基酸的含量〔J〕.西北药学杂志,2008,23(3):136-138.
〔9〕邵金良,黎其万,董宝生.茚三酮比色法测定茶叶中游离氨基酸总量〔J〕.中国食品添加剂,2008(2):162-165.
〔10〕张凌.氨基酸含量测定的分光光度法研究〔J〕.科技信息(学术版),2006(3):238-240.
〔11〕刘玉明,吴玉田,柴逸峰.蓝桉果实中氨基酸成分的含量测定〔J〕.中国药房,2007,18(12):915-916.
〔12〕王斌,张腾霄,宋相周,等.不同产地板蓝根中多糖及总氨基酸含量的分析比较〔J〕.南方农业学报,2014,45 (1):23-27.
〔Abstract〕Objective:To optimize the extraction technology of total amino acids from parts of Orchidaceae plants in Yunnan and determine the content.Methods:The best extraction conditions were optimized by orthogonal test,and the content of total amino acids was determined in 568 nm through Nihydrin colorimetry method.Results:The best extraction conditions were as follows:20 mL 75%ethanol,3 times of reflux extraction and 60 min for each time.The concentration and the absorbance of the GLY show a good linear correlation when changing from 0.5 μg/mL to 10 μg/mL,r=0.999 8.Conclusion:Nihydrin colorimetry method is simple,accurate,which can be used for the determination of total amino acids in Orchidaceae plant.
〔key words〕Orchidaceae plant;total amino acids;content determination
(责任编辑李杨)
Determination of the Contents of Total Amino Acids in Parts of Orchidaceae Plants in Yunnan
Yu Xiangdong1,Fu Mengyu2,Chen Luqiong2,Yang Shengchun2*
(1.Dali Municipal Environmental Protection Bureau,Dali,Yunnan 671000,China;2.College of Pharmacy and Chemistry,Dali University,Dali,Yunnan 671000,China)
R284
A
2096-2266(2016)08-0020-04
国家自然科学基金资助项目(81160393);云南省教育厅科学研究基金资助项目(2014Y399)
2015-11-26
2016-01-17
俞向东,工程师,主要从事大气和水质监测研究.
杨盛春,副教授.

