差示分光光度法测定漾濞泡核桃花中的总黄酮含量
苏 敏,杨盛春,周 萍
(大理大学药学与化学学院,云南大理 671000)
差示分光光度法测定漾濞泡核桃花中的总黄酮含量
苏敏,杨盛春,周萍*
(大理大学药学与化学学院,云南大理671000)
目的:优选漾濞泡核桃花总黄酮的提取工艺,建立漾濞泡核桃花总黄酮含量测定的方法。方法:在单因素考察基础上,用正交试验法对漾濞泡核桃花总黄酮的提取工艺优选,并以芦丁为对照品,采用差示分光光度法测漾濞泡核桃花总黄酮含量。结果:漾濞泡核桃花总黄酮最佳提取工艺为:提取溶剂50%乙醇,料液比1:20,沸水加热回流3次,每次40 min;漾濞泡核桃花总黄酮浓度在11~77 μg/mL范围内与吸光度成良好线性关系(r=0.999 3),平均加样回收率为99.7%,RSD为1.94%,总黄酮的含量为2.16%~2.82%。结论:此方法简单、准确、稳定、可靠,可作为漾濞泡核桃花总黄酮的含量测定。
漾濞泡核桃花;差示分光光度法;总黄酮;含量测定
[DOI]10.3969/j.issn.2096-2266.2016.08.005
泡核桃(Juglans sigillata Dode.)又名漾濞核桃,系胡桃亚科Juglandaceae胡桃属Juglans植物〔1〕,主要分布在云南、贵州、四川等地〔2〕。2013年3月,国家质检总局批准对漾濞泡核桃实施地理标志产品保护。核桃植株全身都是宝,除了其果仁可食用外,核桃枝、核桃花、核桃壳、核桃叶等都可入药〔3〕。核桃花即核桃花柱,又称核桃纽,长寿菜,龙须菜,含有丰富的磷脂,有益于增强人体细胞活力,促进人体造血功能,能有效降低血脂,胆固醇,预防动脉硬化,此外核桃花酊剂可治疣子〔4〕。贾忠等〔5〕从核桃花中分离鉴定了7个黄酮类化合物。赵磊等〔6〕采用HPLC-DAD对核桃花中槲皮素与山奈酚进行了含量测定,李少泓等〔7〕采用紫外分光度法对兰州的核桃花总黄酮进行了含量测定。因核桃花的提取物具有较深的颜色,对测定结果影响较大,故本实验采用差示分光光度法消除背景吸收的干扰,测定漾濞泡核桃花总黄酮含量,以期为漾濞泡核桃花的进一步开发利用提供依据。
1 实验仪器与试剂
1.1仪器TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);CP224C电子天平(奥豪斯仪器上海有限公司);电子恒温水浴锅(上海科析试验仪器厂);超声波清洁器(宁波新芝生物科技股份有限公司)。
1.2药品与试剂芦丁(中国药品生物制品检定研究院,批号:080-9303);乙醇、氢氧化钠、亚硝酸钠、硝酸铝等试剂均为分析纯;漾濞泡核桃花2013年4月采于漾濞县平坡镇(由大理大学药学与化学学院杨月娥老师鉴定为Juglans sigillata Dode.的花),样品编号为1#~6#,将核桃花置阴凉通风的地方自然风干,粉碎备用。
2 实验方法和结果
2.1溶液制备
2.1.1芦丁对照品溶液的制备精密称取在40℃下干燥至恒重的芦丁对照品5.5 mg置于25 mL量瓶中加入适量50%乙醇溶解,定容,摇匀,得0.22 mg/mL的芦丁对照品溶液。
2.1.2样品溶液的制备精密称取1#样品0.5 g,置100 mL的烧瓶中,加入50%的乙醇溶液10 mL,加热回流3次,每次40 min,过滤,合并滤液后定容至50 mL,即得样品溶液。
2.2测定波长的选择精密移取“2.1.1”对照品溶液1 mL和“2.1.2”样品溶液2 mL,分别置于10 mL量瓶中,加入5%亚硝酸钠溶液0.2 mL摇匀,放置6 min,加入10%硝酸铝溶液0.2 mL摇匀,放置6 min,再加入4%氢氧化钠1 mL,摇匀放置15 min后定容,采用差示分光光度法在400~800 nm进行光谱扫描,结果表明,芦丁对照品和样品在510 nm处均有最大吸收,与文献〔7-8〕报道一致,故选择510 nm作为测定波长。
2.3供试品溶液制备方法的考察
2.3.1提取方法的选择取1#样品10份(编号1至10号),每份约0.5 g,精密称定,分别加入40%乙醇10 mL,其中第1、2号浸泡12 h后直接过滤,第3、4号浸泡12 h后加热回流40 min后过滤,第5、6号直接加热回流40 min后过滤,第7、8号直接超声40 min后过滤,第9、10号浸泡12 h后超声40 min后过滤,均定容至50 mL。分别取各试液2 mL,于10 mL量瓶中,按“2.2”方法显色,以各样品提取液作为空白对照,在510 nm波长处测定吸光度,计算黄酮提取率。结果表明加热回流提取法的黄酮提取率均大于超声提取法,浸泡12 h后加热回流与直接加热回流2种提取方法吸光度接近,故本实验采用直接加热回流的方法。
2.3.2料液比的选择精密称取1#样品7份,每份约0.5 g,以3:1、6:1、9:1、12:1、15:1、20:1、25:1的料液比加入40%的乙醇,在沸水浴中加热回流40 min后过滤,滤液定容为50 mL。分别取各试液2 mL,于10 mL量瓶中,按“2.2”方法显色,以各样品提取液作为空白对照,在510 nm波长处测定吸光度,计算黄酮提取率。见图1。结果表明,料液比为20:1时总黄酮提取率最大,故本实验采用的最佳料液比为20:1。

图1 料液比对提取率的影响
2.3.3提取时间的选择精密称取1#样品5份,每份约0.5 g,加入40%的乙醇10 mL,分别在沸水浴中加热回流20、30、40、50、60 min后过滤,滤液定容为50 mL。分别取各试液2 mL,于10 mL量瓶中,按“2.2”方法显色,以各样品提取液作为空白对照,在510 nm波长处测定吸光度,计算黄酮提取率。见图2。结果表明,加热回流40 min时总黄酮提取率较大,故本实验采用的最佳提取时间为40 min。
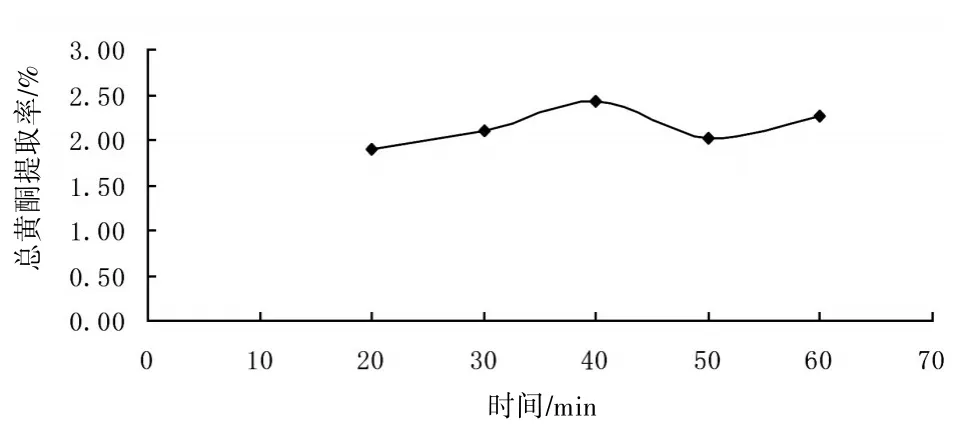
图2 提取时间对提取率的影响
2.3.4提取温度的选择精密称取1#样品6份,每份约0.5 g,加入40%的乙醇10 mL,分别在40、50、60、70、80℃,沸水浴中加热回流40 min后过滤,滤液定容为50 mL。分别取各试液2 mL,于10 mL量瓶中,按“2.2”方法显色,以各样品提取液作为空白对照,在510 nm波长处测定吸光度,计算黄酮提取率。见图3。结果表明,随温度的增加,总黄酮提取率变大,沸水时最大,故本实验采用的最佳提取温度为沸水。
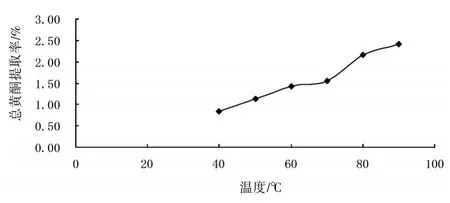
图3 提取温度对提取率的影响
2.3.5乙醇浓度的选择精密称取1#样品8份,每份约0.5 g,加入20%、30%、40%、50%、60%、70%、80%、90%的乙醇10 mL,分别在沸水浴中加热回流40 min后过滤,滤液定容为50 mL。分别取各试液2 mL,于10 mL量瓶中,按“2.2”方法显色,以各样品提取液作为空白对照,在510 nm波长处测定吸光度,计算黄酮提取率。见图4。结果用40%乙醇总黄酮的提取率最高,因此选择40%乙醇为提取溶剂。
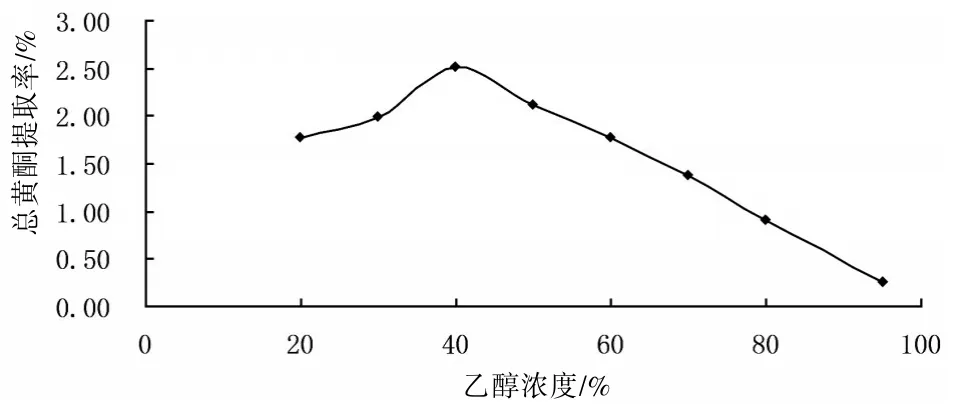
图4 乙醇浓度的选择
2.3.6提取次数的考察精密称取1#样品3份,每份约0.5 g,加入40%的乙醇10 mL,分别在沸水浴中加热回流1、2、3次,每次加热40 min后过滤,滤液定容为50 mL。分别取各试液2 mL,于10 mL量瓶中,按“2.2”方法显色,以各样品提取液作为空白对照,在510 nm波长处测定吸光度,计算黄酮提取率。见图5。结果表明,随着提取次数的增加,总黄酮提取率变大,在提取3次的情况下总黄酮提取率最大,故本实验采用的最佳提取次数为3次。
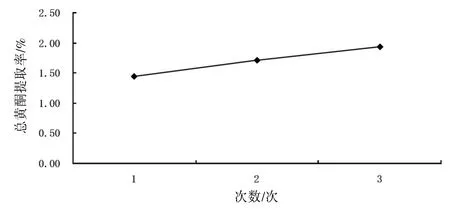
图5 提取次数对提取率的影响
单因素考察泡核桃花总黄酮的提取方法为加入40%的乙醇料液比为1:20,在沸水浴中加热回流3次,每次40 min。
2.4正交试验考察在单因素试验的基础上,对核桃花总黄酮的提取工艺条件进行优化,选用L9(34)正交试验,选择提取次数(A)、提取时间(B)、乙醇浓度(C)、料液比(D)4个因素,每个因素选择3个水平。确立因素水平见表1,结果见表2。
正交试验结果表明,4种因素对提取结果影响大小依次为提取次数>提取时间>料液比>乙醇浓度。核桃花总黄酮提取最佳条件组合为A3B1C3D2,即最佳条件为50%乙醇浓度,料液比为1:20,提取3次,每次时间为40 min,总黄酮提取率最高。
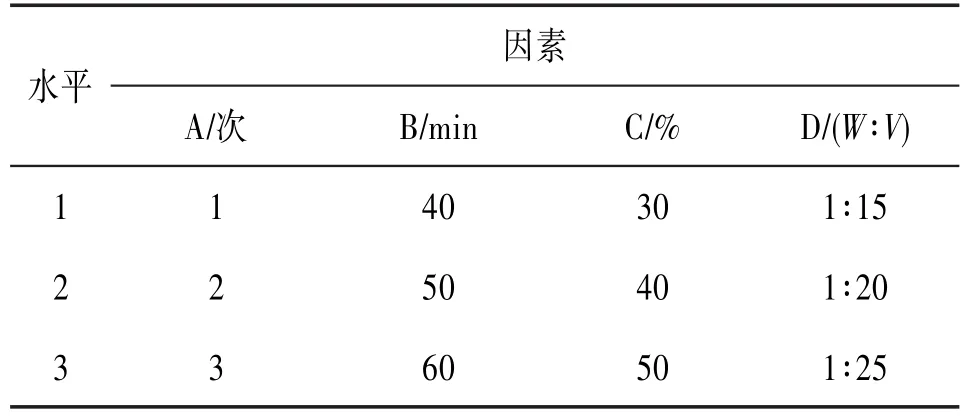
表1 总黄酮提取正交因素及水平设计

表2 总黄酮提取的正交试验结果及分析
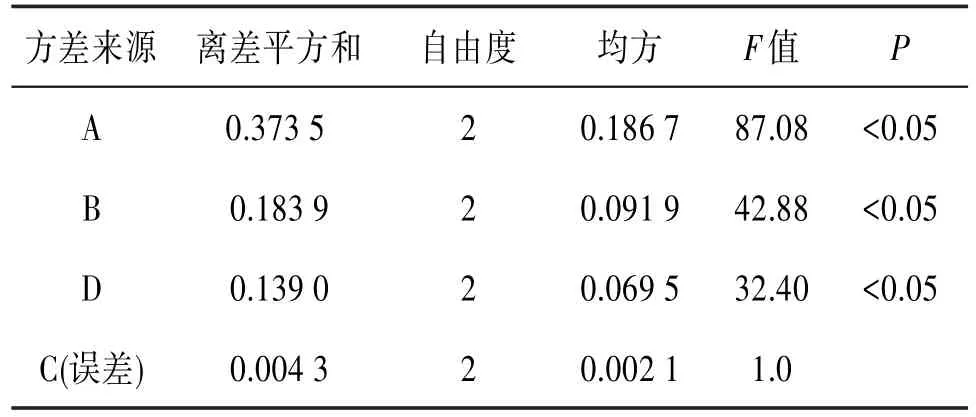
表3 提取工艺方差分析
2.5验证性实验精密称取1#样品3份,每份约0.5 g,按正交试验的最佳条件提取样品溶液,按“2.2”方法显色,以样品提取液作为空白对照,在510 nm波长处测定吸光度,计算黄酮提取率。结果总黄酮提取率为2.19%,RSD为1.67%。
3 方法学考察
3.1线性关系考察精密吸取芦丁标准溶液0.5、1.0、1.5、2.0、2.5、3.0、3.5 mL分别于10 mL量瓶中,按“2.2”方法显色,在510 nm波长处测定吸光度。以吸光度(Y)为纵坐标,浓度(C)为横坐标,进行线性回归分析,得到线性方程:Y=0.011 8 C+0.016,r= 0.999 3,结果表明芦丁在11~77 μg/mL范围内线性关系良好。
3.2显色稳定性试验取同一样品溶液2 mL,于10 mL量瓶中,按“2.2”方法显色,以样品提取液作为空白对照,分别放置0、0.5、1、2、4、6 h,在510 nm波长处测定吸光度,RSD为1.56%。实验结果表明,样品6 h内显色稳定性良好。
3.3样品稳定性试验取放置时间为0、0.5、1、2、4、6 h的同一样品试液2 mL,于10 mL量瓶中,按“2.2”方法显色,以样品提取液作为空白对照,在510 nm波长处测定吸光度,RSD为2.19%。实验结果表明,样品在6 h内稳定性良好。
3.4仪器精密度试验取同一样品溶液2 mL,平行6份,于10 mL量瓶中,按“2.2”方法显色,以样品提取液作为空白对照,在510 nm波长处测定吸光度,RSD为1.05%。实验结果表明,仪器精密度良好。
3.5重复性试验精密称取1#样品6份,每份约0.5 g,按“2.1.2”项下制备样品溶液,按“2.2”方法显色,以样品提取液作为空白对照,在510 nm波长处测定吸光度,代入回归方程计算黄酮提取率。测得核桃花中总黄酮平均含量为2.24%,RSD为2.05%,实验结果表明,该方法的重复性良好。
3.6加样回收率试验取已知总黄酮含量(2.24%)的1#样品约0.25 g,平行6份,精密称定,加入芦丁标准溶液适量,按“2.1.2”项下制备样品溶液,按“2.2”项下方法显色,以样品提取液作为空白对照,在510 nm波长处测定吸光度,计算加样回收率。见表4。
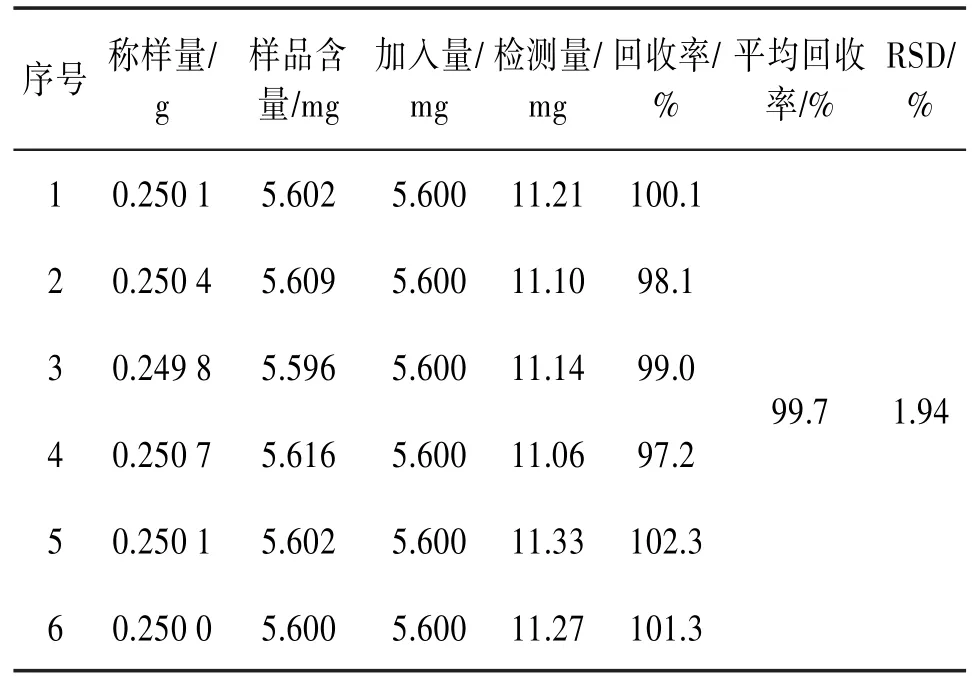
表4 加样回收率试验
3.7样品含量测定精密称取1#~6#核桃花粉末各3份,每份约0.5 g。按“2.1.2”项下制备样品溶液,按“2.2”方法显色,以样品提取液作为空白对照,在510 nm波长处测定吸光度,代入回归方程计算黄酮提取率。见表5。
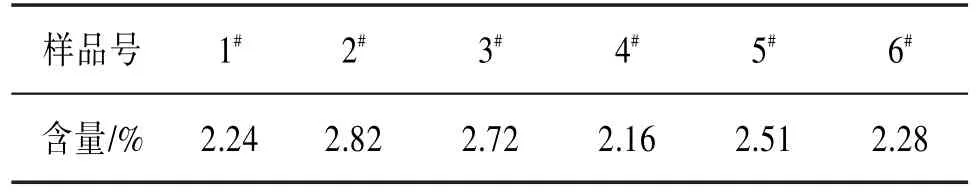
表5 样品含量测定
4 讨论
目前已有文献报道核桃花内含有大量天然黑色素,且该色素易溶于水和乙醇〔9〕,李少泓等〔7〕采用紫外分光度法对核桃花中总黄酮进行含量测定,但并未考虑核桃花提取液中色素对实验结果的影响。另有文献报道采用比色法测总黄酮含量时会产生较大误差〔10-11〕。预实验中,扫描未显色样品提取液,在510 nm处吸光度大于0.2,测样品溶液时,以空白试剂为参比测得的吸光度比以未显色样品溶液为参比时的吸光度大。由吸光度过高或过低引起较大测量误差时采用差示分光光度法能提高其精密度、准确度、灵敏度,故本实验采用差示分光光度法。以NaNO2-Al(NO3)3-NaOH显色,并以等量未显色的提取液作为参比,在510 nm处测定漾濞泡核桃花中的总黄酮含量,消除背景吸收的干扰。该方法操作简单,有良好的稳定性、重复性和准确度。
〔1〕张海珠,邓水来,张海,等.泡核桃多糖中单糖的组分及测定〔J〕.中成药,2012,12(34):12-14.
〔2〕赵家全.影响漾濞泡核桃树生长结实的主要因素及应对措施〔J〕.林业调查规划,2013,38(3):73-77.
〔3〕陆斌,宁德鲁,暴江山.核桃花药用价值与加工技术研究发展〔J〕.中国果蔬,2006(4):41-43.
〔4〕付苗苗.核桃的营养保健功能及药用价值研究进展〔J〕.中国食物与营养,2014,20(10):74-76.
〔5〕贾忠,张培芬,陶保全,等.核桃花的黄酮类化学成分研究〔J〕.中国药学杂志,2009,4(44):496-497.
〔6〕赵磊,李阳,侯嘉,等.核桃花中槲皮素与山奈酚含量的高效液相色谱-二极管阵列检测器法测定〔J〕.时珍国医国药,2011,22(5):1257-1259.
〔7〕李少泓.核桃花中总黄酮的含量测定研究〔J〕.中华中医学刊,2012,30(4):915-917.
〔8〕郑佳,卢先明,易超宇,等.金盏花总黄酮提取工艺研究及含量测定〔J〕.中药研究,2014,37(3):1-7.
〔9〕余晓焕,高虹,黎碧娜,等.核桃花天然色素提取工艺的研究〔J〕.江苏调味副食品,2007,24(1):16-18.
〔10〕陈英红,张晓荧,罗浩铭,等.苦碟子提取物中总黄酮含量测定方法的探讨〔J〕.时珍国医国药,2012,23(2):313-315.
〔11〕池玉梅,于生,郭戎,等.差示分光光度法测定猫爪草中总黄酮的含量〔J〕.江苏中成药,2007,39(12):56-58.
〔Abstract〕Objective:To optimize extraction technology of total flavonoids from the flower of Juglans sigillata Dode and establish its content determination method.Methods:On the basis of single factor test,orthogonal experiment was used to to optimize extraction technology of total flavonoids from the flower of Juglans sigillata Dode.With Rutin as the reference substance,differential spectrophotometry method was adopted to determine the content of total flavonids of the flower of Juglans sigillata Dode.Results:The optimum extraction conditions were described as follows:ethanol volume scores 50%,the solid/liquid ratio 1:20,3 times of heating reflux,and the time duration for each extraction was 40 min.Total flavonoids of the flower of Juglans sigillata Dode showed good linear relationship in the range of 11~77 μg/mL(r=0.999 3),the average recovery was 99.7%,RSD=1.94%.The content of total flavonoids was 2.24%.Conclusion:The method was simple,accurate,stable and reliable,and could be used to measure the content of total flavones of the flower of Juglans sigillata Dode.
〔Key words〕flower of Juglans sigillata Dode;differential spectrophotometry;total flavonoids;content determination
(责任编辑李杨)
The Determination of the Content of Total Flavonoids in Juglans sigillata Dode by Differential Spectrophotometry
Su Min,Yang Shengchun,Zhou Ping*
(College of Pharmacy and Chemistry,Dali University,Dali,Yunnan 671000,China)
R284
A
2096-2266(2016)08-0015-05
大理大学应用开发研究基金资助项目(KYYY201401)
2015-11-11
2016-03-28
苏敏,硕士研究生,主要从事药物分析研究.
周萍,教授.
——谨以献给漾濞5.21地震救援的消防指战员

