CT判断不同密度同种异体骨犬椎体间融合效果研究
曹广如,廖文波,蔡玉强,王霞,陈太勇,陈琦,王翀
(遵义医学院附属医院 脊柱外科,贵州 遵义 563003)
论著
CT判断不同密度同种异体骨犬椎体间融合效果研究
曹广如,廖文波,蔡玉强,王霞,陈太勇,陈琦,王翀
(遵义医学院附属医院 脊柱外科,贵州 遵义 563003)
目的计算机断层扫描(CT)判断不同密度同种异体骨在犬椎体间融合情况,为临床椎体间植骨融合术中植入合适密度骨提供依据。方法将21只健康中华田园犬随机分成3组,每组7只。所有动物均行经前路腰椎间盘摘除椎体间植骨融合术。3组分别予高密度植骨(甲组),正常密度植骨(乙组),空白对照(丙组)。于术后12周行腰椎CT平扫+三维重建观察椎间融合效果。应用Photoshop软件测量融合骨横截面CT图形面积,计算椎体间融合程度。结果术后12周,3组椎体间融合的比例分别为甲组(75.91±8.25)、乙组(94.67±3.35)、丙组(37.78±1.16)。植骨组(甲组、乙组)与空白对照组(丙组)比较,差异有统计学意义(P<0.05),正常密度植骨组(乙组)椎间融合效果优于其他两组(P<0.05)。结论椎体间融合术中移植未经压缩的同种异体骨,有利于促进椎体间融合。
同种异体骨;骨移植;骨密度;脊柱融合术
脊柱融合术为现阶段脊柱外科常用手术方法之一。目前临床上判断椎体间植骨融合是否成功尚无明确统一的非侵入性评定标准,X线对椎体间融合的评定方法尚不够理想[1]。FDA认为的X线判定椎体间融合的标准为:①伸、屈为X线片上椎体间角度变化<5°;②Cage周围不透亮,没有偏移。但其由于受内固定材料、摄片角度技巧等原因影响较大。本实验利用CT成像及像素叠加的方法来研究不同密度同种异体骨在犬椎体间融合情况,旨在为临床上椎体间植骨融合手术应用移植骨量提供可行性依据。
1 材料与方法
1.1实验动物
考虑到兔、鼠体型较小,对创伤较大的脊柱椎体间融合术的耐受能力较差,因此,本实验选用中华田园犬为实验动物。本实验随机选取21只中华田园犬,由遵义医学院实验动物中心提供,月龄12个月。实验前适应性饲养2周,确认无疾病、畸形等。实验操作遵守《关于善待实验动物的指导性意见》标准。
1.2主要实验材料、仪器及软件
椎间融合器[该产品材料采用聚醚醚酮(PEEK)材料,上海超聚新材料科技有限公司],炫速双源CT(SIEMENS,德国),超低温冰箱(Thermo Electron,美国),Photoshop软件:Adobe Photoshop CC 2015(32 Bit)。
1.3实验分组
将实验动物以体重大小编序,以动物序号按照“随机数字表法”将动物完全随机地分成3组,每组7只。植骨高密度组(甲组):行经前路椎间盘摘除椎间融合器植骨融合术,植入经过压缩的高密度同种异体骨。植骨正常密度组(乙组):经前路椎间盘摘除椎间融合器植骨融合术,植入未经压缩的正常密度同种异体骨。空白对照组(丙组):仅行单纯前路椎间盘摘除椎体间融合术。
1.4方法
1.4.1制备同种异体骨选择健康犬安乐死,取出股骨及髋骨,取松质骨,BPS冲洗髓腔,生理盐水洗净。1%新洁尔灭溶液浸泡20min,70%酒精浸泡10min。制作同种异体骨颗粒。生理盐水洗净并辐射灭菌,冷冻干燥后置于-80℃冰箱中冷冻2周脱免疫原性。使用前常规细菌培养3次,确定无菌。查阅文献[2-3]确定椎间隙大小,制作19.0mm×8.0mm×2.5mm同种异体骨块,按照上述方法对其进行脱免疫原性。置于-80℃冰箱冷冻2周后,同种异体骨块置于-4℃冰箱保存备用。使用之前辐射灭菌处理。
1.4.2建立椎体间融合模型0.5%戊巴比妥钠(30mg/kg)腹腔注射麻醉成功后,将犬置于操作台仰卧固定。10%NaS腹部脱毛备皮后,生理盐水冲洗、擦干。常规碘伏消毒、铺无菌巾。沿腹前正中线逐层切开组织至腹腔,将肠管等腹腔脏器轻拨至一旁,并用生理盐水纱布保护。切开腹后膜,撑开软组织,切开前纵韧带,显露腰椎间盘。髓核钳摘除椎间盘,撑开器撑开,植骨高密度组(甲组)植入事先制备好的椎间融合器及同种异体骨。植入之前将同种异体骨颗粒填满融合器,用骨锤、植骨棒将松质骨压实。植骨正常密度组(乙组)将事先塑形的同种异体骨块完整植骨椎间隙。空白对照组(丙组)摘除椎间盘后不予植入任何材料。取出撑开器,充分冲洗后明胶海绵填塞止血,清点器械无误后逐层关腹。手术过程中注意即时止血。术后予庆大霉素肌注3 d预防感染。动物分狗圈单独饲养,自由进食及饮水。各组实验动物饲养条件一致,观察动物活动情况。于术后12周对实验动物进行安乐死处理,取出部分胸椎及全部腰椎,行腰椎CT平扫+三维重建。整个饲养过程中,无实验动物死亡,正常进食,无四肢不能活动等情况,且未出现术区切口感染。
1.5CT图像及Photoshop测量处理方法
CT图像及Photoshop测量处理方法见图1A、1B。融合骨面积比值(AR)=融合骨面积(S1)×50%相邻上下椎体横截面积之和;融合骨面积(S1)=[椎体间融合部分像素(N1)×标尺面积]÷标尺面积像素A1;为便于计算所有图像标尺像素均设为70像素/cm,标尺面积设定为1 cm2。椎体间融合部分像素N1=13 400,标尺面积像素(A1)=70×70=4 900像素/cm2,融合骨面积(S1)=(N1×1)÷A1=13 400÷ 4 900=2.73 cm2。同样的方法计算出相邻上一椎体横截面积(S2)=4.29 cm2,和相邻上一椎体横截面积(S3)=4.36 cm2。融合骨面积比值(AR)=融合骨面积(S1)×50%相邻上下椎体横截面积之和,即S1×50%(S2+S3)=63.11%。

图1 CT图像及Photoshop测量处理方法
1.6检测指标及椎体间融合评价
各组分别于术后12周行腰椎CT平扫+三维重建。依据CT检查结果,应用Photoshop测量融合处横截面积占椎体横截面积比值,计算出新骨生成量,判断椎间融合效果。
1.7统计学方法
采用SPSS 16.0统计软件进行数据分析,计量资料用均数±标准差()表示,横截面融合骨面积比值经正态性检验后,组间比较用完全随机设计资料进行随机区组设计资料的单因素方差分析;Levene检验定量资料方差齐性:总体有差异则进一步用Bonferroni进行两两比较,P<0.05为差异有统计学意义。
2 结果
2.1各组典型图像三维重建图
通过3组典型CT图像之间比较,可以直观看出,甲组(图2)、乙组(图3)和丙组(图4)中,正常密度植骨组(乙组)的椎体间融合效果好。
2.2CT图像处理及数据分析
横截面融合骨面积比值乙组高于甲组和丙组,甲组高于丙组(P<0.05)。见附表。
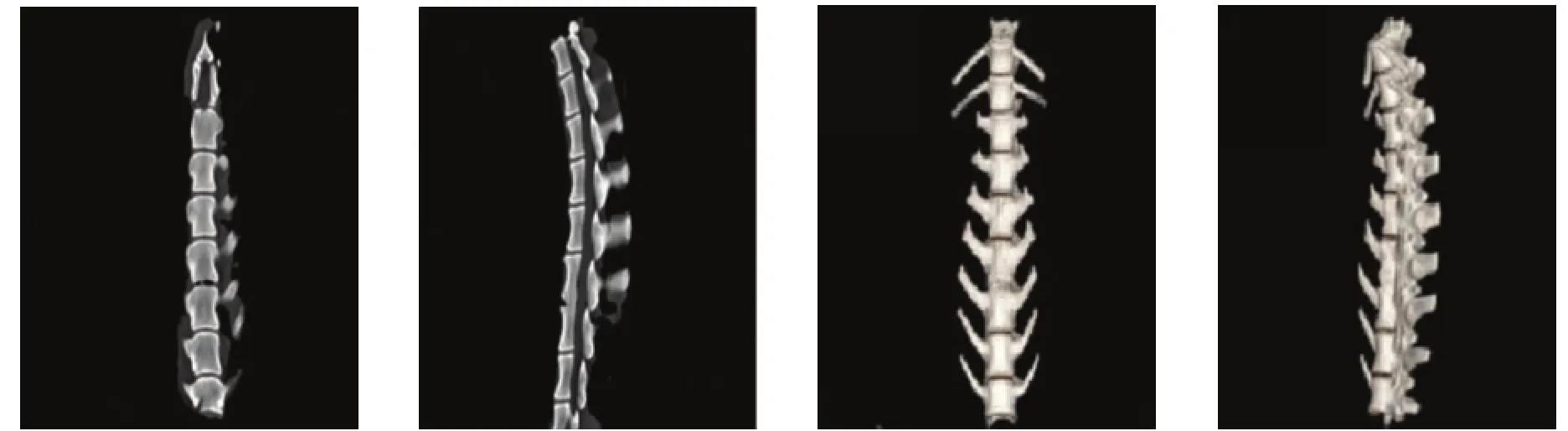
图2 甲组腰4、腰5椎体间部分融合典型图像
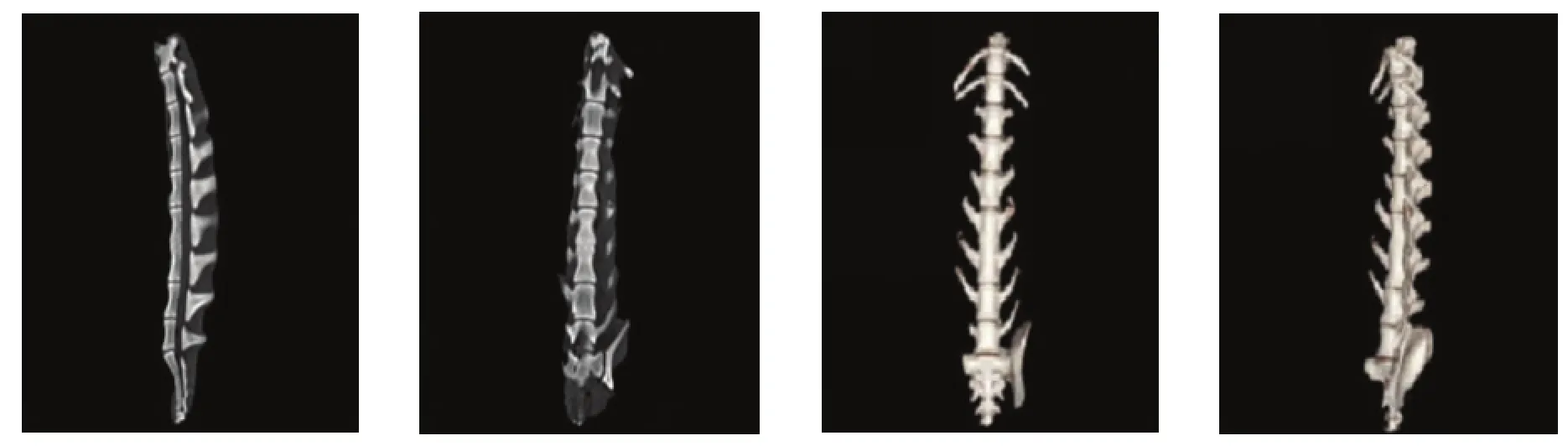
图3 乙组腰4、腰5椎体间完全融合典型图像

图4 丙组腰2、腰3椎体未融合典型图像
附表 术后12周3组CT检查横截面融合骨面积比值 ()

附表 术后12周3组CT检查横截面融合骨面积比值 ()
注:1)与甲组比较,P<0.05;2)与乙组比较,P<0.05;完全随机设计的单因素方差分析,F=3.798。Bonferroni结果显示,甲组与乙组比较,P=0.042;甲组与丙组比较,P=0.046;乙组与丙组比较,P=0.039
组别 横截面融合比例/%甲组(n=7) 75.91±8.25乙组(n=7) 94.67±3.351)丙组(n=7) 37.78±1.161)2)
3 讨论
椎体融合过程中除了内固定因素[4]外,移植材料的性质也是影响移植效果的重要因素。目前常用的骨移植材料可以分为:自体骨、同种异体骨、异种骨和天然材料(如海藻酸盐[5]),以及包括3D打印材料技术[6-7]在内的各种人工替代材料。用取自髂嵴的自体松质骨作为骨移植材料,是目前治疗骨缺损的“金标准”[8],同时也是椎体间植骨融合的最佳植骨材料。良好的移植材料应当具有很好的骨传导性、骨诱导性、生物可降解性、组织相容性、低免疫原性及无疾病传播等优点。自体骨与其他材料比较有上述优点,但也有骨量少、取骨部位医源性创伤、增加患者痛苦等缺点。各种骨移植替代材料如磷酸钙、羟基磷灰石和生物玻璃等又因为缺少骨诱导能力等因素而不能作为理想的骨移植材料。BODENN等[9-10]利用兔腰椎横突间脊柱融合动物模型,观察自体髂骨移植的脊柱融合过程。将其整个过程分成3个阶段:融合早期(2~3周);融合中期(4~5周);融合晚期(6周以后)观察到10周时,融合块开始重塑,周围开始出现皮质化现象。TORIATAKE等[11]认为,骨愈合与移植物的血管化的范围密切相关。在移植物愈合的过程中,血运建立对于营养的新骨形成起到非常重要的作用,移植物血管化的多少是影响融合的一个重要因素。同种异体松质骨移植是一种天然的可生物降解的骨传导和骨诱导材料[12],适宜密度移植同种异体骨的有效孔径为骨诱导和骨传导作用提供良好条件。椎体间植入同种异体骨有利于新生血管网的长入,为间充质干细胞的增殖、分化创造条件,有利于椎体间融合。但由于过度压缩,失去了天然的松质骨孔隙的三维立体结构,高密度同种异体骨植入椎体间,不利于椎体间融合。
组织损伤后的自我修复能力在很大程度上取决于损伤局部的血液循环是否良好[13]。例如[14-15]半月板外三分之一结构,又被称为红区,局部血液供应良好,在损伤后有很好的修复能力;相比之下,半月板内部三分之一(白区)的白区血液供应较差,损伤后就很难自我修复。而摘除椎间盘,将相邻椎体融合的过程,相当于一次骨组织创伤愈合过程。决定组织损伤修复成败的关键:良好的血液循环提供充足的营养、细胞和细胞因子,适当的外界刺激(生化、物理等),以及损伤组织局部稳定的微环境。几乎任何组织损伤后若没有良好的血液循环,损伤组织很难恢复到未损伤以前的自然形态。例如骨组织有良好的再生能力,然而到目前为止还没有一个令人满意的逆转骨缺血性坏死的方法[16]。与骨不愈合的治疗目标[17]相似,椎间融合的临床治疗导向,也是希望在最短的时间内达到最佳的椎间融合状态,尽可能地获得最好的功能恢复并且尽量避免并发症的发生。
采用经前路椎间盘切除、椎体间植骨融合术的优点在于椎体间能提供较大的植骨空间,并可以较快速地进入手术区,避免经过椎管,避免损伤对脊柱稳定相对重要的后纵韧带复合体。临床上在手术植骨过程中常因为个人习惯、操作视野小、避免植骨块脱入椎管等因素,常常需要将同种异体骨压紧填实。必定导致植入的同种异体骨密度增加,必然会引起填充材料的三维孔径和空隙率等变化。脊柱融合术中利用植入同种异体骨的支架作用,松质骨间隙为血管网的长入提供适宜大小的空间。毛细血管网形成后,血管周围组织逐渐长入同种异体骨的空隙中,通过骨传导作用、骨诱导作用,相应的间质干细胞进入松质骨间隙,并定向诱导分化为成骨细胞,进而进一步分化为骨细胞。同种异体骨的三维立体结构主导新骨空间结构的形成。正常密度同种异体比经过压缩后的同种异体骨能提供更加适宜的三维空间。
本实验结果给椎体间植骨融合手术的启示,脊柱融合术中应用同种异体骨的椎体间融合效果比未用同种异体骨移植的融合效果好,且未经压缩的同种异体骨比压缩后的同种异体骨能为新骨的形成提供更适宜的三维空间,有利于椎体间融合。
[1]蔡宏歆,范顺武,赵凤东,等.腰椎椎间融合术后融合评价方法和标准[J].国际骨科杂志,2007,28(1):22-25.
[2]张翊,张远,吴宏飞,等.16排螺旋CT在比格犬椎间融合器研制中的应用[J].齐齐哈尔医学院学报,2012,33(23):3192-3195.
[3]唐勇,王新伟,袁文,等.犬腰椎椎体解剖学测量及犬椎体模型在前路融合中的应用[J].中国组织工程研究与临床康复,2010,14(4): 673-676.
[4]杨新明,张瑛,孟宪勇,等.内固定对带蒂筋膜瓣稳定性影响及其促超临界骨缺损成骨作用的观察[J].中国修复重建外科杂志, 2013,27(3):358-364.
[5]樊星,雷胜男,任利玲,等.混合阳离子交联剂甲基丙烯酸海藻酸盐微球的构建及其性能研究[J].生物医学工程学杂志,2013,6: 1272-1275.
[6]ZHANG W,LIAN Q,LI D,et al.Cartilage repair and subchondral bone migration using 3D printing osteochondral composites:a one-year-period study in rabbit trochlea[J].Biomed Res Int, 2014,2014:746138.
[7]CUI X,BREITENKAMP K,FINN M G,et al.Direct human cartilage repair using three-dimensional bioprinting technology[J]. Tissue Eng Part A,2012,18(11/12):1304-1312.
[8]ZHAO Z Y,HAO CG,ZHAO H M,et al.Injectable allogeneic bone mesenchymal stem cells:A potential minimally invasive therapy for atrophic nonunion[J].Med Hypotheses,2011,77(5): 912-913.
[9]BODEN S D,SCHIMANDLE J H.The use of an osteoinductive growth factor for lumbar spinal fusion:part I:biolog of spinal fusion[J].Spine,1995,20(24):2626-2632.
[10]BODEN SD,SCHIMANDLE JH,HUTTON W C,et al.An experimental lumbar intertransverse process spinal fusion model. Radiographic,histologic,and biomechanical healing characteristics[J].Spine,1995,20(4):412-420.
[11]TORIBATAKE Y,HUTTON W C,TOMITA K,et al.Vascularization of the fusion mass in a posterolateral intertransverse process fusion[J].Spine,1998,23(10):1149-1154.
[12]FERNANDEZ-BANCES I,PEREZ-BASTERRECHEA M,PEREZLOPEZ S,et al.Repair of long-bone pseudoarthrosis with autologous bone marrow mononuclear cells combined with allogenic bone graft[J].Cytotherapy,2013,15(5):571-577.
[13]陈琦,廖文波.滑膜间充质干细胞修复膝关节软骨损伤的应用与进展[J].中国组织工程研究,2015,19(36):5886-5891.
[14]YU H,ADESIDA A B,JOMHA N M,et al.Meniscus repair using mesenchymal stem cells-a comprehensive review[J].Stem Cell Res Ther,2015,6(1):86.
[15]LONGO U G,LOPPINI M,FORRIOL F,et al.Advances in meniscal tissue engineering[J].Stem Cells Int,2012,2012: 420346.
[16]LI Z,LIAO W,ZHAO Q,et al.Angiogenesis and bone regeneration by allogeneic mesenchymal stem cell intravenous transplantation in rabbit model of avascular necrotic femoral head[J]. Surg Res,2013,183(1):193-203.
[17]GÉMEZ-BARRENA E,ROSSET P,LOZANO D,et al.Bone fracture healing:Cell therapy in delayed unions and nonunions[J]. Bone,2015,70:93-101.
(张西倩编辑)
CT in assessment of effect of lumbar interbody fusion after allotransp lantation with different-density bones in dog
Guang-ru Cao,Wen-bo Liao,Yu-qiang Cai,XiaWang,Tai-yong Chen,Qi Chen,Chong Wang
(Departmentof Spinal Surgery,the Affiliated Hospital of Zunyi Medical College,ZunYi,Guizhou 563003,China)
Objective To assess the effect of application of allogeneic bones with different densities to canine's lumbar interbody fusion by CT,so as to provide clinical basis for such allotransplantation with appropriate-density allogeneic bones.Methods Twenty-one healthy Chinese pastoral dogs were randomly divided into 3 groups.All the dogs underwent anterior lumbar discectomy and interbody fusion.The three groups were treated with high-density bone allograft(group A),normal-density bone allograft(group B)and no graft(blank control group,group C).Lumbar CT scan and three-dimensional reconstruction were performed at the 12th week after operation to observe the effect of intervertebral fusion.Photoshop software was used to measure the area of the CT image of the cross section of newly-formed bones and calculate the degree of vertebral-body fusion.Results In the 12th week after surgery,the proportion of interbody fusion was(75.91±8.25)%in the group A,(94.67±3.35)%in the group B and(37.78±1.16)%in the group C.There were statistically significant differences between the grafting bone groups(groups A and B)and the blank control group(group C)(P<0.05).The effect of interbody fusion in the normal-density bone graft group(group B)was better than that of the other two groups(P<0.05).Conclusions Transplantation of uncompressed allograft bone in interbody fusion can promote the fusion of the vertebral bodies.
allograft;bone transplantation;bone density;spinal fusion
R 687.3
A
10.3969/j.issn.1005-8982.2016.14.007
1005-8982(2016)14-0032-05
2015-12-04
廖文波,E-mail:wenbo900@sina.com;Tel:13985685360

