预切开内镜黏膜切除术诊治结肠侧向发育型肿瘤的临床疗效评价
金燕,龚镭,唐学军,彭晓斌,谈春晓,王小云,华萍,任元梅,周平红(.江苏省无锡市第二人民医院 消化科,江苏 无锡 4000;.复旦大学附属中山医院 内镜中心,上海 0003)
预切开内镜黏膜切除术诊治结肠侧向发育型肿瘤的临床疗效评价
金燕1,龚镭1,唐学军1,彭晓斌1,谈春晓1,王小云1,华萍1,任元梅1,周平红2
(1.江苏省无锡市第二人民医院 消化科,江苏 无锡 214000;2.复旦大学附属中山医院 内镜中心,上海 200032)
目的 评价预切开内镜黏膜切除术(Pre-cut-EMR)治疗大肠侧向发育型肿瘤(LST)的临床疗效。方法 从2014年1月-2014年12月,共有65例直径>2.0 cm的LST病变纳入研究,治疗前采用染色放大内镜或内镜窄带成像技术(NBI)观察病灶黏膜,完成内镜评估和病理诊断证实符合内镜下治疗指证。研究分析LST病灶直径、病灶部位、内镜分型和病理结果,统计观察手术时间、整块切除率、完全切除率、并发症及术后复发情况,随访观察治疗的临床效果及安全性。结果 65例结肠LST肿瘤直径2.0~5.0 cm,平均直径(2.4±1.7)cm,病灶部位直肠28例(43.1%),乙状结肠11例(16.9%),降结肠6例(9.2%),结肠脾曲2例(3.1%),横结肠9例(13.8%),结肠肝曲4例(6.2%),升结肠2例(3.1%),盲肠3例(4.6%)。LST内镜分型中形态呈颗粒均一型23例(35.4%),结节混合型27例(41.5%),扁平隆起型13例(20.0%),假凹陷型2例(3.1%);LST病理结果:管状腺瘤12例(18.5%),管状绒毛状腺瘤19例(29.2%),绒毛状腺瘤26例(40.0%),高级别上皮内瘤变7例(10.7%),黏膜内癌1例(1.5%)。65例LST病灶均应用Pre-cut-EMR成功切除,手术时间20~45 min,平均时间(18.0±11.7)min,整块切除率100.0%,完全切除率100.0%,术中即刻出血5例(7.7%),术后7天内迟发出血1例(1.5%),无1例发生穿孔。术后随访3~6个月,复查肠镜所有病例均无复发。结论 应用Pre-cut-EMR能完全切除直径>2.0 cm的LST病变,且安全有效。
结直肠;侧向发育型肿瘤;预切开内镜黏膜切除术
结 肠 侧 向 发 育 型 肿 瘤(coloreetal laterally spreading tumor,LST)是一类起源于大肠黏膜的平坦隆起型病变,这类病变主要沿黏膜表面呈侧向扩展为主,很少垂直浸润生长。因其病变局限于黏膜及黏膜下层,极少向肌层侵犯,临床应用内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)或内镜下黏膜切除术(endoscopic mucosal resection,EMR)都可有效切除此类病变[1]。虽然ESD可以完全整块剥离病灶,但该技术操作难度较高,设备要求高,手术耗时较长,并发症发生率和操作者技术水平有密切关系[2]。因此。临床亟需新的有效的应用于较大面积LST的内镜下治疗技术。结合本院内镜水平及临床实际,应用预切开内镜黏膜切除术(pre-cut-endoscopic mucosal resection,Pre-cut-EMR)技术治疗了65例结肠LST病灶,取得了良好的临床疗效。现报道如下:
1 资料与方法
1.1一般资料
回顾分析2014年1月-2014年12月我院内镜中心电结肠镜检查65例LST患者资料。其中,男37例,女28例,年龄26~75岁,平均(35.2±16.8)岁。所有患者术前签署知情同意书,告知可能获得的益处和风险。所有患者均切除息肉后做病理检查。所有患者均于术后1~6个月后复查肠镜。LST诊断标准:直径10 mm以上,呈侧向扩展而非垂直生长的表浅型病变。内镜分型:按照工藤进英分型,内镜下大体分为颗粒型和非颗粒型两大类型,颗粒型进一步细分为颗粒均一型和结节混合型两个亚型,非颗粒型又包括扁平隆起型和假凹陷型两个亚型。
1.2治疗器械
采用日本Olympus CF-Q260型电子肠镜、NM-4L-l注射针、德国ERBE公司ICC-200高频电切装置、APC300氩离子凝固器、FD-410LR热活检钳、KD-620LR Hook刀、IT刀(insulated-tip knife)、SD-16U-1型圈套器、HX-610-90和HX-600-135金属夹、Boston ResolutionTM金属夹、HX-110LR(1 650 mm)金属夹释放器,旋转手柄可以调整金属夹方向。黏膜下注射溶液按生理盐水100 ml+靛胭脂5 ml+肾上腺素1 ml比例配制,治疗术中结肠镜头端安装透明帽。
1.3术前准备
患者术前完善血常规、凝血3项、心电图及胸片检查,除外手术禁忌。如患者有口服阿司匹林、波立维等抗血小板聚集药物时,必须停服此类药物7 d后再行内镜下治疗。患者术前3天进食流质饮食,术前6~8 h口服复方聚乙二醇电解质散溶液2 000 ml清洁肠腔,建议于2 h内分次口服,清洁效果优于一次口服。治疗术前患者签署麻醉知情同意书,内镜治疗手术均在静脉注射异丙酚全身麻醉情况下进行。
1.4治疗方法
1.4.1手术过程术前采用染色放大内镜或内镜窄带成像技术(narrow band imaging,NBI)观察黏膜完成内镜评估和病理诊断,判断是否适合内镜下治疗,也可通过观察负压吸引病灶处肠腔空气,观察病灶是否出现变形现象来判断。进一步在对病灶注射黏膜下溶液时,根据病灶是否隆起来判断是否合适内镜下治疗。染色观察病灶大小及范围,结合放大内镜联合NBI区分病灶范围,在病灶外0.5~1.0 cm处应用氩离子凝固(argon plasma coagulation,APC)作出标记,标记病灶边缘。在标记点外侧进行黏膜下注射含靛胭脂和肾上腺素的生理盐水,可多次多点黏膜下注射;黏膜下注射点的选择建议先口侧端黏膜下注射,再从病灶侧缘黏膜下注射,最后选择肛侧黏膜下注射,每点黏膜下溶液注射量2~5 ml不等,依据注射处病灶能否抬举决定注射量。钩刀切开标记点外侧边缘,应用Hook刀沿标记点外侧0.5 cm处切开黏膜至黏膜下层,注意切开过程中避免切及肌层,切开过程中发生的切缘出血可以选择切开刀直接电凝止血,如发生小动脉出血,则选择热活检钳烧灼止血。完整切开病灶边缘后,选择合适的圈套器套取病灶,调整视野后,观察病灶完全套入后,以圈套器外套管抵住病灶处黏膜下层,透明帽辅助负压吸引病灶,收紧圈套器后观察圈套范围及套入组织量。完整切开病灶边缘后如黏膜下注射液吸收病灶抬举欠佳,可再次黏膜下注射抬举病灶后圈套。套入病灶后轻微松开圈套器,避免套入病灶处肌层组织,避免发生肠穿孔。在圈套器切除过程中,应间断应用电凝-电切模式,避免过快切割,发生术中即刻出血。对于直径大于3.0 cm的较大病灶,圈套器一次套入难度较大,可应用IT刀剥离病灶部分黏膜下层,直至病灶能够被圈套器完全套入。术后创面完全切除病变后,内镜下应用生理盐水冲洗创面,观察创面有无病灶残留,有无出血、穿孔的发生。较小创面可以应用金属夹对吻样缝合,较大创面应用APC灼创面裸露血管,预防术后迟发性出血的发生。具体手术过程见附图。
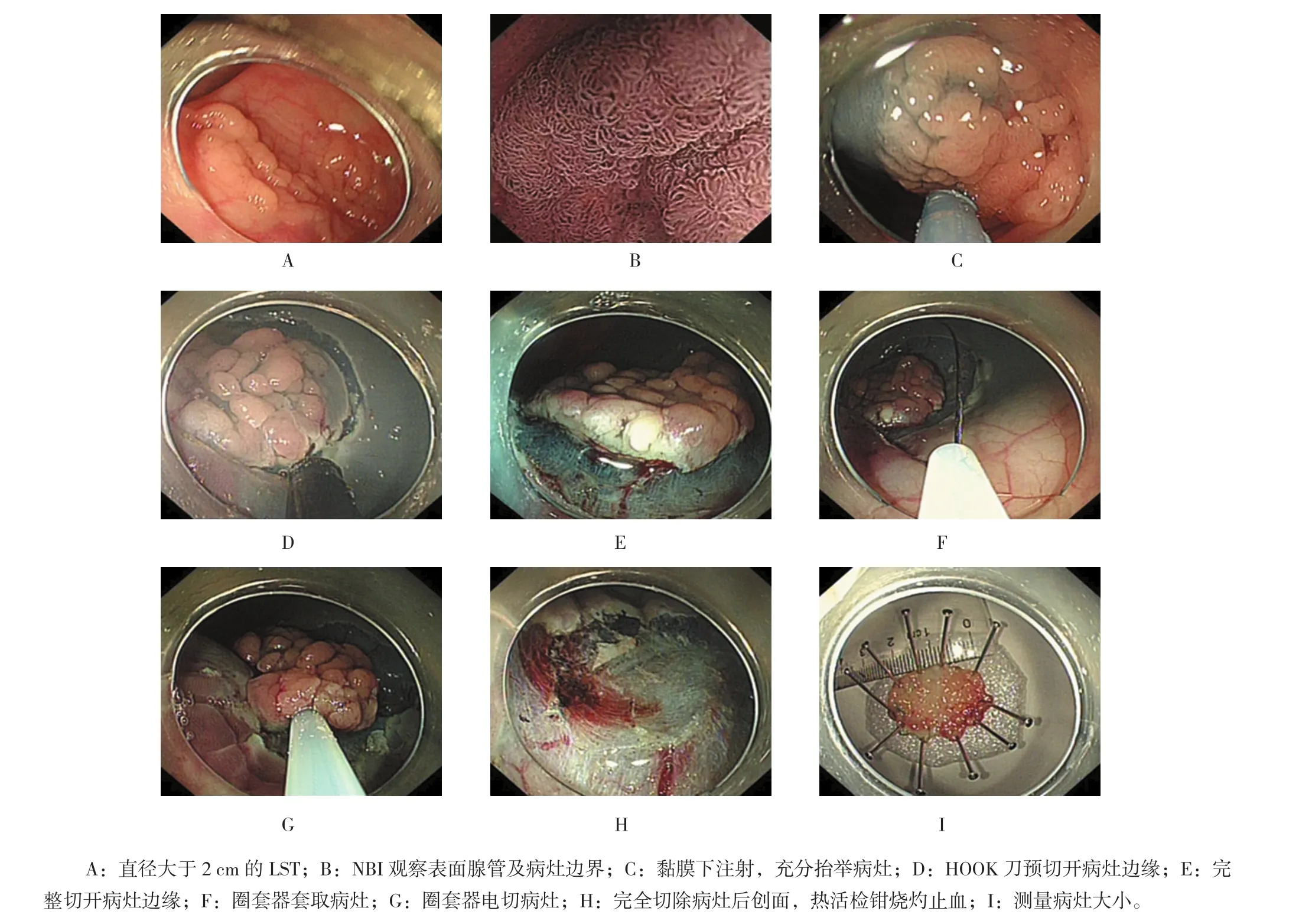
附图 Pre-cut-EMR治疗直径大于2 cm结肠LST
1.4.2标本处理切除病灶组织均浸泡于中性甲醛溶液中送病理检查,观察病灶边缘和基底有无病变累及。病理类型根据WHO消化道肿瘤病理分类标准及维也纳标准。其中高级别上皮内瘤变相当于重度异型增生、原位癌及黏膜内癌;黏膜下癌指肿瘤侵透黏膜肌层达黏膜下层。整块切除是指病变在内镜下整块切除,获得单块标本。完整切除是指整块切除的病变,标本病理诊断外侧缘、基底无肿瘤侵犯。
1.5术后处理
内镜治疗术后常规禁食、禁水24 h,如无穿孔发生,可不用抗生素治疗,常规给予止血、补液等治疗。术后第2天可进流质饮食,术后第3天可进软食,但禁辛辣刺激类食物。观察术后排便情况、生命体征、腹部体征及有无皮下气肿。必要时复查腹部平片了解有无膈下气体。术后1、3和6个月复查肠镜,观察创面愈合情况和病变有无复发。
2 结果
2.1临床结果
65例结肠LST肿瘤直径2.0~5.0 cm,平均直径(2.4±1.7)cm,病灶部位直肠28例(43.1%),乙状结肠11例(16.9%),降结肠6例(9.2%),结肠脾曲2例(3.1%),横结肠9例(13.8%),结肠肝曲4例(6.2%),升结肠2例(3.1%),盲肠3例(4.6%)。LST内镜分型中形态呈颗粒均一型23例(35.4%),结节混合型27例(41.5%),扁平隆起型13例(20.0%),假凹陷型2例(3.1%)。
2.2术后病理
LST病理结果:管状腺瘤12例(18.5%),管状绒毛状腺瘤19例(29.2%),绒毛状腺瘤26例(40.0%),高级别上皮内瘤变7例(10.7%),黏膜内癌1例(1.5%)。
2.3手术并发症
65例LST病灶均应用Pre-cut-EMR成功切除,手术时间20~45 min,平均时间(18.0±11.7)min,整块切除率100.0%,完全切除率100.0%,术中即刻出血5例(7.7%),术后7天内迟发出血1例(1.5%),无1例发生穿孔。
2.4术后复查
65例LST患者于术后1、3和6个月分别复查肠镜,无1例发生肿瘤复发。
3 讨论
LST指起源于大肠黏膜的一类平坦隆起型病变,在病变形态及发生发展上不同于一般腺瘤,包括颗粒型和非颗粒型病变,颗粒型又分为颗粒均一型和结节混合型2个亚型,非颗粒型又分为扁半隆起型和假凹陷型2个亚型[3]。LST与肠癌关系密切,对其采用内镜下早期治疗成为临床治疗的趋势。
目前临床治疗LST的常用方法包括EMR、内镜分片黏膜切除术(endoscopic piecemeal mucosal resection,EPMR)、ESD以及外科手术。EMR切除较小LST时可实现一次完整切除的临床效果,是内镜下治疗消化道早期癌、消化道黏膜及黏膜下层病变的主要方法之一[4]。临床上已成为一项成熟的内镜诊疗技术,被广泛用于平坦型消化道黏膜病变诊断、病变浸润深度评价、癌前病变及早癌的治疗性切除[5]。结直肠因其肠壁的松、软、薄,更适宜行EMR治疗,但EMR在治疗较大面积的结肠病变时,存在一定的技术局限性,而EPMR则无法整块切除病灶,存在病变残留及复发的风险,对于EPMR术后复发的病灶,创面的疤痕化改变使得无论选择EMR或ESD均治疗困难,并且术中容易发生出血和穿孔[6]。对于较大面积的结肠LST病灶,ESD则可以将其整块剥离,且复发率低。与EMR相比,ESD有一定的优势。ESD同时也存在着不足之处,操作难度大、耗时长和穿孔率高[7]。徐美东等[8]研究认为ESD是治疗直径大于2.0 cm的LST的最佳方法,在他们174例ESD治疗LSTs的研究中,整块切除率达98.3%,完整切除率95.4%,3.4%的患者出现出血,2.9%的患者出现穿孔。
为降低手术并发症的发生,针对直径大于2.0 cm的结肠LST,本研究采用Pre-cut-EMR术完成LST的治疗。Pre-cut-EMR有独特的优点,能避免穿孔并发症的发生,增加治疗的安全性。笔者的经验是:①行多点黏膜下注射时,注射量要充足,每点3~5 ml不等,保持足够的黏膜下层液体垫,以保证病灶的充分隆起;②注射顺序建议遵循先口侧,再肛侧的顺序,以保证病灶抬举过程中视野的清晰;③应用HOOK刀切开病灶边缘时建议选择电切模式(Endo cut 2,50 W),发生出血时可及时切换为电凝止血;④圈套病灶时,将圈套器尖端顶住病灶口侧黏膜下层切开处,可使圈套器张开最大的直径,达到完整圈套病灶的目的。如病灶面积过大,可先行病灶的部分黏膜下剥离,以满足完整圈套病灶的要求;⑤完整圈套病灶后,电切过程中应间断轻松圈套器,避免圈套器电切肌层的发生。
本研究应用Pre-cut-EMR技术治疗了65例平均直径(2.4±1.7)cm的结肠LST,整块切除率达100.0%,完整切除率100.0%,术中即刻出血5例(7.7%),术后7天内迟发出血1例(1.5%),无1例发生穿孔。研究发现Pre-cut-EMR存在有一定的并发症发生率,常见的并发症为出血。术中出血常见,用热活检钳烧灼可获得满意的效果,本组术中出血5例,包括渗血和小动脉出血,均内镜下应用热活检钳烧灼止血成功。术后迟发性出血1例,再次内镜下热活检钳联合金属止血夹止血成功,考虑与患者术后从事重体力劳动过累有关。本研究无穿孔病例发生,笔者认为避免穿孔关键在于合适的黏膜下注射量,以及操作圈套电切时间断放松圈套器,可以有效避免套入电切消化道肌层。
本研究显示Pre-cut-EMR可一次整块切除大于2.0 cm的LST病灶,与EPMR相比较,Pre-cut-EMR能避免病灶残留和复发的风险;与ESD相比,Precut-EMR技术难度低,手术出血及穿孔风险均较ESD低,且手术操作时间短,技术难度低。
综上所述,Pre-cut-EMR作为新技术的尝试,能够有效地治疗直径大于2.0 cm的结肠LST病变,有助于降低较大面积LST病变的内镜治疗风险,由于本中心水平有限,Pre-cut-EMR治疗LST的远期临床效果尚待进一步积累病例资料,加强随访观察。
[1] BAE J H, YANG D H, LEE J Y, et al. Clinical outcomes of endoscopic submucosal dissection for large colorectal neoplasms: a comparison of protruding and laterally spreading tumors[J]. Surg Endosc, 2016, 30(4): 1619-1628.
[2] AREZZO A, PASSERA R, MARCHESE N, et al. Systematic review and meta-analysis of endoscopic submucosal dissection vs endoscopic mucosal resection for colorectal lesions[J]. United European Gastroenterol J, 2016, 4(1): 18-29.
[3] JEON H H, LEE H S, YOUN Y H, et al. Learning curve analysis of colorectal endoscopic submucosal dissection (ESD) for laterally spreading tumors by endoscopists experienced in gastric ESD[J]. Surg Endosc. 2016, 30(6): 2422-2430.
[4] BRIEDIGKEIT A, SULTANIE O, SIDO B, et al. Endoscopic mucosal resection of colorectal adenomas > 20 mm: Risk factors for recurrence[J]. World J Gastrointest Endosc, 2016, 8(5): 276-281.
[5] BARENDSE R, MUSTERS G, FOCKENS P, et al. Endoscopic mucosal resection of large rectal adenomas in the era of centralization: Results of a multicenter collaboration[J]. United European Gastroenterol J, 2014, 2(6) :497-504.
[6] 周平红, 姚礼庆, 陈巍峰, 等. 内镜黏膜下剥离术在治疗胃肠道黏膜切除术后残留和复发病灶中的应用[J]. 中华消化内镜杂志, 2008, 25(6): 281-285.
[7] ACQUISTAPACE F, MATERNINI F, SNIDER L, et al. Endoscopic treatment of superficial colorectal neoplasms. Retrospective analysis of a single center technique and results[J]. G Chir, 2015,36(6): 247-250.
[8] 徐美东, 王小云, 周平红, 等. 内镜黏膜下剥离术治疗不同亚型结直肠侧向发育型肿瘤的临床与病理研究[J]. 中华消化内镜杂志, 2012, 29(8): 422-428.
(吴静 编辑)
Clinical evaluation of pre-cut-endoscopic mucosal resection in treatment of colorectal lateral spreading tumor
Yan Jin1, Lei Gong1, Xue-jun Tang1, Xiao-bin Peng1, Chun-xiao Tan1,Xiao-yun Wang1, Ping Hua1, Yuan-mei Ren1, Ping-hong Zhou2
(1.Department of Digestive Diseases, the Second People's Hospital, Wuxi, Jiangsu 214000, China;2.Department of Endoscopy Center, Zhongshan Hospital, Fudan University, Shanghai 200032, China)
Objective To evaluate the effect of pre-cut-endoscopic mucosa resection of colorectal laterally spreading tumor. Methods 65 patients with LST were enrolled from January 2014 to February 2014. LST was detected by chromoendoscopy and NBI combined with magnifying endoscopy technique. The size, site, morphological features, were observed and the histopathological features of the specimen of LST was analyzed. All the 65 LSTs were resect by pre-cut-EMR. The clinical results including enbloc resection rate, all bloc resection rate, procedure time, complication and recurrence rates were retrospectively evaluated. Results All the 65 LSTs lesions ranged from 2.0 cm to 5.0 cm, with a mean diameter of (2.4 ± 1.7) cm. The site of 65 LSTs was in rectum 28 (43.1 %), 11 LSTs in sigmoid colon (16.9 %), 6 LSTs in descending colon (9.2 %), 2 LSTs in splenic fl exure of colon (3.1 %), 9 LSTsin transverse colon (13.8 %), 4 LSTs in Hepatic fl exure of colon (6.2 %), 2 LSTs in ascending colon(3.1 %), and 3 LSTs in cecum (4.6 %). Morphology of 23 LSTs were homogeneous granular type (35.4 %), 27 LSTs were mixed non-granular type (41.5 %), 13 LSTs were flat elevated type (20.0 %), and 2 LSTs were pseudo-depressed type (3.1 %). The histopathological diagnoses of LST included 12 tubular adenoma (18.5 %), 19 villous-tubular adenoma (29.2 %), 26 villous adenoma (40.0 %), 7 advanced intraepithelial tumor (10.7 %), 1 intramucosal carcinoma (1.5 %). Enbloc resection was achieved in 65 patients (100.0 %) with a mean operation time of (18.0 ± 11.7) min. 5 cases were bleeding during the operation (7.7 %), 1 case was bleeding 7 days after operation (1.5 %), no perforation was happened. 65 patients were followed up for 3~12 months, and no local recurrence was found. Conclusion Pre-cutendoscopic mucosal resection an effective and safe therapy for colorectal LST larger than 2.0 cm.
colorectal; laterally spreading tumor; pre-cut-endoscopic mucosa resection
R735.3
B
10.3969/j.issn.1007-1989.2016.08.022
1007-1989(2016)08-0094-05
2016-03-25
周平红,E-mail:13951514799@163.com;Tel:13951514799

