抗白灵霜在黑素合成中对TYR和MITF的调节作用
徐漫远 孔迎辉 闵仲生
抗白灵霜在黑素合成中对TYR和MITF的调节作用
徐漫远1孔迎辉1闵仲生2
目的: 明确抗白灵霜(KBL)在黑素合成中对TYR和MITF的调节作用。方法: 体外培养小鼠B16黑素瘤细胞,分为空白对照组和不同浓度KBL(5mg/mL,10mg/mL和15mg/mL)用NaOH溶解法检测黑素合成量,Real time-PCR检测TYR和MITF基因mRNA表达,Western Blot检测KBL组TYR和MITF蛋白的表达。结果: 各浓度KBL组黑素合成量及TYR和MITF基因的mRNA和蛋白表达的水平均高于空白对照组,且呈浓度依赖性。结论: KBL可能通过上调MITF基因的表达,激活参与黑素合成的TYR以促黑素合成。
抗白灵霜? 小鼠B16黑素瘤细胞? 酪氨酸酶? 小眼畸形相关转录因子? 黑素合成
白癜风是一种进行性色素脱失性疾病,是在多种因素共同作用下,表皮功能性黑素细胞(MC)发生破坏,皮肤出现白斑,中医称为“白驳风”。白癜风的发病与黑素合成有密切的关系。酪氨酸酶(TYR)和小眼畸形相关转录因子(MITF)在黑素合成过程中有重要作用。黑素合成的速率与TYR的量和活性直接相关。在黑素细胞中,MITF可调控酪氨酸酶家族(TYR和TRP-l)的表达,从而参与黑素生成的调控,其主要是通过与酪氨酸酶家族启动子中的特殊部位结合(如M-Box),刺激启动子的转录活性[1]。MITF是Rab27和Pmel17关键转录因子,Rab27和Pmel17对黑素小体的转输和其基质的形成起重要作用[1,2]。
抗白灵霜(批准文号是苏药制字Z04001778)是江苏省中医院皮肤科外用制剂,选用补骨脂、白芷、汉防己、乌梅、甘草等药物组成。本试验探讨抗白灵霜组分在黑素合成中对TYR、MITF的调节作用,为临床应用提供理论依据。
1 材料
1.1细胞株小鼠B16黑素瘤细胞购置中国科学院上海细胞所。
1.2药物均购自江苏省中医院,由江苏省中医院药学部鉴定,制剂部制成抗白灵霜组分醇提浸膏。根据预实验结果,将原配质量浓度1 g/mL的醇提药液配制成细胞培养细胞所需的5、15、25 mg/mL,高温灭菌后,置4℃冰箱中保存、备用。
1.3主要试剂DMEM培养基(Gibco公司)、小牛血清(上海普飞公司)、0.25%胰蛋白酶(Gibco公司)、MTT、DMSO、TritonX-100(Sigm公司)、cDNA第一链合成试剂盒(KeyGen公司)、SYBR Green荧光定量试剂盒(TOYOBO公司)、一抗及内参(β-Actin)(Ab-cam)、二抗(羊抗兔IgG-HRP)(Jckson)、Braford蛋白含量检测试剂盒(南京赛研生物技术有限公司)。
1.4仪器CO2恒温培养箱(SANYO)、倒置显微镜(Olympus公司)、高速冷冻离心机(科俊仪器公司)、PCR仪(Bio-Red公司)、超低温冰箱(SANYO)、紫外光度仪(SHIMADZU UV-2450)、PCR循环仪(Labnet MultiGene Gradient)、荧光定量PCR循环仪(中山达安DA7600)、凝胶成像仪(BIO-RAD)、Western电泳仪(Bio-Red公司)。
2 方法
2.1细胞培养 B16细胞用含10%小牛血清的DMEM培养液(10%FCS),37℃、5%CO2培养箱常规培养。待细胞生长至融合状态,0.25%胰蛋白酶消化传代。
2.2NaOH溶解法检测黑素含量 取对数生长期的黑素瘤细胞,消化计数,接种于6孔细胞培养板,每空5×104个,过夜,细胞贴壁,吸去培养液,分别加入不同浓度的药物(5、15、25 mg/m L),每个浓度做4个复孔,空白对照组仅加入培养液,继续培养。24 h后,去上清,用PBS洗涤2次,每孔加500μL浓度为1mol/ L的NaOH,置在70℃水浴2 h以溶解黑素。将6孔板中的裂解液转移至96孔板,每孔100μL,设3个复孔,置酶标仪400 nm处测黑素吸光值。黑素含量以药物处理组A400/空白对照组A400×100来表示。
2.3Real time-PCR检测TYR、MITF基因mRNA的表达 将B16黑素瘤细胞接种于6孔板,每孔5×104个细胞,培养过夜待其贴壁后,药物组分别加入4 mL 10%FCS,1 mL各组药液?空白对照组加入5mL 10% FCS,继续孵育培养。24 h后,去上清,用Trizol、氯仿和异丙醇提取黑素细胞RNA,反转录,最后行荧光定量PCR。实验步骤参照KeyGen公司cDNA第一链合成试剂盒及TOYOBO公司SYBR Green荧光定量试剂盒说明书进行。
引物设计:利用Primer Primer5软件,分别依据人survivin及内参GAPDH基因全序列,均由南京金斯瑞科技公司合成(表1)。

表1 引物序列
2.4Western blot检测TYR、MITF蛋白的表达 将B16黑素瘤细胞接种于6孔板,每孔5×104个细胞,培养过夜待其贴壁后,药物组分别加入4 m L 10% FCS,1 m L不同浓度的KBL组分醇提浸膏?空白对照组加入5mL 10%FCS,继续孵育培养24 h后,提取各组细胞的总蛋白,并用BCA法测定蛋白浓度,加热变性后-20℃保存。取其总蛋白70μg进行SDS-PAGE凝胶电泳,将分离后的蛋白电转移至PVDF,封闭液封闭滤膜4 h,按约0.1 mL/cm2的量加入封闭液和适量一抗TYR(1∶500),兔抗大鼠β-actin(1∶5000)。摇床摇荡孵育(4℃,过夜)。PBST漂洗滤膜4次,每次10 min。将膜与HRP结合的二抗(辣根过氧化酶标记羊抗兔,二抗用封闭液稀释)(1∶5000)室温下摇荡孵育2 h,然后用PBST充分洗膜,漂洗4次,每次10 min。按0.1 mL/cm2显影液计算用量,将显影液加于NC膜上,室温放置1 min。用保鲜膜将膜包好(尽量避免气泡)。暗室中迅速将膜蛋白贴在X光胶片上曝光,洗片机中显影、洗像。调整曝光时间,直至出现最佳条带。
2.5统计学方法 实验数据以¯x±s表示,使用SPSS 17.0进行单因素方差分析(A-NOVA),P<0.05为差异有统计学意义,P<0.01为差异极显著。
3 结果
3.1KBL组分促小鼠B16黑素瘤细胞黑素合成 如表2所示,不同浓度的KBL组分醇提浸膏,与空白对照组相比,对黑素合成量均具有一定促进作用(P< 0.05),呈浓度依赖性。

表2 KBL组分对黑素合成的影响
3.2KBL组分上调小鼠B16黑素瘤细胞TYR基因的mRNA和蛋白表达水平 不同浓度的KBL组分醇提浸膏与空白对照组相比,对TYR基因的mRNA和蛋白表达水平均显著提高(P<0.01),呈浓度依赖性。见表3和图1。
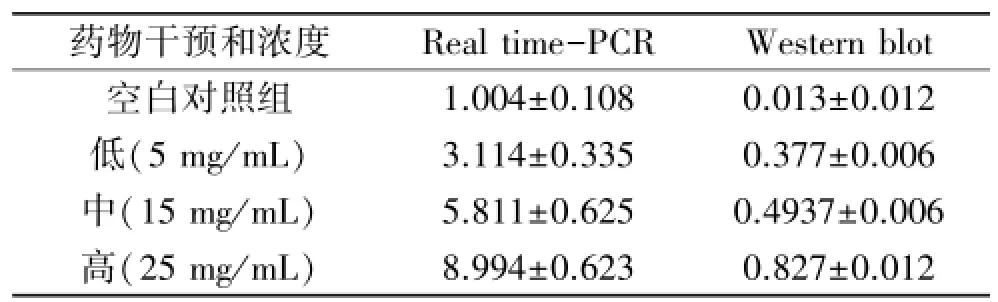
表3 KBL组分对TYR基因的mRNA及蛋白水平变化(与内参比值)
3.3KBL组分上调小鼠B16黑素瘤细胞MITF基因的mRNA和蛋白表达水平 不同浓度的KBL醇提浸膏与空白对照组相比,各药物浓度组对TYR基因的mRNA和蛋白表达水平均显著提高(P<0.01),呈浓度依赖性。见表4和图1。
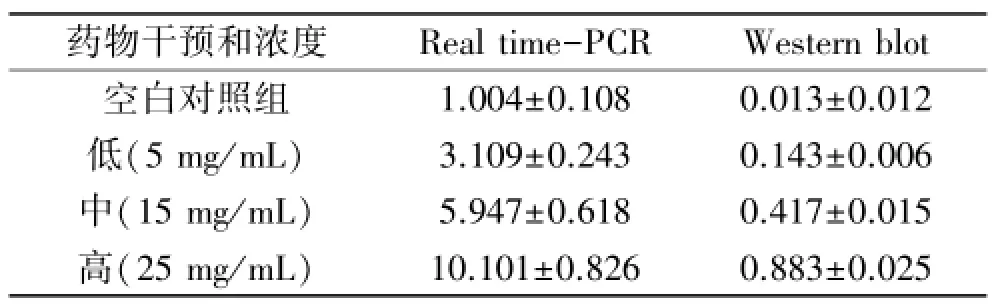
表4 KBL组分对MITF基因的mRNA及蛋白水平变化(与内参比值)
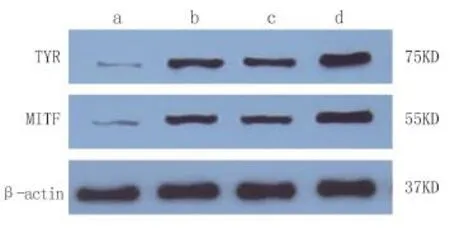
图1 KBL组分对TYR、MITF相关蛋白表达的影响
4 讨论
白癜风是一种与遗传和自身免疫性密切相关的常见皮肤病,一般认为其病因为:遗传因素,免疫损伤,氧化应激机制,神经体液,黑素细胞经皮丢失学说等。白癜风的发病机制尚未明确,从而缺乏有效的治疗方案,临床治疗多为药物治疗(如:光敏性药物、糖皮质激素类药物、免疫制剂、维生素D3衍生物、抗氧化剂等),物理疗法(如NB-UVB、定向高能中波紫外线、308 nm准分子激光与准分子激光等)及自体表皮与自体黑素细胞移植。此外,中医药治疗白癜风临床疗效确切,但许多药物的具体作用机制尚不明确。
研究证明很多药物都是通过增加TYR生物合成和对它的分子结构进行翻译后的重新修饰等方式来发挥对黑素合成的调节作用[3]。简丹研究己烯雌酚对黑素合成的影响及其机制,观察到不同浓度下己烯雌酚对TYR、MITF的mRNA转录和相应蛋白的表达有上调作用?还探讨己烯雌酚促黑素合成cAMPMITF-TYR途径。Tuerxuntayi等[4]研究发现卡力孜然酊提取物通过上调TYR、MITF表达促小鼠B16黑素瘤细胞黑素合成。Drira等[5]研究发现异野樱素以浓度依赖方式促B16黑素瘤细胞黑素合成?此外,作用24和48 h后,激活MITF并上调TYR、TRP1、TRP2。
KBL组方含有补骨脂、乌梅、白芷、汉防己、甘草等,具有祛风和血,补益肝肾,润肤退白斑之效。补骨脂、乌梅均有提高机体免疫力及抗氧化的作用[6,7]。补骨脂及白芷具有光敏作用[6,8],UVB照射后,可促进黑素合成、黑素细胞分裂及迁移。汉防己甲素药理研究显示:具有调节免疫机能、抑制炎症反应及扩张局部血管、改善血液循环等作用[9]。甘草有增强机体免疫及抑制变态反应等作用[10]。方中甘草、汉防己主要成份甘草酸与汉防己甲素有类似糖皮质激素样作用,可增强对黑素细胞的保护,抑制局部免疫反应。
有研究表明人与小鼠在黑素细胞特异性基因(melanocyte-specific gene,MSG1)附近的基因序列并无很大差异[11]。MSG1基因专门调控MC的特异性表达,与MC的分化紧密联系,且对调节黑素生成有重要作用。但B16黑素瘤细胞株存在老化和变性等问题,其与正常人MC在生长代谢方面有所不同,仍需寻求更为合适的模型。参考了相关文献暂无明确的TYR激活药物,未设阳性对照组,从而缺乏抗白灵霜与其他药物促黑素合成的比较。
PKA途径是目前研究较多的影响黑素合成的重要信号通路之一。这一作用可能机制是由于PKA途径被激活后,CREB磷酸化水平增高,修饰MITF的启动子而产生的。可进一步探讨KBL组分促黑素合成是否通过该途径发挥作用。氧化应激机制为白癜风病因之一,冗余的氧化应激产物可破坏黑色细胞、抑制细胞内黑素合成酶,影响黑素代谢及黑素细胞的存亡。KBL组分中补骨脂和乌梅现代药理研究均具有抗氧化作用,接下来可以从该角度探讨抗白灵霜组分治疗白癜风的可能作用机制。
在本研究中,我们观察到KBL组分促小鼠B16黑素瘤细胞黑素合成,并上调TYR、MITF基因的mRAN及相应蛋白表达水平。我们推测KBL组分可能通过MITF-TYR途径发挥其促进黑素合成的作用,其作用的具体机制仍有待进一步研究。中药效用是多靶点的,今后可多方法多途径研究中药治疗白癜风的作用机理,为治疗白癜风提供更多的思路。
[1]Goding CR.Mitf from neural crest tomelanoma signal transduction and transcription in the melanocyte lineage[J]. Genes,2000,14(14):1712-1728.
[2]Du J,Miller AJ,Widlund HR,et al.MLANA/MART1 and SILV/PMEL17/GP10 are transcriptionally regulate by MITF in melanocytes and melanoma[J].Am J Pathol,2003,163(1):333-343.
[3]ChiaveriniC,Beuret L,Flori E,etal.Microphthalmia associated transcription factor(MITF)regulates rab27A gene expression and controls melanosomes transport[J].J Biol Chem,2008,283(18):12635-12642.
[4]Tuerxuntayi A,Liu YQ,Tulake A,etal.Kaliziriextractupregulates tyrosinase,TRP-1,TRP-2 and MITF expression in murine B16 melanoma cells[J].BMC Complement Altern Med,2014,22(14):166.
[5]Drira R,Sakamaoto K.a 4'-o-methylated flavonoid,stimulates melanogenesisi in B16BL6 mu-Rine melanoma cells[J].Life Sci,2015,143:43-49.
[6]郭秀芝,刘卫萍,杨杰.补骨脂的药理活性及其开发利用[J].中医药报,2005,33(5):52.
[7]张飞,李劲松.乌梅的研究进展[J].海峡药学,2006,18(4):22-23.
[8]吴媛媛,蒋桂华,马逾英,等.白芷的药理作用研究进展[J].时珍国医国药,2009,20(3):625.
[9]陈志蓉.汉防己甲素的临床应用概述[J].海峡药学,2008,20(8):119-120.
[10]王元,瞿彩云,彭雪晶.甘草及其衍生物药理作用的研究新进展[J].甘肃医药,2011,30(7):399-400.
[11]侯麦花,朱文元.黑素细胞特异性基因的研究进展[J].国外医学:皮肤性病学分册,2003,29(5):318.
(收稿:2016-01-20 修回:2016-02-15)
The regulative effect of Kang Bai Ling cream on TYR and MITF in melanogenesis
XU Manyuan,KONG Yinghui,MIN Zhongsheng.
1.Huai'an First People'sHospitalNanjing Medical University,Huai'an 223300,China?2.Province Hospitalof TCM Affiliated Hospital of Nanjing University of TCM,Nanjing 210029,China
MIN Zhongsheng,E-mail:minzhsh@sina.com
Objective:To determine the regulative effect of Kang Bai Ling(KBL)creams on TYR and MITF in melanogenesis.M ethods:The cultured B-16 murine melanoma cells were divided into blank group and KBL groups with different concentration(5mg/mL,10 mg/mL and 15mg/mL).The amount ofmelanin was detected by NaOH dissolvedmethod.The expression of TYR and MITFmRNA and protein was detected by real time-PCR and Western blot respectively.Results:The amount ofmelanin,the expressions of TYR and MITFmRNA and protein in KBL groupswere higher than those in blank group.The effectswere significant in a concentration dependentmanner.Conclusion:KBL can promotemelanogenesis through up-regulating the expression of MITF genes and activating TYR.
KBL?B16 murinemelanoma cells?tyrsionase?MITF?melanogenesis
1南京医科大学附属淮安第一医院,淮安,223300
2南京中医药大学附属江苏省中医院,南京,210029
闵仲生,E-mail:minzhsh@sina.com

