山楂多糖分散片的制备及质量控制
景永帅,吴兰芳,戎欣玉,谢英花,杜红霞,马 喆,邢文雪(.河北科技大学化学与制药工程学院,河北石家庄 05008;.河北中医学院药学院,河北石家庄 05000)
山楂多糖分散片的制备及质量控制
景永帅1,吴兰芳2,戎欣玉1,谢英花1,杜红霞1,马 喆1,邢文雪1
(1.河北科技大学化学与制药工程学院,河北石家庄 050018;2.河北中医学院药学院,河北石家庄 050200)
为优化山楂多糖分散片的制备工艺,对其进行了质量控制。在单因素试验的基础上,以崩解时间为评价指标,选用压片压力、崩解剂用量、乙醇溶液浓度为因素,利用正交试验对山楂多糖分散片的制备工艺进行优化;按照《中华人民共和国药典》的方法,对主药含量、崩解时间、分散均匀性、溶出度等指标进行测定,以期对山楂多糖分散片的质量进行控制。得到山楂多糖分散片的最优制备工艺如下:采用交联聚乙烯基吡咯烷酮(PVPP)为崩解剂,碳酸钙为填充剂,体积分数为65%的乙醇溶液为黏合剂,滑石粉为润滑剂,压片的压力为6kg。研究表明,该分散片每片含山楂多糖40mg,崩解时间为65s,分散均匀性良好,15min溶出度为标示量的75.40%。
中药药剂学;山楂;多糖;分散片;制备;质量控制
山楂为蔷薇科山楂属山楂的成熟果实,主产于中国北方、欧洲以及北美等地区,已发现山楂属植物1 000多种[1-2]。山楂在中国有悠久的食用和药用历史,且为中国卫生部公布的药食两用资源,其性微温,味酸甘,有健脾、消食、行气散瘀、抗血栓、降血压、降血脂、抗恶性肿瘤等功效。世界卫生组织的药用植物专辑中对山楂也有相应的记载[3-5]。据报道,山楂含有的主要化学成分有黄酮、有机酸、多糖、三萜及挥发油类等[6-7],山楂多糖是其含量最高的活性成分。现代药理研究表明,山楂多糖具有降血脂、缓解疲劳、抗氧化以及促进益生菌生长等作用[8-11]。
分散片是近年来人们研制开发的一种新剂型,具有分散度高、溶出速度快、生物利用度高等优点[12]。目前,国内外对于山楂多糖分散片的研究尚未见报道。本研究以山楂多糖为原料,选用交联聚乙烯基吡咯烷酮、碳酸钙、滑石粉、食用乙醇等为辅料,制备山楂多糖分散片,并按照《中华人民共和国药典》对其质量进行研究。本研究通过对山楂多糖分散片制备工艺的探索,丰富其产品剂型,为产品生产提供理论参考。
1 仪器与试剂
1.1仪器
RE-52A旋转蒸发仪,上海亚荣生化仪器厂提供;电热恒温鼓风干燥箱,宁波自动化仪器研究所提供;YD-1智能片剂硬度测定仪,ZRS智能溶出测定仪,天津大学无线电厂提供;红外光谱扫描仪,美国BIO-RAD公司提供;754型紫外分光光度仪,上海光谱仪器有限公司提供;TDP型单冲压片机,中南制药机械厂提供;ZB-IB智能崩解仪,天津大学精密仪器厂提供。
1.2试剂
山楂(购自河北安国药材市场,经河北中医学院严玉平教授鉴定为山楂属山楂的果实);交联聚乙烯基吡咯烷酮(PVPP,药用级,安徽山河药用辅料股份有限公司提供,批号为141008);滑石粉(药用级,上海昌为医药辅料技术有限公司提供,批号为20130915);无水碳酸钙(CaCO3,成都市科龙化工试剂厂提供,批号为20120906);淀粉(成都市科龙化工试剂厂提供,批号为20140531);低取代羟丙基纤维素(L-HPC,药用级,上海厚诚精细化工有限公司提供,批号为20130091);乙醇,过氧化氢,葡萄糖标准品,溴化钾,重蒸苯酚,国药集团公司提供;浓硫酸,北京化工厂提供;其他化学试剂为进口或国产分析纯以上。
2 方法与结果
2.1山楂多糖的制备
将山楂干燥粉碎,使用95%(体积分数,下同)的乙醇回流脱脂,采用超声波辅助热水回流提取,使用旋转蒸发仪减压浓缩提取液,得到山楂提取液浸膏。在浸膏中加入80%的乙醇进行沉淀,得到山楂粗多糖。将粗多糖经蛋白酶-Sevag法除去蛋白、大孔吸附树脂除色素、截流量为3 500Da的透析袋透析后,再经冷冻干燥得到山楂多糖(RCP)[13]。
2.2山楂多糖的红外光谱分析
取山楂多糖约1.0mg,于红外灯下与干燥的KBr研磨均匀,压片,压力约为14MPa,在500~4 000cm-1区间内进行红外光谱扫描[14]。
如图1所示:3 428cm-1处的强吸收为山楂多糖—OH基的伸缩振动吸收峰,2 925cm-1处为C—H的伸缩振动吸收峰,1 636cm-1处为—OH的弯曲振动吸收峰,1 422cm-1处为C—H键的弯曲振动峰,1 076cm-1处则是C—O键的伸缩振动,上述吸收峰均为多糖的特征吸收峰。896cm-1和810 cm-1处的吸收峰显示山楂多糖具有α和β两种糖苷键的构型,1 740cm-1处无吸收,则显示山楂多糖不含有糖醛酸结构[15]。
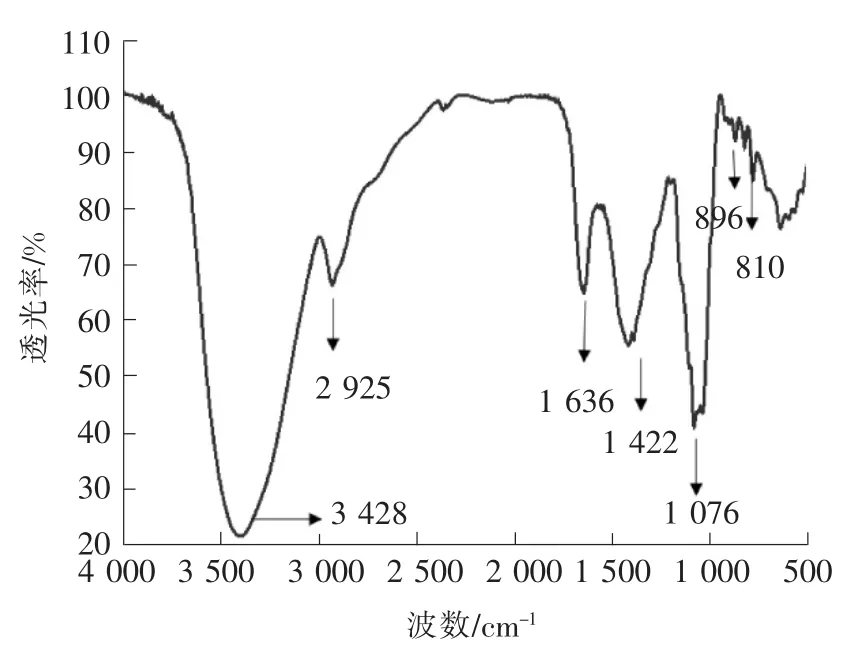
图1 山楂多糖的红外光谱图Fig.1 FI-IR spectrum of RCP
2.3山楂多糖分散片的制备
将山楂多糖(主药)、碳酸钙(填充剂)、PVPP(内加崩解剂)分别过筛(100目),充分混匀,以设定浓度的乙醇作为黏合剂制备软材,过筛(30目)制粒,于60℃减压条件下干燥20min,过筛(18目)整粒,外加崩解剂(PVPP)和润滑剂(滑石粉),充分混匀,压片,控制片重200mg,每片含山楂多糖40mg[16]。
2.4山楂多糖分散片的处方筛选
2.4.1辅料
由于片剂辅料多为多糖类物质,对采用硫酸-苯酚法测定山楂多糖的含量会产生影响,因此实验选择淀粉、甘露醇、碳酸钙、聚乙二醇(PEG)4000、滑石粉、低取代羟丙基纤维素(L-HPC)及PVPP等常用辅料,进行硫酸-苯酚法处理,考察其对吸光度的影响[17]。
由表1可以看出,碳酸钙、PVPP和滑石粉的吸光度较小,表明其对山楂多糖含量测定无干扰。因此,在后续实验中选用碳酸钙为填充剂,PVPP为崩解剂,滑石粉为润滑剂。
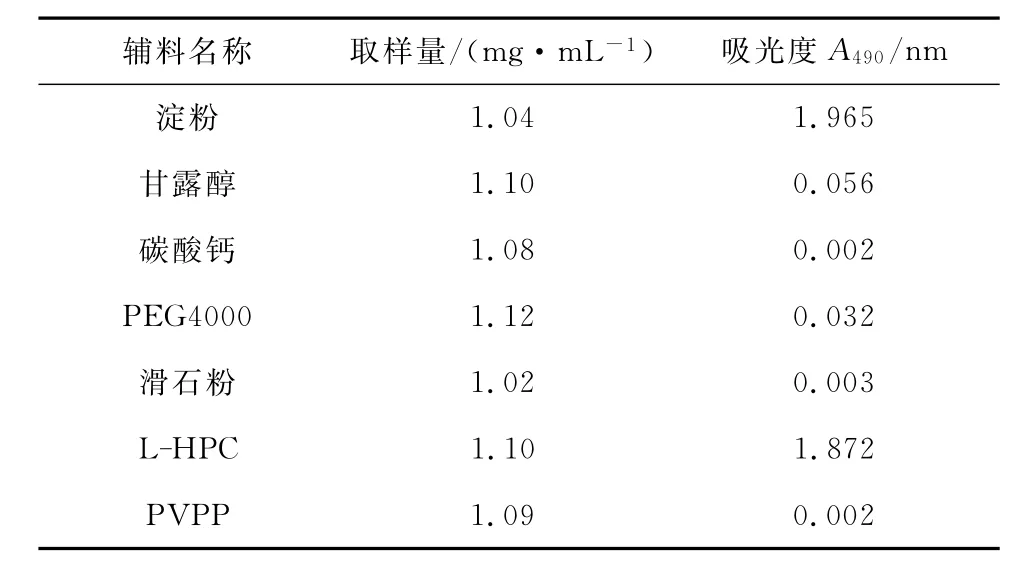
表1 辅料用苯酚-硫酸法测定结果Tab.1 Results of accessories by phenol-sulfuric acid method
2.4.2压片压力
按照制备山楂多糖分散片的处方,调整压力大小,考察分散片的崩解时间。处方组成及测定结果见表2。
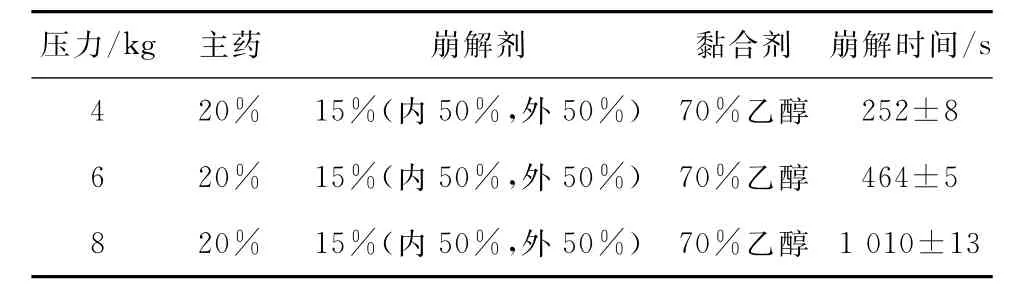
表2 压力对崩解时间的影响(n=6)Tab.2 Results of disintergration time by different pressure(n=6)
由表2得知,压力为4kg时,崩解时间较短,但是硬度太小,不符合《中华人民共和国药典》对片剂的规定;压力为8kg时,硬度适宜,但崩解时间较长;压力为6kg时,硬度适宜,崩解时间为464s。因此,选择压力为6kg作为后续正交试验设计的中心点。
2.4.3崩解剂用量及加入方式
选择PVPP作为崩解剂,对其用量和加入方式进行考察,按照制备山楂多糖分散片的处方,分别采用内加或内外加崩解剂的方式,考察分散片的崩解时间。处方组成及测定结果见表3。
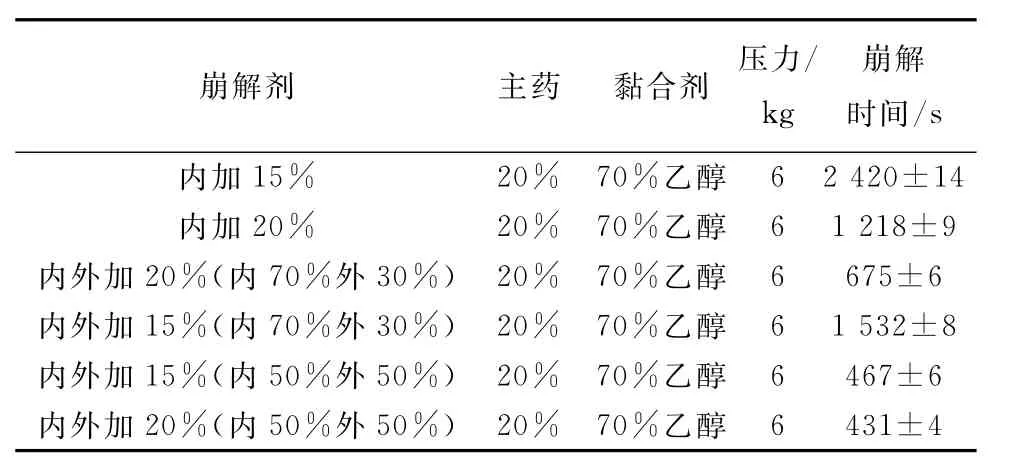
表3 崩解剂用量和加入方式对崩解时间的影响(n=6)Tab.3 Results of disintergration time by different disintegrator(n=6)
由表3可以看出,崩解剂15%的PVPP用量已能使片剂较快崩解。对各组进行比较,可得崩解剂采取内外加法,内加50%,外加50%较好。因此,选择崩解剂用量为15%作为正交试验设计的中心点。
2.4.4黏合剂乙醇溶液浓度的考察
以碳酸钙作为填充剂,PVPP作为崩解剂,滑石粉作为润滑剂,按2.2项下方法压片,考察黏合剂(乙醇溶液)浓度对崩解时间的影响。处方组成及实验结果如表4所示。
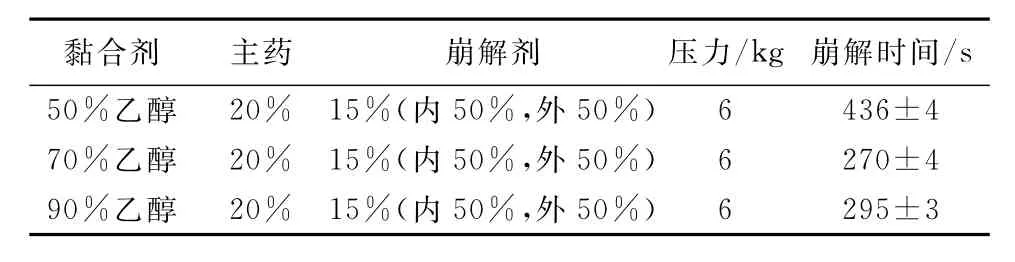
表4 黏合剂对崩解时间的影响(n=6)Tab.4 Results of disintergration time by different adhesive(n=6)
通过比较结果可以看出,70%乙醇溶液的崩解时间优于50%和90%的乙醇溶液,综合考虑能源损耗,在正交试验设计中选择乙醇溶液体积分数为70%作为中心点。
2.5正交试验优化处方[18]
通过预实验及单因素筛选,本试验考察压力(A)、PVPP用量(B)、乙醇溶液浓度(C)3个因素对山楂多糖分散片质量的影响,以崩解时间为指标,优化处方组成,进行正交试验,结果见表5和表6。
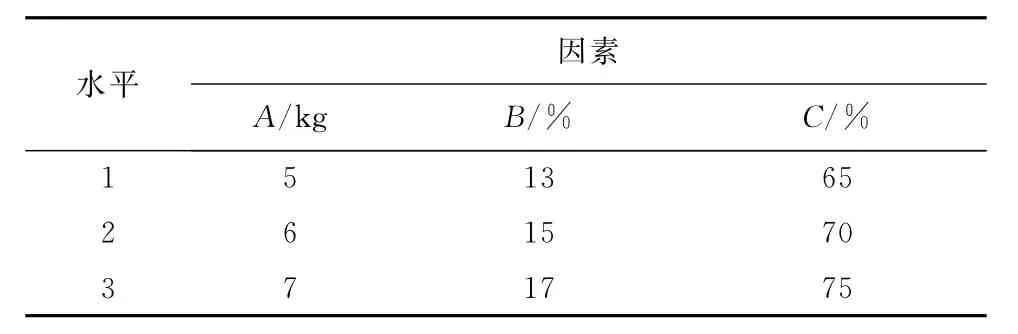
表5 正交试验因素与水平表Tab.5 Factors and levels of orthogonal test
极差分析表明,所考察的3个因素对崩解时间的影响程度为A>B>C,即压力>崩解剂PVPP的用量>黏合剂乙醇溶液的体积分数,最佳处方为A2B3C1,即压力大小为6kg,PVPP的体积分数为17%,乙醇溶液的体积分数为65%。
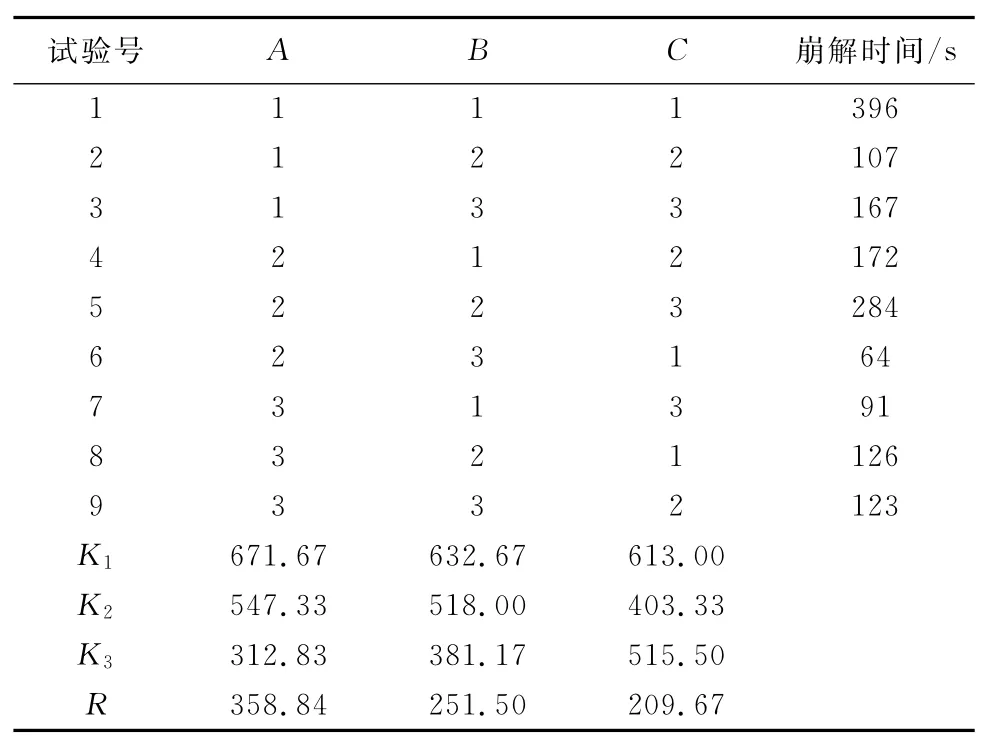
表6 正交试验结果Tab.6 Results of the orthogonal experiment
2.6重现性试验
按优选的处方和工艺分别制备3批山楂多糖分散片,进行外观评价并测定崩解时间、分散均匀性、脆碎度及片重差异。由结果可知,3批样品外观光洁,色泽均匀,平均崩解时间分别为62,65,67s,分散均匀性、脆碎度及片重差异均符合《中华人民共和国药典》对分散片的相关规定。
2.7山楂多糖分散片的含量测定
2.7.1葡萄糖标准曲线的绘制
精密称取干燥至恒重的葡萄糖25.0mg,于50 mL容量瓶中加水定容,摇匀。精密量取此标准液1.0,2.0,4.0,6.0,8.0,10.0mL,分别置于50mL容量瓶中,定容,摇匀。吸取1.0mL,置于10mL干燥具塞试管中,补水加至2.0mL,加入5%苯酚溶液1.0mL、浓硫酸6.0mL,充分混匀后,于沸水浴中加热10min。另以蒸馏水同上操作作为空白,在490nm处测定吸光度值。以浓度(c)对吸光度值(D)回归,得到标准曲线方程式为D=4.792 9c+0.045 3,r=0.999 2,n=6。结果显示:在0.01~0.10mg/mL范围内,线性关系良好,说明根据吸光度值计算多糖含量是可靠的,可用于本试验的测定。
2.7.2专属性试验
按照处方比例,配制空白辅料,混匀,研细。称取处方量的空白辅料,置于100mL容量瓶中定容,振摇使之溶解,过滤。取续滤液1.0mL,同2.7.1操作,于200~700nm扫描。结果显示,在490nm处无吸收,说明辅料对多糖的测定无干扰,可用于分散片中多糖含量的测定。
2.7.3精密度试验
取分散片6片,分别研细溶于适量水中,过滤,定容于100mL量瓶中。同2.7.1操作,测定吸光度,分别为0.385,0.383,0.387,0.382,0.382,0.389,经计算RSD值为0.96%,说明测定方法精密度良好。
2.7.4回收率试验
按照处方比例,配制空白辅料,混匀,研细。称取处方量的空白辅料,精密加入20,25,30mg山楂多糖,置于100mL容量瓶中定容,振摇使之溶解,过滤。取续滤液0.6mL,同2.7.1操作,测定吸光度[1920]。结果表明,其回收率分别为99.60%,99.55%,99.68%,99.62%,99.59%,99.52%,99.60%,99.68%,99.65%,经计算RSD值为0.92%,n=9。
2.7.5含量测定
参照文献方法[10-20],按照优选的山楂多糖分散片处方工艺制备分散片,同2.7.1操作,测定吸光度。结果显示,山楂多糖分散片的平均含量为40mg。
2.8崩解时间的测定
依据《中华人民共和国药典》中崩解时间检查方法进行测定[21]。结果显示,6片山楂多糖分散片的崩解时间分别为63,62,65,66,60,68s。
2.9分散均匀性的检查
依据《中华人民共和国药典》中分散均匀性检查方法进行测定[21],6片山楂多糖分散片颗粒全部崩解并通过2号筛(24目)。
2.10分散片溶出度的测定
依据《中华人民共和国药典》中溶出度测定第2法进行测定[21],15min时,6片山楂多糖分散片的溶出度分别为74.26%,75.84%,76.43%,75.91%,74.89%,75.07%,平均溶出度为75.40%。同时作溶出度曲线,见图2。由图2可知,山楂多糖分散片的溶出度较好,符合《中华人民共和国药典》对分散片的有关规定。
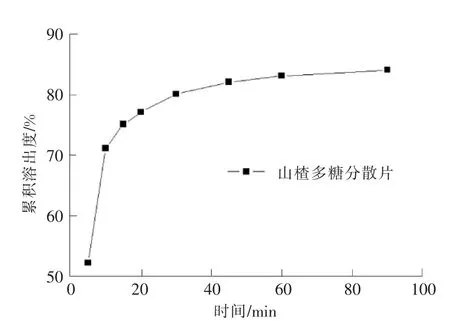
图2 山楂多糖分散片的溶出度曲线Fig.2 Dissolution rate of dispersible tablets of polysaccharides
3 结 论
本实验以山楂多糖分散片的崩解时间为主要指标,采取正交试验法对山楂多糖分散片的辅料和压力进行筛选,并对该分散片的质量控制进行研究。得出最优工艺如下:采用交联聚乙烯基吡咯烷酮(PVPP)为崩解剂,用量为17%;碳酸钙为填充剂;65%的乙醇溶液为黏合剂;滑石粉为润滑剂;压力大小为6kg。制备的山楂多糖分散片每片200mg,含山楂多糖40mg,崩解时间为65s,15min时平均溶出度为75.40%,符合《中华人民共和国药典》对分散片的要求。所制备的山楂多糖分散片制备工艺相对简单,操作简便,崩解较快,性质稳定,可为山楂多糖分散片的开发提供科学依据。
/References:
[1] LIU P Z,YANG B R,KALLIO H.Characterization of phenolic compounds in Chinese hawthorn(Crataegus pinnatifida Bge.var.major)fruit by high performance liquid chromatography-electrospray ionization mass spectrometry[J].Food Chemistry,2010,121:1188-1197.
[2] LI L Z,PENG Y,NIU C,et al.Isolation of cytotoxic compounds from the seeds of Crataegus pinnatifida[J].Chinese Journal of Natural Medicines,2013,11(4):411-414.
[3] WEN L R,GUO X B,LIU R H,et al.Phenolic contents and cellular antioxidant activity of Chinese hawthorn“Crataegus pinnatifida”[J].Food Chemistry,2015,186:54-62.
[4] LI L Z,GAO P Y,SONG S J,et al.Monoterpenes and flavones from the leaves of Crataegus pinnatifida with anticoagulant activities[J].Journal of Functional Foods,2015,12:237-245.
[5] 刘家兰,徐晓玉.山楂的药理作用研究进展[J].中草药,2009,40(2):63-66.LIU Jialan,XU Xiaoyu.Progress of pharmacological research on Crataegus pinnatifida[J].Chinese Traditional and Herbal Drugs,2009,40(2):63-66.
[6] EDWARDSA J E,BRPWNA P N,TALENT N,et al.A review of the chemistry of the genus Crataegus[J].Phytochemistry,2012,79:5-26.
[7] 王玲,吴军林,吴清平,等.山楂降血脂作用和机理研究进展[J].食品科学,2015,36(15):245-248.WANG Ling,WU Junlin,WU Qingping,et al.A review of the lipid-lowering activity and mechanism of Fructus Crataegi [J].Food Science,2015,36(15):245-248.
[8] 戴远臣,侯红漫,张公亮.山楂多糖的提取条件优化及对保加利亚乳杆菌的增殖影响[J].中国酿造,2012,31(1):136-140.DAI Yuanchen,HOU Hongman,ZHANG Gongliang.Optimization of extraction condition of hawthorn polysaccharide and its growth-promoting effect on Lactobacillus bulgaricus [J].China Brewing,2012,31(1):136-140.
[9] 唐礼可.山楂多糖抗疲劳作用实验研究[J].云南中医中药杂志,2008,29(2):32-33.TANG Like.An experimental study on the anti-fatigue effect of hawthorn polysaccharides[J].Yunnan Journal of Traditional Chinese Medicine and Materia Medica,2008,29(2):32-33.
[10]郑朋朋,李珊,戚丽蓉,等.山楂多糖的提取及其抗氧化性作用[J].中国酿造,2015,34(6):107-113.ZHENG Pengpeng,LI Shan,QI Lirong,et al.Extraction and antioxidant activity of hawthorn polysaccharides[J].China Brewing,2015,34(6):107-113.
[11]黄飞.山楂叶多糖的功能活性测定研究[J].广西轻工业,2001(2):47-49.HUANG Fei.Determination of activity of polysaccharide extracted from Crataegus pinnatifida leaves[J].Guangxi Light Industry,2001(2):47-49.
[12]王文宝,赵树娟,杨俊涛,等.杜仲叶分散片的制备与质量控制[J].医药导报,2014,33(4):508-510.WANG Wenbao,ZHAO Shujuan,YANG Juntao,et al.Preparation and quality control of dispersible tablets of eucommia ulmoides leaves[J].Herald of Medicine,2014,33(4):508-510.
[13]JING Y S,HUANG L J,LYU W J,et al.Structual characterization of a novel polysaccharide from pulp tissues of Lichi chinensis and its immunomodulatory activity[J].Journal of Agricultural and Food Chemistry,2014,62:902-911.
[14]柳梦思,牛春梅,李绍英.羧甲基决明子多糖的制备及表征[J].河北科技大学学报,2014,35(6):548-554.LIU Mengsi,NIU Chunmei,LI Shaoying.Synthesis and characterization of carboxymethyl Cassia tora gum[J].Journal of Hebei University of Science and Technology,2014,35(6):548-554.
[15]HU X Q,WANG J L,Jing Y S,et al.Structural elucidation and in vitro antioxidant activities of a new heteropolysaccharide fromLitchi chinensis[J].Drug Discoveries &Therapeutics,2015,9(2):116-122.
[16]冯泽岸,廖明琪,邵婷玑,等.南沙参多糖分散片的制备[J].中国医院药学杂志,2012,32(9):699-704.FENG Zean,LIAO Mingqi,SHAO Tingji,et al.Preparationg of Radix Adenophorae Potanin Korsh polysaccharides dispersible tablet[J].Journal of Chinese Hospital Pharmacy,2012,32(9):699-704.
[17]张东娜,丁建新,窦茜茜,等.桑黄多糖片剂的成型工艺研究[J].军事医学科学院院刊,2009,33(5):444-446.ZHANG Dongna,DING Jianxin,DOU Xixi,et al.Development of tablets of polysaccharides isolated from Phellinus linteus[J].Bulletin of the Academy of Military Medical Sciences,2009,33(5):444-446.
[18]谢英花,曹德英.己酮可可碱渗透泵控释片的研制[J].河北科技大学学报,2010,31(2):142-146.XIE Yinghua,CAO Deying.Preparation of pentoxify lline osmotic pump cont rolled release tablets[J].Journal of Hebei University of Science and Technology,2010,31(2):142-146.
[19]王小芳,戈延茹,夏国华,等.桑黄多糖分散片的制备及质量控制[J].江苏大学学报(医学版),2011,21(1):76-79.WANG Xiaofang,GE Yanru,XIA Guohua,et al.Preparation and quality control of dispersible tablets of polysacharides isolated fromPhellinus linteus[J].Journal of Jiangsu University (Medicine Edition),2011,21(1):76-79.
[20]张芳,韩丽,张定堃,等.混料设计优化感咳双清分散片的制备工艺[J].中药材,2014,37(3):499-503.ZHANG Fang,HAN Li,ZHANG Dingkun,et al.Using mixture design to optimize preparation technology of Gankeshuangqing dispersible tablets[J].Journal of Chinese Medicinal Materials,2014,37(3):499-503.
[21]国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2010.
Preparation and quality control of dispersible tablets of polysaccharides isolated fromCrataegus pinnatifida Bunge
JING Yongshuai1,WU Lanfang2,RONG Xinyu1,XIE Yinghua1,DU Hongxia1,MA Zhe1,XING Wenxue1
(1.School of Chemical and Pharmaceutical Engineering,Hebei University of Science and Technology,Shijiazhuang,Hebei 050018,China;2.School of Pharmacology,Hebei University of Chinese Medicine,Shijiazhuang,Hebei 050200,China)
To optimize the preparation technics of dispersible tablets of polysaccharides isolated from Crataegus pinnatifida Bunge,quality control is implemented.On the basis of single factor test,with the disintegration time as evaluation index,and the pressure tableting,the amount of disintegrant and the concentration of ethanol as factors,the formulation of polysaccharides dispersible tablets is optimized by orthogonal design;according to the method in Chinese Pharmacopoeia,the main ingredients,disintegration,dispersion uniformity,dissolution and other indicators are measured to control the quality of the dispersble tablet.The optimal formulation is conducted using polyvingypyrrolidone(PVPP)as disintegrator,CaCO3as fillers,65% (volume fraction)ethanol as adhesive,and pulvistalci as lubricant under the pressure of 6kg.The research shows that the dispersible tablets contain 40mg polysaccharides fromCrataegus pinnatifida Bunge,the disintegration time is 65seconds and the dissolution rate is 75.40%in 15minutes.
traditional chinese medicine pharmaceutics;Crataegus pinnatifida Bunge;polysaccharides;dispersible tablets;preparation;quality control
1008-1534(2016)01-0035-05
R944.4
A
10.7535/hbgykj.2016yx01007
2015-10-20;
2015-11-30;责任编辑:张士莹
河北省食品药品监督管理局食品药品安全科技项目(QN2015016);河北科技大学“五大平台开放基金”(2014PT96)
景永帅(1985—),男,河北石家庄人,讲师,博士,主要从事中药新药研发方面的工作。
吴兰芳博士。E-mail:wulanfang757@163.com
景永帅,吴兰芳,戎欣玉,等.山楂多糖分散片的制备及质量控制[J].河北工业科技,2016,33(1):35-39.
JING Yongshuai,WU Lanfang,RONG Xinyu,et al.Preparation and quality control of dispersible tablets of polysaccharides isolated from Crataegus pinnatifida Bunge[J].Hebei Journal of Industrial Science and Technology,2016,33(1):35-39.

