艾塞那肽对单纯性肥胖合并糖调节受损模型大鼠脂肪因子及体质量的影响
李晓明,赵 娜,郭 芳
(1.河北省人民医院,河北 石家庄 050051;2.河北医科大学,河北 石家庄 050031)
艾塞那肽对单纯性肥胖合并糖调节受损模型大鼠脂肪因子及体质量的影响
李晓明1,赵娜1,郭芳2
(1.河北省人民医院,河北 石家庄 050051;2.河北医科大学,河北 石家庄 050031)

目的观察艾塞那肽对单纯性肥胖合并糖调节受损模型大鼠脂肪因子和体质量的影响。方法取60只Wistar大鼠,随机选择10只作为空白组,其余50只大鼠通过喂养高脂饲料与注射链脲佐菌素方法制备单纯性肥胖合并糖调节受损模型,将造模成功大鼠随机分为艾塞那肽组、二甲双胍组与模型组。空白组、模型组给予生理盐水6 mL/kg灌胃;二甲双胍组给予二甲双胍混悬液250 mg/(kg·d)灌胃;艾赛那肽组皮下注射艾赛那肽10 μg/kg,2次/d。实验周期6周,比较4组大鼠体质量、Lee’s指数、腹部脂肪湿质量、肝脏形态学病理表现及血清瘦素(Leptin)、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)水平变化。结果干预6周后,二甲双胍组和艾赛那肽组体质量、Lee’s指数及腹部脂肪湿质量均明显低于模型组(P均<0.05),且艾赛那肽组体质量明显低于二甲双胍组(P<0.05),艾赛那肽组Lee’s指数明显低于干预前(P<0.05)。干预6周后,二甲双胍组和艾赛那肽组肝组织病理改变明显轻于模型组;二甲双胍组和艾赛那肽组血清Leptin、TNF-α水平均明显低于模型组(P均<0.05),且艾赛那肽组血清TNF-α水平明显低于二甲双胍组(P<0.05),二甲双胍组和艾赛那肽组IL-6水平与模型组比较差异均无统计学意义(P均>0.05)。结论艾塞那肽可有效减慢单纯性肥胖合并糖调节受损大鼠体质量增长速度,降低大鼠Lee’s指数及血清Leptin、TNF-α水平,并可能通过减轻Leptin抵抗及下调TNF-α水平以减轻中心性肥胖及肥胖慢性炎症状态。
肥胖;瘦素;肿瘤坏死因子-α;白细胞介素-6;艾塞那肽
肥胖症是人体摄入能量过多而消耗不足的一种慢性能量失衡状态。国际肥胖特别工作组研究显示,现代社会肥胖症已成为最严重且蔓延速度最快的公共卫生问题之一[1]。单纯性肥胖症不仅可降低肥胖人群生活质量,更为重要的是肥胖与高血压病、糖尿病、动脉粥样硬化性心脏病(冠心病)、高血脂症等多种疾病密切相关,进而严重危害人类健康。艾塞那肽为胰高血糖素样肽-1(GLP-1) 类似物的一种,其降低血糖的作用机制为通过激活GLP-1受体,刺激葡萄糖依赖的胰岛素分泌,从而抑制胰高血糖素分泌,延缓胃排空及食欲,增加细胞质量[2]。为进一步探讨其作用机制,笔者通过建立单纯性肥胖合并糖调节受损大鼠模型,观察了该药对大鼠体质量及脂肪因子的影响,现将结果报道如下。
1 实验资料
1.1动物成年健康雄性Wistar大鼠60只,清洁级,体质量(200±20)g,河北医科大学实验动物中心提供,动物合格证号:SCXK(冀)2013-1-003。常规饲料分笼饲养,自由饮水。
1.2试剂PBS缓冲液(磷酸缓冲液),河北省人民医院实验中心提供;96T大鼠瘦素(Leptin)ELISA试剂盒,美国R&D有限公司; 96T大鼠白细胞介素-6(IL-6)ELIAS试剂盒,美国R&D有限公司;96T大鼠肿瘤坏死因子-α(TNF-α)ELISA试剂盒,美国R&D有限公司。
1.3药品艾塞那肽,美国Amylin公司生产,国药准字H20090382;盐酸二甲双胍,齐鲁制药有限公司生产,国药准字H37020561;10%的水合氯醛麻醉剂,河北省人民医院实验中心提供。
1.4仪器电子分析天平,METTLERAE240瑞士梅特勒公司; -80 ℃超低温冰箱;Elx50型洗板机;全波长酶标仪,美国BioTek公司;gavplus型超纯水系;ClassⅡ2085型超净工作台,美国Thermo Forma公司;H-7500型透射电子显微镜,日本HITACHI公司;Leica石蜡切片机及石蜡包埋机,德国LEICA公司;低温高速冷冻离心机,德国Eppendorf。
1.5实验方法将大鼠60只适应性喂养1周后,随机选择10只作为空白组,喂饲普通饲料(购于河北医科大学实验动物中心,其中脂肪占10.2%,蛋白质占23.3%,碳水化合物占66.5%,能量13.4 kJ/g);余50只大鼠进行造模,喂饲高脂饲料(清洁级高脂饲料购于河北医科大学实验动物中心,配方:10.0%猪油,10.0%蔗糖,15.0%蛋黄粉,2.5%胆固醇,1.5%食盐和61%常规饲料,能量22.8 kJ/g,其中脂肪占59.0%,蛋白质占7.0%,碳水化合物占34.7%),造模期间自由饮水、摄食,饲料和水每天更换1次。高糖高脂饲料喂饲6周后,将体质量超过普通饲料喂饲大鼠平均体质量20%的大鼠作为单纯性肥胖模型大鼠,剔除体质量未达标准或体质量增长缓慢、有肥胖抵抗特性大鼠。单纯性肥胖模型大鼠在禁食不禁水12 h条件下,一次性腹腔内注射链脲佐菌素10 mg/kg,空白组大鼠按0.1 mL/100 g剂量腹腔注射柠檬酸-柠檬酸钠缓冲液(0.1 mmol/L,pH 4.5)。3 d后单纯性肥胖模型大鼠禁食不禁水12 h后,予20%葡萄糖液灌胃(1 mL/100 g),分别于0 min及120 min时尾静脉采血测空腹血糖(FBG)及2 h血糖(2hPG),FBG>6.1 mmol/L且<7.0 mmol/L和/或2hPG>7.8 mmol/L且<11.1 mmol/L判定为单纯性肥胖合并糖调节受损大鼠成模。剔除体质量未达标准或增长缓慢大鼠19只,造模成功31只,单纯性肥胖模型造模成功率62.0%,后单纯性肥胖合并糖调节受损大鼠造模成功26只(5只大鼠血糖超出标准予以剔除)。将造模成功的26只大鼠随机分为模型组8只、二甲双胍组9只、艾赛那肽组9只,空白组、模型组给予生理盐水6 mL/kg灌胃;二甲双胍组给予用生理盐水配制的二甲双胍混悬液250 mg/(kg·d)灌胃,每天灌胃量为6 mL/kg(浓度为41.67 mg/mL);艾赛那肽组皮下注射艾赛那肽10 μg/kg,2次/d。观察周期总计6周。
1.6检测指标及方法
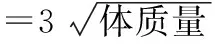
1.6.2大鼠肝脏组织形态学取1.6.1步骤下大鼠肝脏组织,固定后送河北省人民医院病理科,以石蜡包埋,常规梯度乙醇脱水,制成厚度4 μm切片,行HE染色,以光镜观察大鼠肝脏组织病理学变化。
1.6.3血清Leptin、IL-6、TNF-α水平取1.6.1步骤下大鼠腹主动脉血液10 mL,静置2~3 h,12 000 r/min离心10 min后留取血清,-80 ℃超低温冻存后择期应用酶联免疫法检测血清Leptin、IL-6、TNF-α水平,检测时严格按照试剂盒要求操作。
2 结 果
2.1各组大鼠不同时间体质量比较在干预的前4周,艾赛那肽组、二甲双胍组体质量增长较模型组缓慢,但差异均无统计学意义(P均>0.05);干预5周后,二甲双胍组和艾赛那肽组体质量均明显轻于模型组(P均<0.05);干预6周后,二甲双胍组和艾赛那肽组体质量均明显轻于模型组(P均<0.05),且艾赛那肽组体质量明显轻于二甲双胍组(P<0.05)。见表1。
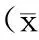
表1 各组大鼠不同时间体质量比较±s,g)
注:①与模型组比较,P<0.05;②与二甲双胍组比较,P<0.05。
2.2各组大鼠干预前后Lee’s指数比较干预前,肥胖各组Lee’s指数均显著高于空白组(P均<0.05),提示造模成功;干预6周后,二甲双胍组和艾赛那肽组Lee’s指数均明显低于模型组(P均<0.05),且艾赛那肽组Lee’s指数明显低于干预前(P<0.05)。见表2。
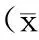
表2 各组大鼠干预前后Lee’s指数比较±s)
注:①与空白组比较,P<0.05;②与模型组比较,P<0.05;③与干预前比较,P<0.05。
2.3各组大鼠腹部脂肪湿质量比较空白组腹部脂肪湿质量为(16.62±4.60)g,模型组为(36.20±9.25)g,二甲双胍组为(22.90±5.09)g,艾赛那肽组为(19.64±5.45)g。二甲双胍组和艾赛那肽组腹部脂肪湿质量均明显低于模型组(P均<0.05)。
2.4各组大鼠肝脏组织形态学比较干预6周后,相较于空白组大鼠肝脏组织形态,模型组大鼠肝脏肝索排列紊乱,基本无放射状排列,肝细胞体积增大、浊肿,部分轻度变形,可见大小不等的脂肪空泡,部分肝细胞出现坏死,汇管区可见大量炎性细胞浸润;二甲双胍组肝细胞肿胀不明显,可见轻度脂肪变性,胞浆内仍有脂肪空泡,但较模型组减少,汇管区有少量炎性细胞浸润;艾赛那肽组大鼠肝脏细胞结构基本完整,脂肪肿胀变性并不明显,细胞内偶见脂肪空泡,基本未见炎性细胞浸润,无肝细胞坏死。
2.5各组大鼠血清Leptin、TNF-α、IL-6水平比较模型组血清Leptin、TNF-α、IL-6水平均明显高于空白组(P均<0.05);二甲双胍组和艾赛那肽组血清Leptin、TNF-α水平均明显低于模型组(P均<0.05),且艾赛那肽组血清TNF-α水平明显低于二甲双胍组(P<0.05);二甲双胍组和艾赛那肽组IL-6水平与模型组比较差异均无统计学意义(P均>0.05)。见表3。
3 讨 论
根据2000年世界卫生组织对肥胖的判定标准及定义,单纯性肥胖症首次被定义为一种与生活方式密切相关的全身性脂肪过度增生的慢性疾病,其主要特征为 “过度营养”“运动不足”“行为偏差”,一般来说,肥胖症主要以体内脂肪堆积过多和/或分布异常、体质量增加为主要表现,其中脂类物质的形成、聚集是肥胖症一系列危害性的基础[3-4]。脂肪作为生物体的能量提供者,对人类生命个体的正常生理过程具有极为重要的意义[5]。当没有外来食物、能量供应时,机体需要动员脂肪分解释放出游离脂肪酸以满足各个器官需求,而当进食过多能量饮食时,机体会将多余脂肪以三酰甘油形式储存于体内[6]。我国自上世纪80年代改革开放以来,由于经济的迅速发展,以往以低脂肪、高膳食纤维、碳水化合物为膳食结构特点的谷类物质膳食结构逐渐丢失[7],代之以动物性、脂肪类物质急剧增加、谷类物质迅速减少的类西方膳食结构[8],造成近几十年来单纯性肥胖症发病率不断增高,脂类物质的聚集成为肥胖症发病的重要原因。现有研究显示,中心性肥胖是2型糖尿病的独立危险因素,相比全身性肥胖更易导致2型糖尿病[9],且与心血管疾病的发生发展密切相关[10-11];另外内脏组织的脂肪沉积和脂代谢紊乱有密切的关系,而脂肪代谢的动态平衡会因代谢环节中的异常而发生改变[12],最终导致肝细胞的脂肪堆积及肝脏微循环障碍等一系列结果[13],减重可有效改善甚至逆转肝细胞脂肪沉积[14],而脂肪沉积的改变亦会促进体质量下降及脂质代谢紊乱。

表3 各组大鼠血清Leptin、TNF-α、IL-6水平比较
注:①与空白组比较,P<0.05;②与模型组比较,P<0.05;③与二甲双胍组比较,P<0.05。
目前研究表明,艾塞那肽的作用与内源性GLP-l非常相似,两者均能提升机体内胰岛素分泌水平,并能抑制餐后胰高血糖素的分泌,降低肝糖原的输出量,延长胃内容物的存留时间[15],它还能刺激中枢神经,增加患者的饱腹感,进而减少患者食物的摄入量,帮助其减轻体质量,达到控制疾病发展的目的[16]。本研究通过建造与人相似的肥胖生成过程,并以小剂量链脲佐菌素破坏胰岛细胞,更为完整地模拟出肥胖合并糖调节受损及代谢综合征整体发生过程,使实验更准确可靠,并应用艾赛那肽及确有减重效果的西药二甲双胍对模型大鼠进行干预,旨在评价艾赛那肽对内脏脂肪及脂肪组织慢性炎症反应的作用。结果显示,在干预的前4周,艾赛那肽组、二甲双胍组大鼠体质量增长较模型组缓慢,但差异均无统计学意义;干预5周后和干预6周后,二甲双胍组和艾赛那肽组体质量均明显轻于模型组,且干预6周后艾赛那肽组体质量明显轻于二甲双胍组;干预6周后,二甲双胍组和艾赛那肽组Lee’s指数及腹部脂肪湿质量均明显低于模型组,且艾赛那肽组体质量明显低于二甲双胍组,艾赛那肽组Lee’s指数明显低于干预前。提示艾赛那肽与二甲双胍具有相似甚至更为优秀的减重疗效,且可有效减低评价成年肥胖模型大鼠肥胖程度的Lee’s指数[17],进一步明确了艾赛那肽的减重疗效;且艾赛那肽在减重的同时可有效减轻肝细胞脂肪变性,而肝细胞脂肪变性减轻可使肝细胞内肝脂酶合成及活性增加,进一步减少肝脏脂肪沉积,减轻中心性肥胖,改善胰岛素抵抗。
脂肪组织根据现今研究显示不仅是能量储存场所,更具内分泌功能,可分泌多种细胞炎症因子,如TNF-α、Leptin、IL-6、脂联素、抵抗素和蛋白纤维酶原激物抑制剂-1(PAI-1)等[18],这些脂肪因子可干扰血管生理和新陈代谢,并参与到一系列与肥胖症相关疾病的发生发展中[19]。脂肪因子炎症因子表达的增多,也是单纯型肥胖症与胰岛素抵抗密切联系的潜在机制[20]。本研究结果显示,模型组血清Leptin、TNF-α、IL-6水平均明显高于空白组;二甲双胍组和艾赛那肽组血清Leptin、TNF-α水平均明显低于模型组,且艾赛那肽组血清TNF-α水平明显低于二甲双胍组;二甲双胍组和艾赛那肽组IL-6水平与模型组比较差异均无统计学意义。提示艾赛那肽可有效减轻肥胖合并糖调节受损大鼠血清Leptin抵抗及慢性炎症抵抗状态,并可能以此为机制减轻胰岛素抵抗。
综上所述,艾塞那肽可有效减慢单纯性肥胖合并糖调节受损大鼠体质量增长速度,降低大鼠Lee’s指数及血清Leptin、TNF-α水平,并可能通过减轻Leptin抵抗及下调TNF-α水平以减轻中心性肥胖及肥胖慢性炎症状态。
[1]Consultation WHO.Obesity: preventing and managing the global epidemic.Report of a WHO consultation[J].World Health Organ Tech Rep Ser,2000,214(i-xii):894
[2]Feldstein AE,Werneburg NW,Canbay A,et al.Free fatty acids promote hepatic lipotoxicity by stimulating TNF-alpha expression via a lysosomal pathway[J].Hepatology,2004,40(1):185-194
[3]Wu S,Fisher-Hoch SP,Reninger B,et al.Metabolic Health Has Greater Impact on Diabetes than Simple Overweight/Obesity in Mexican Americans[J].J Diabetes Res,2016,2016:4094876
[4]Thomas DM,Brown A,Dawson JA,et al.Letter to the Editor: Exceptional Data in Paper on “The effect of meridian massage on BM,BMI,WC and HC in simple obesity patients:a randomized controlled trial”[J].World J Acupunct Moxibustion,2015,25(1):66-67
[5]Wise J.Body fat rather than weight should be considered when assessing a patient's health,study finds[J].BMJ,2016,352:1360-1367
[6]Sahebkar A,Watts GF.Developing role of microRNA-33 in lipid metabolism and atherosclerosis[J].Curr Opin Lipidol,2016,27(2):197-199
[7]杜树发,吕冰,王志宏,等.中国居民膳食的变迁[J].卫生研究,2001,30(4):221-225
[8]葛可佑.中国人群膳食结构的变化[J].卫生研究,1996,25(S1):28-32
[9]Ohlson LO,Larsson B,Svärdsudd K,et al.The influence of body fat distribution on the incidence of diabetes mellitus:13.5 years of follow-up of the participants in the study of men born in 1913[J].Diabetes,1985,34(10):1055-1058
[10] Grievink L,Alberts JF,O’Niel J,et al.Waist circumference as a measurement of obesity in the Netherlands Antilles; associations with hypertension and diabetes mellitus[J].EurJ Clin Nutr,2004,58(8):1159-1165
[11] Hsieh SD,Muto T.The superiority of waist-to-height ratio as an anthropometric index to evaluate clustering of coronary risk factors among non-obese men and women[J].Prev Med,2005,40(2):216-220
[12] Marchesini G,Bugianesi E,Forlani G,et al.Nonalcoholic fatty liver,steatohepatitis,and the metabolic syndrome[J].Hepatology,2003,37(4):917-923
[13] Poniachik J,Mancilla C,Contreras J,et al.Obesity: risk factor for steatohepatitis and hepatic fibrosis[J].Rev Med Chil,2002,130(7):731-736
[14] 朱惠娟,史轶蘩,胡明明,等.减重治疗逆转超重及肥胖症患者脂肪肝的作用[J].中华内科杂志,2003,42(2):98-102
[15] Gumuslu E,Mutlu O,Celikyurt IK,et al.Exenatide enhances cognitive performance and upregulates neurotrophic factor gene expression levels in diabetic mice[J].Fundam Clin Pharmacol,2016,3:12192-12198
[16] Quan H,Zhang H,Wei W,et al.Gender-related different effects of a combined therapy of Exenatide and Metformin on overweight or obesity patients with type 2 diabetes mellitus[J].J Diabetes Complications,2016,30(4):686-692
[17] 何明,涂长春.Lee’s指数用于评价成年大鼠肥胖程度的探讨[J].中国临床药理学与治疗学杂志,1997,2(3):177-179
[18] Farquharson AJ,Steele RJ,Carey FA,et al.Novel multiplex method to assess insulin,leptin and adiponectin regulation of inflammatory cytokines associated with colon cancer[J].Mol Biol Rep,2012,39(5):5727-5736
[19] Pereira SS,Alvarez-Leite JI.Low-Grade Inflammation,Obesity,and Diabetes[J].Curr Obes Rep,2014,3(4):422-431
[20] Adabimohazab R,Garfinkel A,Milam EC,et al.Does Inflammation Mediate the Association Between Obesity and Insulin Resistance?[J].Inflammation,2016,3:2142-2149
Effect of Exenatide on adipokines and body weight in model rats with simple obesity and impaired glucose regulation
LI Xiaoming1,ZHAO Na1,GUO Fang2
(1.The General Hospital of Hebei Province,Shijiazhuang 050051,Hebei,China; 2.Hebei Medical University,Shijiazhuang 050031,Hebei,China)
Objective It is to observe the effect of Exenatide on adipokines and body mass in rats model of simple obesity with impaired glucose regulation (IGR).Methods 60 Wistar rats were selected and randomly divided into 2 groups,10 in control group and 50 in the model group.Through high fat feeding and by given Streptozotocin,the rats in model group were randomly divided into the Exenatide group,metformin group and model control group.Control group and model group were given normal saline 6 mL/kg by gavage; metformin group were given metformin configured by saline suspension 250 mg/(kg·d) by gavage; Exenatide group were given Exenatide 10 μg/kg by subcutaneous,2 times a day.The experiment lasted six weeks,compared body weight,liver pathology observed morphology,serum leptin (Leptin),tumor necrosis factor-α(TNF-α),and interleukin-6 (IL-6) content change of four groups.Results Six weeks after the intervention,compared with the control group,body mass of the metformin group and Exenatide group was significantly reduced (P<0.05),Exenatide group was more effective on lose body mass than metformin group (P<0.05);compared with pre-intervention,Lee’s index of Exenatide group was significantly reduced (P<0.05),compared with the control group,Lee's index of Exenatide group and metformin group was significantly lower after the intervention (P<0.05); after drugs intervention,compared with the control group,abdominal fat wet weight of exenatide group decreased significantly (P<0.01),metformin group also decreased (P<0.05);After high fat diet,compared with the control group,Leptin,TNF-α,IL-6 of model group were significantly higher (P<0.01,P<0.05),compared with the control group,Exenatide group and metformin group significantly decreased serum Leptin and TNF-α levels (P<0.05),but no significant differences in IL-6 levels.Conclusion Exenatide can effectively slow down the growth rate of body mass of rats,induced a significant reduction of Lee's index,reduce abdominal fat wet weight,reduce central obesity,and can effectively reduce serum Leptin and TNF-α levels of simple obese rats,the mechanism may be by ease Leptin resistance and reducing TNF-α levels to reduce obesity and chronic inflammatory state.
obesity;Leptin; TNF-α; IL-6; Exenatide
李晓明,女,主管药师,从事药学研究工作。
E-mail:1661009771@qq.com
10.3969/j.issn.1008-8849.2016.16.009
R-335
A
1008-8849(2016)16-1741-04
2015-10-10

