抗结核药物研究新进展
任金凤,赵跃,王菊仙
·综述·
抗结核药物研究新进展
任金凤,赵跃,王菊仙
结核病(tuberculosis,TB)是由结核分枝杆菌(mycobacterium tuberculosis,MTB)引起的一种在全球范围内流行的慢性致死传染性疾病。MTB 主要通过侵袭肺部形成肺结核,也可能侵入人体其他器官(如骨骼、关节、淋巴结和肠道等)形成肺外结核。结核病主要通过呼吸道传播,故肺结核占临床 TB 的 80% 以上。据 WHO 最新统计数据显示,2014 年,全球新增结核病例 600 万,其中 150 万人死亡;耐多药结核(multidrug-resistant tuberculosis,MDR-TB)病例高达 48 万,其中包括艾滋病阳性患者 39 万人,结核/艾滋病(MTB/HIV)双重感染将严重威胁人类的健康[1]。在中国,结核病被列为重大传染病之一,2012 年中国疾病预防控制中心的调查报告显示,未来数年内中国将可能出现以耐药菌为主的结核病流行态势,耐药结核病的危害日益凸显。
传统的抗结核药物包括链霉素(streptomycin,1944年)、异烟肼(isoniazid,1952 年)、吡嗪酰胺(pyrazinamide,1954 年)、利福平(rifampicin,1965 年)和乙胺丁醇(ethambutol,1968 年)等一线药物,以及乙硫异烟胺(ethinamide)、对氨基水杨酸(4-aminosalicylic acid)、环丝氨酸(L-cycloserine)、氨硫脲(thiacetazone)、卡那霉素(kanamycin)、阿米卡星(amikacin)和卷曲霉素(capreomycin)等二线药物。这些抗结核药物的使用时间已长达半个世纪,临床应用中也存在诸多问题,如治疗周期长、且对 MDR-TB 无效,同时对潜伏态的结核分枝杆菌(latent tuberculosis infection,LTBI)作用也不强,为了有效避免治疗期间出现耐药性而导致治疗失败,目前临床上普遍采用 3 种或 4 种抗 TB 药物的联合给药方案,其治疗周期通常为 6 ~ 9 个月以上。而针对 MDR-TB 的治疗方案更复杂,治疗周期更长。因此,亟需研发出新型抗结核药物以应对耐药结核的挑战。近年来,抗结核研究领域出现了很多活性优秀的新型药物以及候选物,本文将对这些药物及候选物的最新研究进展作一综述。
1 二芳基喹啉类抗结核药物
2012年12月,FDA 加速审批了强生公司的 Sirturo(贝达喹啉,bedaquiline)(图 1)。贝达喹啉是 40 多年以来第一种以新机制上市的抗结核药物,也是首个被 FDA 批准上市的治疗耐多药结核的药物。贝达喹啉作用机制新颖,通过靶向作用于 MTB 中 ATP 合成酶,阻止结核分枝杆菌利用 ATP 产生能量,进而发挥抗 MTB 作用[2]。药理学研究结果表明,贝达喹啉可高度选择性地作用于 MTB(选择性系数大于 20 000),几乎不对宿主细胞产生毒性[3]。且能够有效对抗复制期和休眠期的 MTB[4]。临床试验结果表明,贝达喹啉与异烟肼、利福平、乙胺丁醇、吡嗪酰胺、链霉素、阿米卡星和莫西沙星联合使用治疗 TB 和 MDR-TB 的疗效显著,且无交叉耐药性[5]。遗憾的是,在贝达喹啉临床研究中,有患者死亡和心脏 QT 间期延长的报道,这较严格地限制了贝达喹啉的使用[6]。目前,贝达喹啉还在进行临床III 期安全性评价。
2 硝基咪唑类抗结核药物
与传统抗结核药物相比,硝基咪唑类化合物具有全新的抗菌机制及全新的结构,对 MTB 有很好的抑制效果,在抗结核药物研究中非常具有开发前景。该类化合物主要包括PA-824、TBA-354、delamanid 等(图 2)。
硝基咪唑并吡喃类化合物 PA-824 属于第一代硝基咪唑类抗 TB 候选物,由瑞士诺华制药公司研发,2002 年全球结核病研发联盟获得 PA-824 及硝基咪唑衍生物开发权,2008 年,PA-824 获得美国 FDA“罕用药物”身份,用于结核病的治疗。2014 年,上海复星医药公司获得 PA-824 在中国的独家授权,相关研究工作正在进行。机制研究表明,PA-824 为前体药物,需经细菌代谢活化发挥疗效,其具有抑制细胞壁脂质和蛋白质合成的双重作用机制[7]。体外研究结果显示,PA-824 具有广谱抗 MTB 活性,对 MTB 的MIC 值为(0.015 ~ 0.25)μg/ml[8],与目前一、二线抗结核药物无交叉耐药性;与莫西沙星和吡嗪酰胺联用疗效最显著[9];在感染结核动物模型试验中,口服效果也较为理想[10]。然而,致突变性成为 PA-824 在临床应用中的突出问题[11]。不过该问题有可能通过联合用药方案中药物的协调作用来克服。PA-824 现处于 III 期临床试验,有望成为具有良好临床应用前景的新型抗结核药物,被认为是近几年抗结核药物研究领域的重大突破。

图2 硝基咪唑类化合物的结构
TBA-354,是在 PA-824 基础上进行结构优化得到的第二代硝基咪唑类化合物。TBA-354 除对结核分枝杆菌敏感外,对其他大多数细菌不敏感;体外抗结核效果与抗结核新药 delamanid 相似,优于同处于 III 期临床研究的PA-824[12]。吡啶环的引入使得 TBA-354 具有更好的溶解性和药代动力学性质,肺结核小鼠模型研究表明,TBA-354 具有较好的生物利用度和较长的半衰期,其最终半衰期为 8 ~12 h,适合每日 1 次的给药方式[13]。TBA-354 较高的抗结核活性和优良的代谢性质使其成为下一代具有开发潜力的硝基咪唑类化合物。
Delamanid(OPC-67683)是 Otsuka 制药公司为克服硝基咪唑类化合物的致突变性,而对该类化合物进行结构修饰开发得到的硝基二氢咪唑并噁唑类化合物。2014 年 5 月,delamanid 获得欧盟委员会的上市许可,在其他疗法因耐药或耐受性原因而无效的情况下,该药可以作为适当的联合治疗方案的组成部分用于成人 MDR-TB 的治疗。目前,我国南京长澳医药科技有限公司也正在对其进行研究。相关机制研究表明,delamanid 通过抑制细胞壁上霉菌酸的生物合成来杀灭 MTB[14]。无论是在体外还是体内,delamanid 对MTB 敏感型和耐药型菌株均有良好的活性,其最小抑菌浓度(MIC)为 0.006 ~ 0.024 μg/ml[15]。Delamanid 耐药突变率大大降低,具有比 PA-824 更有效的抗 MTB 活性与更高的安全性,目前处于 III 期临床试验[16-17]。
3 噁唑烷酮类抗结核药物

图3 噁唑烷酮类化合物的结构
噁唑烷酮类抗结核药物(图 3)的典型代表是利奈唑胺(linezolid),2000 年,利奈唑胺获得美国 FDA 批准,用于治疗耐革兰阳性球菌引起的感染。后来研究发现,利奈唑胺具有很好的抗 MTB 作用,但其同时具有骨髓抑制等不良反应[18-19],限制了它的使用。多名研究者对利奈唑胺进行了一系列的结构改造,并获得了几个具有深入研究价值的抗 TB 候选物,如 sutezolid、AZD-5847、radezolid 和tedizolid[20-25]。其中,sutezolid 和 AZD-5847 已进入 II 期临床试验。据报道,sutezolid 对临床分离的敏感 MTB 和MDR-TB 均表现出较好的体外活性(MIC ≤ 0.5 μg/ml),其口服给药时的体内疗效与异烟肼相当。临床研究结果表明,sutezolid 600 mg 每天两次的用药方案杀菌效果优于 1200 mg每天四次,但有 14% 的病患出现短暂性的肝谷丙转氨酶和天门冬氨酸氨基转移酶升高[26]。AZD-5847 是由阿斯利康公司研制的首个 TB 候选药物,其 II 期临床研究已在南非展开,但目前还没有相关研究结果报道[27]。
4 乙二胺类抗结核药物
SQ109(图 4)是目前唯一一个进入临床研究的乙二胺类抗 TB 候选物。2007 年 1 月,美国 FDA 通过其快速通道药认定,同年,欧洲药物管理局(EMA)和 FDA 又通过了其孤儿药的审核。众多研究表明,乙胺丁醇的抗结核分枝杆菌作用机制是抑制 MTB 中阿拉伯半乳聚糖和脂质阿拉伯甘露聚糖的合成,与之不同,SQ109 的作用靶点则是 MTB 的霉菌酸转运蛋白 MmpL3,这种转运蛋白在细胞壁合成过程中扮演着不可或缺的角色[28]。体外活性测试结果显示,SQ109 对 MDR-TB 和广泛耐药结核(XDR-TB)均有效,而且与现有一线抗结核药物(异烟肼、利福平、乙胺丁醇和链霉素)联合用药时显示出协同或增强作用,尤其与利福平联合时,在极低浓度下,SQ109 对结核分枝杆菌生长的抑制率超过 99%,更重要的是对耐利福平菌株同样有效。小鼠模型数据显示,SQ109 10 mg/kg 的给药方案杀菌效果优于乙胺丁醇 100 mg/kg 的给药方案。目前,SQ109处于 II 期临床试验[29-31]。

图4 SQ109 的结构
5 吩嗪类抗结核药物
吩嗪类抗结核药物的典型代表是氯法齐明(CFM),氯法齐明可缩短多药耐药结核的治疗周期,但在随后使用过程中发现,氯法齐明很容易在脂质组织和器官中蓄积而造成皮肤变色,因此限制了它的临床应用[32]。为了解决这个问题,研究者们设计合成了一系列吩嗪类化合物,并从中筛选出了TBI-166(图 5)。研究结果显示,TBI-166 显示出了比氯法齐明更好的抗结核活性,同时又能够改善皮肤变色问题,目前,TBI-166 已进入临床前研究阶段,有望成为新一代吩嗪类抗结核药物[33-35]。
6 咪唑并吡啶氨基类抗结核药物
咪唑并吡啶氨基化合物 Q203(图 6),通过封闭呼吸细胞色素 bc1 复合体(为维持质子梯度和 ATP 的合成所必需)来抑制细菌的生长。Q203 抗菌活性潜力高,MIC 可达到纳摩尔级别。小鼠模型试验数据显示,Q203 具有良好的药代性质和安全性,是一个非常具有开发前景的抗结核候选物[36]。
7 苯并噻嗪酮类抗结核药物
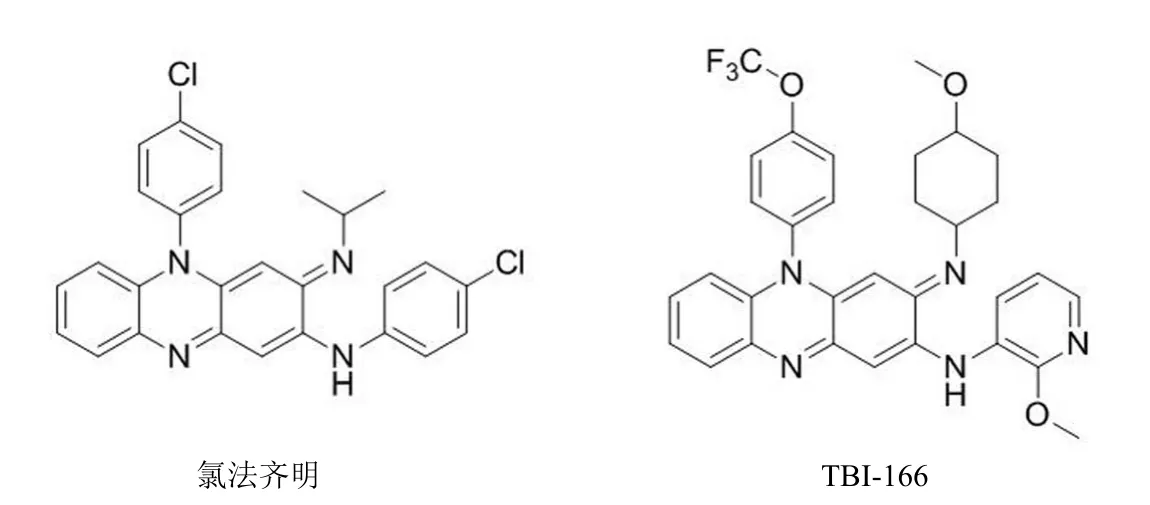
图5 氯法齐明和 TBI-166 的结构

图6 Q203 的结构
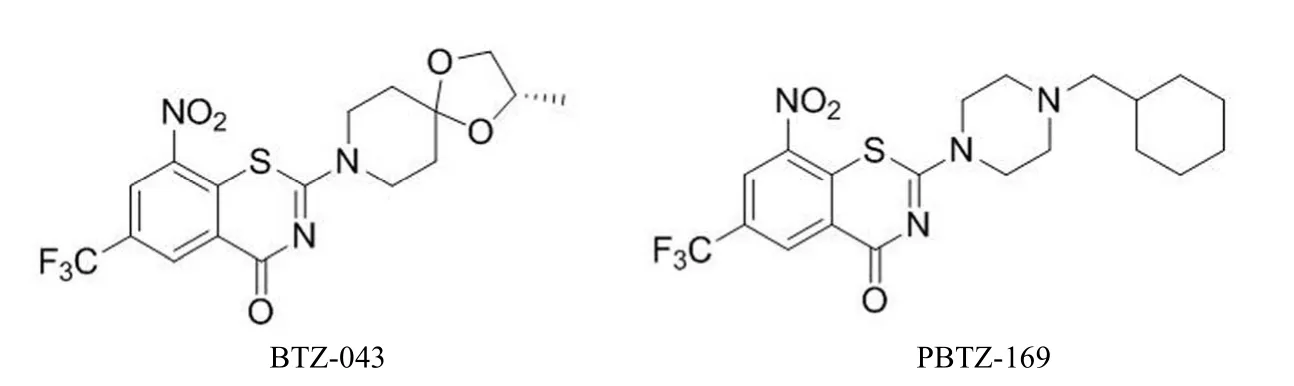
图7 BTZ-043 和 PBTZ-169 的结构
苯并噻嗪酮类(BTZ)化合物主要包括两个处于临床前研究的化合物 BTZ-043 和 PBTZ-169(图 7)。该类化合物通过抑制 MTB 中的 DprE1 酶,阻止十异戊二烯磷酸阿拉伯糖(一种细胞壁阿拉伯多糖生物合成的必要前体)的合成,使其细胞壁溶解,最终导致 MTB 死亡。苯并噻嗪酮类化合物对快速生长复制期的 MTB 杀灭效果优于休眠期的MTB[37]。BTZ-043 对临床分离的多重耐药及广泛耐药菌株均有活性,其抗结核分枝杆菌 H37Rv 的 MIC 为 1 ng/ml,而异烟肼对 MTB 的 MIC 为 0.02 ~ 0.2 μg/ml。PBTZ-169是新一代苯并噻嗪酮类化合物,抗结核活性是 BTZ-043 的3 ~ 7 倍,其水溶性也较前者有了很大的提高,PBTZ-169 显示出更加优良的抗结核活性[38]。
8 氟喹诺酮类抗结核药物
氟喹诺酮类(fuoroquinolones,FQs)药物中环丙沙星(CPLX)、氧氟沙星(OFLX)、左氧氟沙星(LVLX)、加替沙星(GTLX)、司帕沙星(SPLX)、莫西沙星(MXLX)、格林沙星(GRN)、西他沙星(STFX)均具有抗 MTB 活性。该类药物主要通过抑制 DNA 促旋酶对 MTB 发挥作用。
目前对氟喹诺酮类药物的研究主要分为两个方向:①继续对已上市氟喹诺酮类药物进行结构修饰得到新 FQs 类修饰物;②研究结构变幅更大的新型 2-吡啶酮(2-pyridones)化合物,开发新一代的 FQs 类药物。
莫西沙星和加替沙星为近年上市的第四代 8-位甲氧基FQs 类药物,因具有较好的抗 MTB 活性和较低的 MIC值,现作为 TB 短程治疗候选药物,正处于 III 期临床试验[39-40]。

图8 DC-159a 的结构
DC-159a(图 8)是一种新型 8-甲氧基 FQs 类化合物,对药物敏感和喹诺酮类多重耐药菌株有效,其抗 MTB 活性比莫西沙星、左氧氟沙星高。DC-159a 抗结核分枝杆菌的 MIC 为 0.06 μg/ml,活性分别是莫西沙星、左氧氟沙星的 4 倍和 8 倍;抗多重耐药菌的 MIC 为 0.5 μg/ml,而莫西沙星、左氧氟沙星则分别为 4、16 μg/ml[41]。在应用于MTB 及其他常见细菌感染中,DC-159a 比其他喹诺酮类药物筛选出耐药菌的几率更小。小鼠感染模型数据显示,DC-159a 用莫西沙星的一半剂量,便可达到同莫西沙星一样的抗 TB 活性,DC-159a 是新一代比较有潜力的 FQs类抗结核药物,目前处于临床前研究阶段[42]。
9 新型利福霉素类抗结核药物
利福霉素类药物主要有利福平、利福定、利福布汀、利福喷汀等,其中利福平仍是最经典的抗 TB 药物[43]。该类药物是细菌 DNA 依赖 RNA 聚合酶(DDRP)抑制剂,通过抑制细菌 DDRP 而阻止 mRNA 合成,最终导致细菌死亡。目前,研究较多的新型利福霉素类衍生物主要有利福美坦和利福拉齐(图 9)。利福美坦为新的高效、长效连氮甲基利福霉素类衍生物,与利福平相比,利福美坦抗 MTB 活性更强,动物体内 t1/2更长,对利福平耐药 MTB 具有特殊活性。利福美坦安全性与药动学性质均优于利福平,现处于 III 期临床试验[44-45]。利福拉齐的抗菌活性优秀,活性比利福平强 16 ~ 25 倍,t1/2长,可用于缩短 TB 疗程。遗憾的是,利福拉齐在 II 期临床试验中显示出一定毒性而导致开发停止[46]。

图9 利福美坦和利福拉齐的结构
10 其他具有开发前景的抗结核药物
近几年,在抗结核领域还出现了很多其他具有抗结核潜力的化合物,包括:吡咯类衍生物中的 sudoterb(LL-3858)、BM-212;开普拉霉素核苷类天然抗生素中的移位酶 1 (TL-1)抑制剂 SQ641;肽脱甲酰酶抑制剂中的 BB3497、PDF709、PDF611;天然来源的新型抗结核抗生素硫内酯霉素;烷磺酸基乙酸胺类中的辛磺酰基乙酰胺;RNA 多聚酶抑制剂中的黏派洛宁 B、克拉派洛宁 A 以及从植物与海洋生物等提取的抗结核活性成分等。
11 结语
近年来,新型抗结核药物的研发取得了显著成果。其中,最引人注意的是首个被 FDA 批准上市用于治疗耐多药结核的药物贝达喹啉以及硝基咪唑类抗结核药物中的delamanid;另外,化合物 PA-824、TBA-354、SQ109、Q203以及 BM-212、硫内酯霉素等均表现出较强的抗结核活性,是比较有潜力的抗 TB 候选药物,这些抗结核药物及候选物为结核病的治疗提供了新方案,尤其使多重耐药、广泛耐药结核的有效治疗以及疗程的缩短成为可能,为人类有效控制结核病奠定了基础。
[1] Global tuberculosis report 2014. World Health Organization, 2014. (2014-10-22) [2016-03-20]. http://reliefweb.int/report/world/globaltuberculosis-report-2014.
[2] Koul A, Vranckx L, Dhar N, et al. Delayed bactericidal response of Mycobacterium tuberculosis to bedaquiline involves remodelling of bacterial metabolism. Nat Commun, 2014, 5:3369.
[3] Haagsma AC, Abdillahi-Ibrahim R, Wagner MJ, et al. Selectivity of TMC207 towards mycobacterial ATP synthase compared with that towards the eukaryotic homologue. Antimicrob Agents Chemother,2009, 53(3):1290-1292.
[4] Dhillon J, Andries K, Phillips PP, et al. Bactericidal activity of the diarylquinoline TMC207 against Mycobacterium tuberculosis outside and within cells. Tuberculosis (Edinb), 2010, 90(5):301-305.
[5] Centers for Disease Control and Prevention. Provisional CDC guidelines for the use and safety monitoring of bedaquiline fumarate (Sirturo) for the treatment of multidrug-resistant tuberculosis. MMWR Recomm Rep, 2013, 62(RR-09):1-12.
[6] Kwon YS, Jeong BH, Koh WJ. Tuberculosis: clinical trials and new drug regimens. Curr Opin Pulm Med, 2014, 20(3):280-286.
[7] Singh R, Manjunatha U, Boshoff HI, et al. PA-824 kills nonreplicating Mycobacterium tuberculosis by intracellular NO release. Science,2008, 322(5906):1392-1395.
[8] Stover CK, Warrener P, Vandevanter DR, et al. A small-molecule nitroimidazopyran drug candidate for the treatment of tuberculosis. Nature, 2000, 405(6789):962-966.
[9] Baker WR, Shaopei C, Keeler EL. Nitroimidazole antibacterial compounds and methods of use thereof: Europe, EP0866793. 2004-10-27.
[10] Lenaerts AJ, Gruppo V, Marietta KS, et al. Preclinicaltesting of the nitroimidazopyran PA-824 for activity against Mycobacterium tuberculosis in a series of in vitro and invivo models. Antimicrob Agents Chemother, 2005, 49(6):2294-2301.
[11] Boshoff HI, Barry CE 3rd. Tuberculosis - metabolism and respiration in the absence of growth. Nat Rev Microbiol, 2005, 3(1):70-80.
[12] Upton AM. TBA-354: a next generation nitroimidazole for treatment of drug sensitive and drug-resistant tuberculosis//52nd Interscience Conference on Antimicrobial Agents and Chemotherapy, San Francisco, CA, USA, 2012.
[13] Upton AM, Cho S, Yang TJ, et al. In vitro and in vivo activities of the nitroinidazoleTBA-354against Mycobacteriun tuberculosis. Antimicrob Agents Chemother, 2015, 59(1):136-144.
[14] Gler MT, Skripconoka V, Sanchez-Garavito E, et al. Delamanid for multidrug-resistant pulmonary tuberculosis. N Engl J Med, 2012,366(23):2151-2160.
[15] Matsumoto M, Hashizume H, Tomishige T, et al. OPC-67683, a nitro-dihydro-imidazooxazole derivative with promising action against tuberculosis in vitro and in mice. PLoS Med, 2006, 3(11):2131-2144.
[16] Tomioka H. Development of new antituberculous agents based on new drug targets and structure-activity relationship. Expert Opin Drug Discov, 2008, 3(1):21-49.
[17] Tomioka H, Tatano Y, Yasumoto K, et al. Recent advances in antituberculous drug development and novel drug targets. Expert Rev Resp Med, 2008, 2(4):455- 471.
[18] Sotgiu G, Centis R, D'Ambrosio L, et al. Efficacy, safety and tolerability of linezolid containing regimens in treating MDR-TB and XDR-TB: systematic review and meta-analysis. Eur Respir J, 2012,40(6):1430-1442.
[19] Jankowski A, Stefanik W. Linezolid--novel antibiotic for the treatment of gram-positive bacterial infections. Wiad Lek, 2006, 59(9-10):727-731.
[20] Jadhavar PS, Vaja MD, Dhameliya TM, et al. Oxazolidinones as anti-tubercular agents: discovery, development and future perspectives. Curr Med Chem, 2015, 22(38):4379-4397.
[21] Grosset JH, Singer TG, Bishai WR. New drugs for the treatment of tuberculosis: hope and reality. Int J Tuberc Lung Dis, 2012,16(8):1005-1014.
[22] Barbachyn MR, Hutchinson DK, Brickner SJ, et al. Identification of a novel oxazolidinone (U-100480) with potent antimycobacterial activity. J Med Chem, 1996, 39(3):680-685.
[23] Gravestock MB. Oxazolidinone derivatives, process for their preparation and pharmaceutical compositions containing them: U S A,6617339. 2003-09-09.
[24] Burak E, Bortolon E, Molstad D, et al. Radezolid, a novel oxazolidinone, accumulates in infected thigh tissue//49th Interscience Conference on Antimicrobial Agents and Chemotherapy, San Francisco, CA, USA: 2009. http://melinta.com/wp-content/uploads/ 2015/08/Rib-X_Radezolid_ICAAC-2009_A1-1938.pdf.
[25] Kanafani ZA, Corey GR. Tedizolid (TR-701): a new oxazolidinone with enhanced potency. Expert Opin Investig Drugs, 2012, 21(4):515-522.
[26] Zhu T, Friedrich SO, Diacon A, et al. Population pharmacokinetic/ pharmacodynamic analysis of the bactericidal activities ofsutezolid (PNU-100480) and its major metabolite against intracellular Mycobacterium tuberculosis in ex vivo whole-blood cultures of patients with pulmonary tuberculosis. Antimicrob Agents Chemother,2014, 58(6):3306-3311.
[27] Zumla AI, Gillespie SH, Hoelscher M, et al. New antituberculosisdrugs, regimens, and adjunct therapies: needs, advances, and future prospects. Lancet Infect Dis, 2014, 14(4):327-340.
[28] Tahlan K, Wilson R, Kastrinsky DB, et al. SQ109 targets MmpL3, a membrane transporter of trehalose monomycolate involved in mycolic acid donation to the cell wall core of Mycobacterium tuberculosis. Antimicrob Agents Chemother, 2012, 56(4):1797-1809.
[29] Sacksteder KA, Protopopova M, Barry CE 3rd, et al. Discovery and development of SQ109: a new antitubercular drug with a novel mechanism of action. Future Microbiol, 2012, 7(7):823-837.
[30] Nikonenko BV, Protopopova M, Samala R, et al. Drug therapy of experimental tuberculosis (TB): improved outcome by combining SQ109, a new diamine antibiotic, with existing TB drugs. Antimicrob Agents Chemother, 2007, 51(4):1563-1565.
[31] Sacksteder KA, Protopopova M, Barry CE 3rd, et al. Discovery and development of SQ109: a new antitubercular drug with a novel mechanism of action. Future Microbio, 2012, 7(7):823-837.
[32] Xu HB, Jiang RH, Xiao HP. Clofazimine in the treatment of multidrug-resistant tuberculosis. Clin Microbiol Infect, 2012, 18(11):1104-1110.
[33] Li D, Sheng L, Liu X, et al. Determination of TBI-166, a novel antituberculotic, in rat plasma by liquid chromatography-tandem mass spectrometry. Chromatographia, 2014, 77(23):1697-1703.
[34] Lu Y, Zheng M, Wang B, et al. Clofazimine analogs with efficacy against experimental tuberculosis and reduced potential for accumulation. Antimicrob Agents Chemother, 2011, 55(11):5185-5193.
[35] Zhang D, Lu Y, Liu K, et al. Identification of less lipophilic riminophenazine derivatives for the treatment of drug-resistant tuberculosis. J Med Chem, 2012, 55(19):8409-8417.
[36] Pethe K, Bifani P, Jang J, et al. Discovery of Q203, a potent clinical candidate for the treatment of tuberculosis. Nat Med, 2013, 19(9):1157-1160.
[37] Makarov V, Manina G, Mikusova K, et al. Benzothiazinones kill Mycobacterium tuberculosis by blocking arabinan synthesis. Science,2009, 324(5928):801-804.
[38] Zumla AI, Gillespie SH, Hoelscher M, et al. New antituberculosis drugs, regimens, and adjunct therapies: needs, advances, and future prospects. Lancet Infect Dis, 2014, 14(4):327-340.
[39] van den Boogaard J, Kibiki GS, Kisanga ER, et al. New drugs against tuberculosis: problems, progress, and evaluation of agents in clinical development. Antimicrob Agents Chemother, 2009, 53(3):849-862.
[40] Conde MB, Efron A, Loredo C, et al. Moxifloxacin versus ethambutol in the initial treatment of tuberculosis: a double-blind, randomised,controlled phase II trial. Lancet, 2009, 373(9670):1183-1189.
[41] Disratthakit A, Doi N. In vitro activities of DC-159a, a novel fluoroquinolone, against mycobacterium species. Antimicrob Agents Chemother, 2010, 54(6):2684-2686.
[42] Ahmad Z, Minkowski A, Peloquin CA, et al. Activity of the fluoroquinolone DC-159a in the initial and continuation phases of treatment of murine tuberculosis. Antimicrob Agents Chemother, 2011,55(4):1781-1783.
[43] Lu Y, Duan LS. Trends and advances in antituberculosis agents. Chin J Antibiot, 2005, 30(4):250-253. (in Chinese)陆宇, 段连山. 抗结核药物的研究进展和发展趋势. 中国抗生素杂志, 2005, 30(4):250-253.
[44] Tu XY, Zhang JX, Cao SH. Progress in studies of rifamycin derivatives. World Notes Antibiot, 2008, 29(6):255-261. (in Chinese)土欣瑜, 张静霞, 曹胜华. 利福霉素类衍生物的研究进展. 国外医药抗生素分册, 2008, 29(6):255-261.
[45] Chen GL, Tan GL, Sun PH. Research and development of anti-tuberculosis drugs. Prog Pharm Sci, 2004, 28(12):529-537. (in Chinese)陈国良, 谭国良, 孙平华. 抗结核药物的研究与开发. 药学进展,2004, 28(12):529-537.
[46] Portero JL, Rubio M. New anti-tuberculosis therapies. Expert Opin Ther Patents, 2007, 17(6):617-637.
10.3969/j.issn.1673-713X.2016.04.014
十二五“重大新药创制”科技重大专项(2014ZX09201001-011);国家自然科学基金面上项目(81473098)
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所合成室
王菊仙,Email:imbjxwang@163.com
2016-04-22

