胞外囊泡在肿瘤发生发展中的研究进展
夏鹏,黄晶
·综述·
胞外囊泡在肿瘤发生发展中的研究进展
夏鹏,黄晶
胞外囊泡(extracellular vesicles,EVs)是释放到细胞外的膜性小囊泡,是传递细胞间信号的一种新方式,在生理或病理情况下发挥重要调节作用。几乎所有类型的细胞均可以产生并释放 EVs,尤其是肿瘤细胞[1-2]。越来越多的证据表明,在肿瘤的发生和发展过程中,肿瘤来源的胞外囊泡能够通过传递囊泡中的内容物来改变受体细胞的生物学功能,比如导致免疫抑制,诱导血管生成,甚至促进肿瘤转移[3-4]。近年来,关于胞外囊泡与肿瘤关系的研究越来越受到人们的关注。
1 胞外囊泡的概述
Chargaff 和 West[5]在 1946 年发现胞外囊泡作为促凝血的血小板微颗粒存在于健康人的血浆中。之后,又发现直肠癌微绒毛细胞可以释放质膜囊泡[6]。直到 1987 年,Johnstone 等[7]观察到绵羊网织红细胞在成熟过程中会释放一种囊泡状结构的小体,并命名为外泌体。随后发现多种细胞均可产生外泌体,如树突状细胞、血小板、神经元、小肠上皮细胞以及肿瘤细胞等。近年来,随着分子生物学技术的发展,更多种类的胞外囊泡被发现。在静息状态和(或)活化状态下,几乎所有类型的细胞都能组成性地和(或)诱导性地产生并释放 EVs,包括正常细胞和肿瘤细胞。而且 EVs已被发现存在于多种体液中,包括血液、尿液、唾液、乳汁等[8]。根据细胞或组织来源的不同,EVs 可被分为若干种,如前列腺来源的 EVs 称为前列腺小体,肿瘤来源的 EVs称为肿瘤小体。根据产生机制的不同,EVs 可被分为以下三大类:外泌体、微囊泡和凋亡小体(图 1)。
外泌体是由多囊泡小体和细胞质膜融合后被细胞释放出来的囊泡状结构,直径为 40 ~ 100 nm;微囊泡是由细胞质膜脱落或出芽后被细胞释放出来的囊泡状结构,直径为100 ~ 1000 nm;凋亡小体是由程序性死亡的细胞通过出泡的方式产生的,内含有高度致密的细胞核碎片的囊泡状结构,直径为 500 ~ 2000 nm(图 1)。新近报道,某些肿瘤细胞能释放直径非常大的胞外囊泡(1 ~ 10 μm),称之为巨型肿瘤小体;这是一群比普通 EVs 大十倍以上的新型胞外囊泡,其显著特点就是产生这种 EVs 的母体细胞被证明是具有高度转移能力的肿瘤细胞[9]。尽管 EVs 有多种分类,但是迄今为止人们还未对其具体而精确的分类标准达成共识,并且目前仍无法筛选出能区分出这几种 EVs 亚群的分子标志物[10]。
EVs 主要由外层的脂质双分子层和包绕其中的内容物组成。EVs 具有脂质双分子层包裹的囊泡状结构,这犹如在大海中航行的货船,它能携带诸多“货物”,包括蛋白(如细胞因子、膜受体蛋白、细胞骨架蛋白、热休克蛋白等),核酸(如 DNA、mRNA、小干扰 RNA、长非编码 RNA 等)和脂类[11]。依据蛋白组成的特异性,可对分离纯化的 EVs进行鉴定。近期 EVs 中的核酸成分也受到研究者们的高度重视,其中 EVs 中的 mRNA 进入细胞质后能被直接翻译成蛋白质,microRNA(miRNA)可定向调节 mRNA 的功能,shuttle RNA 可影响受体细胞蛋白质的产生[12]。
早在 30 年前,研究者们就发现 EVs 能够被受体细胞摄入胞内,并引发一系列生物学效应。目前,EVs 已被当作一个功能强大的细胞间通讯的媒介,携带和传递重要的信号分子,影响细胞的生理状态并与多种疾病发生发展密切相关。多项临床研究发现,与健康人相比,肿瘤患者外周血或者其他体液中含有更高水平的循环形式的 EVs[13]。这些来自于肿瘤患者或者荷瘤实验动物的 EVs 中含有大量的肿瘤相关的标志分子,如糖类抗原 19-9(CA 19-9)、小鼠酪氨酸酶相关蛋白 2(TYRP 2)、Melan-A、突变基因 K-Ras 以及活化形式的表皮生长因子受体(EGFR)[14-15]。更多实验数据证明,肿瘤来源的 EVs 能够通过旁分泌或者内分泌的形式与近处或远处正常组织细胞发生“相互对话”,促进肿瘤的发生和发展[16]。
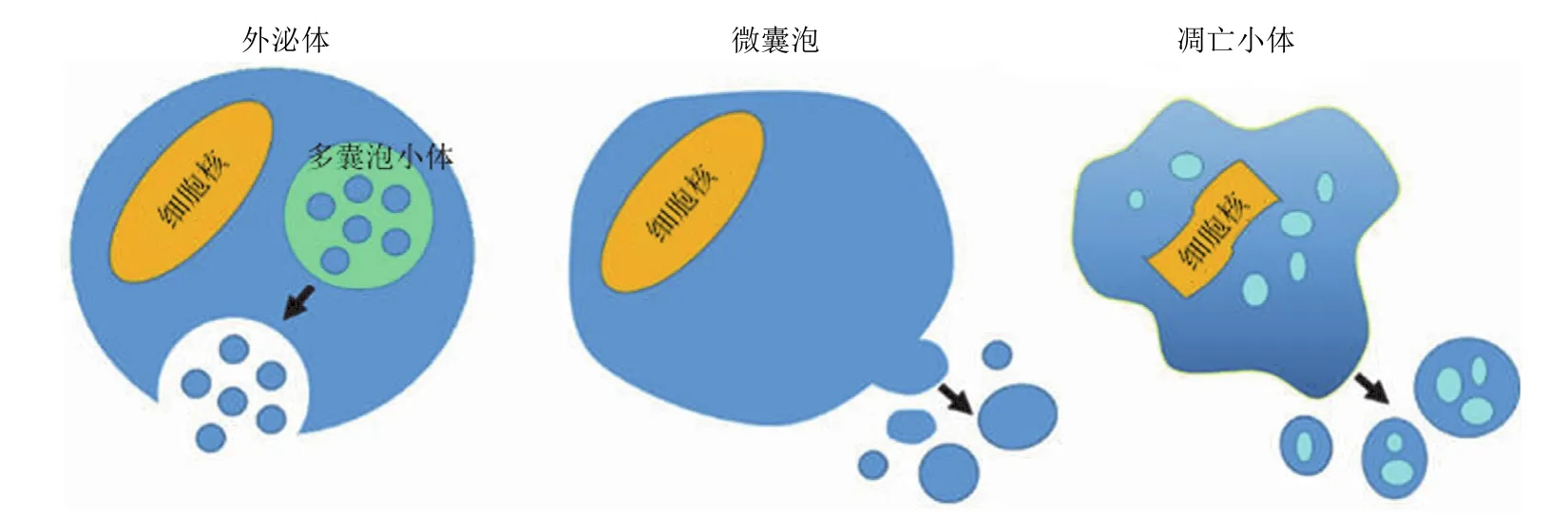
图1 胞外囊泡的主要分类及其特点
2 胞外囊泡与肿瘤发生
最初从肿瘤细胞分泌获得的外泌体,因其包含有肿瘤抗原,可以通过 APC 交叉呈递给细胞毒性 T 淋巴细胞,产生肿瘤杀伤作用,因此最初研究围绕外泌体的免疫刺激作用,探讨其作为潜在有效的肿瘤疫苗。然而,研究者们又发现,当正常细胞出现基因突变时,肿瘤细胞来源的外泌体可通过膜融合将突变信息传递给其他正常细胞,导致原癌基因激活、抗凋亡基因表达,促进肿瘤的发生。Melo 等[17]报道,乳腺癌来源的外泌体包含的 miRNA 能在 RNA 诱导的沉默复合体协助下,不依赖细胞,在体外即能将前体 miRNA转变成促肿瘤的成熟形式的 miRNA。正是由于肿瘤来源的外泌体包含了帮助完成这一转化的关键分子 Dicer、argonaut protein 2(Ago 2)和 TAR RNA-binding protein (TRBP),使得正常的上皮细胞被重编程改变整个转录组,从而表达肿瘤相关蛋白进而恶变成肿瘤细胞,导致肿瘤的发生。同样在另一个研究中,Boelens 等[18]发现将基质细胞来源的外泌体转入乳腺癌细胞能刺激模式识别受体 RIG-I 并激活信号转导及转录激活因子 1(signal transducer and activator of transcription-1,STAT-1)依赖的抗病毒信号通路以及 Notch 信号通路,从而会增加乳腺癌患者体内肿瘤细胞对放疗的耐受性,并且揭示外泌体中引发此放疗耐受效应的物质本质就是存在于外泌体中的 RNA 成分。类似的,Skog 等[19]近期研究结果也提示神经胶质瘤细胞产生的含有 mRNA 及 miRNA 的外泌体在被大脑微血管内皮细胞摄入后促进肿瘤邻近微血管发生小血管化,有利于肿瘤的进一步生长和转移。这就提示肿瘤来源的 EVs 能够利用其包含的 miRNA 或 RNA 使得受体细胞发生肿瘤转化或者促进肿瘤的发生。
Antonyak 等[20]证实利用两株人肿瘤细胞系(MDA-MB-231 乳腺癌细胞系和 U87 神经胶质瘤细胞系)产生的微囊泡能促使正常的成纤维细胞和上皮细胞转化成肿瘤细胞。而完成这一转变需要肿瘤来源的微囊泡中两个关键蛋白分子:组织型谷氨酰胺转氨酶和纤维黏连蛋白,肿瘤来源的微囊泡中这两个分子会共同激活受体细胞的丝裂原信号通路,使正常细胞获得类似肿瘤细胞的特征(如锚定-非依赖生长和极强的细胞生存能力)。同时,Al-Nedawi等[21]的研究也表明,早期神经胶质瘤患者只有少数肿瘤细胞表达致瘤性的表皮细胞生长因子受体 vIII(EGFRvIII),然而进入进展期后大部分的胶质瘤细胞却获得被转化的肿瘤细胞表型,其机制是由于荷载有 EGFRvIII 蛋白的 EVs从这些少数细胞分泌后会被其余大多数正常细胞共享,导致受体细胞丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)和 Akt 信号通路的激活以及 EGFRvIII 调节基因(如 VEGF、Bcl-xL 和 p27)表达发生改变,引发受体细胞锚定非依赖生长能力增强,即发生了恶性转化。这就提示肿瘤来源的 EVs 能够利用其包含的蛋白分子使得受体细胞发生肿瘤转化,促进肿瘤的发生。
此外,Bergsmedh 等[22]研究也发现,肿瘤来源的凋亡小体能够将摄入该凋亡小体的正常成纤维细胞转变成失去接触抑制的肿瘤细胞。研究者利用荧光原位杂交分析发现肿瘤来源的凋亡小体的 DNA 在被吞噬到宿主细胞后被选择性扩增,进而使得整个体外培养的正常细胞群都被转化成肿瘤细胞,并且这些宿主细胞都是 p53 阴性的成纤维细胞,提示肿瘤来源的 EVs 能够利用其包含的 DNA 成分使得受体细胞发生肿瘤转化,促进肿瘤的发生。
3 胞外囊泡与肿瘤发展
肿瘤细胞来源的 EVs 可以同时进入淋巴系统和肿瘤组织中,通过释放细胞因子、与肿瘤抑制因子相互作用等方式,改变肿瘤微环境,作为信息载体参与肿瘤的发展过程。
3.1胞外囊泡与肿瘤增殖
肿瘤来源的 EVs 既可引起抗肿瘤免疫应答,又可在机体免疫应答过程中发挥负性调节作用,诱导免疫耐受,使肿瘤细胞逃避免疫监视,其作用机制与 EVs 含有的肿瘤相关抗原和免疫抑制分子相关。研究发现:人乳腺癌和胸膜间皮瘤细胞系的外泌体含有 NKG2D 配体,能够抑制 NK 细胞和 CD8+T 细胞的细胞毒作用,促进肿瘤生长;肿瘤细胞分泌的外泌体可诱导单核细胞转化为髓源性抑制细胞,阻止其向树突状细胞分化;胶质瘤来源的 EVs 可直接抑制 CD3ζ的表达,从而抑制 CD8+T 细胞的功能;黑色素瘤来源的包含 TNF-α 的外泌体可直接诱导 T 细胞凋亡[23]。此外,有研究显示,胶质细胞瘤来源的微颗粒可以促进肿瘤细胞的增殖;同样,肝癌细胞来源的 EVs 可以将一种 lncRNA 转移给其他肝癌细胞促进其增殖[24];Yang 等[25]也证实膀胱癌来源的 EVs 能够抑制肿瘤细胞的凋亡,促进其增殖。总之,EVs 与肿瘤细胞增殖关系密切,促进肿瘤的发展。
3.2胞外囊泡与肿瘤转移微环境的形成
EVs 与肿瘤转移密切相关,参与调节细胞表型转化、肿瘤侵袭和浸润,以及肿瘤血管生成等诸多过程。证实肿瘤来源的 EVs 能够促进肿瘤转移微环境形成的研究者归功于 Jung 等[26]。然而 Hoshino 等[27]的一项重磅研究发现,准备并形成肿瘤转移微环境的傀儡是摄入了肿瘤来源 EVs的器官常驻细胞,并且具有特定器官转移倾向性的肿瘤细胞之所以能特异性地转移到靶器官中,正是由于肿瘤来源的EVs 膜表面的整合素分子起到了关键性作用。肿瘤来源的EVs 膜表面的整合素分子类型与转移灶部位有类似于配体受体对应关系的组合:EVs 膜表面如果是 α6β4 和 α6β1则容易发生肺转移;EVs 膜表面如果是 αvβ5 则容易发生肝转移。另外一项动物实验中,无肿瘤的小鼠经过外源性给予肿瘤来源的 EVs,研究者惊奇地发现这些经过血液循环的 EVs 最后选择性地扎根于某些特定的组织器官,这与两百多年前肿瘤转移的种子土壤学说奠基人 Paget 所观察的现象有异曲同工之处。实验证实:包含有胰腺癌细胞产生的EVs 和胰腺癌细胞可溶性基质的条件培养基分别被注射到大鼠体内后,在胰腺癌最易发生转移的肝脏和骨组织中含有较高水平的肿瘤来源的 EVs;经过比较分析发现含有巨噬细胞迁移抑制因子(macrophage migration inhibitory factor,MIF)的 EVs 能促进肝脏 Kupffer 细胞分泌细胞因子TGF-β,TGF-β 又进一步作用于成纤维细胞,促进纤黏连蛋白的分泌,促进肿瘤细胞在肝脏的定植,从而促进肿瘤细胞倾向性地转移到肝脏[28]。研究证实,低转移的肿瘤细胞摄入高转移肿瘤细胞的 EVs 能使其发生低转移向高转移的转变,说明肿瘤来源的 EVs 确实可以影响肿瘤转移微环境的形成进而影响肿瘤的转移[29-30]。
肿瘤细胞来源的 EVs 也含有各种细胞因子,如血管内皮生长因子(vascular endothelial growth factor,VEGF)、纤维母细胞生长因子(fibroblast growth factor,FGF)等,可将其释放到细胞外,作用于内皮细胞膜表面受体,导致血管形成并促进肿瘤的迁移。Kim 等[31]研究表明,肿瘤细胞来源的 EVs 通过其携带的神经鞘磷脂在体内外实验中直接促进内皮细胞迁移、侵袭和形成管腔,促进新生血管形成。Hong 等[32]也报道结直肠癌细胞来源的 EVs 富含细胞周期相关 mRNA,可以直接促进内皮细胞增殖,可能形成新生肿瘤血管。同时,缺氧多形性胶质瘤细胞来源的外泌体中的蛋白质和 mRNA 在肿瘤微血管形成中发挥重要作用[33]。总之,EVs 可以改变受体细胞的生理状态甚至能影响受体细胞周围其他细胞的物质代谢或信号转导,并通过多条途径影响肿瘤转移微环境的形成,进而促进肿瘤的发展。
3.3胞外囊泡与能量代谢重编程
肿瘤细胞在不断生长增殖的时候是处在一个酸性条件下,葡萄糖运输和糖酵解在肿瘤状态下是被上调的,这样就造成肿瘤微环境的酸性代谢产物不断堆积导致酸中毒[34]。在酸中毒情况下,肿瘤细胞产生释放的 EVs 会增多,使肿瘤细胞间通过 EVs 的交互通讯更加频繁。Wang 等[35]研究发现,在乳腺癌细胞中,酸中毒增加了 EVs 的释放,并且被释放出来的 EVs 膜表面的 RAB22A(一种小 GTP 酶,其表达依赖于 HIF)表达量也会显著升高。同时,体外实验结果也显示 RAB22A 表达升高能进一步促进细胞的局部黏附和侵袭能力。因此,处于酸中毒条件下的肿瘤细胞更容易产生 EVs,从而增强细胞间的通讯,最终推动了肿瘤的进展。
3.4其他
关于 EVs 和肿瘤发展的机制还有其他多个方面的研究与猜测,如肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)表型的获得、肿瘤耐药性的发生等[36]。不难发现,大部分关于 EVs 和肿瘤关系的研究都显示肿瘤来源的 EVs 主要功能是促进肿瘤发生发展的。但是最近也不乏有相反作用研究结果的报道,如 Gabriel 等[37]报道从多种肿瘤细胞系获得的 EVs 和从临床前列腺癌患者血浆获得的 EVs 中发现有功能活性的经典抑癌蛋白 PTEN (phosphatase and tensin homolog),并且该含有 PTEN 蛋白的 EVs 确实能抑制受体肿瘤细胞(缺乏 PTEN 蛋白的细胞)的增殖能力,发挥肿瘤抑制作用。
4 展望
总而言之,以上研究强有力证实了肿瘤来源的 EVs 的确与肿瘤发生发展关系密切,并且大部分研究证实肿瘤来源的 EVs 主要促进肿瘤发生发展,这就提示 EVs 可以作为临床诊断治疗肿瘤的有效突破口。近几年,EVs 研究领域迅速发展,已经成为国际研究热点,尤其近几年在国际上十分热门的液体活检技术的基本支柱之一就是肿瘤来源的EVs[38-39];此外,EVs 本身就是一个良好的物质运输载体,利用这个生物兼容性极好的运输载体,通过生物工程或者基因工程的方法可以将其装载肿瘤预防用的疫苗,肿瘤治疗用的化疗药物或者溶瘤病毒,甚至是基因治疗用的基因产物[40],提示临床背景下的 EVs 研发尤为重要。由此可见,肿瘤来源的 EVs 是一个极有前景的领域,更深层次的理解肿瘤来源的 EVs 与肿瘤发生发展的关系将对开阔肿瘤治疗视野,推进精准治疗进程有极其重要的意义。
[1] Yáñez-Mó M, Siljander PR, Andreu Z, et al. Biological properties of extracellular vesicles and their physiological functions. J Extracell Vesicles, 2015, 4:27066.
[2] Lai CP, Mardini O, Ericsson M, et al. Dynamic biodistribution of extracellular vesiclesin vivo using a multimodal imaging reporter. ACS Nano, 2014, 8(1):483-494.
[3] Colombo M, Raposo G, Théry C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annu Rev Cell Dev Biol, 2014, 30:255-289.
[4] Garcia-Olmo DC, Dominguez C, Garcia-Arranz M, et al. Cell-free nucleic acids circulating in the plasma of colorectal cancer patients induce the oncogenic transformation of susceptible cultured cells. Cancer Res, 2010, 70(2):560-567.
[5] Chargaff E, West R. The biological significance of the thromboplastic protein of blood. J Biol Chem, 1946, 166(1):189-197.
[6] De Broe M, Wieme R, Roels F. Leteer: Membrane fragments with koinozymic properties released from villous adenoma of the rectum. Lancet, 1975, 2(7946):1214-1215.
[7] Johnstone RM, Adam M, Hammond JR, et al. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). J Biol Chem, 1987,262(19):9412-9420.
[8] Sadovska L, Bajo-Santos C, Kalnina Z, et al. Biodistribution, uptake and effects caused by cancer-derived extracellular vesicles. J Circ Biomark, 2015, 4:2.
[9] Morello M, Minciacchi VR, de Candia P, et al. Large oncosomesmediate intercellular transfer of functional microRNA. Cell Cycle,2013, 12(22):3526-3536.
[10] Kanada M, Bachmann MH, Contag CH. Signaling by extracellular vesicles advances cancer hallmarks. Trends Cancer, 2016, 2(2):84-94.
[11] Kharaziha P, Ceder S, Li Q, et al. Tumor cell-derived exosomes: a message in a bottle. Biochim Biophys Acta, 2012, 1826(1):103-111.
[12] Lasser C, Eldh M, Lötvall J. Isolation and characterization of RNA-containing exosomes. J Vis Exp, 2012, (59):e3037.
[13] Muller L, Muller-Haegele S, Mitsuhashi M, et al. Exosomes isolated from plasma of glioma patients enrolled in a vaccination trial reflect antitumorimmuneactivityandmightpredictsurvival. Oncoimmunology, 2015, 4(6):e1008347.
[14] Kahlert C, Melo SA, Protopopov A, et al. Identification of double-stranded genomic DNA spanning all chromosomes with mutated KRAS and p53 DNA in the serum exosomes of patients with pancreatic cancer. J Biol Chem, 2014, 289(7):3869-3875.
[15] Al-Nedawi K, Meehan B, Kerbel RS, et al. Endothelial expression of autocrine VEGF upon the uptake of tumor-derived microvesicles containing oncogenic EGFR. Proc Natl Acad Sci U S A, 2009,106(10):3794-3799.
[16] Stec M, Szatanek R, Baj-Krzyworzeka M, et al. Interactions of tumour-derived micro(nano)vesicles with human gastric cancer cells. J Transl Med, 2015, 13:376.
[17] Melo SA, Sugimoto H, O'Connell JT, et al. Cancer exosomes perform cell-independent microRNA biogenesis and promote tumorigenesis. Cancer cell, 2014, 26(5):707-721.
[18] Boelens MC, Wu TJ, Nabet BY, et al. Exosome transfer from stromal to breast cancer cells regulates therapy resistance pathways. Cell,2014, 159(3):499-513.
[19] Skog J, Wurdinger T, van Rijn S, et al. Glioblastoma microvesicles transport RNA and proteins that promote tumour growth and provide diagnostic biomarkers. Nat Cell Biol, 2008, 10(12):1470-1476.
[20] Antonyak MA, Li B, Boroughs LK, et al. Cancer cell-derived microvesiclesinducetransformationbytransferringtissue transglutaminase and fibronectin to recipient cells. Proc Natl Acad Sci U S A, 2011, 108(12):4852-4857.
[21] Al-Nedawi K, Meehan B, Micallef J, et al. Intercellular transfer of the oncogenic receptor EGFRvIII by microvesicles derived from tumour cells. Nat Cell Biol, 2008, 10(5):619-624.
[22] Bergsmedh A, Szeles A, Henriksson M, et al. Horizontal transfer of oncogenes by uptake of apoptotic bodies. Proc Natl Acad Sci U S A,2001, 98(11):6407-6411.
[23] Liu Y, Gu Y, Cao X. The exosomes in tumor immunity. Oncoimmunology, 2015, 4(9):e1027472.
[24] Kogure T, Yan IK, Lin WL, et al. Extracellular vesicle-mediated transfer of a novel long noncoding RNA TUC339: a mechanism of intercellular signaling in human hepatocellular cancer. Genes Cancer,2013, 4(7-8):261-272.
[25] Yang L, Wu XH, Wang D, et al. Bladder cancer cell-derived exosomes inhibit tumor cell apoptosis and induce cell proliferation in vitro. Mol Med Rep, 2013, 8(4):1272-1278.
[26] Jung T, Castellana D, Klingbeil P, et al. CD44v6 dependence of premetastatic niche preparation by exosomes. Neoplasia, 2009, 11(10):1093-1105.
[27] Hoshino A, Costa-Silva B, Shen TL, et al. Tumour exosome integrins determine organotropic metastasis. Nature, 2015, 527(7578):329-335. [28] Mendoza M, Khanna C. Revisiting the seed and soil in cancer metastasis. Int J Biochem Cell Biol, 2009, 41(7):1452-1462.
[29] Luga V, Zhang L, Viloria-Petit AM, et al. Exosomes mediate stromal mobilization of autocrine Wnt-PCP signaling in breast cancer cell migration. Cell, 2012, 151(7):1542-1556.
[30] Ono M, Kosaka N, Tominaga N, et al. Exosomes from bone marrow mesenchymal stem cells contain a microRNA that promotes dormancy in metastatic cancer cells. Sci Signal, 2014, 7(332):ra63.
[31] Kim CW, Lee HM, Lee TH, et al. Extracellular membrane vesicles from tumor cells promote angiogenesis via sphingomyelin. Cancer Res, 2002, 62(21):6312-6317.
[32] Hong BS, Cho JH, Kim H, et al. Colorectal cancer cell-derived microvesicles are enriched in cell cycle-related mRNAs that promote proliferation of endothelial cells. BMC Genomics, 2009, 10:556.
[33] Kucharzewska P, Christianson HC, Welch JE, et al. Exosomes reflect the hypoxic status of glioma cells and mediate hypoxia-dependent activation of vascular cells during tumor development. Proc Natl Acad Sci U S A, 2013, 110(18):7312-7317.
[34] Berchem G, Noman MZ, Bosseler M, et al. Hypoxic tumor-derived microvesicles negatively regulate NK cell function by a mechanism involving TGF-β and miR23a transfer. Oncoimmunology, 2015,5(4):e1062968.
[35] Wang T, Gilkes DM, Takano N, et al. Hypoxia-inducible factors and RAB22A mediate formation of microvesicles that stimulate breast cancer invasion and metastasis. Proc Natl Acad Sci U S A, 2014,111(31):E3234-E3242.
[36] Gu J, Qian H, Shen L, et al. Gastric cancer exosomes trigger differentiation of umbilical cord derived mesenchymal stem cells to carcinoma-associated fibroblasts through TGF-β/Smad pathway. PLoS One, 2013, 7(12):e52465.
[37] Gabriel K, Ingram A, Austin R, et al. Regulation of the tumor suppressor PTEN through exosomes: a diagnostic potential for prostate cancer. PLoS One, 2013, 8(7):e70047.
[38] Brinton LT, Sloane HS, Kester M, et al. Formation and role of exosomes in cancer. Cell Mol Life Sci, 2015, 72(4):659-671.
[39] Cai X, Janku F, Zhan Q, et al. Accessing genetic information with liquid biopsies. Trends Genet, 2015, 31(10):564-575.
[40] Ran L, Tan X, Li Y, et al. Delivery of oncolytic adenovirus into the nucleus of tumorigenic cells by tumor microparticles for virotherapy. Biomaterials, 2016, 89:56-66.
10.3969/j.issn.1673-713X.2016.04.012
国家自然科学基金面上项目(81372254)
100191 北京大学医学部基础医学院免疫学系
黄晶,Email:huangjing82@bjmu.edu.cn
2016-05-31

