LAS共代谢降解菌的降解动力学研究
季瑞武,周 利,冉治霖,朱 佳
(1. 青岛理工大学 环境与市政工程学院,青岛 266033;2. 深圳信息职业技术学院 交通运输与环境学院,深圳 518172;3. 深圳职业技术学院建筑与环境工程学院,深圳 518055)
LAS共代谢降解菌的降解动力学研究
季瑞武1,周利1,冉治霖2,朱佳3
(1. 青岛理工大学 环境与市政工程学院,青岛 266033;2. 深圳信息职业技术学院 交通运输与环境学院,深圳 518172;3. 深圳职业技术学院建筑与环境工程学院,深圳 518055)
研究2株直链烷基苯磺酸钠(LAS)共代谢降解菌的降解动力学.分别对2株直链烷基苯磺酸钠共代谢降解菌克雷伯氏菌属(Klebsiella sp.)和肠杆菌属(Enterobacter sp.)进行研究,通过正交实验考察了其最佳降解条件,并进行降解动力学研究.当温度为30 ℃,pH值为7.5,装液量为50 mL时,最适合两株细菌降解LAS.其中菌株L-2在生长基质葡萄糖质量浓度为500 mg/L时,对50 mg/LLAS降解率为94.2%;菌株L-15在生长基质葡萄糖质量浓度为1 000 mg/L时,对50 mg/LLAS降解率为92.2%;当LAS质量浓度在25~100 mg/L范围内,2菌株降解反应符合一级动力学特征.本研究可为全基质生活污水处理LAS废水提供一定的理论依据.
LAS;生物降解;共代谢;动力学
Linear alkylbenzene sulfonates (LAS),它是一种阴离子表面活性剂,由于是合成洗涤剂的主要成分,在国内外已得到广泛应用[1-2].研究发现,好氧条件下LAS易生物降解,但经过较长降解时间后,仍然有20%~50%的残留[3].废水中的LAS会给环境带来巨大危害,它能够影响酶的活性,溶解微生物和无脊椎动物的生物膜,破坏蛋白质结构,危害动、植物的健康[4-7].因此,如何高效率地去除废水中LAS成为研究的热点.目前处理LAS的方法主要有物理分离、催化氧化和生物处理.其中生物处理法处理规模大,设备简单,成本低,应用广泛,是研究最多的一种方法[8-9].
本实验利用已经分离鉴定的2株细菌[10],通过正交实验,确定其最佳降解条件,并对不同质量浓度下的LAS降解进行了研究,分析了降解动力学特征,为全基质生活污水处理LAS提供一定的理论基础.
1 材料与方法
1.1菌种来源
以深圳某污水厂曝气池和二沉池污泥为菌源,分离得到了2株通过共代谢机制降解LAS的细菌,经过鉴定为克雷伯氏菌属(Klebsiella sp.)和肠杆菌属(Enterobacter sp.).
1.2培养基
无机盐培养基成分(g/L):MgSO4·7H2O 0.14,Ka2HPO40.43,KaCl0.06,FeSO4·7H2O 0.005,NH4Cl 0.75,LAS 0.05.蒸馏水定容1 L,调节pH=7.2.
1.3实验仪器
全温振荡器(HZQ-FX,哈尔滨东联电子技术有限公司);高压灭菌锅(HVE-50,日本 Hirayama)、正置荧光显微镜(BX51,日本奥林巴斯)、微量离心机(MIKRO 200R,德国Hettich)、荧光分光光度计(F-7000, 日本日立)、紫外分光光度计(UV-7504,上海欣茂仪器有限公司)、电子天平(BS-124S,德国赛多利斯)、恒温培养箱(MIR-254,日本三洋).
1.4实验方法
1.4.1LAS降解性能的影响因素实验
以无机盐培养基为基础,分别改变温度、pH、装液量、葡萄糖质量浓度,以1%接菌量接种培养基,将250 mL锥形瓶在转速为150 r/min摇床上振荡培养5 d,检测残留LAS质量浓度,计算菌株对LAS降解率.
1.4.2菌株降解动力学
在最优降解条件下,用Monod方程拟合菌株L-2与L-15对LAS降解速率.
1.4.3LAS质量浓度测定[11]
取1.5 mL菌体浓度OD600为1.0的培养液放入离心管中,8 000 r/min离心10 min后取上清液1 mL加入25mL比色管,取pH为10.6的氨-氯化铵缓冲溶液5 mL加入比色管中,添加去离子水至25 mL.以试剂空白为参比,在激发波长λex=230 nm,发射波长λem=290 nm处,测得荧光强度F,根据F值由标准曲线求得LAS质量浓度,计算LAS降解率.降解率计算公式为:
降解率=(C3-C2)/C1×100%
(1)
其中:C3为空白组培养一定时间后培养基中LAS质量浓度;C2为试验组培养一段时间后培养液中LAS质量浓度;C1为初始培养时LAS质量浓度.
2 结果分析
2.1LAS降解性能影响因素的正交实验
以温度(A)、pH(B)、装液量(C)、葡萄糖质量浓度(D)为因素进行正交试验,各因素均取3个水平,因素水平表见表1.
正交试验分析表2,3反映了细菌L-2与L-15在各因素水平下120 h后对LAS的降解率.

表1 正交试验各因素及其水平表

表2 L-2正交试验分析表
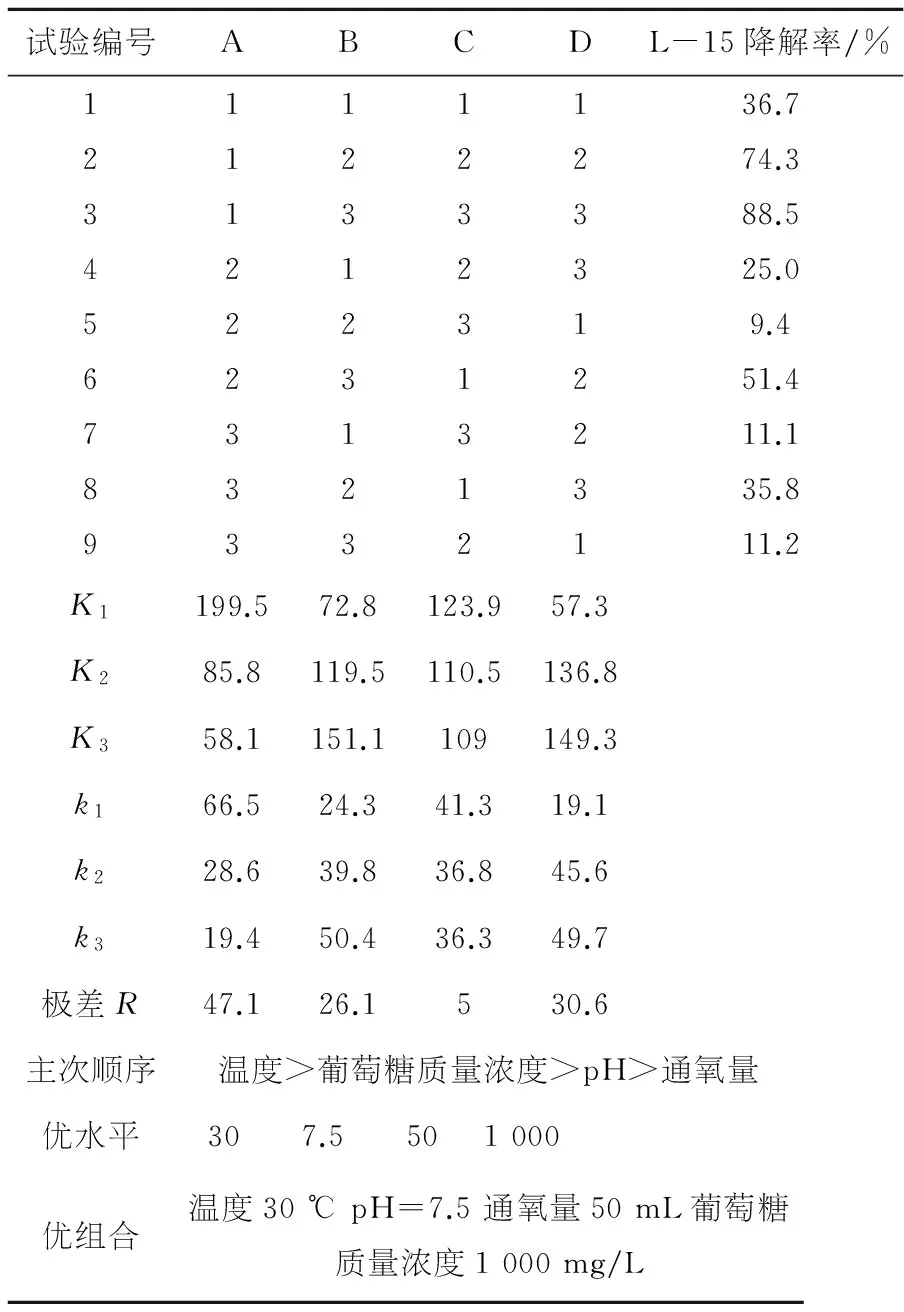
表3 L-15正交试验分析表
对于因素A,1、2、3号试验反映了A1对试验影响,4、5、6号试验反映了A2的影响,7、8、9号试验反映了A3的影响.A1、A2、A3对LAS降解率影响大小可以由kA1、kA2、kA3的值判断.由于kA1>kA2>kA3,所以A1为A因素的优水平.根据同样方法可知,B3、C1、D2为L-2细菌降解优水平,B3、C1、D3为L-15细菌降解优水平.对于L-2细菌,A1B3C1D2为最优水平组合,即温度为30 ℃,pH值为7.5,装液量为50 mL,葡萄糖质量浓度为500 mg/L;对于L-15细菌,A1B3C1D3为最优水平组合,即温度为30 ℃,pH值为7.5,装液量为50 mL,葡萄糖质量浓度为1 000 mg/L.极差R的大小可以判断各因素对降解率影响主次,对于L-2与L-15,R1>R4>R2>R3,所以温度对两株细菌降解LAS影响最大,其次是葡萄糖质量浓度和pH,装液量对降解率的影响最小.
2.2菌株共代谢降解动力学研究
对初始质量浓度为25、50、100 mg/L的LAS废水进行降解试验,结果如图1、 2所示.
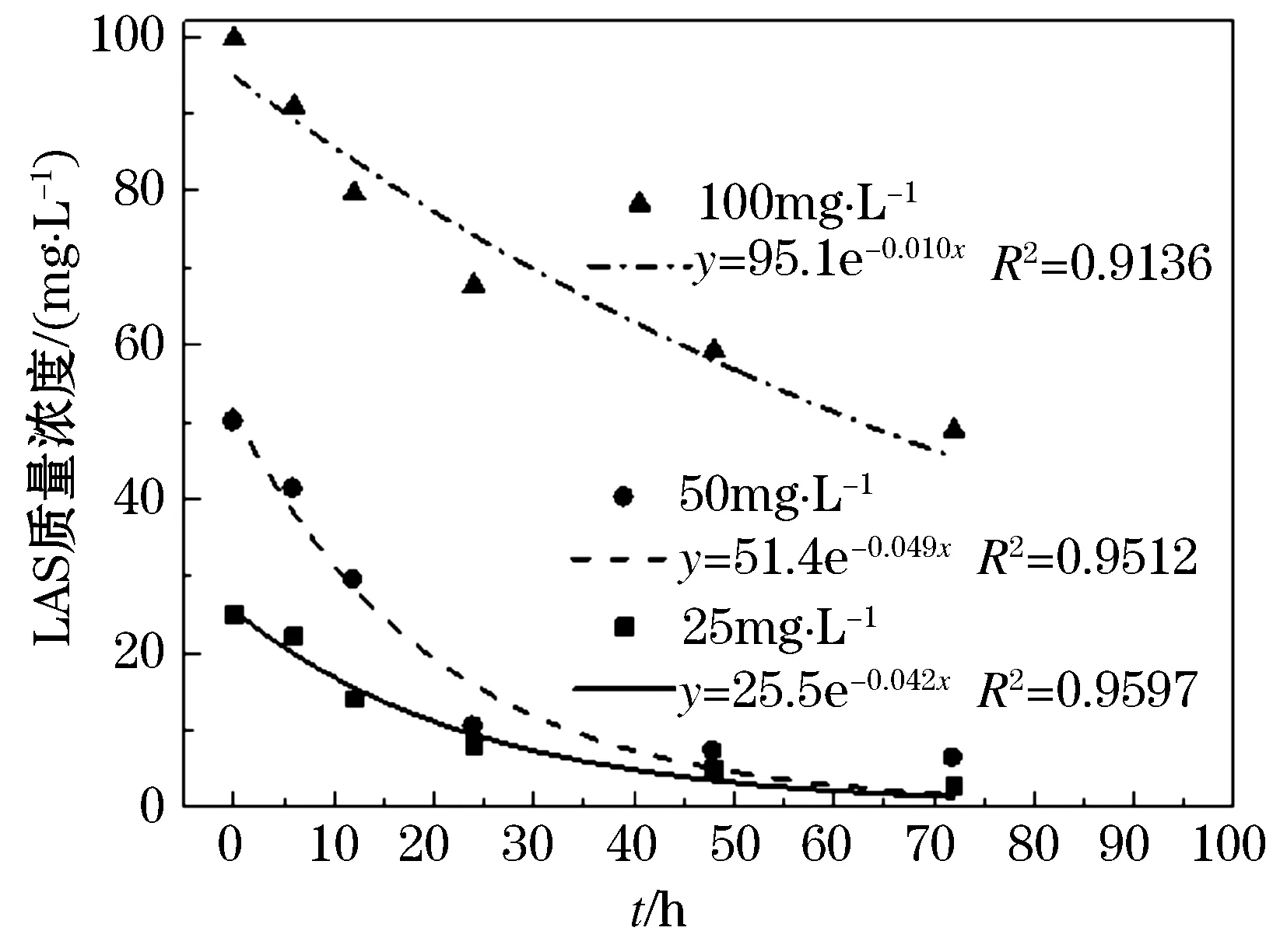
图1 优化条件下L-2降解不同质量浓度LAS过程
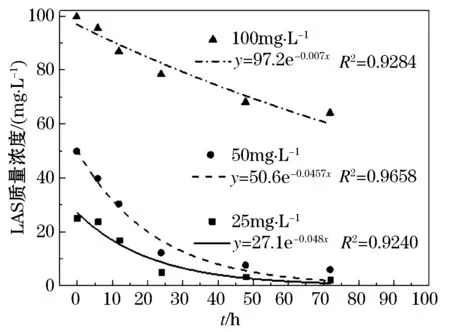
图2 优化条件下L-15降解不同质量浓度LAS过程
从图1、2中可以看出,LAS质量浓度呈指数型下降,在降解初始阶段,LAS质量浓度下降快,随后趋于平缓.各拟合曲线均符合一级反应动力学方程,一般反应过程可表示为:
V=VmC/(k+C)
(2)
其中:V为反应速率,t-1;Vm为最大反应速率,t-1;C是底物质量浓度,mg/L,k为半饱和速率常数,当降解反应遵循一级动力学方程时,C≪k时,方程(2)可以写为:
V=VmC/k
(3)
反应速率常数k0=Vm/k,由式(3)求得底物质量浓度与时间关系为:
C=C0e-k0t
(4)
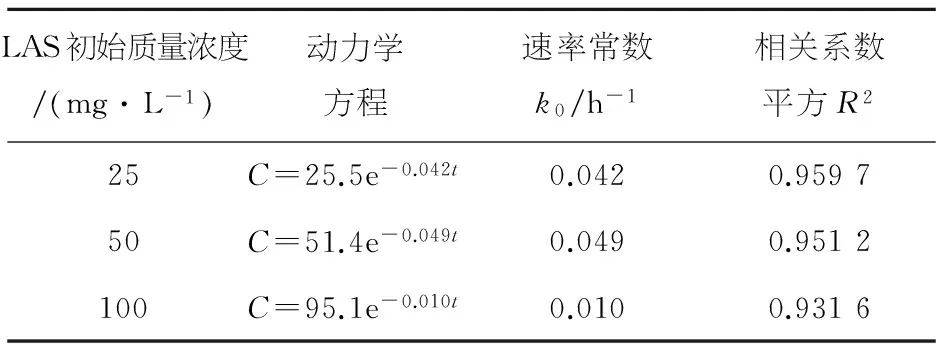
表4 L-2降解动力学方程
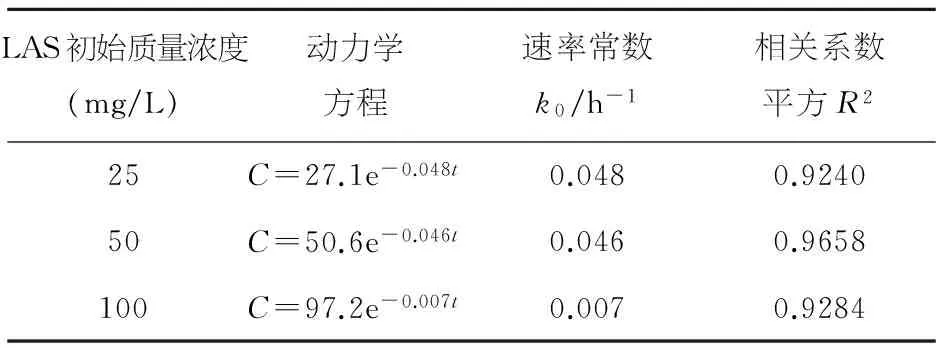
表5 L-15降解动力学方程
从表4、5可以看出,不同初始LAS质量浓度条件下,LAS降解率的实际值与理论值符合较好,拟合的相关系数平方R2均在0.92以上.对于菌株L-2,随着LAS初始质量浓度的升高,反应速率常数k0先升高后降低,当LAS初始质量浓度高于50 mg/L时,由于LAS的毒性作用,细菌生长繁殖会受到抑制,代谢活动减慢,因此降解速率下降,属于典型的抑制动力学.
3 结 论
1)正交实验表明细菌L-2的最适降解条件是温度30 ℃ ,pH=7.5,装液量50 mL,葡萄糖质量浓度500 mg/L;细菌L-15的最适降解条件是温度30 ℃,pH=7.5,装液量50 mL,葡萄糖质量浓度1 000 mg/L.
2)添加葡萄糖为生长基质的无机盐培养基中,在最适降解条件下,细菌L-2在120 h后对50 mg/L的LAS降解率为94.2%,细菌L-15在120 h后对50 mg/L的LAS降解率为92.2%.
3)当LAS质量浓度小于100 mg/L时,细菌L-2与L-15降解LAS反应符合一级动力学方程,LAS质量浓度较低时,反应速率常数较大,质量浓度较大时,由于LAS的毒害用,细菌生长繁殖受到抑制,降解反应速率降低.
[1]NOMURA Y, IKEBUKURO K, YOKOYAMA K,etal. Application of a linear alkylbenzene sulfonate biosensor to river water monitoring [J]. Biosensors and Bioelectronics, 1998, 13(9): 1047-1053.
[2]SCHLEHECK D, LECHNER M, SCHÖNENBERGER R,etal. Desulfonation and degradation of the disulfodiphenylethercarboxylates from linear alkyldiphenyletherdisulfonate surfactants [J]. Applied and Environmental Microbiology, 2003, 69(2): 938-944.
[3]MUNGRAY A K, KUMAR P. Fate of linear alkylbenzene sulfonates in the environment: a review [J]. International Biodeterioration & Biodegradation, 2009, 63(8): 981-987.
[4]JENSEN J. Fate and effects of linear alkylbenzene sulphonates (LAS) in the terrestrial environment [J]. Science of the Total Environment, 1999, 226(2): 93-111.
[5]BRAGADIN M, PERIN G, RACCANELLI S,etal. The accumulation in lysosomes of the anionic detergent linear alkylbenzene sulfonate [J]. Environmental Toxicology andChemistry, 1996, 15(10): 1749-1751.
[7]DUARTE I C S, OLIVEIRA L L, SAAVEDRA N K,etal. Treatment of linear alkylbenzene sulfonate in a horizontal anaerobic immobilized biomass reactor [J]. Bioresource Technology, 2010, 101(2): 606-612.
[9]CAROSIA M F, OKADA D Y, SAKAMOTO I K,etal. Microbial characterization and degradation of linear alkylbenzene sulfonate in an anaerobic reactor treating wastewater containing soap powder[J]. Bioresource technology, 2014, 167: 316-323.
[10]季瑞武. 水基清洗剂(WBD)废水降解菌株的分离、鉴定及特性研究[D].青岛: 青岛理工大学, 2015.
[11]MENG Q, GE S, LI W. The determination of linear alkylbenzene sulphonate in drinking water and sewage by fluorescence spectrometrt [J].Journal of environment and health, 1999, 16(2): 112.
Study on degradation kinetics of co-metabolic biodegradation of linear alkylbenzene sulfonate strains
JI Rui-wu1, ZHOU Li1, RAN Zhi-lin2, ZHU Jia3
(1. School of Environment and Municipal Engineering, Qingdao University of Technology, Qingdao 266033, China;2. School of Transportation and Environment, Shenzhen Institute of Information Technology, Shenzhen 518172, China;3. Department of Building and Environmental Engineering, Shenzhen Polytechnic Institute, Shenzhen 518055, China)
The degradation kinetics of co-metabolic biodegradation of two linear alkylbenzene sulfonate (LAS) strains was studied. Two bacterial strains which could degrade linear alkylbenzene sulfonate by co-metabolism mechanism, named as L-2 and L-15 were determined to Klebsiella sp. and Enterobacter sp. The optimal degradation conditions of L-2 and L-15 were investigated by the orthogonal experiment. The results suggested that the degradation rate of LAS (50 mg/L) by L-2 was up to 94.2% when glucose was chosen as growth substrate under the conditions as: 30 ℃, pH 7.5, glucose concentration 500mg/L, while the degradation rate of LAS (50 mg/L) by L-15 was up to 92.2% under the conditions as: 30 ℃, pH=7.5, glucose concentration 1 000 mg/L. The degradation reactions fitted first order kinetics when the concentration of LAS ranged from 25 mg/L to 100 mg/L. Certain theoretical basis of the treatment of LAS wastewater was provided by this study.
LAS; biodegradation; co-metabolism; degradation kinetics
2015-11-23.
深圳市科技计划(JCYJ2014050815 5916418)
季瑞武(1991-),男,硕士,研究方向:微生物生理生化.
朱佳,E-mail:zhmjia65@163.com.
X172
A
1672-0946(2016)04-0449-04

