正交试验优化厚朴七物汤水提取工艺
张文娓,王 一,方 芳,田 明
(黑龙江中医药大学 教学实验中心,哈尔滨 150040)
正交试验优化厚朴七物汤水提取工艺
张文娓,王 一,方芳,田明
(黑龙江中医药大学 教学实验中心,哈尔滨 150040)
为优选厚朴七物汤水提取工艺,采用正交试验法设计水提取工艺,以出膏率、含浸出物百分量和厚朴酚与和厚朴酚,及含大黄总蒽醌量为测定指标,考察加水量,提取次数和回流时间三个因素参数,确定最佳提取工艺条件.结果表明,厚朴七物汤最佳提取工艺为回流提取3次,第一次加水10倍量提取1.5 h,第二次加水8倍量提取1.0 h,第三次加水6倍量提取0.5 h.厚朴七物汤的水提取工艺简便易行,效率高,稳定可行.
厚朴七物汤;提取工艺;厚朴酚;和厚朴酚;大黄总蒽醌
厚朴七物汤一方出自东汉张仲景所著的《金匮要略》,由厚朴、甘草、大黄、大枣、枳实、桂枝、生姜组成,具有行气除满,解表散寒的功效.厚朴七物汤原为治疗外感表证未罢,里实已成.腹满,大便不通,发热,脉浮而数者.在现代临床上已广泛用于治疗急性肠炎,习惯性便秘,慢性肠胃炎,肠梗阻等[1-3].本方临床应用多以汤剂形式,剂型比较落后,不便于质量控制、服用、贮藏、运输等.本文在继承中医理论的基础上,根据国家新药研发的技术要求,采用正交试验优化水提取工艺[3-7],对厚朴七物汤进行制备工艺改革,为其成药研究奠定基础.
1 仪器与试药
1.1仪器
高效液相色谱仪(Waters1515,美国Waters公司);紫外可见分光光度仪(UV-1601PC,日本岛津公司);超声波清洗机(BL6-180A,上海比朗仪器有限公司);电子分析天平(AB204-N,梅特勒-托利多仪器上海有限公司);电热恒温水浴锅(HH.S11-2,杭州汇尔仪器设备有限公司).
1.2试剂
厚朴酚对照品(批号:110729-200310,中国药品生物制品检定所)、和厚朴酚对照品(批号:110730-201011,中国药品生物制品检定所)、1.8-二羟基蒽醌对照品(批号:704-200115中国药品生物制品检定所)甲醇(色谱纯、美国迪马公司);甲醇、三氯甲烷均为分析纯(天津市天力化学试剂有限公司);冰醋酸(天津市富宇精细化工有限公司);氨水(天津东丽区天大化学试剂厂).
2 实验方法与结果
2.1正交设计试验
称取处方量药材,根据汤剂提取工艺的影响因素,以预试验结果为基础,选择L9( 34) 正交设计表,确定考察因素、水平见表1.
表1水提正交试验因素水平表

因素水平A加水量/倍B提取时间/hC提取次数/次1238,6,410,8,612,10,81.0,0.5,0.51.5,1.0,0.52.0,1.5,1.0123
精密量取2.1项下储备液100 mL,置已干燥恒重的蒸发皿中,水浴蒸干后105 ℃干燥3 h,冷却0.5 h,迅速精密称定质量,计算出膏率.
2.3含浸出物量测定方法
精密称定2.1项下备用的干膏细粉2.0 g,置100 mL锥形瓶中,精密加乙醇50 mL,密塞,称定质量,静止1 h,水浴回流1 h,冷却,取下锥形瓶,密塞,再次称重,用乙醇补足减失的质量,摇匀,滤过,精密量取滤液25 mL,置已干燥至恒重的蒸发皿中,在水浴上蒸干后,于105 ℃干燥3 h,置干燥器中冷却0.5 h,迅速精密称重,计算浸出物百分含量.
2.4含厚朴酚、和厚朴酚量测定
2.4.1对照品溶液的制备
如果将胞元结构等效成一个等体积均质实心单元,则该等效单元在yoz面内与所取胞元结构有相同的剪切模量。该等效单元在yoz面内所承受的剪应力为:
精密称取厚朴酚对照品2.12 mg、和厚朴酚对照品1.54 mg,加甲醇制成每1mL含厚朴酚84.8 μg,和厚朴酚61.6 μg溶液,作为对照品溶液,备用.
2.4.2供试品溶液的制备
取2.1项下备用的提取液5 mL,用三氯甲烷萃取3次,每次10 mL,合并三氯甲烷提取液,水浴蒸干,残渣加甲醇使溶解至25 mL容量瓶中,摇匀,过滤,作为供试品溶液.
2.4.3测定方法
精密吸取对照品溶液5 μL与供试品溶液10 μL,分别注入液相色谱仪,测定,并折算出每个处方量中含厚朴酚、和厚朴酚总量.色谱柱Agilent Extend ODS反相柱(4.6 mm×250 mm,5 μm);流动相:甲醇∶水(70∶30)为流动相;检测波长294 nm;流速1.0 mL/min;柱温:室温.理论板数不低于3800.记录色谱图,HPLC图谱见图1.
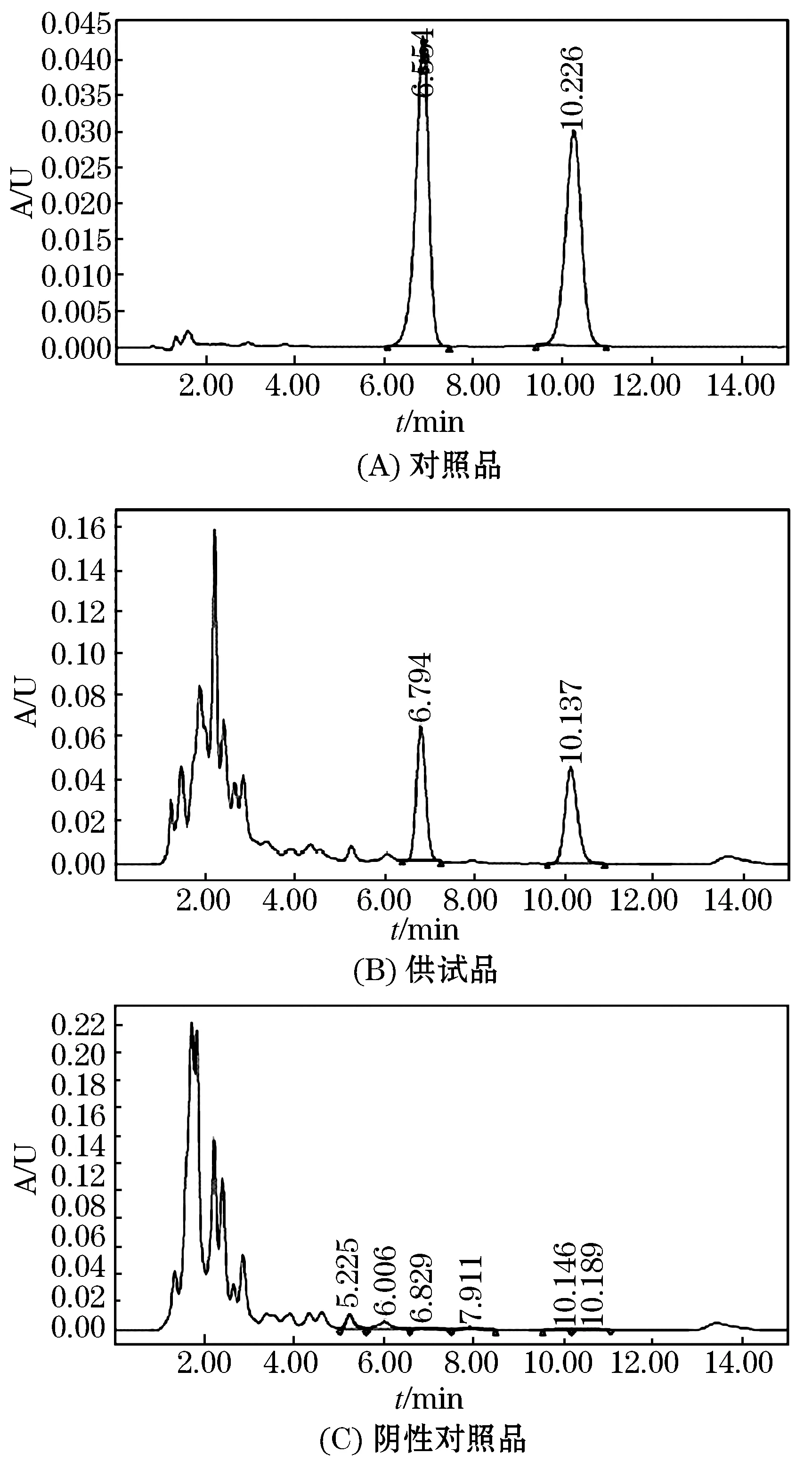
图1 厚朴酚、和厚朴酚HPLC色谱图
2.4.4方法学考察
线性关系考察:精密吸取2.4.1项下对照品溶液0.2、0.4、0.6、0.8、1.0 mL置10 mL容量瓶中,加甲醇稀释至刻度,摇匀,精密吸取上述溶液10 μL注入液相色谱仪,记录峰面积,以峰面积为纵坐标,质量比为横坐标作线性回归,得厚朴酚回归方程y= 1 381 028x+ 18 842,R2= 0.999,线性范围为0.205 ~1.025 μg;和厚朴酚回归方程y= 1 601 497x+ 57 843,R2= 0.999,线性范围为0.203~1.015 μg.
精密度试验:精密吸取2.4.2项下供试品溶液10 μL,连续进样6次,测定厚朴酚与和厚朴酚的峰面积的RSD值分别为1.78%,1.23%.
稳定性实验:分别精密吸取供试品溶液10 μL,于0、2、4、6、8、10 h进样,测定厚朴酚与和厚朴酚峰面积积分值的RSD值分别为1.59%,1.92%
重复性试验:取同一批样品6份,按供试品溶液制备方法分别制备样品溶液,进行质量比测定,测定结果厚朴酚与和厚朴酚峰面积的RSD值分别为2.22%,2.41%.
加样回收试验:精密量取样品共6份,分别加入一定量的厚朴酚与和厚朴酚对照品,按样品质量比测定方法测定,计算回收率,结果见表2、3.
表2加样回收率(厚朴酚)(n=3)
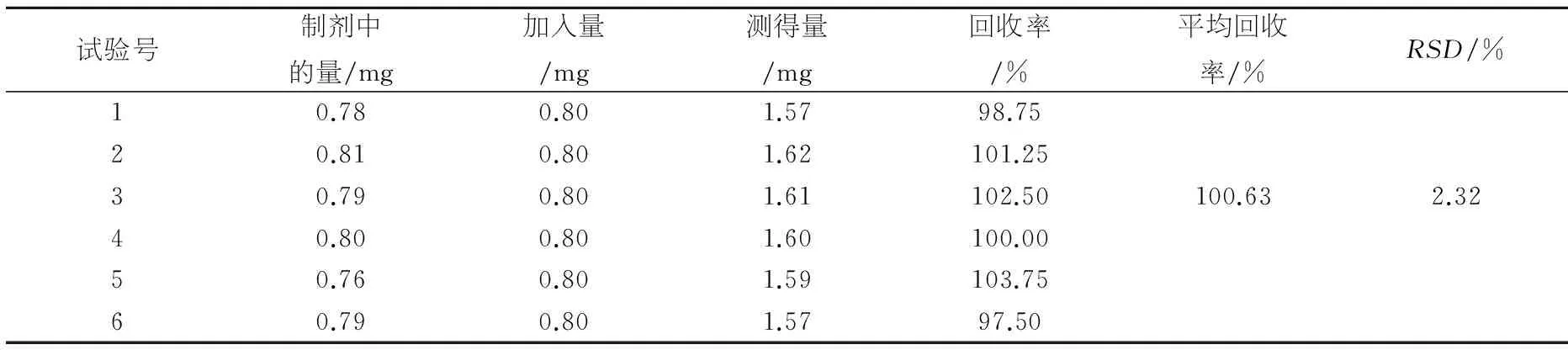
试验号制剂中的量/mg加入量/mg测得量/mg回收率/%平均回收率/%RSD/%10.780.801.5798.7520.810.801.62101.2530.790.801.61102.50100.632.3240.800.801.60100.0050.760.801.59103.7560.790.801.5797.50
表3加样回收率(和厚朴酚)(n=3)
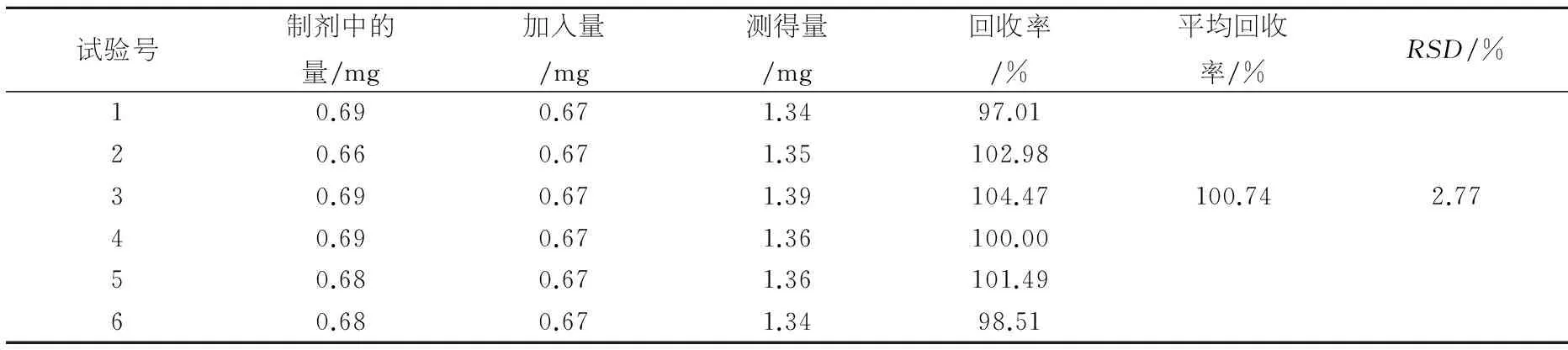
试验号制剂中的量/mg加入量/mg测得量/mg回收率/%平均回收率/%RSD/%10.690.671.3497.0120.660.671.35102.9830.690.671.39104.47100.742.7740.690.671.36100.0050.680.671.36101.4960.680.671.3498.51
2.5含大黄总蒽醌量测定
2.5.1供试品溶液的制备
取2.1项下提取液5 mL,置于圆底烧瓶中,加冰醋酸10 mL,水浴回流30 min,用乙醚洗涤2次,每次15 mL,合并滤液,再加10 mL(6 mol/L)氢氧化钠和5%氢氧化钠,2%氢氧化铵混合液5 mL,振摇提取,放置分层,分出红色碱水层.乙醚层再用混合碱液提取2次,每次20 mL,将提取的碱液至于100 mL容量瓶中,水浴加热30 min,冷却至室温,加混合碱液至刻度.
2.5.2对照品溶液的制备
精密称取1.8-二羟基蒽醌2.14 mg,加甲醇使溶解至25 mL,作为对照品储备液溶液.精密量取储备液3.0 mL置10 mL容量瓶中,水浴蒸去甲醇,加5%氢氧化钠,2%氢氧化铵混合液至刻度,摇匀后静置30 min,作为对照品溶液.
2.5.3最佳吸收波长的确定
按照2010年版《中国药典》附录VA紫外-可见分光光度法项下操作,取2.5.1项下供试品溶液和2.5.2项下的对照品溶液,在200~800 nm范围进行光谱扫描.由光谱图2可看出,在523 nm处,有最大吸收,且无干扰,最终确定检测波长为523 nm.
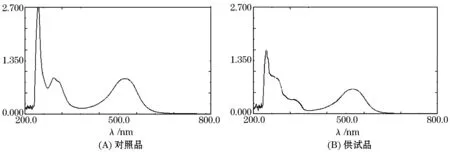
图2 大黄总蒽醌光谱图
2.5.4标准曲线的制备
分别精密吸取对照品0.5、1.0、2.0、3.0、4.0 mL至10 mL容量瓶中,水浴蒸去甲醇,加5%氢氧化钠,2%氢氧化铵混合液至刻度,摇匀后静置30 min,在523 nm 波长处测定吸光度.以浓度为横坐标,吸光度为纵坐标作标准曲线,得回归方程y=0.033 9x+0.077 5,R2=0.999 3,线性范围为4.28~34.24 μg.
2.6正交试验结果
根据L9( 34) 正交设计表进行试验,分别测定提取液所得出膏率、浸出物及提取液中含厚朴酚与和厚朴酚、及大黄总蒽醌量为水浴回流提取正交试验的主药考核指标,试验结果见表4,方差分析见表5~8.
表4正交试验结果

试验序号ABCD出膏率/%浸出物/%含厚朴酚与和厚朴酚总量/mg含大黄总蒽醌量/mg综合评分1111115.5026.7330.7619.820.692122221.7527.0939.7030.960.913133324.3126.2564.0947.011.204212319.1826.5642.5624.850.845223122.9323.52118.4749.161.466231217.8626.4738.9335.750.907313224.5724.1661.8544.851.158321316.7827.0444.5615.990.699332123.5426.1277.48300.91K12.82.682.28K23.23.062.66K32.753.013.81R0.450.381.53
综合评分=(含厚朴酚与和厚朴酚总量/含厚朴酚与和厚朴酚总量平均数)×0.3+(含大黄总蒽醌量/大黄总蒽醌量平均数)×0.3+(出膏率/出膏率平均数)×0.2+(浸出物/浸出物平均数)×0.2
表5出膏率的方差分析结果表
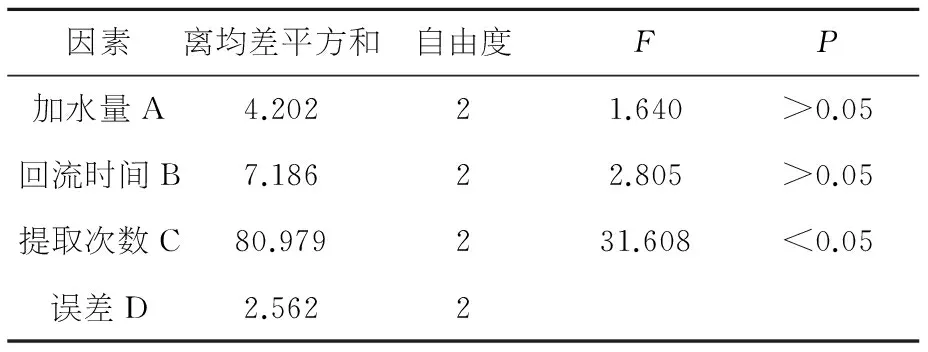
因素离均差平方和自由度FP加水量A4.20221.640>0.05回流时间B7.18622.805>0.05提取次数C80.979231.608<0.05误差D2.5622
表6浸出物的方差分析结果表
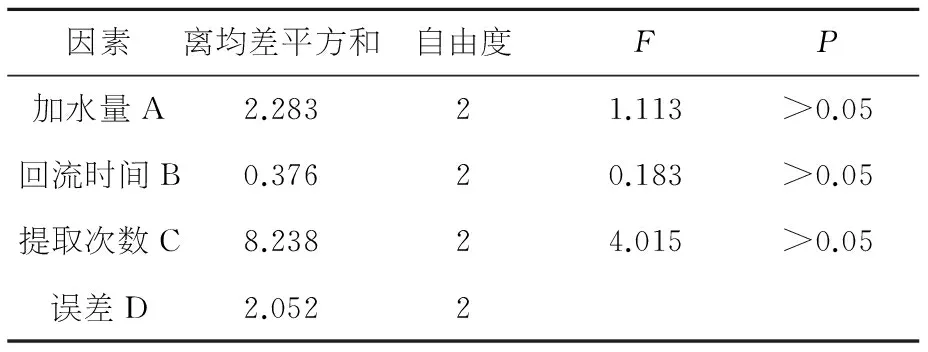
因素离均差平方和自由度FP加水量A2.28321.113>0.05回流时间B0.37620.183>0.05提取次数C8.23824.015>0.05误差D2.0522
表7含厚朴酚与和厚朴酚总量的方差分析结果表

因素离均差平方和自由度FP加水量A774.57220.526>0.05回流时间B790.37120.537>0.05提取次数C2908.88621.976>0.05误差D1472.3332
表8含大黄总蒽醌量方差分析结果表
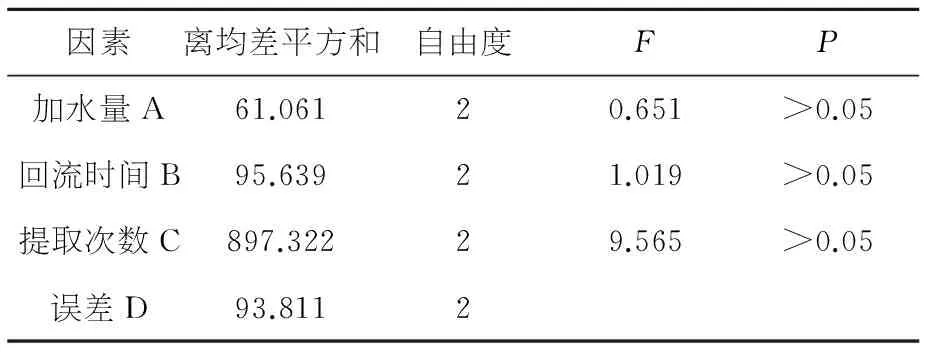
因素离均差平方和自由度FP加水量A61.06120.651>0.05回流时间B95.63921.019>0.05提取次数C897.32229.565>0.05误差D93.8112
综合方差分析结果,除因素C在出膏率方差分析中差异显著(P<0.05)之外,其他因素差异均不显著(P>0.05),含厚朴酚与和厚朴酚量测定中,优组合为A2B2C3,含大黄总蒽醌量测定中,优组合为A2B2C3,含浸出物量测定中优组合为A1B2C2,出膏率测定中,优组合为A3B1C3.依据综合评分极差C > A > B (R=1.53>0.45>0.38),故影响试验结果的主次因素顺序为C> A > B,即提取次数影响最大,加水量次之,影响最小的是提取时间,同时考虑到节能、生产实际等诸方面因素,综合评价确定最佳提取工艺为A2B2C3,即:第一次加水10倍量,回流提取1.5 h,第二次加水8倍量,回流提取1.0 h,第三次加水6倍量,回流提取0.5 h.
2.7验证试验
称取10倍处方量药材三份,按照最佳工艺提取,分别测定出膏率,浸出物,厚朴酚与和厚朴酚及大黄总蒽醌的量.结果见表9.
表9提取工艺验证试验结果表
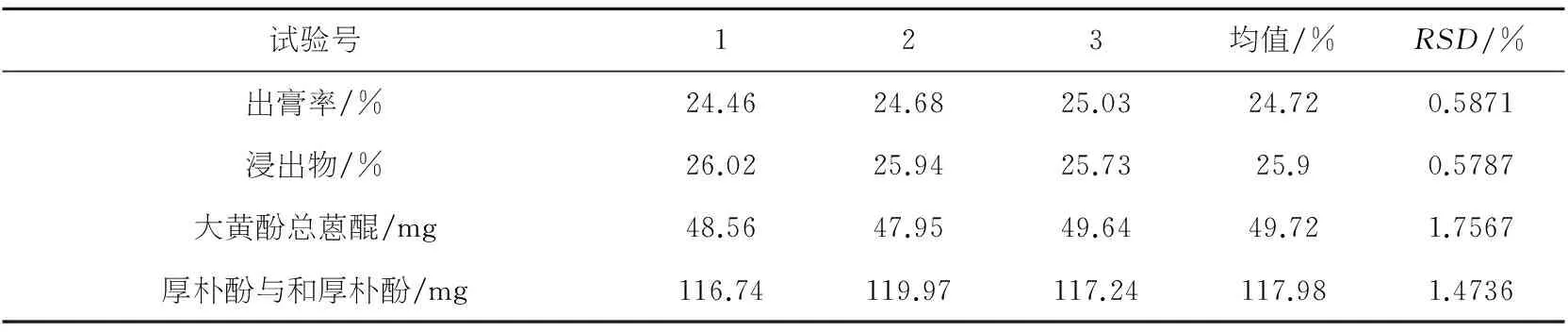
试验号123均值/%RSD/%出膏率/%24.4624.6825.0324.720.5871浸出物/%26.0225.9425.7325.90.5787大黄酚总蒽醌/mg48.5647.9549.6449.721.7567厚朴酚与和厚朴酚/mg116.74119.97117.24117.981.4736
3 结 语
本文采用现代科学方法对厚朴七物汤传统方剂进行提取工艺改革,方中厚朴为君药,在临床疗效中起着重要作用,大黄蒽醌作用显著,并且药物处理过程简单,质量比测定方法明确,故选厚朴中的有效成分厚朴酚与和厚朴酚以及大黄总蒽醌作为含量测定指标性成分,测定方法确切,具有一定的代表性,与含出膏率、浸出物量综合评分,筛选提取工艺条件.结果表明,该提取工艺条件和方法简便、稳定、可行.
[1]陈纪藩. 金匮要略[M]. 北京: 人民卫生出版社, 2000.
[2]范永升.金匮要略[M]. 北京:中国中医药出版社,2003.
[3]李广林. 加味厚朴七物汤治疗腹部术后早期炎性肠梗阻64例[J]. 陕西中医学院学报, 2011, 34(2): 52-53.
[4]任虹, 何瑶, 刘芳, 等. 厚朴酚与和厚朴酚HPLC含量测定方法及厚朴提取工艺研究[J]. 中药与临床, 2014, 5(2): 32-34.
[5]刘云娣, 李得堂, 任结梅, 等. 紫外分光光度法测定大承气冲剂中大黄总蒽醌的含量[J].中医药导报, 2010, 16(7): 108-110.
[6]国家药典委员会.中华人民共和国药典(一部)[M]. 北京: 化学工业出版社, 2010.
[7]李春花, 王永泽, 李瑞平, 等. 鼻渊灵颗粒剂提取工艺研究[J]. 时珍国医国药, 2009, 20(3): 540-541.
Extraction technology of Houpu Qiwu decoction
ZHANG Wen-wei, WANG Yi, FANG Fang, TIAN Ming
(Teaching Laboratory Center, Heilongjiang University of Chinese Medicine, Harbin 150040, China)
To study the optimal extraction process of Houpu Qiwu decoction, the orthogonal experiment was used. The optimal extraction process was determined with the rate of extraction, the percentage composition of extractive and the content of magnolol, honokil and total anthraquinone in radix et rhizoma rhei as the index. Results indicated that the optimal extraction of Houpu Qiwu decoction was reflux extraction 3 times, the first time of 1.5 h with 10 times water; the second time of 1 h with 8 times water, and the third time of 0.5 h with 6 times water. The optimal extraction technology was easy, high efficiency and stable.
Houpu Qiwu decoction granules; extraction process; magnolol; honokil total anthraquinone in radix et rhizoma rhei
2015-08-28.
张文娓(1982-),女,硕士,实验师,研究方向:中药新药研发与质量标准研究.
田明(1963-),男,教授,硕士研究生导师,研究方向:中药新药研发与质量标准研究.
R284
A
1672-0946(2016)04-0421-05

