川芎嗪对血管紧张素Ⅱ诱导的大鼠肝星状细胞转化生长因子-β1/S m a d s通路的影响
魏国微,李克跃
(贵州省人民医院 1.干部综合病房,2.肝胆外科,贵州 贵阳 550002)
论著
川芎嗪对血管紧张素Ⅱ诱导的大鼠肝星状细胞转化生长因子-β1/S m a d s通路的影响
魏国微1,李克跃2
(贵州省人民医院 1.干部综合病房,2.肝胆外科,贵州 贵阳 550002)
目的通过研究川芎嗪对体外培养的血管紧张素Ⅱ诱导的肝星状细胞(H S C)转化生长因子-β1(T G F-β1)/S m a d s通路的作用,探讨其治疗肝纤维化的机制。方法对大鼠H S C使用血管紧张素Ⅱ(1×10-5m ol/L)及血管紧张素Ⅱ(1×10-5m ol/L)联合不同浓度的川芎嗪(0.04、0.20和1.00m g/m l)干预48 h,活细胞计数法(CC K-8)检测各组细胞增殖水平的变化,实时荧光定量聚合酶链反应及W e s t e r n blot检测各组细胞T G F-β1、S m a d2、S m a d4的mR NA及蛋白表达。结果血管紧张素Ⅱ明显促进H S C的增殖,同时上调该细胞T G F-β1、S m a d2、S m a d4的mR NA及蛋白表达(P<0.01),而血管紧张素Ⅱ对H S C的诱导作用可被川芎嗪抑制(P<0.01),并呈现浓度依耐性。结论川芎嗪抗肝纤维化的机制之一可能是通过调控肝星状细胞T G F-β1/ S m a d s通路实现的。
肝星状细胞;转化生长因子-β1/S m a d s;川芎嗪;血管紧张素Ⅱ
肝纤维化是指肝脏内弥漫性细胞外基质(特别是胶原物质)过度沉积,是机体对各种病因引起的慢性肝损伤后的一种损伤修复反应[1],是肝硬化的早期可逆阶段,如不及时治疗则可能进展成为失代偿期肝硬化并出现各种终末期肝病等并发症[2]。我国是肝硬化的高发地区,因此,肝纤维化的深入研究对缓解肝纤维化病情具有重要的临床意义。研究发现肝星状细胞(hepatic stellate cell,H S C)在肝纤维化发病过程中发挥重要作用[3-5]。血管紧张素Ⅱ通过促进H S C发生,影响转化生长因子β1(trans f ormin g g ro w th f actor-β1,T G F-β1),参与肝纤维化形成[6-8]。T G F-β1/S mads通路在H S C激活、增殖及肝纤维化过程中发挥重要作用[5,9]。报道显示,活血化瘀中药川芎嗪具有一定的抗组织纤维化作用[10-15],但其未彻底阐明抗肝纤维化的机制,对血管紧张素Ⅱ干预后H S C的T G F-β1/S mads通路作用也不清楚。为探索川芎嗪对血管紧张素Ⅱ干预后H S C的T G F-β1/S mads通路的作用,笔者使用血管紧张素Ⅱ及血管紧张素Ⅱ联合不同浓度的川芎嗪对大鼠H S C细胞进行干预,并检测细胞增殖水平及细胞T G F-β1、S mad2、S mad4 的m R N A及蛋白表达。
1 材料与方法
1.1实验动物与主要试剂、仪器
大鼠肝星状细胞H S C-T6购自中国科学院细胞库,达尔伯克必需基本培养基(d u lbecco's minim u m essential medi u m,D M E M)(高糖型,美国H yclone公司),0.25%胰酶(美国H yclone公司),胎牛血清(美国H yclone公司),S YB RR P remi x E x Ta qTM实时荧光定量聚合酶链反应(q R T-PC R)试剂盒(日本Ta K a R a公司),T G F-β1、S mad2、S mad4及β肌动蛋白引物(美国I ntro g en公司),T G F-β1正向引物:T GG CG TT A CC TT GG T AA CC,反向引物:GG T G TT G A GCC C TTT CC A G;S mad2正向引物:CC A GG T C T C TT G A T G G T CG T,反向引物:GGCGGC A G TT C T G TT A G AA T;S mad4正向引物:C TTTT GC TT GGG T C AA C T C T C,反向引物:T GGGC T C A CGC A T A T A TTT CC;β肌动蛋白正向引物:A GGCC A T G T A CG T A GCC A T CC A,反向引物序列:T C T CCGG A G T CC A T C A C AA T G。抗T G F-β1抗体及抗S mad4抗体(英国A bcam公司),抗β肌动蛋白抗体(北京全式金生物技术有限公司),活细胞计数法(cell co u ntin g k it-8,CC K-8)试剂盒(上海生工生物技术有限公司),血管紧张素Ⅱ(美国S i g ma公司),注射用盐酸川芎嗪(北京四环科宝有限公司)。
1.2细胞的培养
大鼠肝星状细胞H S C-T6,调整细胞密度为4× 104~5×104个/ml,置于37℃、5%二氧化碳C O2培养箱内用含10%胎牛血清的D M E M培养。每3天换培养液1次。5~7 d细胞布满瓶底后使用0.25%胰蛋白酶消化传代,取4~6代H S C进行实验。
1.3细胞的分组及其处理
将培养好的4~6代细胞用于实验。总共分为5个组,即对照组、血管紧张素Ⅱ1×10-5mol/L组(血管紧张素Ⅱ组)、血管紧张素Ⅱ(1×10-5mol/L)+川芎嗪0.04m g/ml组(血管紧张素Ⅱ+川芎嗪0.04组),血管紧张素Ⅱ(1×10-5mol/L)+川芎嗪0.20m g/ ml组(血管紧张素Ⅱ+川芎嗪0.20组),血管紧张素Ⅱ(1×10-5mol/L)+川芎嗪1.00m g/ml组(血管紧张素Ⅱ+川芎嗪1.00组)。待细胞长到50%左右后,各组细胞置入无血清的D M E M培养饥饿过夜,次日各组细胞加入上述含不同浓度的川芎嗪培养基培养48 h。
1.4观察指标及测定方法
1.4.1CC K-8法测定细胞增殖水平将成纤维细胞接种于96孔板,细胞浓度为2×104个/孔,每孔体积为100μl,每孔做5个复孔。各组细胞在37℃、5%C O2培养箱培养24 h,加入不含或含有不同浓度的川芎嗪分别培养48 h,每孔加入10μl CC K-8试剂培养2.5 h,按细胞计数说明书在酶标仪上450 nm波长处测定其光密度值,采用目前普遍使用的扣除本底策略来消除误差。
1.4.2q R T-P C R检测T G F-β1、S m a d2及S m a d4 mR NA的表达各组细胞提取R N A,将纯度好、完整性高的R N A合成cDN A。按2×S YB RR P remi x 10μl,正向引物0.4μl,反向引物0.4μl,cDN A 2μl,dd H2O 7.2μl配成总量20μl体系进行q R T-PC R。反应条件:95℃预变性30 s,95℃变性5 s,60℃退火30 s,共计40个循环。目的基因的表达使用相对定量法,以β肌动蛋白作为内参计算△C t,以2-△△ct计算目的基因的相对表达量。
1.4.3W e s t e r n blot法检测T G F-β1及S m a d4的蛋白表达提取各组细胞总蛋白,采用二喹啉甲酸法定量蛋白浓度,所得蛋白于聚丙烯酰胺凝胶中电泳,电转至聚偏二氟乙烯膜后以足量的封闭液封闭,用一抗稀释液按1∶5 000比例稀释检测蛋白的一抗,4℃冰箱内孵育过夜。去掉一抗孵育液后以足量三羟甲基氨基甲烷缓冲盐溶液(tris b uff ered saline and t w een 20,T B S T)摇床洗涤3次,每次10min,用二抗稀释液按1∶5 000比例稀释辣根过氧化物标记的二抗后室温振荡孵育2 h,倒掉二抗孵育液后以足量T B S T洗涤3次,每次10 min,以电化学发光,显影和定影方法对胶片进行拍照和扫描,以β肌动蛋白为内参照,Q u antity one系统分析目标条带的相对灰度值。
1.5统计学方法
采用S P SS 16.0统计软件进行数据分析,计量资料用均数±标准差(x±s)表示,多组的比较用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1血管紧张素Ⅱ对H SC-T6增殖水平的影响
血管紧张素Ⅱ干预后的H S C增殖水平较正常值上升(t=-18.703,P=0.000),使用不同浓度的川芎嗪干预后,血管紧张素Ⅱ对H S C增殖的刺激作用受到抑制(川芎嗪浓度为0.04m g/ml时,t=5.630,P=0.000;川芎嗪浓度为0.20m g/ml时,t=8.628,P=0.000;川芎嗪浓度为1.00m g/ml时,t=17.508,P=0.000),且呈现浓度依耐性。见图1及表1。
2.2血管紧张素Ⅱ及 TMP对 H SC-T6细胞T GF-β1、S m a d2、S m a d4 m RN A表达的影响
使用血管紧张素Ⅱ(1×10-5mol/L)干预后,H S CT6的T G F-β1、S mad2、S mad4 m R N A表达均上调(T G F-β1:t=-58.751,P=0.000;S mad2:t=-36.644,P=0.000;S mad4:t=-80.719,P=0.000),但血管紧张素Ⅱ对H S C的调控作用被川芎嗪不同程度地抑制:①川芎嗪浓度为0.04m g/ml时,T G F-β1:t=1.905,P=0.105;S mad2:t=1.180,P=0.283;S mad4:t=2.417,P=0.052。②川芎嗪浓度为0.20m g/ml时,T G F-β1:t= 10.870,P=0.000;S mad2:t=9.092,P=0.000;S mad4:t=22.739,P=0.000。③T MP浓度为1.0m g/ml时,T G F-β1:t=15.187,P=0.000;S mad2:t=14.011,P= 0.000;S mad4:t=27.299,P=0.000。表现为浓度依耐性。见图2及表2。
2.3血管紧张素Ⅱ及TMP对T GF-β1、S m a d4蛋白表达的影响

图1 各组细胞增殖水平 (n=5,x±s)

表1 各组细胞增殖水平方差分析

图2 各组细胞各基因m RN A相对表达量 (n=3,x±s)

表2 各组细胞各基因m RN A相对表达量方差分析
使用血管紧张素Ⅱ(1×10-5mol/L)干预后,H S C-T6的 T G F-β1及 S mad4蛋白表达均上调(T G F-β1:t=-49.025,P=0.000;S mad4:t=-32.745, P=0.000),但血管紧张素Ⅱ对H S C的调控作用被川芎嗪不同程度地抑制:①川芎嗪浓度为0.04m g/ml时,T G F-β1:t=2.380,P=0.055;S mad4:t=2.130,P= 0.077。②川芎嗪浓度为0.20m g/ml时,T G F-β1:t= 12.983,P=0.000;S mad4:t=11.202,P=0.000。③川芎嗪浓度为1.00m g/ml时,T G F-β1:t=17.259,P=0.000;S mad4:t=16.362,P=0.000。表现为浓度依耐性,与各基因m R N A的变化趋势一致。见图3、4和表3。

图3 各组细胞各蛋白相对表达量 (n=3,x±s)
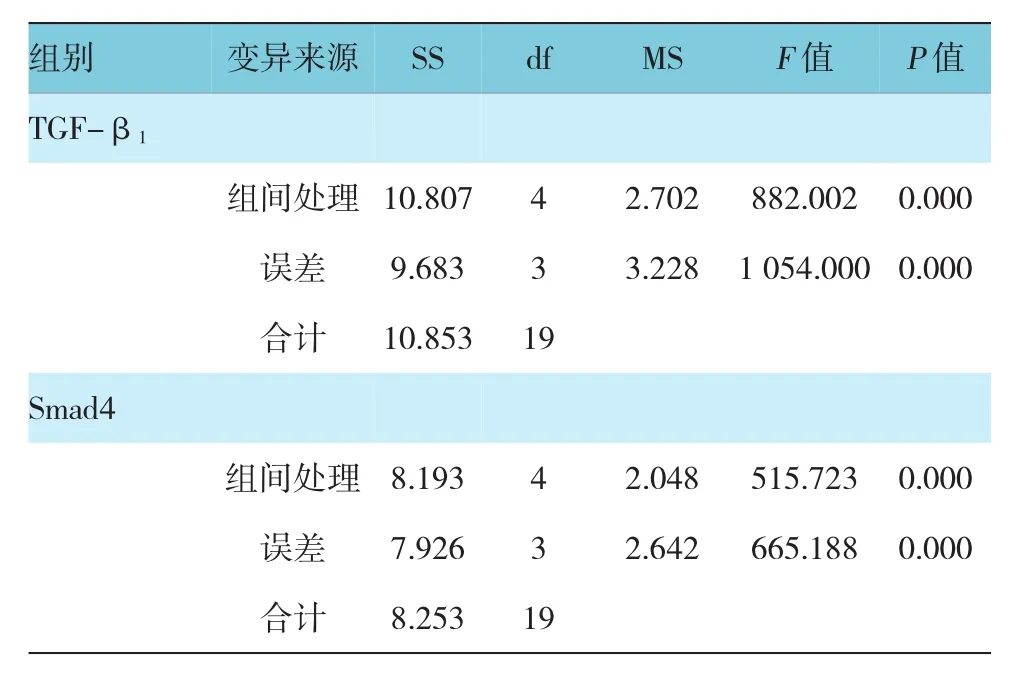
表3 各组细胞各蛋白相对表达量的方差分析
3 讨论
肝纤维化是各种慢性肝病共有的病理改变,其特点是以胶原为主的细胞外基质在肝内过度沉积。肝星形细胞又称I to细胞、维生素A储存细胞、窦周细胞等,其约占肝内细胞总数的5%~8%,正常情况下具有贮存脂肪和维生素A、维持肝窦细胞外基质平衡、肝窦胶原及微生态平衡等功能[16]。当肝脏受到物理、化学及生物因素刺激时,通常静止的H S C被“激活”或“活化”。而活化的H S C是肝纤维化时细胞外基质的主要来源细胞,与细胞外基质相互作用,在肝纤维化中起关键作用[5,9,17]。
T G F-β1作为一种细胞因子,在活化的H S C中的表达明显增强,T G F-β1反过来又能激活H S C,使其增殖旺盛。如果作用过度或持续表达,将会导致肝纤维化形成,是目前已知的与肝纤维化形成最密切的细胞因子[2,5,9]。一般情况下,T G F-β1是通过与其相应受体TβRⅠ、TβRⅡ、内皮蛋白结合形成复合物后调控S mad2/S mad3、S mad4、S mad6/S mad7等蛋白形成T G F-β1/S mads信号传导通路发挥作用[18]。在肝纤维化过程中,H S C中的 T G F-β1、S mad2、S mad4等的表达均明显增强[19-20],干预H S C中T G F-β1/S mads信号传导通路中的T G F-β1、S mad2、S mad4等的表达已经成为治疗肝纤维化的主要策略之一[19-23]。
研究发现,在肝纤维化的H S C中,血管紧张素Ⅱ的表达明显增强[24]。血管紧张素Ⅱ通过促进H S C发生,影响T G F-β,参与肝纤维化形成,在肝纤维化过程中发挥主要作用[9]。也有报道显示,血管紧张素Ⅱ对H S C的调控作用与J A K2及R ho-R oc k通路有关[25-26]。血管紧张素Ⅱ引起的的肝纤维化可能与诱导N A D P H氧化酶依赖的氧化应激作用有关,而血管紧张素(1-7)能够抑制血管紧张素Ⅱ引起的肝纤维化[27]。在机体肝纤维化过程中血管紧张素Ⅱ主要是通过肾素-血管紧张素-醛固酮系统发挥作用[24]。干预H S C中肾素-血管紧张素-醛固酮系统的表达已经成为治疗肝纤维化的策略之一[28]。笔者的体外实验研究提示血管紧张素Ⅱ能够上调H S C 中T G F-β1、S mad2及S mad4的m R N A及蛋白表达(P<0.01),从而促进H S C的增殖(P<0.01)。
中药川芎嗪具有抗组织纤维化、抗氧自由基、改变血液流变学、免疫抗肿瘤等功效,尤其是它的抗组织纤维化作用越来越引起人们的重视[10-14]。报道显示,川芎嗪抑制H S C的激活与其干扰血小板源生长因子β受体调控E R K及P38通路有关[29]。也有报道显示,川芎嗪抑制H S C的激活与其抑制胰岛素受体调控PI3K/A K T及E R K通路有关[30]。还有报道显示,川芎嗪抑制H S C的激活与其对H ed g eho g信号转导通路的调控有关[31]。体内研究提示,川芎嗪的抗肝纤维化作用与其对H S C细胞内P D G F-beta R/N LR P3/C aspase1通路进行调控从而抑制炎症细胞因子的表达有关[32]。笔者的体外实验研究提示,盐酸川芎嗪能够明显抑制由血管紧张素Ⅱ诱导的H S C中T G F-β1、S mad4、S mad2的m R N A及蛋白上调(P<0.01,川芎嗪0.20~1.00m g/ml),从而抑制H S C的增殖(P<0.01,T MP0.04~1.00 m g/ml),且存在浓度依耐性。
综上所述,血管紧张素Ⅱ上调H S C中T G F-β1、S mad2、S mad4的m R N A及蛋白表达,从而促进H S C的增殖;而川芎嗪对血管紧张素Ⅱ诱导的H S C具有抑制作用,在一定范围内表现为浓度依赖性(0.2~1.0m g/ml),提示川芎嗪的抗肝纤维化作用可能是通过其对H S C中T G F-β1/S mads通路的调控产生的。
[1]F R I ED M A N SL.M olec u lar re g u lation o f hepatic f ibrosis,an inte g rated cell u lar response to tiss u e in j u ry[J].J B iol C hem,2000,275(4):2247-2250.
[2]I S M A I L M H,PI N Z A N I M.R e v ersal o f li v er f ibrosis[J].S a u di J G astroenterol,2009,15(1):72-79.
[3]T R A U T W E I N C,F R I ED M A N SL,S C HU PP A N D,et al.H epatic f ibrosis:C oncept to treatment[J].JH epatol,2015,62(1S):S15-S24.
[4]P U C H E J E,S A IM A N Y,F R I ED M A N SL.H epatic stellate cells and li v er f ibrosis[J].C ompr P hysiol,2013,3(4):1473-1492.
[5]G R E SS NE R A M,W E I S K I R C H EN R.M odern patho g enetic concepts o f li v er f ibrosis s u gg est stellate cells and T G F-beta as maj or players and therape u tic tar g ets[J].J C ell M ol M ed,2006,10(1): 76-99.
[6]G R A C E J A,H E R A T H C B,M A K K Y,et al.U pdate on ne w aspects o f the renin-an g iotensin system in li v er disease:clinical implications andne wtherape u tic options[J].C linS ci(L ond),2012,123(4):225-239.
[7]M U N S H IM K,U DD I N M N,G L A S E R SS.The role o f the reninan g iotensin system in li v er f ibrosis[J].E x p B iol M ed(M ay w ood),2011,236(5):557-566.
[8]A BB A S G,S I L V E I R A M G,L I ND O R K D.H epatic f ibrosis and the renin-an g iotensin system[J].A m J Ther,2011,18(6):202-208. [9]K I SS E L E V A T,B R ENNE R D A.R ole o f hepatic stellate cells in f ibro g enesis and the re v ersal o f f ibrosis[J].J G astroenterol H epatol,2007,22(l):S73-S78.
[10]YU A N X P,L I U L S,F U Q,et al.E ff ects o f li g u stra z ine on u reteral obstr u ction-ind u cedrenal t u b u lointerstitial f ibrosis[J]. P hytother R es,2012,26(5):697-703.
[11]C A I X,C H EN Z,P A N X,et al.I nhibition o f an g io g enesis,f ibrosis and thrombosis by tetramethylpyra z ine:mechanisms contrib u tin g to the S D F-1/C X C R4 a x is[J].P L o S O ne,2014,9(2): e88176.Doi:10.1371/j o u rnal.pone.0088176.
[12]L U B,YU L,L I S,et al.A lle v iation o f CC l4-ind u ced cirrhosis in rats by tetramethylpyra z ine is associated w ith do w nre g u lation o f leptin and T G F-beta1 path w ay[J].Dr u g C hem To x icol,2010,33(3):310-315.
[13]Z H A N G F,N I C,KO N G D,et al.L i g u stra z ine atten u ates o xidati v e stress-ind u ced acti v ation o f hepatic stellate cells by interr u ptin g platelet-deri v ed g ro w th f actor-beta receptor-mediated E R K and p38 path w ays[J].To x icol A ppl P harmacol,2012,265(1): 51-60.
[14]Z H A N G F,Z H A N G Z,KO N G D,et al.Tetramethylpyra z ine red u ces g l u cose and ins u lin-ind u ced acti v ation o f hepatic stellate cells byinhibitin g ins u linreceptor-mediatedPI3K/A K Tand E R K path w ays[J].M ol C ell Endocrinol,2014,382(1):197-204.
[15]L EE T F,L I N Y L,HU A N G Y T.S t u dies on antiproli f erati v e e ff ects o f phthalides f rom li g u stic u m ch u an x ion g in hepatic stellate cells[J].P lanta M ed,2007,73(6):527-534.
[16]G EE R T S A.H istory,hetero g eneity,de v elopmental biolo g y,and fu nctions o f q u iescent hepatic stellate cells[J].S emin L i v er Dis,2001,21(3):311-335.
[17]Z HOU W C,Z H A N G Q B,Q I A O L.P atho g enesis o f li v er cirrhosis[J].W orld J G astroenterol,2014,20(23):7312-7324.
[18]B L OB E G C,S C H I E M A NN W P,L O D I S H H F.R ole o f transf ormin g g ro w th f actor(beta)in h u man disease[J].N En g l J M ed,2000,343(3):228.
[19]KOO J H,L EE H J,K IM W,et al.Endoplasmic retic u l u m stress in hepatic stellate cells promotes li v er f ibrosis v ia P E R KM ediatedde g radationo fH N R N P A1andu p-re g u lationo f S M A D2[J].G astroenterolo g y,2016,150(1):181-193.
[20]S U N X E,Z H A N G X Q,L I U MM.E ff ect o f bone marro w mesenchymal stem cells on the T G F-beta1/S mad si g nalin g path w ay o f hepatic stellate[J].G enet M ol R es,2015,14(3):8744-8754.
[21]L I U X,HU H,Y I N J Q.Therape u tic strate g ies a g ainst T G F-beta si g nalin g path w ay in hepatic f ibrosis[J].L i v er I nt,2006,26(1):8-22.
[22]K I SS E L E V A T,B R ENNE R D A.A nti-f ibro g enic strate g ies and the re g ression o f f ibrosis[J].B est P ract R es C lin G astroenterol,2011,25(2):305-317.
[23]吴芙蓉,姜玲,何晓丽,等.橙皮苷对肝星状细胞T G F-β1/S mad信号通路的影响[J].中国中药杂志,2015,40(13):2639-2643.
[24]P E R E I R A R M,D O S S R A,D A C D F L,et al.R enin-ang iotensin system in the patho g enesis o f li v er f ibrosis[J].W orld J G astroenterol,2009,15(21):2579-2586.
[25]张小兰,李旭,肖冰,等.血管紧张素Ⅱ对大鼠肝星状细胞收缩及R ho-R oc k通路的影响[J].南方医科大学学报,2008,28(6):968-971.
[26]G R A N Z OW M,S C H I E R W A G EN R,K L E I N S,et al.A ng iotensin-Ⅱ type 1 receptor-mediated J an u s k inase 2 acti v ationind u ces li v er f ibrosis[J].H epatolo g y,2014,60(1):334-348.
[27]DE M A C ED O S M,G U IM A R A E S T A,F E L TEN B E R G E R J D,et al.The role o f renin-an g iotensin system mod u lation on treatment and pre v ention o f li v er diseases[J].P eptides,2014,62: 189-196.
[28]M O R EN O M,B A T A LL E R R.C yto k ines and renin-an g iotensin system si g nalin g in hepatic f ibrosis[J].C lin L i v er Dis,2008,12(4): 825-852.
[29]Z H A N G F,N I C,KO N G D,et al.L i g u stra z ine atten u ates o xidati v e stress-ind u ced acti v ation o f hepatic stellate cells by interr u ptin g platelet-deri v ed g ro w th f actor-beta receptor-mediated E R K and p38 path w ays[J].To x icol A ppl P harmacol,2012,265(1): 51-60.
[30]Z H A N G F,Z H A N G Z,KO N G D,et al.Tetramethylpyra z ine red u ces g l u cose and ins u lin-ind u ced acti v ation o f hepatic stellate cells byinhibitin g ins u linreceptor-mediatedPI3K/A K Tand E R K path w ays[J].M ol C ell Endocrinol,2014,382(1):197-204.
[31]HU J,C A O G,WU X,et al.Tetramethylpyra z ine inhibits activ ation o f hepatic stellate cells thro u g h hed g eho g si g nalin g pathw ays in v itro[J].B iomed R es I nt,2015,2015:D O I:10.1155/2015/ 603067.
[32]WU X,Z H A N G F,X I O N G X,et al.Tetram ethylpyra z ine red u ces in f lammation in li v er f ibrosis and inhibits in f lammatory cyto k ine e x pression in hepatic stellate cells by mod u latin g N LR P3 in f lammasome path w ay[J].I UB M B L i f e,2015,67(4):312-321.
(申海菊 编辑)
Effects of Tetramethylpyrazine and angiotensinⅡ on TGF-β1/ Smads signaling pathway in rat hepatic stellate cells
Guo-wei Wei1,Ke-yue Li2
(1.General Ward for Cadre,2.Department of Hepatobiliary Surgery,the People's Hospital of Guizhou Province,Guiyang,Guizhou 550002,China)
Objective To investigate the effects of Tetramethylpyrazine and angiotensinⅡ on transforming growth factor-β1(TGF-β1)/Smads signaling pathway in rat hepatic stellate cells(HSCs).M ethods HSCs were cultured,and then treated by angiotensinⅡ(1×10-5mol/L)or angiotensinⅡ(1×10-5mol/L)combined with different concentrations of Tetramethylpyrazine(0.04,0.20 and 2.00mg/ml).The treated cells and control groups were incubated for 48 hours.Cell proliferation was assayed by CCK-8.Relative mRNA expressions of TGF-β1,Smad2 and Smad4 were assayed by quantitative real-time polymerase chain reaction.Relative protein expressions of TGF-β1,Smad2 and Smad4 were investigated by Western blot.Results AngiotensinⅡ significantly promoted HSC proliferation,significantly up-regulated both the mRNA and protein expressions of TGF-β1,Smad2 and Smad4 in HSCs(P<0.01).The effects of angiotensinⅡ in HSCs were significantly inhibited by Tetramethylpyrazine in a dose-dependent manner(P<0.01).Conclusions This study suggested that the antiliver fibrosis effects of Tetramethylpyrazine maybe connect with modulation of TGF-β1/Smads signaling pathway.
hepatic stellate cell;TGF-β1/Smads;Tetramethylpyrazine;angiotensinⅡ
R 285.5
A
10.3969/j.issn.1005-8982.2016.15.009
1005-8982(2016)15-0050-06
2016-01-25

