硫化氢对1型糖尿病大鼠肾脏的保护作用*
杨 锐,刘小粉,马善峰,高 琴,李正红,贾 强
(蚌埠医学院生理学教研室,安徽 蚌埠 233030)
硫化氢对1型糖尿病大鼠肾脏的保护作用*
杨锐,刘小粉,马善峰,高琴,李正红,贾强△
(蚌埠医学院生理学教研室,安徽 蚌埠 233030)
目的:观察硫化氢(H2S)对1型糖尿病大鼠肾脏的保护作用及其机制。方法:32只雄性SD大鼠随机分为4组:正常对照(NC)组、糖尿病(DM)组、糖尿病治疗(NaHS+DM)组和NaHS对照(NaHS)组(n=8)。DM组和NaHS+DM组大鼠采用链脲佐菌素(STZ)55 mg/kg腹腔注射诱导1型糖尿病模型。造模成功后,NaHS+DM组和NaHS组采用腹腔注射NaHS溶液56 μmol/kg干预治疗。8周后,测定大鼠24 h尿蛋白含量、肾重指数、空腹血糖、尿素氮、肌酐等指标;HE染色观察肾脏组织形态学变化;测定肾脏组织脂质过氧化物丙二醛(MDA)含量、超氧化物歧化酶(SOD)和Caspase-3的活性;Western blot检测肾脏组织Bcl-2和Bax蛋白表达。结果:与NC组相比,NaHS组各项指标均无显著差异,DM组,24 h尿蛋白含量、肾重指数、空腹血糖、尿素氮和肌酐水平均明显升高;HE染色结果显示肾小球基底膜增厚、系膜基质增多;MDA含量、Caspase-3活性和Bax蛋白表达明显增高;SOD活性和Bcl-2蛋白表达显著降低。与DM组相比,NaHS+DM组肾功能损伤明显减轻,肾脏组织形态学变化明显改善,MDA含量、Caspase-3活性和Bax蛋白表达明显下降,SOD活性和Bcl-2蛋白表达显著增高。结论:H2S对1型糖尿病大鼠肾脏具有保护作用,其机制可能与抑制氧化应激和细胞凋亡有关。
硫化氢;糖尿病;大鼠;肾功能;氧化应激;细胞凋亡;
糖尿病肾病(diabetic nephropathy,DN)是糖尿病严重的并发症之一,由糖尿病微血管病变引起,以肾小球硬化为主要病理特征。但是DN发病机制复杂,至今仍未完全明确。目前认为,糖基化终末产物、炎症细胞因子、氧化应激、细胞凋亡和内质网应激等都参与了糖尿病肾病的发生和发展,导致肾脏细胞外基质的增生,肾小球基底膜增厚,最终形成糖尿病肾病[1-2]。
硫化氢(hydrogen sulfide,H2S)是继NO和CO之后新发现的第3种新型气体信号分子,参与机体内许多生理功能的调控[3]。我们前期研究发现外源性补充H2S的供体硫氢化钠(sodium hydrosulfide,NaHS),可以明显减轻1型糖尿病大鼠心肌组织损伤,抑制心肌组织氧化应激及细胞凋亡[4]。然而,外源性H2S对1型糖尿病大鼠肾脏是否具有抗细胞凋亡作用,目前尚不清楚。本实验通过给予大鼠一次性腹腔注射链脲佐菌素(steptozotocin,STZ)建立1型糖尿病肾脏损伤的动物模型,通过外源性给予NaHS(56 μmol/kg)作为H2S的供体,研究外源性H2S对糖尿病大鼠肾功能相关指标、肾脏形态学变化、以及氧化应激和细胞凋亡相关蛋白表达和活性的影响,探讨外源性H2S对1型糖尿病大鼠肾脏损伤的保护作用及机制。
1 材料与方法
1.1主要试剂和仪器
STZ和NaHS购自美国Sigma公司;丙二醛(Malondialdehyde,MDA)和超氧化物歧化酶(Superoxide dismutase,SOD)测定试剂盒购自南京建成生物工程研究所;Caspase-3活性检测试剂盒购自碧云天生物技术研究所;兔抗大鼠β-actin一抗抗体购自proteintech公司;兔抗大鼠Bcl-2和Bax一抗抗体购自博士德生物科技有限公司,山羊抗兔二抗抗体购自biosharp生物技术有限公司。大鼠代谢笼购自南京便诊生物科技有限公司,电泳仪、电转槽和ChemiDoc XRS凝胶成像系统均购自美国Bio-Rad公司。
1.2动物分组及处理
雄性SD大鼠32只(蚌埠医学院实验动物中心提供),体重160~200 g,适应性饲养1周后随机分为正常对照(normal control,NC)组,糖尿病(diabetes mellitus,DM)组,糖尿病治疗(DM treatment,NaHS+DM)组和NaHS对照(NaHS control,NaHS)组(n=8)。DM组和NaHS+DM组大鼠空腹12 h后,一次性腹腔注射STZ 55 mg/kg,72 h后尾静脉采血测空腹血糖值,取血糖值≥16.7 mmol/L为糖尿病模型。造模成功后,NaHS+DM组和NaHS组开始腹腔注射NaHS溶液56 μmol/kg(NaHS作为外源性H2S供体,现用现配,浓度为20 mmol/L),NC组和DM组腹腔注射生理盐水2.8 ml/kg,每天1次,共持续8周。第8周末,大鼠处死前2 d用代谢笼收集24 h尿液,记录尿量,测定24 h尿蛋白总量。
1.3空腹血糖、血清尿素氮和肌酐检测
第8周末,测大鼠空腹体重,用10%水合氯醛(3 ml/kg)麻醉,腹主动脉采血,离心后取血清用自动生化分析仪检测空腹血糖(fasting blood gulcose,FBG)、血尿素氮(blood urea nitrogen,BUN)和血肌酐(serum creatinine,Scr)水平。
1.4HE染色观察肾脏形态学变化
大鼠处死后,速取两侧肾脏,去除包膜,称重,计算肾重指数(双侧肾重/体重,renal index)。左肾分装后置于-80℃冰箱保存;右肾置10%甲醛固定,石蜡包埋、切片,HE染色,光镜下观察肾脏形态学变化。
1.5生化指标检测
取肾脏严格按照试剂盒说明书操作,分别测定MDA含量、SOD和Caspase-3活性。
1.6Western blot检测Bcl-2和Bax 蛋白表达
取肾脏组织50 mg,加细胞裂解液匀浆,离心后取上清,BCA法测定蛋白质浓度。各组取30 μg上样,SDS-PAGE电泳,蛋白转至PVDF膜,5%TBST脱脂奶粉室温封闭2 h后,分别加入一抗1∶400稀释的Bcl-2和Bax多克隆抗体,1∶1 000稀释的β-actin单克隆抗体,4℃孵育过夜。次日,二抗孵育1 h,浓度为1∶1 000。化学发光ECL显色,曝光成像。凝胶成像系统测定条带的灰度值,计算Bcl-2/β-actin和Bax/β-actin蛋白表达的相对量。
1.7统计学处理
2 结果
2.1各组大鼠FBG、BUN和Scr水平比较
与NC组相比,DM组和NaHS+DM组大鼠FBG、BUN和Scr水平明显升高(P<0.05,P<0.01);与DM组相比,NaHS+DM组FBG、BUN和Scr水平明显降低(P<0.05,P<0.01);NaHS组与NC组比较无显著差异(表1)。
2.2各组大鼠24 h尿蛋白、体重、肾重和肾重指数比较
与NC组相比,DM组和NaHS+DM组大鼠体重明显减轻(P<0.01),24 h尿蛋白、双侧肾重和肾重指数明显升高(P<0.05,P<0.01);与DM组相比,NaHS+DM组大鼠体重明显增加(P<0.01),24 h尿蛋白、双侧肾重和肾重指数明显降低(P<0.05,P<0.01);NaHS组与NC组比较无显著差异(表2)。

Tab.
NC:Normal control;DM:Diabetes mellitus;NaHS+DM:DM treatment;NaHS:NaHS control;FBG:Fasting blood glucose;BUN:Blood urea nitrogen;Scr:Serum creatinine
*P<0.05,**P<0.01 vs NC group;#P<0.05,##P<0.01 vs DM group
2.3各组大鼠肾脏形态学变化
HE染色结果显示:NC组肾小球结构正常;DM组较NC组肾小球基底膜增厚,系膜基质增多;而NaHS+DM组肾小球形态基本正常,病理形态学改变明显轻于DM组;NaHS组与NC组比较无明显差异(图1见彩图页Ⅱ)。
2.4肾脏组织MDA含量、SOD和Caspase-3活性的检测
与NC组相比,DM组SOD活性明显下降(P<0.01),MDA含量和Caspase-3活性明显升高(P<0.01);与DM组比较,NaHS+DM组SOD活性明显升高(P<0.01),MDA含量和Caspase-3活性明显下降(P<0.01);NaHS组与NC组比较无显著差异(表3)。

Tab.2 Levels of 24 h urinary protein,body weight,kidney weight and renal ±s,n=8)
NC:Normal control;DM:Diabetes mellitus;NaHS+DM:DM treatment;NaHS:NaHS control
*P<0.05,**P<0.01 vs NC group;#P<0.05,##P<0.01 vs DM group

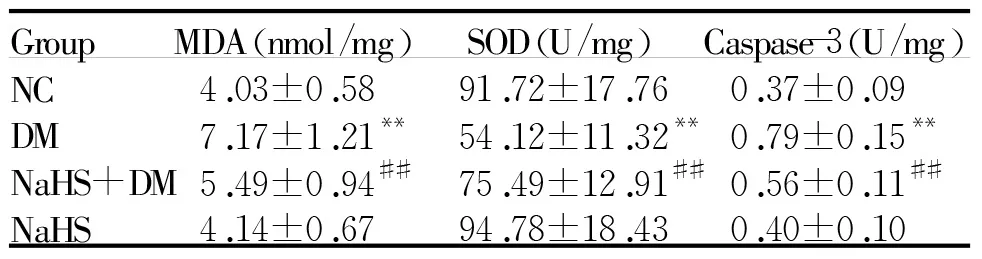
GroupMDA(nmol/mg)SOD(U/mg)Caspase-3(U/mg)NC4.03±0.5891.72±17.760.37±0.09DM7.17±1.21**54.12±11.32**0.79±0.15**NaHS+DM5.49±0.94##75.49±12.91##0.56±0.11##NaHS4.14±0.6794.78±18.430.40±0.10
NC:Normal control;DM:Diabetes mellitus;NaHS+DM:DM treatment;NaHS:NaHS control;MDA:Malondialdehyde;SOD:Superoxide dismutase
**P<0.01 vs NC group;##P<0.01 vs DM group
2.5肾脏组织Bcl-2和Bax的蛋白表达
与NC组比较,DM组Bcl-2蛋白表达降低(P<0.01),Bax蛋白表达增高(P<0.01),Bcl-2/Bax比值下降(P<0.01)。与DM组比较,NaHS+DM组Bcl-2蛋白表达显著增强(P<0.01),Bax蛋白表达明显下降(P<0.01),Bcl-2/Bax比值增高(P<0.01,图2,表4)。

Fig.2Protein expression levels of Bcl-2 and Bax in renal tissue

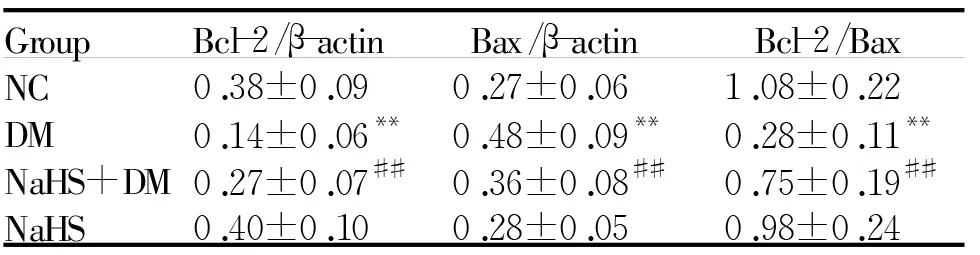
GroupBcl-2/β-actinBax/β-actinBcl-2/BaxNC0.38±0.090.27±0.061.08±0.22DM0.14±0.06**0.48±0.09**0.28±0.11**NaHS+DM0.27±0.07##0.36±0.08##0.75±0.19##NaHS0.40±0.100.28±0.050.98±0.24
NC:Normal control;DM:Diabetes mellitus;NaHS+DM:DM treatment;NaHS:NaHS control
**P<0.01 vs NC group;##P<0.01 vs DM group
3 讨论
糖尿病肾病(DN)是糖尿病严重的微血管并发症,也是导致慢性肾功能衰竭的主要原因。其发病率呈逐年上升趋势,已成为人类健康的重要威胁。DN基本病理改变为肾小球系膜区基质增多、基底膜增厚,临床表现为持续的尿蛋白排泄增加[5]。本实验采用一次性大剂量腹腔注射STZ复制1型糖尿病大鼠模型,观察肾功能指标和形态学变化。结果显示,造模成功8周后,与NC组比较,DM组大鼠体重明显下降,FBG、BUN、Scr、24 h尿蛋白量、双侧肾重和肾重指数均显著升高。HE染色结果显示肾小球基底膜增厚、系膜基质增多,表明DN模型复制成功。
H2S是一种具有臭鸡蛋气味的有毒气体,以往人们一直关注其对机体的毒性作用,直到20世纪90年代中期,H2S被证实是第3种新型气体信号分子[6]。在机体内,内源性H2S是由半胱氨酸磷酸吡多醛-5’-磷酸-依赖性酶包括胱硫醚-β-合成酶(cystathionine -β- synthase,CBS)、胱硫醚-γ-裂解酶(cystathionine-γ-lyase,CSE)及半胱氨酸转移酶催化作用下产生的[4]。研究发现,在人类和其他许多哺乳动物的肾脏中均有CSE和CBS的表达,内源性H2S的增多有效抑制了DN的病理改变[7]。Zhou等[8]研究结果显示,外源性给予糖尿病大鼠NaHS 14 μmol/kg后能够改善肾功能指标和病理结构损伤。本实验结果证实,通过外源性给予大鼠补充H2S的供体NaHS 56 μmol/kg后,NaHS组大鼠各项指标与NC组无显著差异;而与DM组相比,NaHS+DM组大鼠体重明显增加,FBG、BUN、Scr、24 h尿蛋白量、肾重和肾重指数均明显降低,形态学损伤明显改善,结果显示外源性补充H2S对糖尿病大鼠肾脏具有保护作用。
氧化应激在DN的发生和发展中起重要作用[9]。DN时氧化和抗氧化系统的失衡及氧自由基产生过多是肾组织病变的主要发病机制之一。活性氧(reactive oxygen species,ROS)的产生是氧化应激的基本环节,当ROS生成过多时,会破坏组织蛋白,产生脂质过氧化物,进一步扩大氧化损伤[10]。机体中MDA的含量反映氧化应激损伤的程度,SOD可以清除超氧产物,是细胞内还原力水平的检测指标。研究表明,在阿霉素诱导的心肌病中,外源性H2S可以清除氧自由基、降低脂质过氧化物含量,对心脏具有保护作用[11]。本实验结果显示,与NC组比较,DM组MDA含量明显升高,SOD活性明显下降,说明糖尿病大鼠的肾脏存在氧化应激损伤。外源性补充H2S后,NaHS+DM组MDA含量明显降低,SOD活性明显升高,提示H2S可能通过提高SOD活性,减少脂质过氧化物MDA的生成,减轻糖尿病大鼠肾脏的氧化应激损伤。
细胞凋亡在DN的发展中起一定作用,而Bcl-2家族蛋白如Bcl-2、Bax等在细胞凋亡的调节过程中均起重要作用。Bcl-2和Bax可以形成异源二聚体,抑制细胞色素C的释放,继而抑制下游Caspase-3的激活,有效抑制细胞凋亡[12],当Bcl-2和Bax的比值增高时,提示抑制细胞凋亡的作用增强。Caspase-3在Caspase家族中处于关键位置,因此Caspase-3常作为凋亡发生的标志酶。实验结果显示,与NC组比较,DM组Bcl-2蛋白表达明显下降,Bax表达明显升高,Caspase-3活性增高,提示糖尿病大鼠肾脏中存在细胞凋亡。外源性补充H2S后,NaHS+DM组Bcl-2蛋白表达明显升高,Bax蛋白表达明显下降,Caspase-3活性明显下降,提示H2S可以通过上调Bcl-2蛋白表达,下调Bax蛋白表达,继而抑制下游Caspase-3活性,起到抑制细胞凋亡保护肾脏组织的作用。
因此,我们得出结论,糖尿病大鼠肾脏组织存在氧化应激损伤和细胞凋亡,外源性补充H2S能够通过抑制氧化应激和细胞凋亡,改善糖尿病大鼠的肾脏损伤,进而保护糖尿病大鼠的肾脏组织。
[1]Shields J,Maxwell AP.Managing diabetic nephropathy[J].Clin Med,2010,10(5):500-504.
[2]曹延萍,郝咏梅,刘青娟,等.内质网应激及其特有凋亡途径Caspase-12与糖尿病大鼠肾组织固有细胞凋亡之间的关系[J].中国应用生理学杂志,2011,27(2):236-240.
[3]金红芳,杜军保,唐朝枢.“废气不废”:气体信号分子硫化氢的研究进展[J].生理学报,2010,62(6):495-504.[4]贾强,杨锐,马善峰,等.硫化氢对糖尿病大鼠心肌损伤保护作用及其抗凋亡机制[J].安徽医科大学学报,2014,49(2):172-176.
[5]于影,康品方,李徽徽,等.乙醇激动ALDH2对糖尿病大鼠肾脏JNK表达的影响[J].中国应用生理学杂志,2014,30(3):270-273.
[6]Lowicka E,Beltowski J.Hydrogen sulfide(H2S)-the third gas of interest for pharmacologists[J].Pharmacol Rep,2007,59(1):4-24.
[7]Yamamoto J,Sato W,Kosugi T,et al.Distribution of hydrogen sulfide(H2S)-producing enzymes and the roles of the H2S donor sodium hydrosulfide in diabetic nephropathy[J].Clin Exp Nephrol,2013,17(1):32-40.
[8]Zhou X,Feng Y,Zhan Z,et al.Hydrogen sulfide alleviates diabetic nephropathy in a streptozotocin-induced diabetic rat model[J].J Biol Chem,2014,289(42):28827-28834.
[9]Kashihara N,Haruna Y,Kondeti VK,et al.Oxidative stress in diabetic nephropathy[J].Curr Med Chem,2010,17(34):4256-4269.
[10]Forbes JM,Coughlan MT,Cooper ME.Oxidative stress as a major culprit in kidney disease in diabetes [J] .Diabetes,2008,57(6):1446-1454.
[11]Su YW,Liang C,Jin HF,et al.Hydrogen sulfide regulates cardiac function and structure in adriamycin-induced cardiomyopathy[J].Circ J,2009,73(4):741-749.
[12]Lee Y,Gustafsson AB.Role of apoptosis in cardiovascular disease[J].Apoptosis,2009,14(4):536-548.
Protective effect of hydrogen sulfide on kidneys of type 1 diabetic rats
YANG Rui,LIU Xiao-fen,MA Shan-feng,GAO Qin,LI Zheng-hong,JIA Qiang△
(Department of Physiology,Bengbu Medical College,Bengbu 233030,China)
Objective:To explore the protective effects of hydrogen sulfide(H2S)on kidneys of type 1 diabetic rats and its underlying mechanism.Methods:Thirty-two male SD rats were randomly divided into four groups:normal control(NC)group,diabetes mellitus(DM)group,DM treatment(NaHS+DM)group and NaHS control(NaHS)group.The rats from DM group and NaHS+DM group were injected intraperitoneally with Streptozotocin 55 mg/kg to induce type 1 diabetes mellitus(n=8).After modeling,rats in NaHS+DM group and NaHS group were intraperitoneally injected with NaHS solution at the dosage of 56 μmol/kg.After 8 weeks,urinary protein content was detected in urine samples collected for 24 h.and the ratio of kidney weight/body weight(renal index)was determined in isolated kidneys.Besides,the levels of fasting blood glucose(FBG),blood urea nitrogen(BUN)and serum creatinine(Scr)were measured biochemically.The morphological changes of renal tissue were observed by HE staining.The content of malondialdehyde(MDA),the activities of superoxide dismutase(SOD)and Caspase-3 in renal tissue were determined by spectrophotometry.The protein expression levels of Bcl-2 and Bax in renal tissue were detected using Western blot.Results:There was no significant difference in the respective measured indexes in rats between NC group and NaHS group.However,in DM group,the levels of 24 h urinary protein,FBG,BUN,Scr and renal index were increased significantly;HE staining showed that the basement membrane was thickened and the amount of glomerular mesangial matrix was increased;MDA content,Caspase-3 activity and Bax expression levels were increased,while SOD activity and Bcl-2 expression were decreased.Compared with those in DM group,the morphological changes of renal tissue and its function were improved;MDA content,Caspase-3 activity and Bax expression were decreased significantly,while SOD activity and Bcl-2 expression were increased obviously in NaHS+DM group.Conclusion:H2S can protect the kidneys of type 1 diabetic rats,which is related to suppressing oxidative stress and cell apoptosis.
hydrogen sulfide;diabetes mellitus;rat;renal function;oxidative stress;cell apoptosis
国家自然科学基金资助项目(81000074);安徽省高校自然科学研究项目(KJ2013B146,KJ2015B006by,KJ2015A163);蚌埠医学院科研项目(BYKY1312,BYKY1414ZD)
2015-08-13
2016-01-26
△Tel:0552-3175269;E-mail:jiaqiangbbmc@sina.com
R587.1
A
1000-6834(2016)02-181-04
10.13459/j.cnki.cjap.2016.02.023

