缺氧对稳定表达人淀粉样前体蛋白HEK293细胞的存活及阿尔茨海默病相关蛋白表达的影响*
乔 萌,黄 欣,何云凌,周延召,韩 雪,朱玲玲△,范 明,△
(1.首都医科大学神经生物学系,北京 100069;2.军事医学科学院基础医学研究所认知科学研究室,北京 100850)
缺氧对稳定表达人淀粉样前体蛋白HEK293细胞的存活及阿尔茨海默病相关蛋白表达的影响*
乔萌1,黄欣2,何云凌2,周延召2,韩雪1,朱玲玲2△,范明1,2△
(1.首都医科大学神经生物学系,北京 100069;2.军事医学科学院基础医学研究所认知科学研究室,北京 100850)
目的:探讨缺氧对稳定表达人淀粉样前体蛋白的HEK293细胞(HEK293-APP695)存活及相关蛋白表达的影响,为深入研究缺氧对阿尔茨海默病的调节作用提供稳定的细胞模型。方法:利用缺氧手套箱(0.3% O2)处理HEK293-APP695细胞,CCK-8法检测细胞的存活情况;Western blot检测缺氧条件下阿尔茨海默病(AD)相关蛋白APP、APP-CTFs和BACE1的表达变化。结果:缺氧处理后,HEK293-APP695细胞的存活率明显下降,APP表达降低,其剪切体APP-CTFs表达升高。结论:缺氧导致APP剪切的增多,抑制细胞的存活,提示缺氧可能通过影响BACE1的活性在AD的发病进程中起重要的调节作用。
阿尔茨海默病;缺氧;HEK293细胞;淀粉样前体蛋白
阿尔茨海默病(Alzheimer’s disease,AD)是最常见的以认知障碍和痴呆为表型的神经退行性疾病[1]。其患病风险随着年龄的增长而逐渐增加,随着全球人口趋于老龄化,AD发病率日益增高,但目前尚缺乏有效的防治手段。AD的病理学特征主要有β-淀粉样蛋白(beta- amyloid,Aβ)沉积在脑内形成的老年斑块和tau蛋白过度磷酸化形成的神经纤维缠结(neurofibrilary tangles,NFTs)[2]。在诸多关于发病机制的假说中,Aβ假说处于主导地位,Aβ是构成老年斑块的主要成分,其由淀粉样前体蛋白(amyloid peptide precursor,APP)经APP β-位点切割酶1(Beta-site APP-cleaving enzyme1,BACE1)剪切而生成。病理条件下,Aβ异常聚集,这些聚集态的Aβ通过启动炎症反应、氧化应激等一系列的下游事件引起神经元的死亡,最终导致疾病的发生和发展。
缺氧指当组织的氧供应不足或用氧障碍时,导致组织代谢、功能和形态结构发生异常变化的病理过程。由于脑组织耗氧量很高,因此对氧供应不足造成的损伤更加敏感,急性缺氧时低氧诱导因子(hypoxia-induced factor 1α,HIF-1α)及其靶基因的表达上调有利于组织细胞和机体对抗缺氧造成的应激状态,从而对机体具有一定的保护作用[3]。但长时间重度缺氧,机体会通过HIF-1α介导的信号通路诱导凋亡,造成神经损伤[4]。有研究表明,遭受过严重低氧或缺血的个体患AD的风险更高[5]。Sun等在2006年报道,BACE1受HIF-1α的直接调控,在低氧条件下,HIF-1α诱导BACE1表达上调从而加重AD的发生[6]。此外,Fang等报道发现急性缺氧可以通过ERK通路促进tau蛋白的磷酸化,导致神经细胞内tau蛋白的磷酸化增加[7],缺氧造成的tau蛋白过度磷酸化有可能是Aβ的异常聚集造成的下游事件[8]。上述研究结果表明缺氧在AD发病过程中发挥着重要作用。本研究利用稳定表达人淀粉样前体蛋白的HEK293-APP695细胞,建立了稳定的缺氧模型,观察了缺氧对细胞存活的影响,并对其缺氧处理后细胞中APP及其剪切体(amyloid peptide precursor c terminal fragments,APP-CTFs)以及BACE1的表达进行了检测,为后续深入探讨缺氧对AD发病的影响和药物筛选提供稳定的细胞模型。
1 材料与方法
1.1主要试剂
DMEM培养基、DMEM/F12培养基、胎牛血清、G418购自Gbico公司;青/链霉素购自Hyclone公司;胰酶购自Sigma公司;CCK-8购自Dojindo公司;APP兔多抗、β-actin鼠单抗购自Sigma公司;BACE1兔多抗购自Cell Signal Technology公司;其他生化试剂均为国产分析纯。
1.2细胞株及其培养
稳定表达人淀粉样前体蛋白HEK293细胞株(HEK293-APP695)为北京理工大学庆宏教授惠赠,该细胞稳定表达Swedish家族突变K595N/M596L的人APP695基因。细胞培养基为含有10%的胎牛血清(FBS)的DMEM高糖培养基。HEK293-APP695细胞加入G418(100 μg/ml)进行筛选。细胞在37℃,5% CO2环境下培养,取生长良好的细胞进行实验。
1.3低氧处理
细胞传代并置于常氧培养箱孵育24 h后,转至0.3% O2低氧培养箱(COY laboratory products公司)处理24 h或48 h,常氧(20% O2)对照在常氧培养箱(Thermo公司)中培养。
1.4CCK-8检测
将细胞接种于96孔板中,终密度为1×104cells/ml。缺氧处理后加入CCK-8试剂,10 μl/well。放入培养箱孵育3 h,在酶联免疫检测仪(Thermo公司)上测各孔在450 nm波长时的吸光值。
1.5Western blot检测
收集细胞,使用含Cocktail(1∶50,Roche公司)的RIPA裂解液(普利莱公司),置于冰上充分裂解细胞,4℃,12 000 r/min离心20 min,保留上清,以Bradford法测定蛋白总浓度,样品冻存于-80℃贮存。取部分样品加入5×上样缓冲液于沸水浴中变性10 min。SDS-PAGE电泳分离蛋白后,湿转法转移蛋白到PVDF膜上,室温封闭2 h,加入一抗(抗体比例:APP 1∶10 000;BACE1 1∶1 000;β-actin 1∶10 000),4℃孵育过夜。加入二抗:羊抗鼠IgG或羊抗兔IgG(Bio-Rad公司,1∶5 000),室温孵育2 h ,ECL显色,暗室中胶片曝光显影。
1.6统计学处理
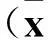
2 结果
2.1稳定表达人淀粉样前体蛋白细胞株的特性
在正常培养条件下,随着培养时间的延长,两种细胞在不同时间点的存活并没有差异(图1 A、图1B)。进一步通过Western blot实验,检测了两种细胞中APP的表达情况,结果显示,HEK293-APP695细胞可稳定表达APP,其蛋白表达量明显高于HEK293细胞(图1C),可作为研究AD的一种细胞模型,进行后续的研究。
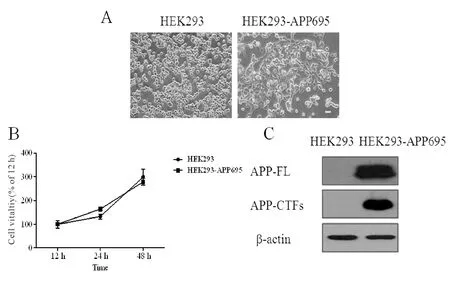
Fig.1Characteristics of cultured HEK293-APP695 cells
A:Morphological observation of cells under the microscope(Olympus,bar=50 μm);B:Growth curve of cultured cells;C:Expression of APP and APP-CTFs in cells
2.2缺氧对细胞存活的影响
采用CCK-8方法比较了缺氧(0.3% O2)对细胞存活率的影响。结果显示:缺氧处理24 h后,与常氧组相比,HEK293细胞的存活率无明显变化,但HEK293-APP695细胞的存活率显著下降(P<0.01);缺氧处理48 h后,两种细胞的存活能力均显著下降,与对照组相比较,缺氧后HEK293-APP695细胞之间连接减少,分布疏散,缺氧促进了细胞的死亡(P<0.01,图2)。
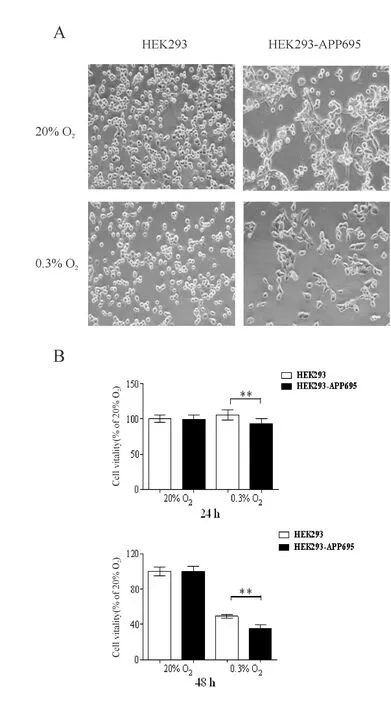
Fig.2Effects of hypoxia(0.3% O2)on cell survival
A:Morphological observation of cells were exposed to hypoxia(0.3% O2,bar=50 μm);B:Survival rate of cells were exposed to 0.3% O2for 24 h or 48 h(n=10)
**P<0.01 vs HEK293 group
2.3缺氧对细胞中AD相关蛋白表达的影响
利用Western blot法检测缺氧处理后HEK293-APP695细胞中APP及其剪切体APP-CTFs和BACE1的表达变化。结果显示:HEK293-APP695细胞中APP表达较常氧组明显减少,而APP剪切体APP-CTFs的表达明显升高,BACE1的表达略有升高(P<0.05,图3,表1)。
3 讨论
目前AD发病机制的研究大部分都是围绕β-淀粉样蛋白级联假说进行的,该假说认为Aβ沉积形成的老年斑块是导致AD发生的主要原因。在体内,淀粉样前体蛋白APP有两种蛋白分解代谢途径。其中主要的一条代谢途径是由α分泌酶和γ分泌酶介导的非淀粉样剪切途径。而另一条途径是APP经过β分泌酶(BACE1)和γ分泌酶介导的淀粉样剪切途径,因为α分泌酶和β分泌酶的作用位点不一样,所以只有在β分泌酶(BACE1)的剪切作用后才会产生Aβ[2]。因此,BACE1的异常剪切是老年斑块形成的主要原因之一。已有研究显示,慢性低氧可以通过增加Aβ的生成,减少Aβ的降解进而影响AD的发生。在人神经母细胞瘤SH-SY5Y细胞中,低氧可以降低和解整合素金属蛋白酶10(disintegrin and metalloproteinase domain containing protein 10,ADAM10)的表达,从而降低β-分泌酶的表达,并提高BACE1的表达[9]。同时,也有研究证实,低氧可以通过调节β和γ分泌酶而使Aβ的生成增加[10]。上述研究表明,缺氧是AD发生发展的重要因素。
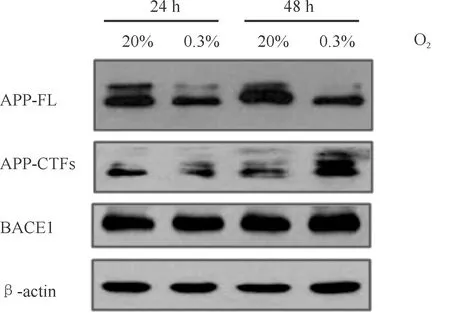
Fig.3Effect of hypoxia(0.3% O2)on the expression of AD-related protein in HEK293-APP695 cells
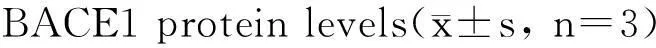

AD-relatedpro-tein20%O2-24h0.3%O2-24h20%O2-48h0.3%O2-48hAPP-FL10.694±0.120*0.928±0.1300.565±0.060*APP-CTFs11.337±0.3101.162±0.4502.161±0.350*BACE111.181±0.1731.058±0.1031.354±0.161
*P<0.05 vs 20% O2-24 h
目前体外研究AD的细胞模型主要有Aβ诱导培养的细胞模型和稳定表达淀粉样前体蛋白细胞株。研究表明,利用Aβ25-35诱导原代培养的海马神经元的AD细胞模型细胞活性降低,电镜观察发现:细胞表面呈泡状,核染色质凝集,凋亡小体形成,说明Aβ可以引起神经凋亡,导致细胞退变[11]。稳定表达人淀粉样前体蛋白的HEK293细胞系是目前较常使用研究Aβ产生和清除机制的细胞模型,其特点是反映了细胞中APP的代谢过程,而不只是局限性的评价Aβ的变化。因此,本研究工作探讨了稳定表达人淀粉样前体蛋白HEK293细胞(HEK293-APP695)存活及相关蛋白表达的影响。细胞水平上的研究表明,缺氧(0.3% O2)明显降低了HEK293-APP695细胞中的APP的表达,同时增加了APP-CTFs的生成,证明缺氧能够促进APP的剪切,而APP剪切的增多有可能导致Aβ的生成增加,进而影响AD的发展,并且还观察到BACE1在缺氧条件下的表达略有升高,缺氧有可能通过增加BACE1的活性及其它分泌酶的表达和活性而增加APP的剪切。鉴此本研究为深入探讨缺氧对AD发生发展的作用提供了稳定的细胞模型,也为后续细胞水平的药物筛选奠定实验基础。
[1]Huang Y,Mucke L.Alzheimer mechanisms and therapeutic strategies [J].Cell,2012,148(6):1204-1222.
[2]王利利,纳鑫,朱小楠,等.Tau/APP/PS1三转基因小鼠模型的建立及生物学特征[J].中国应用生理学杂志,2012,28(6):294-297.
[3]Matsuda T,Abe T,Wu JL,et al.Hypoxia-inducible factor-1alpha DNA induced angiogenesis in a rat cerebral ischemia model [J].Neurol Res,2005,27(5):503-508.
[4]Zhang X,Zhou K,Wang R,et al.Hypoxia-inducible factor 1alpha(HIF-1alpha)-mediated hypoxia increases BACE1 expression and beta-amyloid generation [J].J Biol Chem,2007,282(15):10873-10880.
[5]Peers C,Pearson HA,Boyle JP.Hypoxia and Alzheimer's disease [J].Essays Biochem,2007,43:153-164.
[6]Sun X,He G,Qing H,et al.Hypoxia facilitates Alzheimer's disease pathogenesis by up-regulating BACE1 gene expression [J].Proc Natl Acad Sci U S A,2006,103(49):18727-18732.
[7]Fang H,Zhang LF,Meng FT,et al.Acute hypoxia promote the phosphorylation of tau via ERK pathway [J].Neurosci Lett,2010,474(3):173-177.
[8]Wen Y,Yang S,Liu R,et al.Transient cerebral ischemia induces aberrant neuronal cell cycle re-entry and Alzheimer's disease-like tauopathy in female rats[J].J Biol Chem,2004,279(21):22684-22692.
[9]Marshall AJ,Rattray M,Vaughan PF.Chronic hypoxia in the human neuroblastoma SH-SY5Y causes reduced expression of the putative alpha-secretases,ADAM10 and TACE,without altering their mRNA levels [J].Brain Res,2006,12(1):18-24.
[10]Li L,Zhang X,Yang D,et al.Hypoxia increases Abeta generation by altering beta- and gamma-cleavage of APP [J].Neurobiol Aging,2009,30(7):1091-1098.
[11]Loo DT,Copani A,Pike CJ,et al.Apoptosis is induced by beta-amyloid in cultured central nervous system neurons[J].Proc Natl Acad Sci U S A,1999,90(18):7951-7955.
Effects of hypoxia on the survival and Alzheimer's disease-related protein expression in HEK293 cells stably expression APP695 protein
QIAO Meng1,HUANG Xin2,HE Yun-ling2,ZHOU Yan-zhao2,HAN Xue1,ZHU Ling-ling2△,FAN Ming1,2△
(1.Department of Neurobiology,Capital Medical University,Beijing 100069; 2.Department of Cognitive Science,Beijing Institute of Basic Medical Science,Beijing 100850,China)
Objective:To further study the regulation of hypoxia on Alzheimer’s disease(AD)pathogenesis,we investigate the effect of hypoxia on the effect of cell survival and expression of related proteins in HEK293 cells stably expressing APP695 Swedish mutantK595N/M596L(HEK293-APP695 cells).Methods:HEK293-APP695 cells were cultured at hypoxia condition(0.3% O2).The survival rate of HEK293-APP695 cells was measured by CCK-8 assay.The protein expression levels of APP,APP-CTFs and BACE1 were detected by Western blot.Results:The survival of HEK293-APP695 cells was obviously decreased after exposed to hypoxia.The expression of APP was reduced,and the expression of APP-CTFs was increased under hypoxia.Conclusion:Our data indicate that hypoxia accelerated cell death of HEK293-APP695 cells by increasing the cleavage of APP and production of β-secretase(β-site amyloid precursor protein cleavage enzyme1,BACE1).
Alzheimer’s disease;hypoxia;HEK293-APP695;APP
国家973计划资助项目(2011CB910800,2012CB518200)
2015-04-07
2015-10-10
△Tel:010-66931315;E-mail:fanmingchina@126.com;linglingzhu@hotmail.com
Q189
A
1000-6834(2016)02-106-04
10.13459/j.cnki.cjap.2016.02.003

