心肌缺血预适应循环血中微囊泡对大鼠心肌I/R损伤的作用*
王艺璐,刘 淼,尚 曼,王 瑶,张 琦,王少勋,韦 苏,张琨玮,刘 超,吴艳娜,宋君秋,刘艳霞
(天津医科大学基础医学院药理学教研室,天津 300070)
心肌缺血预适应循环血中微囊泡对大鼠心肌I/R损伤的作用*
王艺璐,刘淼,尚曼,王瑶,张琦,王少勋,韦苏,张琨玮,刘超,吴艳娜,宋君秋△,刘艳霞△
(天津医科大学基础医学院药理学教研室,天津 300070)
目的:研究心肌缺血预适应(IPC)大鼠循环血中微囊泡(MVs)对大鼠在体心肌缺血/再灌注(I/R)损伤的作用及相关机制。方法:反复短暂结扎/松开大鼠冠状动脉左前降支建立大鼠IPC模型,自腹主动脉取血,超速离心法分离循环血中的IPC-MVs,并对其进行流式鉴定。建立在体大鼠心肌I/R模型,股静脉注射IPC-MVs 7 mg/kg。HE染色观察心肌形态学变化,TTC染色检测心肌梗死范围,TUNEL染色检测心肌细胞凋亡率。比色法测定血清乳酸脱氢酶(LDH)活力,分光光度法测定心肌组织 caspase 3活力,Western blot法检测心肌组织 Bcl-2、Bax蛋白表达水平。结果:流式细胞术检测IPC-MVs浓度为4380±745个/μl。与I/R组比较,IPC-MVs能够减轻I/R大鼠心肌组织损伤,缩小心肌梗死范围(P<0.01),减少心肌细胞凋亡数量(P<0.01),明显降低血清 LDH 活力(P<0.01),降低心肌组织caspase 3活力(P<0.01),升高Bcl-2蛋白表达(P<0.01),降低Bax蛋白表达(P<0.01),升高Bcl-2/Bax比值(P<0.01)。结论:IPC-MVs显著减轻大鼠在体心肌I/R损伤,通过上调心肌组织中Bcl-2的蛋白表达,下调Bax的蛋白表达,升高Bcl-2/Bax比值,降低caspase 3活力而发挥心肌保护作用。
细胞微囊泡;心肌缺血预适应;心肌缺血/再灌注;大鼠;细胞凋亡
缺血性心脏病(ischemic heart disease,IHD)是严重危害人类健康的疾病。心肌缺血、缺氧导致心肌组织缺血性损伤,恢复缺血部位血流灌注又引起严重的再灌注损伤,明显影响患者的预后。在缺血心肌保护方面的研究发现,结扎冠状动脉使心脏经历几次反复短暂的I/R后,对随后长时间I/R损伤的耐受性增强,表现为缩小心肌梗死范围、减少细胞凋亡、缓解心肌顿抑、减轻心律失常等,这种现象被称之为心肌缺血预适应(ischemic preconditioning,IPC),IPC是内源性心脏保护机制[1]。有关IPC分子机制的研究发现,IPC增加心肌保护性蛋白的表达,促进内源性活性物质的生成和释放,从而保护心肌细胞膜和线粒体等重要细胞器,抑制心肌细胞凋亡。然而IPC心肌保护作用的分子机制仍未被完全阐明。
细胞微囊泡(microvesicles,MVs)是细胞激活或者凋亡时释放到胞外的膜性囊泡样结构,MVs可以携带母体细胞中的蛋白质、DNA、RNA和细胞因子,或将母细胞的膜受体和细胞器等转移至靶细胞,从而介导细胞间信息的传递,其在心血管系统疾病中的作用已引起广泛地关注[2]。研究发现,MVs对心肌具有保护作用[3-4]。然而IPC模型大鼠循环血中的MVs是否对在体大鼠心肌I/R损伤具有保护作用尚未见文献报道。本实验建立大鼠IPC模型,提取循环血中的IPC-MVs,探讨IPC-MVs对在体大鼠心肌I/R损伤的影响及其相关机制。
1 材料与方法
1.1材料
健康雄性Wistar大鼠,3~6个月龄,体重240~260 g,清洁级,由军事医学科学院卫生学环境医学研究所提供。1、2 μm标准微球,Molecular Probe公司;LDH检测试剂盒,南京建成生物工程研究所;TUNEL细胞凋亡检测试剂盒,Roche公司;caspase 3检测试剂盒,江苏碧云天生物技术研究所;Anti-Bcl-2及anti-β-actin,Cell Signaling Technology公司;Anti-Bax,Santa Cruz公司。
1.2IPC-MVs的分离
大鼠腹腔注射25 %乌拉坦(1 g/kg),麻醉后固定在手术台上。行颈动脉插管,测量血压。气管插管后,开胸连接呼吸机,暴露心脏。于冠状动脉左前降支(LAD)下穿一根丝线,结扎LAD缺血5 min,松开LAD再灌注5 min,经历3个循环,建立大鼠 IPC模型。手术操作结束后自大鼠腹主动脉取血,室温2 600 ×g离心15 min,缓慢吸取上清后于室温,10 000×g离心5 min,再次收集上清得无血小板血清(platelet-free plasma,PFP),取少量PFP经多聚甲醛固定后,用于流式检测IPC-MVs。剩余PFP于4℃,33 000 r/min,超速离心150 min,弃上清,沉淀为IPC-MVs,用生理盐水(normal saline,NS)100 μl重悬后,BCA法进行蛋白定量,-80 ℃保存备用。
1.3IPC-MVs的流式鉴定
根据本实验室前期的实验方法进行测定[5]。采用1 μm标准微球做粒径对照,2 μm标准微球用于计数,Accuri C6流式细胞仪进行检测。将前向角散射信号(forward scatter,FSC)及侧向角散射信号(side scatter,SSC)均置于Log通道,设置FSC阈值最小值为30 000。取稀释后的1、2 μm混合标准微球涡旋后上样,建立FSC-SSC对数散点图,并调节光电倍增管电压。MVs的粒径小于1 μm,将粒径小于1 μm的区域设门R1,定义此区域中的粒子群即为IPC-MVs。取封闭后的PFP样本加入2 μm标准微球涡旋后上样,分析样本中的微粒。
1.4IPC-MVs处理在体I/R损伤大鼠
大鼠随机分为3组(n=8):假手术(Sham)、I/R及IPC-MVs+I/R。Sham 组,LAD下穿一丝线后旷置150 min;I/R组,LAD缺血30 min,再灌注120 min;IPC-MVs+I/R组,LAD缺血30 min,再灌注120 min,缺血25 min时自股静脉注射IPC-MVs 7 mg/kg,其他两组注射相同体积的NS。
1.5心肌组织形态学检测
3组大鼠均于再灌注120 min迅速取下心脏,用冰冷NS洗净残血。心脏穿线部位与心尖之间下1/3处,用锋利刀片垂直于心脏长轴切开,将靠近心尖的心肌组织置于10 %福尔马林溶液室温固定24 h,常规石蜡包埋、切片、染色,观察心肌形态学改变。
1.6心肌细胞凋亡检测
组织处理方法同1.5,切片的荧光染色处理参照试剂盒说明书。使用光学显微镜对荧光染色的心肌组织切片进行高功率放大(×400),并拍照。每张切片随机选取10个高倍视野,分别计数凋亡阳性心肌细胞数和心肌细胞总数,各取平均值,以二者的百分比值作为心肌细胞凋亡指数(apoptotic index,AI)。
1.7心肌梗死面积检测
于再灌注120 min原位结扎LAD,股静脉注射0.6%台盼蓝2 ml。取心脏冷冻后切成约1 mm厚的薄片,1% TTC溶液37℃避光孵育10 min,10%福尔马林溶液室温固定24 h。灰白色区域为梗死区(infarct size,IS),砖红色区域为危险区(area at risk,AAR),蓝色区域为正常心肌组织。将IS和AAR分别从心肌组织中分离,用电子天平精确称重,计算IS与AAR重量比值(IS/AAR %),用以表示梗死面积的相对大小。
1.8血清LDH活力检测
大鼠于麻醉后、缺血30 min及再灌注120 min,分别自股静脉取血0.2 ml。室温下2 000 ×g离心20 min,取血清置于-20 ℃冰箱保存直至检测。参照试剂盒说明书采用比色法对血清LDH活力进行检测。
1.9心肌组织caspase 3活性检测
取大鼠左室前壁心肌组织匀浆,4℃,18 000 ×g,离心15 min提取蛋白,Bradford法进行蛋白定量。参照试剂盒说明书使用微量酶标仪读取405 nm处吸光度,绘制标准曲线,计算样品中caspase 3活性。
1.10 Western blot法检测Bcl-2及Bax的表达
心肌组织使用Western及IP细胞裂解液冰上裂解匀浆,4℃,18 000 ×g,离心15 min提取蛋白,BCA法进行蛋白定量。蛋白100 μg在12 %的分离胶上电泳并转移至PVDF膜。5%脱脂奶粉室温封闭2 h,分别孵育Bcl-2及Bax抗体(anti-Bcl-2 1∶500;anti-Bax 1∶1 000),4℃过夜。TBST洗膜3次,将PVDF膜与IgG抗体(1∶1 000)震荡孵育2 h,β-actin(1∶1 000)作为内参。蛋白印迹通过化学发光试剂发出荧光,条带的灰度值通过Quantity One软件分析。
1.11统计学处理
2 结果
2.1IPC-MVs的鉴定
流式检测结果显示,1、2 μm标准微球分别密集成团分布在FSC-SSC散点图中,R1是为检测IPC-MVs所设的门(图1A)。分析PFP中的粒子,可见R1门中有较集中的粒子信号群,粒径小于1 μm,即IPC-MVs,检测到其浓度为4380±745 cells/μl(图1B)。
2.2组织病理学结果
HE染色结果显示,Sham组心肌细胞边界完整,心肌纤维排列整齐,结构清晰。I/R组胞浆染色深浅不一,部分细胞核消失,炎细胞浸润,红细胞渗出,组织间质水肿,心肌组织坏死明显。与I/R组比较,IPC-MVs+I/R组心肌损伤程度显著降低,仅见部分炎细胞浸润和少量红细胞渗出(图2A)。 TUNEL染色结果显示,凋亡阳性细胞核呈棕黄色,Sham组仅有少量阳性细胞,I/R组阳性细胞数量显著增多。与I/R组比较,IPC-MVs+I/R组心肌细胞凋亡程度明显减轻(图2B)。
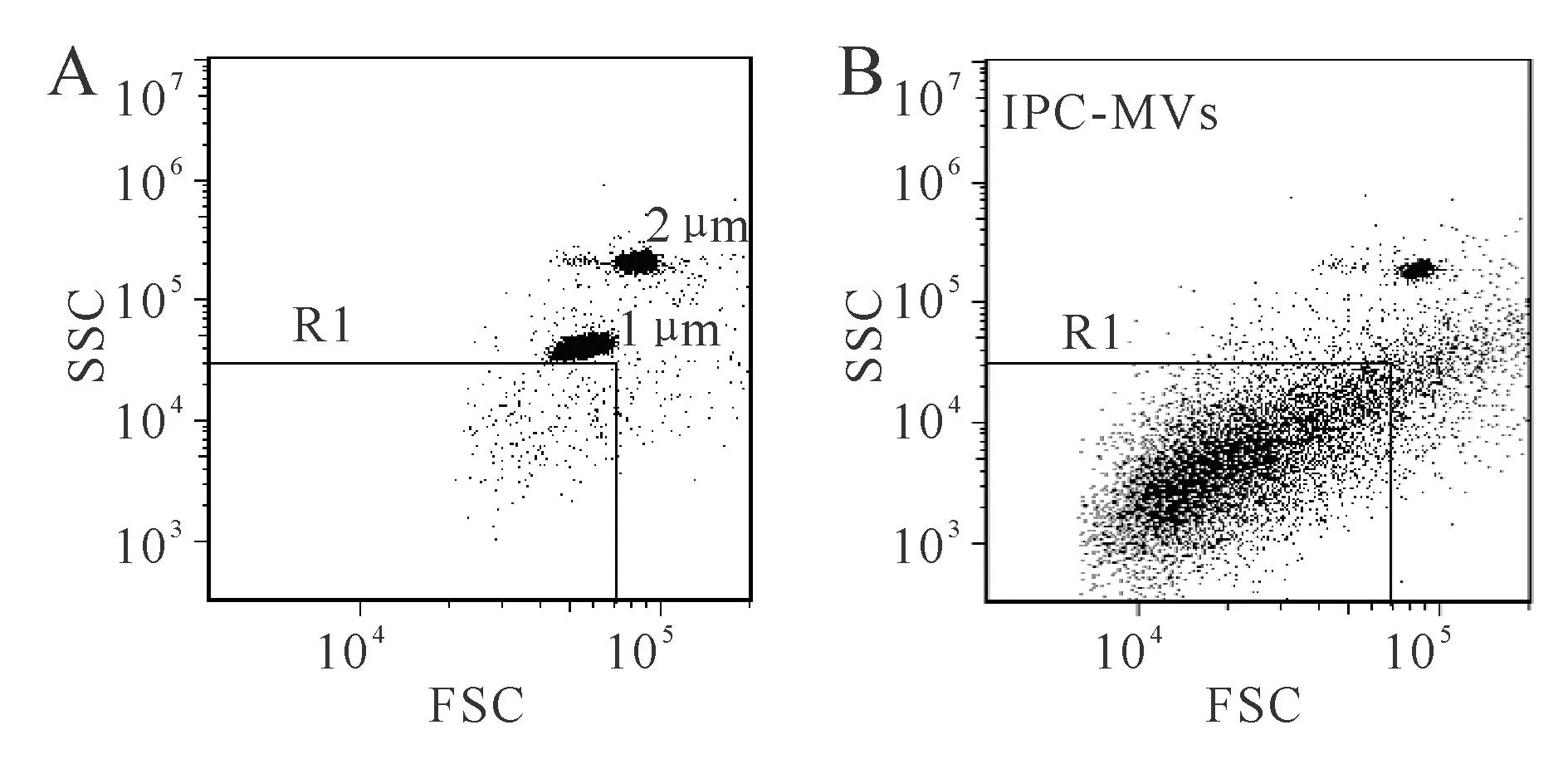
Fig.1Characterization of IPC-MVs by flow cytometry
A:The gating of IPC-MVs;B:Representative dot plots for IPC-MVs in gate R1
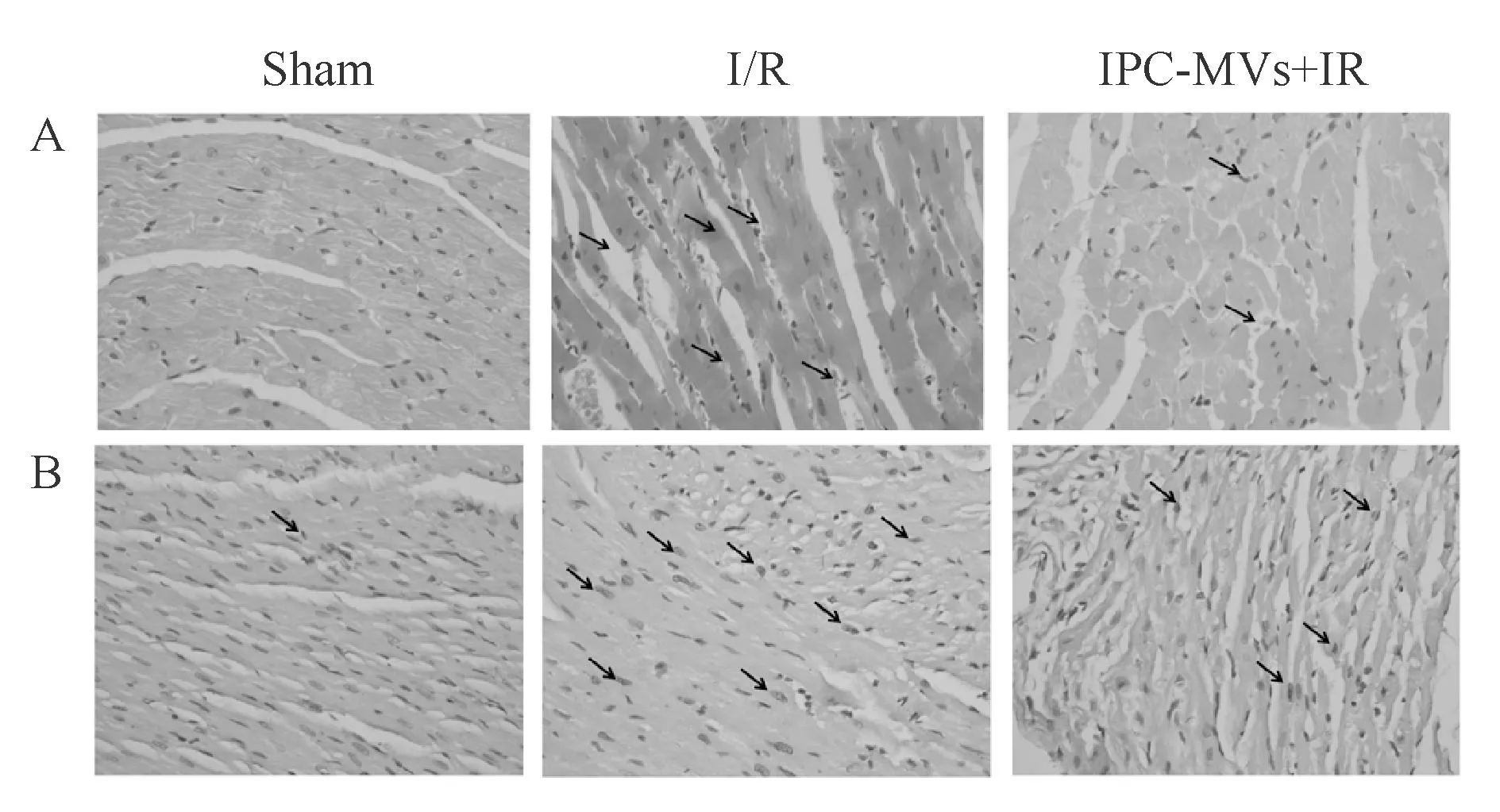
Fig.2Effects of ischemic preconditioning-microvesicles(IPC-MVs)on the morphological changes of myocardial tissues and the myocardial apoptosis(×400)
A:HE staining;B:TUNEL staining
2.3IPC-MVs对心肌梗死面积及心肌细胞凋亡的影响
与I/R组比较,IPC-MVs+I/R组IS/AAR %显著减小(28.73%±4.02% vs 40.68%±3.24%,P<0.01,图3A),两组间AAR重量无显著性差异。Sham组心肌细胞AI仅为4.58%±1.96%,与I/R组比较,IPC-MVs+I/R组AI显著降低(19.98%±1.51% vs 35.75%±1.20%,P<0.01,图3B)。
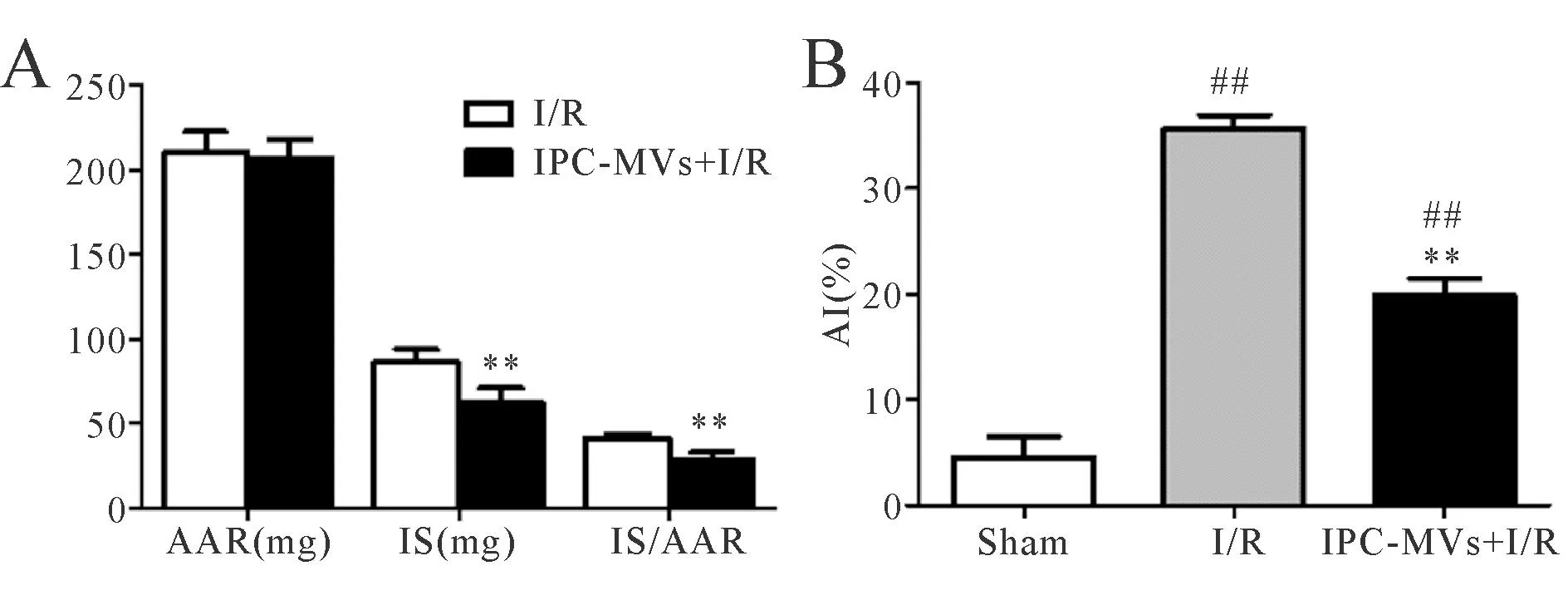
A:Myocardial infarct size;B:Apoptotic index(AI);AAR:Area at risk;IS:Infarct size
**P<0.01 vs I/R group;##P<0.01 vs sham group
2.4IPC-MVs对血清LDH活力的影响
麻醉后(Baseline),3组血清LDH活力无明显差别。缺血30 min及再灌注120 min时,与Sham组相比,I/R组及IPC-MVs+I/R组均明显升高。再灌注120 min时,与I/R组比较,IPC-MVs+I/R组血清LDH活力明显降低(10.83±1.03 vs 13.01±1.10 U/ml,P<0.01,图4)。
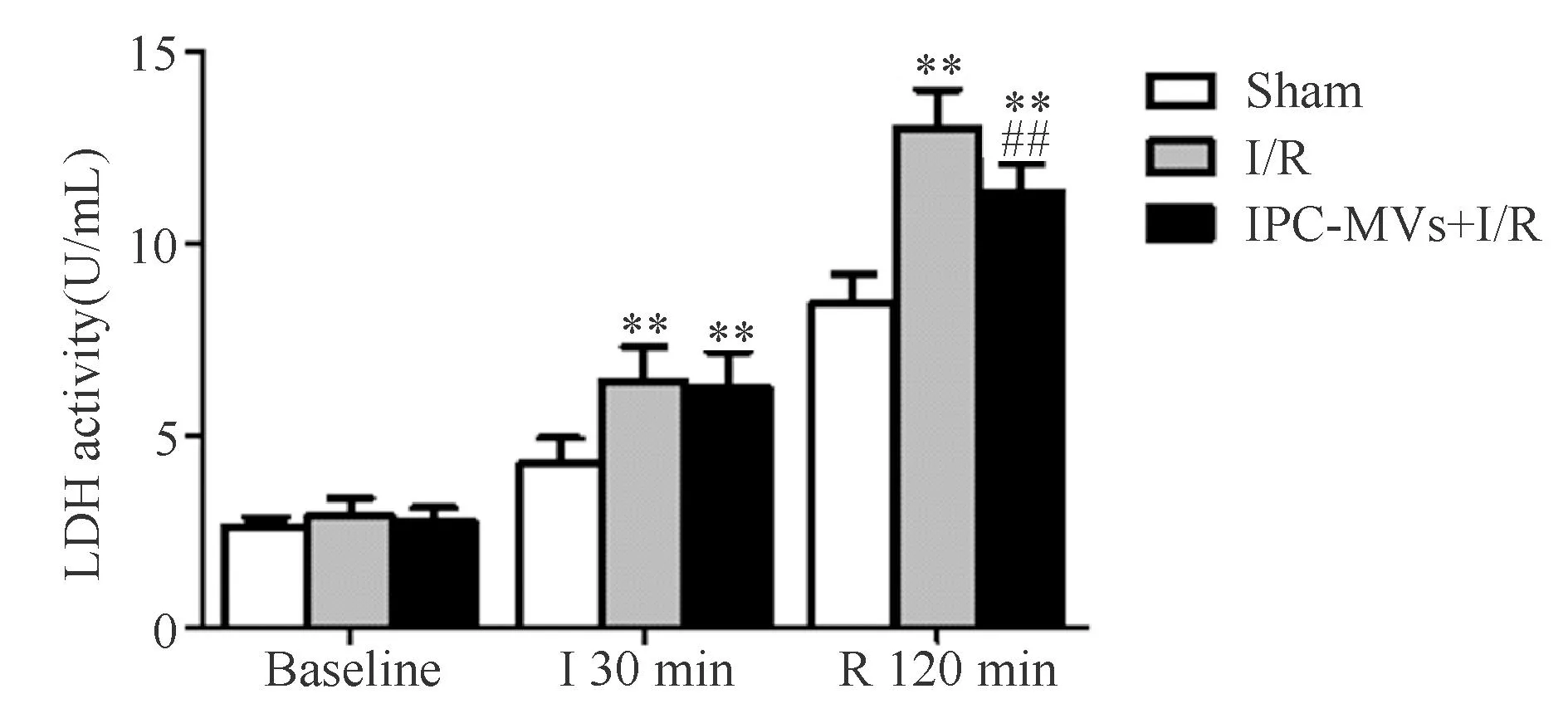
**P<0.01 vs Sham group;##P<0.01 vs I/R group
2.5IPC-MVs对心肌组织caspase 3活力及Bcl-2、Bax表达的影响
与I/R组比较,IPC-MVs+I/R组caspase 3活力明显下降(52.43±2.55 vs 70.25±3.21 U/μg,P<0.01,图5A),Bcl-2蛋白表达明显升高(0.81±0.11 vs 0.51±0.24 ,P<0.01,图5B),Bax蛋白表达明显下降(0.38±0.15 vs 0.60±0.13 ,P<0.01,图5B),Bcl-2/Bax比值显著升高(1.54±0.25 vs 0.86±0.17,P<0.01,图5C)。
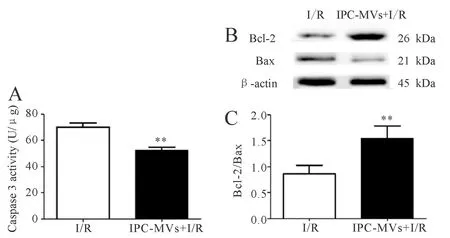
A:Caspase 3 activity;B:Western blots of Bcl-2 and Bax;C:Quantitative analysis of the ratio of Bcl-2/Bax
**P<0.01 vs I/R group
3 讨论
IPC是迄今为止发现的最强有力的内源性心肌保护机制,对I/R损伤心肌产生强大的保护作用,其作用机制与体内产生多种生物活性物质有关,但其作用机制并未全部阐明。本研究结果证实,IPC-MVs对大鼠心肌I/R损伤具有保护作用,并发现其通过上调I/R心肌组织中Bcl-2的蛋白表达,下调Bax的蛋白表达,升高Bcl-2/Bax比值,降低caspase 3活力来发挥心肌保护作用。
研究发现MVs对心脏具有保护作用[6-8],IPC是否通过MVs发挥保护作用仅见少数文献报道。有研究者采用大鼠离体Langendorff心脏IPC模型,分离提取灌流液中的MVs处理离体灌流心脏I/R模型,IPC-MVs能够发挥心脏保护作用[4]。本实验自股静脉注射IPC-MVs 7 mg/kg到心肌I/R模型大鼠体内,观察大鼠循环血中IPC-MVs对在体大鼠I/R损伤的作用。心肌梗死面积测定是反映组织损伤最直观的指标,亦是反映治疗缺血性损伤是否有效的客观证据。TTC染色结果显示,循环血中的IPC-MVs可显著缩少I/R模型大鼠心肌梗死面积。同时HE染色结果显示,IPC-MVs能够使I/R大鼠心肌组织损伤明显减轻。本研究对血清LDH活力这一生化指标进行检测,发现其变化趋势与心梗面积结果相同。以上均提示循环血中的IPC-MVs对I/R大鼠心肌损伤具有保护作用。
心肌I/R损伤的全过程中均可发生细胞凋亡。有研究表明,MVs具有抗凋亡作用[9-10]。因而,本实验在证实循环血中的IPC-MVs能明显减轻I/R大鼠心肌损伤的基础上,进一步研究IPC-MVs在心肌细胞凋亡中可能发挥的作用及作用机制。本研究通过TUNEL染色法,定性、定量的检测心肌细胞凋亡,股静脉注射IPC-MVs 7 mg/kg能明显减轻I/R大鼠心肌组织的细胞凋亡率,这一结果表明IPC-MVs能够抑制I/R心肌细胞凋亡,对I/R心肌产生保护作用。Caspase 3 作为 caspase 级联反应的最后通路,在执行细胞凋亡中起关键作用。有研究者证实,来自多能干细胞的MVs能通过降低小鼠I/R心肌组织内caspase 3的表达从而抑制心肌细胞凋亡[3]。本实验对心肌组织caspase 3活力进行检测,大鼠经历心肌I/R损伤后,心肌组织中caspase 3活力显著增高,IPC-MVs的处理可以降低其升高的幅度,这一结果可以看出IPC-MVs抑制心肌细胞凋亡的机制与降低心肌细胞中caspase 3的活力相关。
Bcl家族蛋白的活性与心肌细胞凋亡密切相关。Bcl家族蛋白包括促进和抑制细胞凋亡两种功能相反的蛋白质,两类蛋白的含量和功能状态之间的平衡是细胞调控凋亡的重要机制[11]。有报道,大鼠心肌I/R损伤中,Bcl-2蛋白表达下降,Bax蛋白表达上升,Bcl-2/Bax比值显著下降[12]。IPC可通过升高大鼠I/R心肌组织中Bcl-2蛋白的表达从而抑制心肌细胞凋亡[13]。另有报道,人T淋巴细胞来源的MVs可通过上调Bcl-2、下调Bax的表达,减少由放射菌素D引起的内皮细胞凋亡[14]。本实验着重探讨IPC-MVs对I/R大鼠心肌细胞凋亡相关蛋白Bcl-2/Bax表达的影响。通过Western blot法检测发现,大鼠经历心肌I/R损伤后,Bcl-2蛋白表达下降,Bax蛋白表达上升,IPC-MVs可明显升高Bcl-2蛋白表达,降低I/R诱导的Bax蛋白表达。提示IPC-MVs抑制心肌细胞凋亡的机制与上调Bcl-2蛋白表达,下调Bax蛋白表达,升高Bcl-2/Bax的比值相关。
本研究发现IPC-MVs对 I/R大鼠心肌具有保护作用,并证明其机制为上调I/R心肌组织中Bcl-2的蛋白表达,下调Bax的蛋白表达,升高Bcl-2/Bax比值,降低caspase 3活力。其他相关的保护机制仍需进一步探讨,随着对IPC-MVs研究的深入,将为IHD的治疗提供新的实验基础。
[1]Williams TM,Waksman R,De Silva K,et al.Ischemic preconditioning-an unfulfilled promise [J].Cardiovasc Revasc Med,2015,16(2):101-108.
[2]Burger D,Schock S,Thompson CS,et al.Microparticles:biomarkers and beyond [J].Clin Sci(Lond),2013,124(7):423-441.
[3]Wang Y,Zhang L,Li Y,et al.Exosomes/microvesicles from induced pluripotent stem cells deliver cardioprotective miRNAs and prevent cardiomyocyte apoptosis in the ischemic myocardium [J].Int J Cardiol,2015,192:61-69.
[4]Giricz Z,Varga ZV,Baranyai T,et al.Cardioprotection by remote ischemic preconditioning of the rat heart is mediated by extracellular vesicles [J].J Mol Cell Cardiol,2014,68(2):75-78.
[5]LIU M,WANG Yi-lu,SHANG M,et al.Flow cytometric analysis of circulating microvesicles derived from myocardial schemic preconditioning and cardioprotecytion of ischemia/reperfusion injury in rats [J].Chin J Appl Physiol,2015,31(6):524-531.
[6]Bian S,Zhang L,Duan L,et al.Extracellular vesicles derived from human bone marrow mesenchymal stem cells promote angiogenesis in a rat myocardial infarction model [J].J Mol Med(Berl),2014,92(4):387-397.
[7]Jansen F,Yang X,Baumann K,et al.Endothelial microparticles reduce ICAM-1 expression in a microRNA-222-dependent mechanism [J].J Cell Mol Med,2015,19(9):2202-2214.
[8]Yu B,Gong M,Wang Y,et al.Cardiomyocyte protection by GATA-4 gene engineered mesenchymal stem cells is partially mediated by translocation of miR-221 in microvesicles [J].PLoS One,2013,8(8):e73304.
[9]Gu S,Zhang W,Chen J,et al.EPC-derived microvesicles protect cardiomyocytes from Ang II-induced hypertrophy and apoptosis [J].PLoS One,2014,9(1):e85396.
[10]Vasina EM,Cauwenberghs S,Staudt M,et al.Aging- and activation-induced platelet microparticles suppress apoptosis in monocytic cells and differentially signal to proinflammatory mediator release [J].Am J Blood Res,2013,3(2):107-123.
[11]Liu Y,Shi L,Liu C,et al.Effect of combination therapy of propofol and sevoflurane on MAP2K3 level and myocardial apoptosis induced by ischemia-reperfusion in rats [J].Int J Clin Exp Med,2015,8(4):6427-6435.
[12]Wang Y,Li X,Wang X,et al.Ginsenoside Rd attenuates myocardial ischemia/reperfusion injury via Akt/GSK-3beta signaling and inhibition of the mitochondria-dependent apoptotic pathway [J].PLoS One,2013,8(8):e70956.
[13]Lai CC,Tang CY,Chiang SC,et al.Ischemic preconditioning activates prosurvival kinases and reduces myocardial apoptosis [J].J Chin Med Assoc,2015,78(8):460-468.
[14]Soleti R,Lauret E,Andriantsitohaina R,et al.Internalization and induction of antioxidant messages by microvesicles contribute to the antiapoptotic effects on human endothelial cells [J].Free Radic Biol Med,2012,53(11):2159-2170.
Effects of circulating microvesicles derived from myocardial ischemic preconditioning on myocardial ischemia/reperfusion injury in rats
WANG Yi-lu,LIU Miao,SHANG Man,WANG Yao,ZHANG Qi,WANG Shao-xun,WEI Su,ZHANG Kun-wei,LIU Chao,WU Yan-na,SONG Jun-qiu△,LIU Yan-xia△
(Department of Pharmacology,School of Basic Medical Sciences,Tianjin Medical University,Tianjin 300070,China)
Objective:To investigate the effects of circulating microvesicles(MVs)derived from ischemic preconditioning(IPC)on myocardial ischemia/reperfusion(I/R)injury in rats and explore the underlying mechanism.Methods:To establish the IPC model,the rats were subjected to brief cycles of left anterior descending(LAD)coronary occlusion and reperfusion.The blood was drawn from abdominal aorta once the operation was finished.IPC-MVs were isolated by ultracentrifugation from the peripheral blood and characterized by flow cytometry.The myocardial I/R model of rats was established in vivo.Rats were injected via the femoral vein with IPC-MVs at 7 mg/kg.Morphological changes of myocardium were observed microscopically after HE staining.Apoptosis of myocardial cells was detected with TUNEL assay.Myocardial infarct size was detected by TTC staining.Moreover,activity of plasma lactate dehydrogenase(LDH)was tested by colorimetry.The activity of caspase 3 in myocardium was assayed with spectrophotometry.Expression levels of Bcl-2 and Bax protein were examined with Western blot.Results:The concentration of IPC-MVs,which was detected by flow cytometry,was 4380±745 cells/μl.Compared with I/R group,IPC-MVs alleviated the damage of tissues in I/R injured rats significantly.The myocardial infarct size and the cardiomyocyte apoptotic index were obviously decreased after IPC-MVs treatment(P<0.01,respectively).The activity of plasma LDH was significantly decreased in IPC-MVs treated rats(P<0.01).Moreover,the activity of caspase 3 was markedly decreased after IPC-MVs treatment(P<0.01).In addition,the expression of Bcl-2 was increased(P<0.01),the expression of Bax was decreased(P<0.01),the ratio of Bcl-2/Bax was significantly increased after IPC-MVs treatment(P<0.01).Conclusion:IPC-MVs protected myocardial against I/R injury by up-regulating the expression of Bcl-2 protein,down-regulating the expression of Bax protein,increasing the ratio of Bcl-2/Bax and decreasing cleavage of caspase 3.
microvesicles;myocardial ischemic preconditioning;myocardial ischemia/reperfusion;rats;apoptosis
天津市自然科学基金项目(11JCZDJC18300);高校博士学科点专项科研基金项目(20101202110005);天津市高等学校科技发展基金计划项目(20110106)
2015-12-14
2016-02-16
△Tel/Fax:86-22-83336660;E-mail:liuyanxia126@126.com,songjunqiu@126.com
R966
A
1000-6834(2016)02-097-05
10.13459/j.cnki.cjap.2016.02.001

