右美托咪定对脑缺血/再灌注大鼠海马兴奋性氨基酸含量及NMDA受体亚单位NR1表达的影响*
尚 宇,薛 强,顾佩菲,李 悦,高光洁△
(1.解放军第四六三医院麻醉科,辽宁 沈阳 110042;2.东北制药集团市场部,辽宁 沈阳 110016;3.哈尔滨医科大学附属一院麻醉科,黑龙江 哈尔滨 150001)
右美托咪定对脑缺血/再灌注大鼠海马兴奋性氨基酸含量及NMDA受体亚单位NR1表达的影响*
尚宇1,薛强1,顾佩菲2,李悦3,高光洁1△
(1.解放军第四六三医院麻醉科,辽宁 沈阳 110042;2.东北制药集团市场部,辽宁 沈阳 110016;3.哈尔滨医科大学附属一院麻醉科,黑龙江 哈尔滨 150001)
目的:观察右美托咪定预处理对全脑缺血/再灌注大鼠海马细胞外谷氨酸(Glu)、天门冬氨酸(Asp)含量及N-甲基-D-天冬氨酸(NMDA)受体1(NR1)表达的影响,探讨右美托咪定脑保护作用及其神经递质机制。方法:雄性Wistar大鼠54只,随机分为3组(n=18):假手术组、脑缺血/再灌注组和右美托咪定预处理组。用四血管闭塞法建立大鼠全脑缺血模型。收集清醒、缺血15 min及再灌注0~1 h微透析标本。于全脑缺血15 min再灌注1 h后,迅速断头取脑,采用免疫组化法和蛋白免疫印迹法检测海马NMDA受体NR1亚单位的表达情况。结果:与脑缺血/再灌注组相应时点比较,右美托咪定预处理组大鼠海马微透析液中Glu、Asp含量明显降低(P<0.05,0.01);免疫组化和Western-blot法检测显示右美托咪定预处理组大鼠海马组织NMDA受体亚单位NR1表达明显受抑制(P<0.05,0.01)。结论:右美托咪定预处理不仅减少脑缺血/再灌注时兴奋性氨基酸释放,还能抑制NMDA受体亚单位NR1的高表达而产生脑保护作用。
右美托咪定;缺血/再灌注损伤;谷氨酸;天门冬氨酸;NMDA受体;大鼠
缺血性脑血管病是常见病、多发病,其致残率和死亡率均高,严重影响着人类的身体健康和生活质量。当脑缺血缺氧后,神经元释放大量以谷氨酸(glutamate,Glu)为代表的兴奋性氨基酸(excitatory amino acids,EAA)通过激活其N-甲基-D-天冬氨酸(N-methy1-D-aspartate,NMDA)受体(NR1是其主要功能亚单位)而引起神经元的缺血缺氧性损伤[1]。右美托咪定(dexmedetomidine,DEX)是一种新型的高选择性α2肾上腺素受体激动剂,因其对大脑和神经细胞具有保护作用而逐渐受到重视,但其发挥神经保护作用的确切机制尚不完全清楚。本实验以“四血管阻断”全脑缺血大鼠为研究对象,利用脑微透析技术结合免疫印迹和免疫组化法动态观察右美托咪定对脑缺血/再灌注早期大鼠海马细胞外谷氨酸(Glu)、天门冬氨酸(Asp)含量及NMDA受体亚单位NR1表达的影响,旨在探讨右美托咪定预处理的脑保护作用及其神经递质机制。
1 材料与方法
1.1仪器与试剂
CK-2倒置显微镜( 日本Olympus公司);Metamorph 显微图像分析系统( 美国、日本联合生产);Cryotome E冷冻切片机(英国Shan Don公司);江湾I 型C 大鼠脑立体定位仪( 第一军医大学);微透析针(瑞典);高压液相仪和AccQ.Tag试剂盒(美国,Waters公司);谷氨酸,天门冬氨酸标准品(Sigma公司);右美托咪定(江苏恒瑞医药股份有限公司,批号050725,每支200 μg);NR1免疫组织化学染色试剂盒、兔源抗-NR1抗体、兔抗β-actin抗体和辣根过氧化物标记的羊抗兔IgG抗体(武汉博士德生物工程有限公司);聚丙烯酰胺凝胶(Novex,San Diego,美国 CA);Western-blot荧光试剂Ecl(美国,Saniacruz公司);RIPA裂解液和BCA试剂盒(江苏碧云天生物技术有限公司)。
1.2实验动物与分组
成年Wistar雄性大鼠,体质量(225±50)g,由沈阳军区总医院实验动物中心提供[实验动物合格证号:SYXK(军)2012-0001]。随机分成3组(n=18):(1)假手术组(Sham组):仅暴露双侧翼小孔双侧颈总动脉,不行阻闭;(2)全脑缺血/再灌注组(the total cerebral ischemia,TCI组);(3)右美托咪定预处理组(DEX组)。采用“四血管阻断法”建立模型成功的大鼠36只随机编入TCI组和DEX组。给药方法:DEX组于全脑缺血前60 min经尾静脉泵注5 μg·kg-1·h-1右美托咪定预处理60 min;Sham组和TCI组于全脑缺血前60 min泵注生理盐水60 min,输注速度2 ml/h。
1.3全脑缺血/再灌注模型的建立
TCI组和DEX组大鼠经乙醚麻醉后俯卧位固定鼠板上,维持大鼠肛温在(37.0±0.5)℃。采用Pulsinelli-Brierley的方法[2],大鼠颈背侧切口,剥离肌肉暴露第一颈椎上双侧翼孔,热凝闭塞从中走行的椎动脉,造成永久性闭塞,缝合切口,置保温鼠笼。手术24 h后,乙醚麻醉仰卧固定大鼠,颈前切口显露双侧颈总动脉,夹闭双侧颈总动脉30 s后描记脑电波判断模型是否成功(脑电变成直线作为模型成功标准)。夹闭15 min后松开动脉夹行再灌注60 min。Sham组大鼠仅暴露双侧翼孔和颈总动脉,不行阻闭。
1.4海马微管透析
Wistar大鼠乙醚麻醉后,颅平位固定于大鼠脑立体定位仪上。参照Paxions&Watson大鼠脑图谱定位:A-5.8 mm,V-8.0 mm,L-4.8 mm,切开头皮,钻孔,直径4 mm。微透析探针(CMA/10,瑞典,透析膜内径0.05 mm,长度为1 mm,能通过分子量最大为20 kD)插入背侧海马(CAI)。将大鼠脑内透析管与微量透析泵相连,用灌流液(Ringer’s:NaCl 150 mmol/L,KCl 3.0 mmol/L,CaCl21.7 mmol/L,MgCl20.9 mmol/L)以2 μl/min速度灌流,收集样品,高压液相仪分析测定Glu和Asp含量。实验结束后检查透析管埋植的位置,取透析管在海马的样本作为有效数据。
1.5谷氨酸(Glu)和天门冬氨酸(Asp)测定
将收集的微透析标本用Savant浓缩干燥仪干燥、AccQ.Tag衍生、上样,用高压液相仪(3.9×150 m氨基酸分析柱,Waters996二极管阵列检测器,Waters2690泵)分析样本Glu和Asp的含量。
1.6免疫组化方法检测NR1亚基的表达
再灌注60 min后,每组抽取6只大鼠行心内快速灌注4%多聚甲醛(0.1 mol·L-1磷酸缓冲液,4℃)固定30 min,断头取脑置固定液中后固定8 h,然后用20%、30%的蔗糖磷酸缓冲液浸至沉底。Cryotome E恒冷切片机行脑连续冠状切片,片厚为30 μm,至所需部位(脑前囟后3~3.5 mm),每隔三取一,连续留存5片,取相邻3套切片,分别行NR1免疫组化染色,阴性对照及HE染色。主要步骤:切片后依次加入3%过氧化氢甲醇溶液室温30 min;正常山羊血清37℃ 30 min;兔抗NR1多克隆抗体置湿盒4℃过夜;生物素标记的二抗37℃ 30 min;链酶亲和素过氧化物酶37℃ 30 min;然后滴加新鲜配制的DAB显色5~10 min。Metamorph 显微图像分析仪对切片进行图像分析测量海马CA1区:(1)积分光密度;(2)阳性细胞面积;(3)灰度值,每只大鼠测5张切片,取平均值。
1.7蛋白印迹技术(Western-blot)检测NR1亚基的表达
脑缺血/再灌注1 h后,每组抽取6只大鼠断头取海马组织碾碎(整个过程需在冰上操作),置入4℃裂解缓冲液中,匀浆、离心取上清液,用BCA法进行蛋白定量。蛋白样品加热、变性。以每孔20 μg总蛋白上样后,SDS-PAGE分离、转膜,膜封闭2 h,加一抗( 兔源抗-NR1抗体或兔源抗-β-actin抗体);加二抗(HRP标记的羊抗兔IgG),室温孵育1 h,加入化学发光底物进行曝光、显影及图像采集;每步骤间TBST洗涤(5 min×3次),以NR1蛋白与内参照β-actin蛋白光密度的比值表示NR1蛋白的相对含量。
1.8统计学方法
2 结果
2.1脑缺血/再灌注不同时点大鼠海马微透析液中EAA含量的变化
大鼠海马微透析液中EAA含量在脑缺血15 min时点达高峰,随着脑血流恢复再灌注开始(0~1 h时)海马细胞外EAA含量开始逐渐降低。与Sham组相应时点比较,TCI组和DEX组大鼠海马微透析液中的Glu、ASP含量明显增高,具有显著性差异(P<0.05,0.01,图1、图2);除再灌注(45~60 min)时点外,DEX组在相应时点与TCI组相比较Glu、ASP含量明显降低,有显著性差异(P<0.05,图1、图2)。
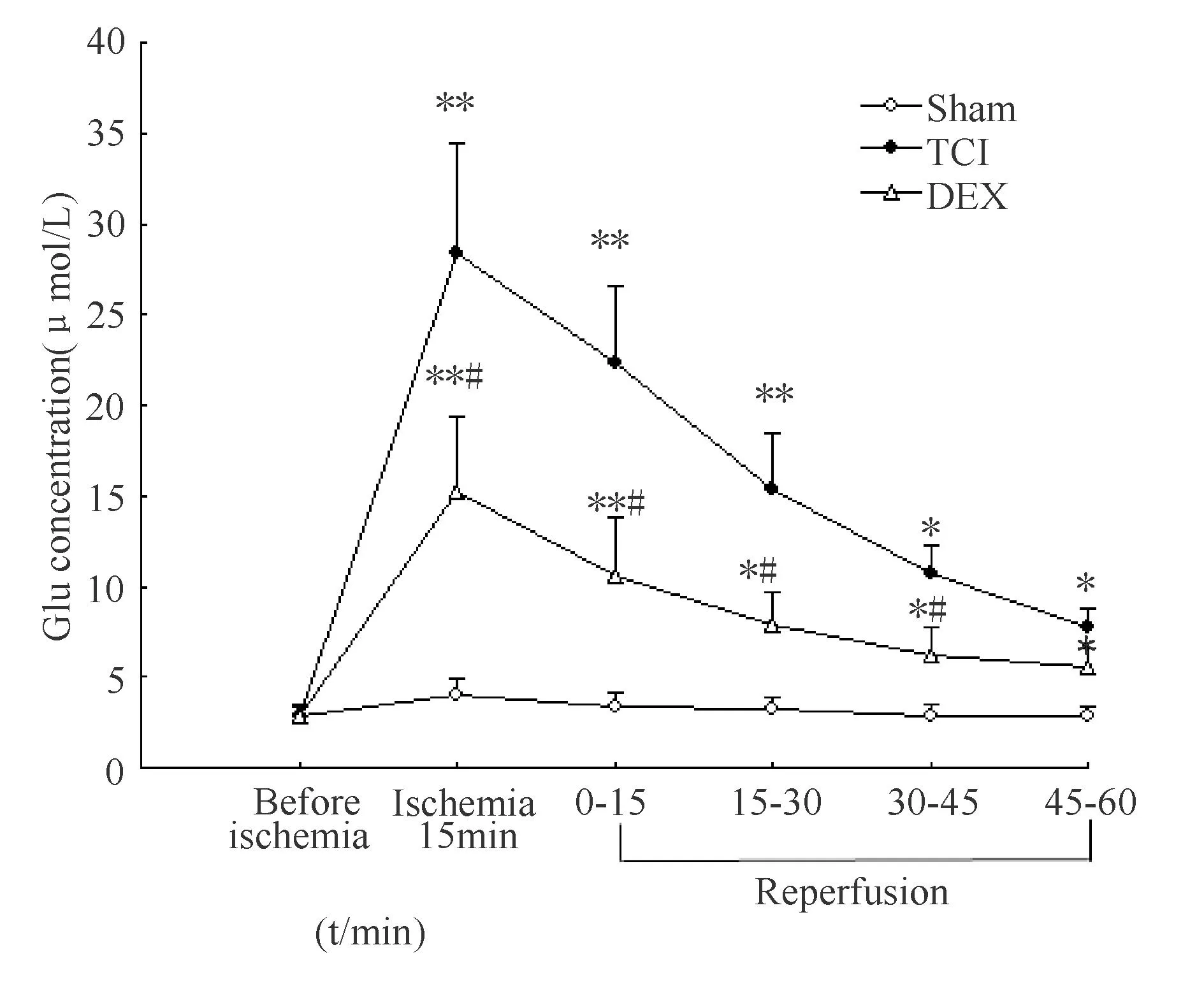
DEX:Dexmedetomidine;Glu:Glutamate
*P<0.05,**P<0.01 vs sham group;#P<0.05 vs TCI group
2.2NMDA受体NR1亚基免疫组化检测
与Sham组比较,TCI组和DEX组大鼠海马CA1区NR1光密度、阳性细胞面积、灰度值均具有显著性差异(P<0.05,0.01,表1,图3)。与TCI组比较,预注DEX能明显下调海马CA1区NR1蛋白表达的各项指标,具有显著性差异(P<0.05,0.01,表1,图3)。


*P<0.05,**P<0.01 vs Sham group;#P<0.05 vs TCI group


GroupIntegratedODPositivecellularareaAveragegreyvalueSham4215.4±305.761536.7±3458.7215.8±18.7TCI11754.3±1004.4**91245.3±8014.3**99.8±8.5*DEX6851.7±421.7*##70004.0±4241.5*#128.9±10.5*##
*P<0.05,**P<0.01 vs sham group;#P<0.05#,##P<0.01 vs TCI group
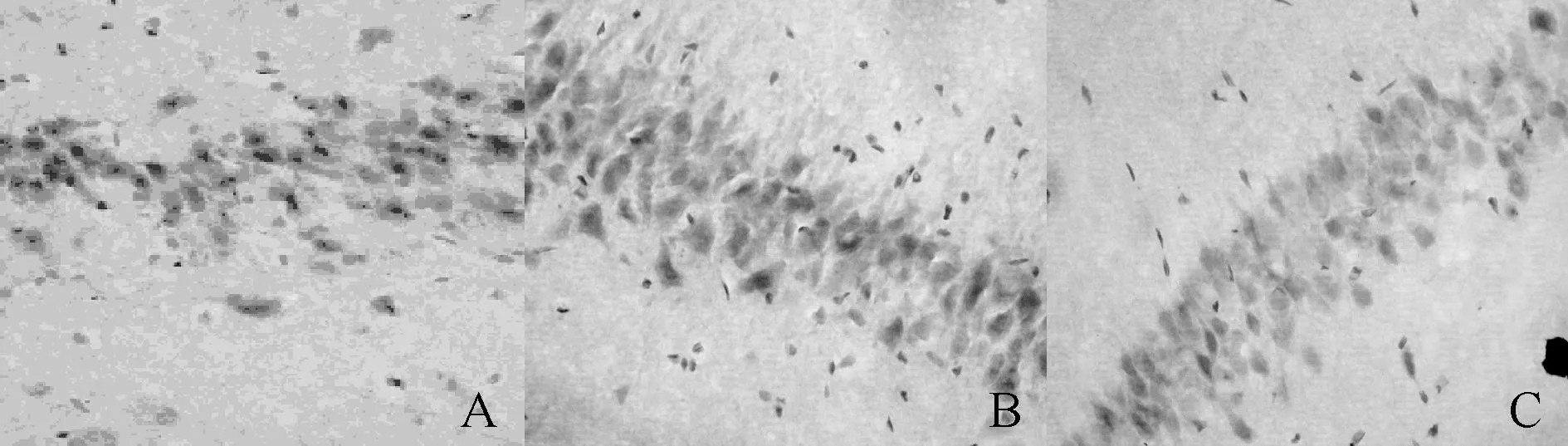
Fig.3NR1 expression in hippocampus CA1 in different group(×400)
A:Sham group;B:Total cerebral ischemia(TCI)group;C:Dexmedetomidine group
2.3NMDA受体NR1亚基Western-blot检测
与Sham组比较,TCI组和DEX组大鼠海马NR1表达水平明显增高(P<0.01,图4);与TCI组比较,经DEX预处理后的大鼠海马NR1表达水平显著降低(P<0.05,图4)。

Fig.4NR1 protein expression by Western blot analysis in different group
3 讨论
缺血性脑损伤是一个复杂的病理生理过程,其中兴奋性氨基酸(excitatory amino acid,EAAs )毒性是脑缺血致神经元损伤的重要触发物和介导者。EAAs主要是指Glu和Asp。正常情况下,EAAs的释放、摄取和重吸收保持动态平衡。当脑缺血缺氧损伤时,脑内产生大量的EAAs,作用其受体,导致细胞内钙超载及一系列的变化,最终使神经细胞代谢衰竭而死亡。EAA升高的程度与脑损伤的程度有关,损伤越严重则EAA升高越显著,持续时间越长[3]。
缺血性脑损伤中神经细胞的死亡与N-甲基-D-天门冬氨酸受体(NMDAR)活性的改变密切相关。其中 NMDA受体1(NR1)作为一种特异性离子型受体,是介导神经毒性最主要的受体之一。脑缺血时,随着海马等脑区细胞外Glu大量释放,刺激NR1过度兴奋,Ca2+大量内流,造成细胞内Ca2+超载等一系列病理反应,最终引起神经元兴奋毒性、溃变,直至死亡。如能阻断Glu的合成和释放、拮抗NR1亚基活性,减少Ca2+的内流,就能有效地防止NMDA受体介导的神经元损伤[4]。所以,检测NR1的蛋白表达,能准确评估右美托咪定预处理后对神经元的保护作用、疗效及其神经递质机制。
本室前期工作已经验证右美托咪定预处理后能够抑制脑缺血/再灌注大鼠齿状回星形胶质细胞GFAP的高表达,减缓脑缺血时星形胶质细胞的过度活化,维持其增生状态,稳定内环境,参与脑缺血损伤后神经功能保护作用[5]。本实验在此基础上,采用脑微透析技术结合免疫组化和蛋白印迹法观察脑缺血/再灌注早期兴奋性神经递质及其受体变化,进一步验证右美托咪定预先给药能否通过此途径产生脑保护作用?结果显示:在脑缺血15 min/再灌注0~1 h,右美托咪定预处理组各时间点的Glu、Asp含量及NMDAR1的表达均低于脑缺血/再灌注组,提示右美托咪定预先给药能对抗脑缺血/再灌注后EAAs过度释放及NMDAR1的表达,减轻EAAs过量生成和NMDAR1的高表达而导致的脑继发性损害,其机制可能是通过以下途径实现:(1)脑缺血时,右美托咪定通过抑制儿茶酚胺释放,降低神经元对EAAs的敏感性,改善毒性效应;同时,右美托咪定激活突触前膜G0或Gi蛋白耦联的α2-肾上腺素能受体(α2-AR),抑制Ca2+通道开放,促进外向型K+通道开放,从而降低胞内Ca2+浓度阻止神经递质囊泡的破裂,抑制EAAs的释放[6];(2)脑缺血性再灌注后,预注右美托咪定后激活α2-AR促进星形胶质细胞对Glu的摄取和降解,抑制肾上腺素β受体的活性,降低神经元的代谢率[7,8];同时,星型胶质细胞存在着谷氨酰胺合成酶,缺血性脑损伤该酶增加,能使谷氨酸转化为谷氨酰胺,右美托咪定可以激活谷氨酰胺酶活性,提高星形胶质细胞氧化代谢Glu的能力,激活大脑皮层神经末梢α2-AR、抑制电压门控性Ca2+通道,进而抑制兴奋性神经递质的释放,减轻其兴奋毒性[9];(3)儿茶酚胺通过激活α2肾上腺素受体可加重神经缺血性损伤,还可提高神经元对EAAs的敏感性,加重缺血时Glu、Asp等神经递质的兴奋性毒性。右美托咪定通过抑制儿茶酚胺释放,进而通过调节脑氧供需平衡,降低兴奋性毒性、改善毒性效应或提高缺血区域灌注产生神经保护作用[10];(4)脑缺血后,细胞外谷氨酸蓄积,刺激N-甲基-D-天冬氨酸(NMDA)受体过度兴奋,引起细胞骨架破坏,右美托咪啶通过氧化还原机制增加了脑内谷氨酰胺在星状神经细胞中的代谢,减少其作为EAAs前体的活性,从而调节神经的兴奋性[11]。
综上所述,右美托咪定不仅在神经外科手术中,可以满足镇静、稳定血流动力学和减少脑血流等要求,而且在缺血/再灌注时也可以减少脑组织的损伤,具有一定的神经保护作用。但其在脑保护作用中的剂量、使用方法及其脑保护机制等还有待进一步深入研究,以期更有效地应用于临床。
[1]张卫同,柴栋,徐珊,等.石菖蒲对脑缺血大鼠纹状体氨基酸类神经递质含量变化的影响[J].中国应用生理学杂志,2014,30(4):352-356.
[2]Pulsinelli WA,Brierley JB,Plum F.Temporal profile of neuronal damage in a model of transient forebrain ischemia[J].Ann Neurol,1982,11(5):491-498.
[3]张翠兰,文德鉴,董兴高,等.竹节人参总皂苷对脑缺血大鼠兴奋性氨基酸的影响[J].中国应用生理学杂志,2008,24(4):473-474.
[4]尚游,顾佩菲,尚宇,等.盐酸戊乙奎醚(长托宁)抑制脑缺血/再灌注时谷氨酸的释放及受体机制研究[J].中国应用生理学杂志,2011,27(3):353-356.
[5]尚宇,顾佩菲,袁士涛,等.右美托咪定预处理对局灶性脑缺血/再灌注星形胶质细胞胶质纤维酸性蛋白表达的影响[J].中国现代应用药学,2015,32(7):799-803.
[6]Kose EA,Bakar B,Kasimcan O,et al.Effects of intracisternal and intravenous dexmedetomidine on ischemia- induced brain injury in rat:a comparative study[J].Turk Neurosurg,2013,23(2):208-217.
[7]Dahmani S,Rouelle D,Gressens P,et al.Characterization of the postconditioning effect of dexmedetomidine in mouse organotypic hippocampal slice cultures exposed to oxygen and glucose deprivation[J].Anesthesiology,2010,112(2):373-383.
[8]Liu L,Ji F,Liang J,et al.Inhibition by dexmedetomidine of the activation of spinal dorsal horn glias and the intracellular ERK signaling pathway induced by nerve injury[J].Brain Res,2012,1427:1-9.
[9]Chiu KM,Lin TY,Lu CW,et al.Inhibitory effect of glutamate release from rat cerebrocortical nerve terminals by α2-adrenoceptor agonist dexmedetomidine[J].Eur J Pharmacol,2011,670(1):137-147.
[10]Mantz J,Josserand J,Hamada S.Dexmedetomidine:new insights[J].Eur J Anaesthesiol,2011,28(1):3-6.
[11]Degos V,Charpentier TL,Chhor V,et al.Neuroprotective effects of dexmedetomidine against glutamate agonist-induced neuronal cell death are related to increased astrocyte brain-derived neurotrophic factor expression[J].Anesthesiology,2013,118(5):1123-1132.
Effect of dexmedetomidine on the changes of EAA and the expression of NMDA NR1 protein in hippocampus in global cerebral ischemia/reperfusion rats
SHANG Yu1,XUE Qiang1,GU Pei-fei2,Li Yue3,GAO Guang-jie1△
(1.No.463 Hospital of PLA,Shenyang 110042;2.Northeast Pharmaceutical Group,Shenyang 110016; 3.The First-Affiliated Hospital of Harbin Medical University,Harbin 150001,China)
Objective:To observe the effects of dexmedetomidine(DEX)on glutamate(Glu),aspartic acid(Asp)release and NMDAR1 expression in hippocampus in global cerebral ischemia/reperfusion rats,and investigate the protective effect and the related mechanism of neurotransmitters.Methods:Fifty-four male Wistar rats were randomly divided into three groups(n=18):sham group(A),ischemia/reperfusion group(B),dexmedetomidine pretreatment group(C).Total cerebral ischemia model was set up by four vessel occlusion in rats.Glu and Asp levels were measured with microdialysis at different time.Then the animals were decapitated and the brains were immediately removed to detect NMDAR1 expression in hippocampus area by immunohistochemistry and Western-blot.Results:Compared with that in group B,the levels of Glu ,Asp and NMDA NR1 protein were significantly decreased in the dexmedetomidine pretreatment group(P<0.05 or 0.01).Conclusion:Dexmedetomidine might has a protective effect on hippocampus in global cerebral ischemia/reperfusion animals.The protective mechanism might be involved in inhibiting excitatory amino acids(EAA)release and NMDAR1 expression.
dexmedetomidine;ischemia/reperfusion injury;glutamate;aspartic acid;N-methyl-D-aspartate receptor;rat
辽宁省自然科学基金资助项目(2015020416)
2015-09-06
2016-01-25
△Tel:024-28845351;E-mail:guangjie420@126.com
R363
A
1000-6834(2016)02-158-05
10.13459/j.cnki.cjap.2016.02.016

