高糖对神经干细胞凋亡的影响
张俊涛,刘志贞,刘 丹,张悦红
高糖对神经干细胞凋亡的影响
张俊涛,刘志贞,刘丹,张悦红
目的探讨高糖环境是否可以诱导神经干细胞凋亡。方法从C57大鼠海马组织提取培养神经干细胞,分为3组:正常对照组、低糖组(5 mmol/L)、高糖组(50 mmol/L),不同浓度葡萄糖作用48 h后,运用琼脂糖凝胶电泳检测DNA 梯状条带、流式细胞术检测细胞凋亡。结果培养的神经干细胞具有形成神经球的能力,Nestin免疫荧光染色呈阳性反应,可分化为神经元、星形胶质细胞和少突胶质细胞。琼脂糖凝胶电泳显示高糖组提取的DNA出现特征性梯状条带,正常对照组和低糖组未出现。流式细胞术检测正常对照组细胞凋亡率(5.83±0.36)%,低糖组细胞凋亡率(6.25±0.52)%,两组比较差异无统计学意义(P>0.05);高糖组细胞凋亡率(20.97±1.21)%,与正常对照组和低糖组比较,差异有统计学意义(P<0.05)。结论高糖环境可以诱导神经干细胞凋亡。
神经干细胞;细胞凋亡;高糖;琼脂糖凝胶电泳;Nestin免疫荧光染色
糖尿病是一种由于胰岛素分泌缺陷或作用障碍所致的以血糖增高为特征的代谢性疾病,可引起中枢神经系统损伤,导致病人出现认知功能障碍和痴呆等疾病[1]。临床研究发现,糖尿病病人海马组织可出现严重萎缩,并且萎缩程度与糖尿病病程相关;同时基础实验证实在糖尿病大鼠模型海马组织中发现大量凋亡的神经元细胞[2],表明高糖环境引起的神经细胞凋亡在糖尿病病人中枢神经系统损伤中发挥重要作用。
神经干细胞是神经组织特异性的具有无限自我复制与更新和分化为神经元、星形胶质细胞和少突胶质细胞能力的干细胞[3]。研究发现:成年哺乳动物脑组织的海马齿状回和侧脑室下层也存在神经干细胞,并且可以分化为神经前体细胞、神经元及各类神经胶质细胞[4],但是由于成年哺乳动物脑组织中神经干细胞数量有限,机体自身神经干细胞对神经系统损伤修复的效果并不明显。随着生物治疗技术的开展,国内外学者探索神经干细胞颅内移植治疗各种中枢神经系统疾病,为传统方法治疗难以取得效果的疾病带来希望。
糖尿病高糖环境下神经干细胞是否也会发生凋亡,影响神经干细胞在高血糖病人脑内存活率,降低神经干细胞损伤修复的治疗效果。本实验拟通过高糖环境培养海马组织神经干细胞,运用DNA ladder检测凋亡小体,Annexin V/PI染色观察神经干细胞凋亡率,研究高糖环境对神经干细胞凋亡的影响。
1 材料与方法
1.1材料葡萄糖购于Sigma公司,DMEM/F12培养基、B27 购自Gibco公司,EGF、bFGF购自PeproTech公司,Nestin、NF-H、GFAP、GALC兔抗小鼠多克隆抗体购于SANTA CRUZ公司,FITC标记羊抗兔二抗、Cy3标记羊抗兔二抗购于Invitrogen公司,DNA ladder检测试剂盒购于生工生物工程(上海)股份有限公司。
1.2神经干细胞培养及鉴定
1.2.1神经干细胞培养取成年C57小鼠(山西医科大学实验动物中心提供)大脑组织分离海马区域,采用机械消化法,反复吹打海马组织直到呈单细胞悬液,收集细胞悬液,1 000 r/min离心5 min,去上清,神经干细胞培养液重悬,通过细胞计数调整细胞浓度为1×106/mL,转移至50 mL细胞培养瓶,37 ℃、5% CO2培养箱中悬浮培养。
1.2.2神经干细胞鉴定将神经干细胞球吸出转移至6孔板中,37 ℃,5% CO2培养2 h;0.01 mol/L PBS洗3次,4%多聚甲醛固定;0.1%Triton破膜;2%山羊血清封闭;0.01 mol/L PBS洗3次,加入兔抗Nestin多克隆抗体,4 ℃过夜;0.01 mol/L PBS洗3次,加入羊抗兔IgG-Cy3二抗,避光作用2 h;抗荧光淬灭剂封片,荧光显微镜下观察。
1.2.3神经干细胞分化与鉴定将神经干细胞球吸出转移至24孔板中,加入神经干细胞分化液,37 ℃,5% CO2培养1周,0.01 mol/L PBS洗3次,4%多聚甲醛固定;0.1%Triton破膜;2%山羊血清封闭;0.01 mol/L PBS洗3次,分别加入小鼠抗NF-H多克隆抗体、兔抗GFAP多克隆抗体、兔抗GALC多克隆抗体,4 ℃过夜;0.01 mol/L PBS洗3次,各孔中分别加入相应荧光二抗:羊抗兔FITC标记二抗或Cy3标记羊抗兔二抗,避光作用2 h;抗荧光淬灭封片剂封片,荧光显微镜下观察。
1.3实验分组神经干细胞经鉴定后传代至六孔板37 ℃、5% CO2培养24 h用于实验,观察高糖环境对海马神经干细胞的影响,实验分为3组:正常对照组、低糖组(5 mmol/L)、高糖组(50 mmol/L),各组加入葡萄糖后再放入培养箱作用48 h。
1.4DNA梯状条带凝胶电泳检测离心(800 r/min,5 min)收获各组细胞,0.01 mol/L PBS洗3次,将细胞沉淀重悬于400 μL细胞裂解液中,离心去上清液,加入RNase、蛋白酶K,酚/氯仿抽提DNA,20 μL TE溶解,1.5%的琼脂糖凝胶中电泳,紫外线下照相,伯乐凝胶成像系统进行灰度值分析。
1.5流式细胞术检测细胞凋亡离心(800 r/min,5 min)获取各组细胞,0.01 mol/L PBS洗3次,加入500 μL结合缓冲液重悬细胞,调整细胞浓度至106/mL,取100 μL细胞悬液加入5 mL流式管中,分别加入5 μL Annexin V/FITC(20 μg/mL)、10 μL PI(10 μg/mL)液,避光作用15 min,再加入400 μL结合缓冲液,流式细胞仪检测,结果用随机软件分析。
2 结 果
2.1神经干细胞培养及鉴定原代培养C57小鼠海马源性神经干细胞(见图1A)个体小而且呈透明圆形,悬浮生长。培养1周,可见神经干细胞球形成,随球体增大,位于球体中心的干细胞因营养成分摄取不足出现一定程度坏死,呈现黑色斑块(见图1B)。经传代后的神经干细胞可增殖再次聚集形成细胞球,球体形态规则,折光性好。Nestin免疫荧光染色神经干细胞球呈阳性反应(见图1C)。对加入神经干细胞分化液后呈贴壁状态生长的细胞进行免疫荧光染色,结果显示海马源性神经干细胞可以分化为神经元(见图1D)、星形胶质细胞(见图1E)和少突胶质细胞(见图1F)。

图1 神经干细胞及鉴定
2.2DNA梯状条带凝胶电泳检测实验结果显示经高糖(50 mmol/L)处理的神经干细胞,其细胞提取的DNA中呈现典型的细胞凋亡梯状条带,而正常对照组和低糖组(5 mmol/L)提取的DNA中未出现梯状条带(见图2),实验证明高糖环境可诱导神经干细胞发生凋亡。
2.3流式细胞术检测细胞凋亡经流式细胞仪检测,正常对照组和低糖组(5 mmol/L)中有少量神经干细胞发生凋亡(见图3A、图3B),正常对照组为(5.83±0.36)%,低糖组为(6.25±0.52)%,两组比较差异无统计学意义(P>0.05);高糖组(50 mmol/L)神经干细胞凋亡率明显增加(见图3C),达到(20.97±1.21)%,分别与正常组和低糖组比较,差异有统计学意义(P<0.05)。
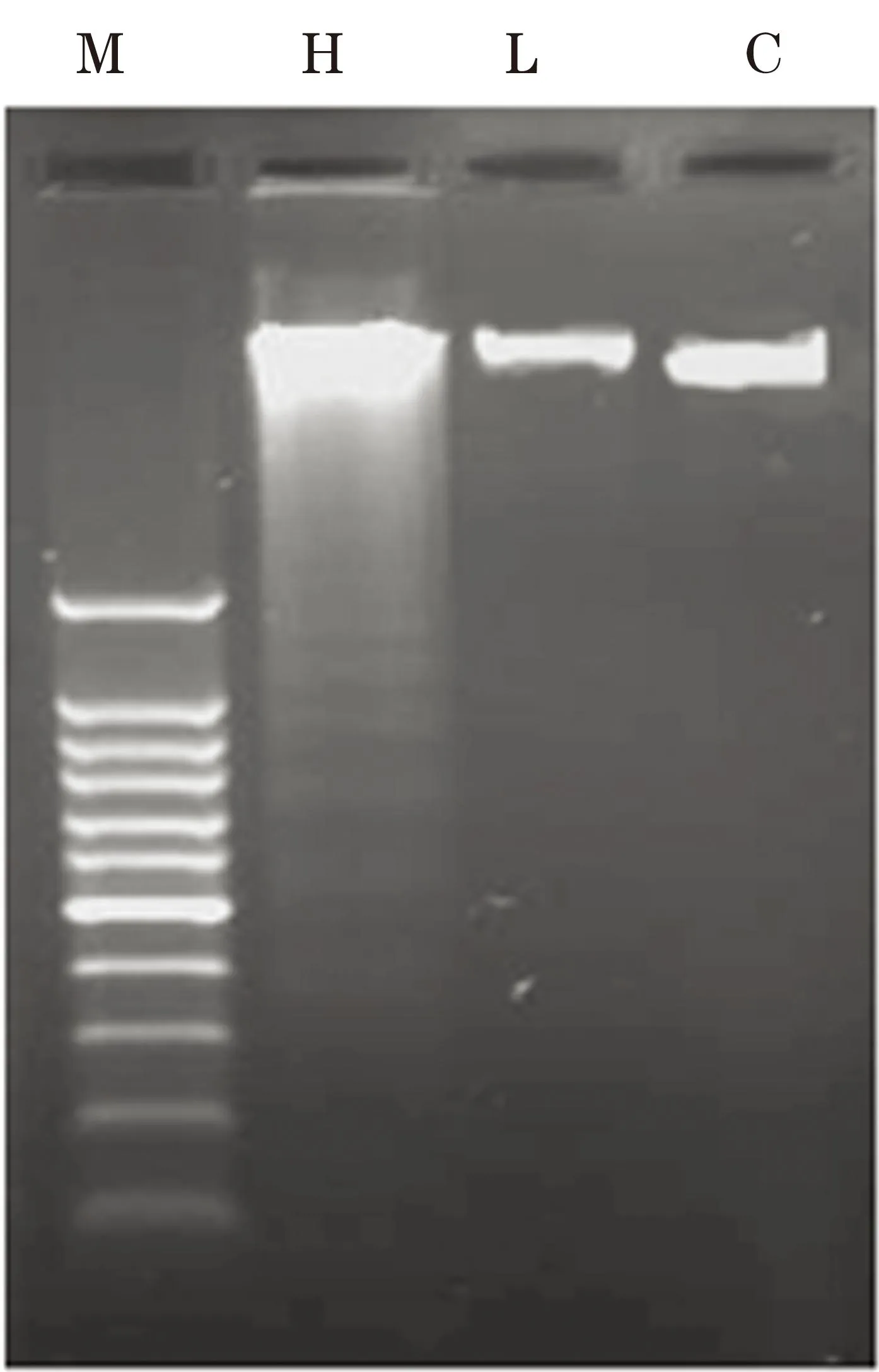
注:M为 DNA Maker;H为高糖组(50 mmol/L);L为低糖组(5 mmol/L); C为正常对照组。
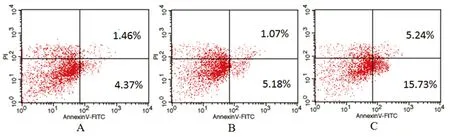
图3 流式细胞术测定各组细胞凋亡流式图
3 讨 论
神经干细胞具有自我更新和多向分化潜能,可对机体神经损伤部位进行再生修复,同时神经干细胞具有迁移作用和极好的组织相容性[5]。经静脉输入的外源性神经干细胞可优先迁移至机体神经系统损伤部位,发挥修复神经组织的作用,因为神经干细胞属于未分化细胞,其免疫原性低,移植后很少发生排异反应,有利于移植细胞的存活[6]。以上特点促使神经干细胞成为生物治疗研究领域的热点,在移植治疗脑出血、脑缺血、中枢神经创伤及退变性脑病等研究中,对疾病动物模型的治疗取得良好效果。糖尿病是导致老年认知障碍和痴呆的高危因素,可以引起海马神经元细胞发生凋亡。在高糖环境下使用神经干细胞对老年认知障碍等疾病进行治疗,可能会诱导神经干细胞发生凋亡从而影响其修复能力。
凋亡是细胞为维持内环境稳定,引发的自主有序的死亡现象。引发细胞凋亡的原因有生理性或病理性多种因素。在早期可通过检测细胞外膜是否含有磷脂酰丝氨酸(phosphatidylserine,PS)来确定凋亡的发生。正常细胞的PS存在于细胞膜内侧,当细胞发生凋亡时,PS可从细胞膜内侧翻转到细胞膜外表面,暴露于细胞外环境中。Annexin V是一种Ca2+依赖性磷脂结合蛋白,可与PS特异性结合。将Annexin V进行荧光标记作为探针,利用荧光显微镜或流式细胞仪可检测细胞凋亡的发生。在细胞凋亡晚期,DNA在核小体连接处被核酸酶切断,可产生200 bp的整数倍大小的DNA碎片,经琼脂糖凝胶电泳可呈现出凋亡细胞特征性的梯状条带[7]。本实验通过模拟糖尿病时机体的内环境,使用琼脂糖凝胶电泳检测发现在高糖环境下神经干细胞提取的DNA中出现碎片呈现特征性的梯状条带,同时流式细胞仪检测也发现高糖环境下神经干细胞发生凋亡的比率明显增多,证实高糖可以诱导神经干细胞发生凋亡,提示在对糖尿病病人进行神经干细胞移植治疗时,首先需要控制病人的血糖水平,然后再进行神经干细胞移植,这样才能保证神经干细胞移植的成功率,确保最终治疗效果。
总之,本实验通过建立高糖环境对鼠海马源性神经干细胞刺激的模型,模仿并证实糖尿病病人大脑海马区损伤后,机体调动内源性神经干细胞或移植外源性神经干细胞时,高糖环境可诱导神经干细胞发生凋亡,不利于对损伤的中枢神经系统进行修复。但高糖是通过何种机制诱导神经干细胞发生凋亡,还需进一步研究探讨。
[1]李梅,马兰,李静,等.胰岛素在糖尿病认知障碍发病中的作用 [J].中西医结合心脑血管病杂志,2013,11(3):353-355.
[2]肖复茜,李洪秀,隋海娟,等.知母皂苷元对高糖引起的体外培养大鼠海马神经元损伤的保护作用 [J].中国药理学通报,2013,29(1):107-112.
[3]Angel R,Maldonado S,Derek H,et al.Stem cells in the nervous system [J].Am J Phys Med Rehabil,2014,93(1103):S132-S144.
[4]Ma DK,Ming GL,Song HJ.Glial influences on neural stem cell development:cellular niches for adult neurogenesis [J].Current Opinion in Neurobiology,2015,15(5):514-520.
[5] Zheng T, Gregory MI,Chen KA,et al.Transplantation of neural stem/progenitor cells into developing and adult CNS [J].Methods in Molecular Biology,2009,482:185-197.
[6]Odeberg J,Piao JH,Samuelsson EB,et al.Low immunogenicity of in vitro-expanded human neural cells despite high MHC expression [J].Journal of Neuroimmunology,2005,161 (1-2):1-11.
[7]高超,华子春.细胞凋亡检测方法新进展 [J].中国细胞生物学学报,2011,33(5):564-569.
(本文编辑郭怀印)
国家自然科学基金青年科学基金项目资助(No.81300487);山西医科大学校青年基金项目资助(No.02201401)
山西医科大学(太原 030001),E-mail:zhangjuntao4435@sohu.com
R587.1R255.4
Adoi:10.3969/j.issn.1672-1349.2016.14.014
1672-1349(2016)14-1610-04
2016-03-01)

