酸性介质中苯甲醛缩苯胺对A3碳钢的缓蚀作用*
王家辉,周东魁,万小康,阮 航
(长江大学工程技术学院,湖北 荆州 434020)
酸性介质中苯甲醛缩苯胺对A3碳钢的缓蚀作用*
王家辉,周东魁,万小康,阮航
(长江大学工程技术学院,湖北荆州434020)
采用失重法及电化学法研究了苯甲醛缩苯胺在不同浓度盐酸介质和温度中对 A3 碳钢的缓蚀行为。结果表明,该缓蚀剂对盐酸介质中的 A3 碳钢有明显的缓蚀作用;加入缓蚀剂后,腐蚀反应活化能由52.23 kJ/mol 升高到 103.85 kJ/mol,随着温度的升高这种缓蚀剂能在一定程度上抑制温度对腐蚀速率的影响。随着缓蚀剂浓度的提高,腐蚀速率显著降低,缓蚀率显著提高,但最终会随着缓蚀剂用量加大,腐蚀速率和缓蚀率趋于平缓。
席夫碱 ;失重法;盐酸;缓蚀
在用酸液清洗锅炉工业锅炉的过程中,酸液将会对设备造成腐蚀。在酸液中加入缓蚀剂被认为是一种经济高效的防腐方法[1-2]。
席夫碱(Schiff base)是一种含有亚胺或甲亚胺特性基团(-RC=N-,如图1所示)的一类有机化合物,它主要由胺和活性羰基缩合而成。由于其原料来源广泛,制备工艺简单,缓蚀效果显著,所以常被用作酸洗过程中的缓蚀剂。本文采用苯胺和苯甲醛合成了一种席夫碱缓蚀剂,采用失重法评价了该种缓蚀剂的缓蚀效果,分析了该缓蚀剂对腐蚀反应活化能的影响。
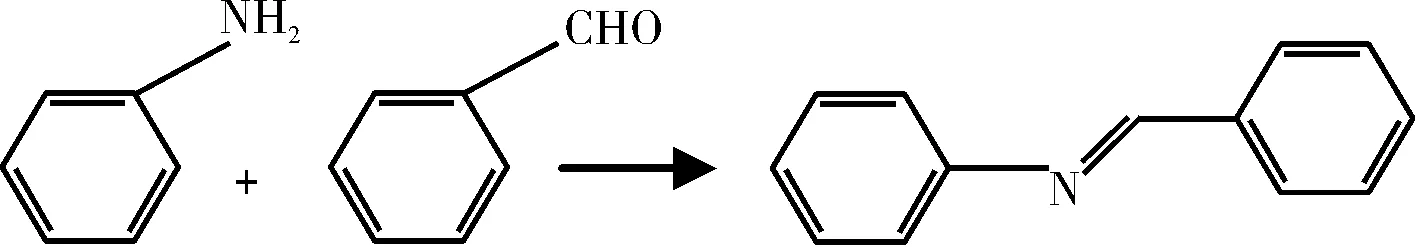
图1 合成反应方程式
1 实 验
以苯胺和苯甲醛为原料,加热回流3 h,以乙醇为溶剂重结晶,制备得到了目标产物。按 DLT 523-2007 《化学清洗缓蚀剂应用性能评价指标及试验方法》配制浓度百分比为10%的盐酸溶液,将A3钢片分别用400、800、1200 目砂纸打磨,再依次用乙醇、丙酮洗净,晾干,放入干燥器保存1 h。记录钢片初始质量m1(g)及面积s(m2)。将钢片浸入酸液中,在30~60 ℃下恒温1 h,测定钢片损失的质量。按式(1)和式(2)计算腐蚀速率和缓蚀率:
(1)
(2)
式中:η——缓蚀率
v0——未加缓蚀剂腐蚀速率
v——为加入缓蚀剂后的腐蚀速率
2 结果与讨论
2.1温度对腐蚀速率和缓蚀率的影响
在缓蚀剂添加量为0.4%,盐酸浓度为10%,温度依次为:30 ℃、40 ℃、50 ℃、60 ℃的水浴中加热1 h测定了一组和η,如表1 所示。

表1 数据结果Table 1 Results of data

图2 不同温度对缓蚀性能的影响(0.4%)
从表1和图 2 可见,未加缓蚀剂时的腐蚀速率曲线随着温度的升高而直线上升,测得30~60 ℃腐蚀速率从34.01 g·m-2·h-1升至221.05 g·m-2·h-1,加入0.4%的缓蚀剂后,测得速率从2.89 g·m-2·h-1升至135.28 g·m-2·h-1在所研究的温度范围内,加入缓蚀剂的酸液对钢片的腐蚀速率均小于未加缓蚀剂的体系。随着温度的上升,无论是空白酸液和加入缓蚀剂的酸液中,腐蚀速率都将随着温度的升高而上升。但加入缓蚀剂后,这种上升的趋势变得更为缓慢。这表明苯甲醛缩苯胺能在一定程度上抑制温度对腐蚀速率的影响。
2.2缓蚀剂浓度对腐蚀速率和缓蚀率的影响
在温度为 30 ℃,酸液浓度10%,缓蚀剂的用量为0.02、0.05、0.1、0.2、0.4,反应1 h后钢片的失重量测试结果如表2、图3所示。
从表 2中看出缓蚀剂浓度分别为0~0.4的腐蚀速率从34.01 g·m-2·h-1降低至2.89 g·m-2·h-1。结合图3可得出,当提高缓蚀剂浓度时,腐蚀速率显著降低,缓蚀率显著提高。并且可看出随着缓蚀剂用量加大,腐蚀速率和缓蚀率趋于平缓,说明在反应条件下缓蚀剂在钢片表面的吸附已渐趋饱和。当缓蚀剂浓度为0.4% 时,缓蚀率可达92%。

表2 数据结果Table 2 Results of data
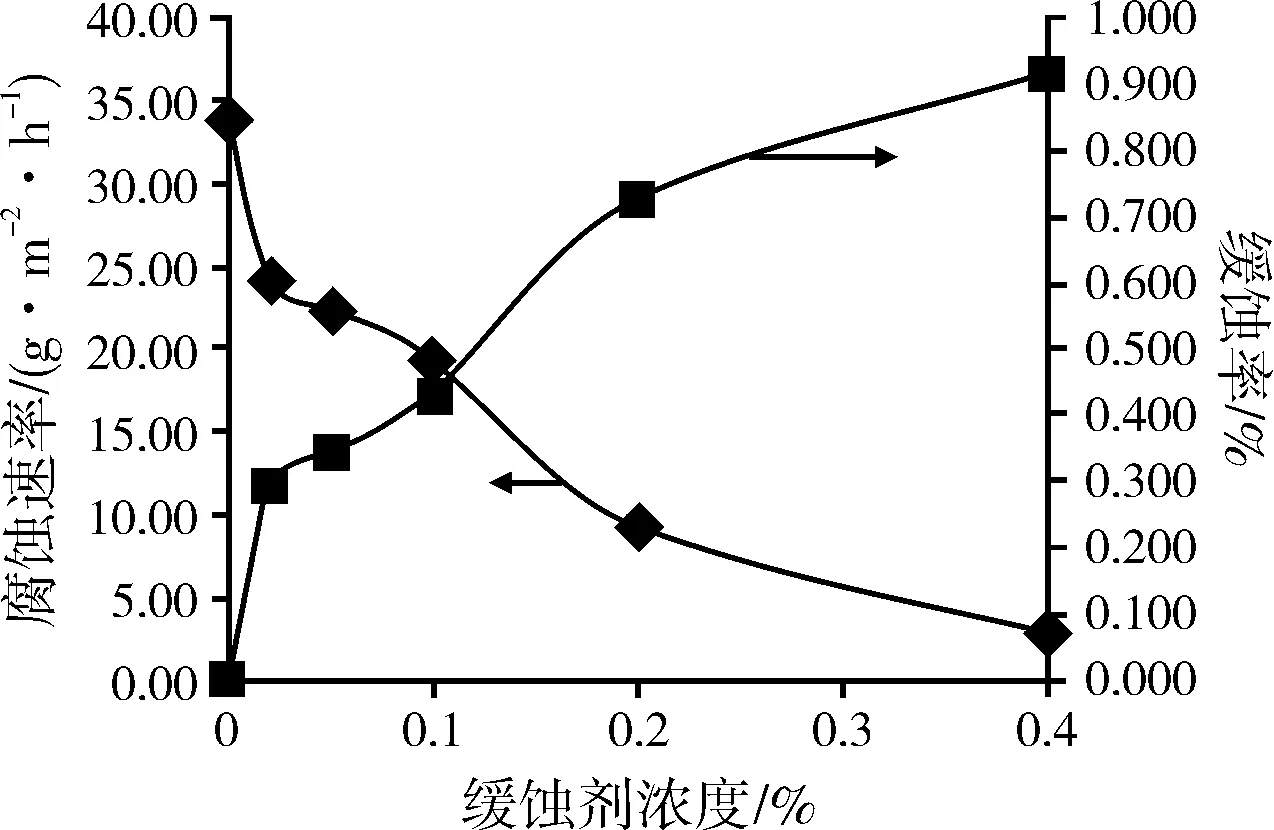
图3 不同缓蚀剂浓度对缓蚀率的影响(30 ℃)
2.3缓蚀剂对腐蚀反应活化能的影响
一般认为,腐蚀反应可以用式(3)所示的Arrhenius方程来描述:
v=Aexp(-Ea/RT)
(3)
式中:v——腐蚀速率
A——指前因子
Ea——表观活化能
R——摩尔气体常量
T——热力学温度
将式(3)两边取对数变形得:
(4)
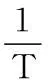
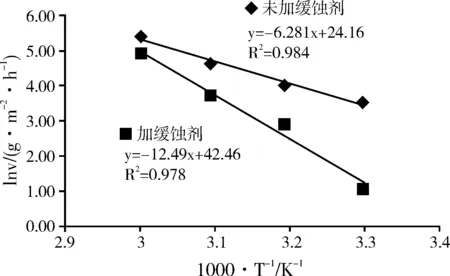
图4 未加缓蚀剂和加入0.4% 缓蚀剂条件下的 Arrhenius 曲线

指前因子A活化能Ea复相关系数R2空白3.11E+1052.230.9840.4%缓蚀剂2.76E+18103.850.978
结合图 4和表 3可得,线性拟合的复相关系数分别为 0.984 和 0.978,表明用Arrhenius 方程来处理腐蚀反应过程是合理的。经计算,对比可看出,加入缓蚀剂后钢片的腐蚀反应需克服较高的能垒,有效的降低了化学反应速率,起到了较好的缓蚀效果。
3 结 论
(1) 制备得到的苯甲醛缩苯胺在酸度为10%HCL对A3钢片有较好的缓蚀效果,当温度为30 ℃、缓蚀剂浓度为0.4%时,缓蚀率可达到91.51%。
(2)与未加缓蚀剂相比,当酸液中缓蚀剂浓度为0.4%时,腐蚀反应活化能从52.23 kJ/mol 提高到 103.85 kJ/mol,较好地抑制了腐蚀反应的发生。
[1]詹世平. 锅炉的化学清洗[J]. 清洗世界,1999(04):16-18.
[2]雷鸿毅,董元彦,王保成,等.钢在浓盐酸中的腐蚀和某些缓蚀剂作用机理探讨[J].中国腐蚀与防护学报,1983(02):85-96.
[3]陈玉红,王庆飞,崔敏,等. 席夫碱应用研究新进展[J].河北师范大学学报,2003(01):71-74.
[4]国家发展改革委办公厅.DL/T 523-2007.中华人民共和国电力行业标准[S].北京:中国电力出版社,2007.
[5]胡英.物理化学[M].北京:高等教育出版社,2007:51-85.
[6]刘俊吉,周亚平,李松林.物理化学.5版[M].北京:高等教育出版社,2009:529-534.
Inhibition Action of Benzalaniline for A3 Steel in Acid Medium*
WANG Jia-hui, ZHOU Dong-kui, WAN Xiao-kang, RUAN Hang
(College of Technology and Engineering, Yangtze University, Hubei Jingzhou 434020, China)
The inhibition actions of benzalaniline in different concentrations of hydrochloric acid medium and in different temperature were studied by weight-loss. Results showed that benzalaniline was a good inhibitor. Active energy on corrosion reaction was increased from 52.23 kJ/mol to 103.85 kJ/mol with benzalaniline. As temperature went up, the corrosion inhibitor can be suppressed with the influence of temperature on the corrosion rate to a certain extent. With the increase of the concentration of the corrosion inhibitor, the corrosion rate decreased significantly, the corrosion rate increased significantly, but eventually, the corrosion rate of mild erosion rate was leveling off, as corrosion inhibitor dosage increased.
schiff base; weight loss; hydrochloric acid; corrosion inhibition
长江大学工程技术学院大学生创新实验(15d0601)。
王家辉(1994-),男,高分子材料与工程专业学生。
TG174.42
A
1001-9677(2016)014-0078-03

