大肠杆菌与水体中U(Ⅵ)的作用行为和产物研究
黄 荣,覃贻琳,聂小琴*,董发勤,刘明学,杨 刚,马佳林,龚俊源,黄文波,陈 博
大肠杆菌与水体中U(Ⅵ)的作用行为和产物研究
黄 荣1,1,聂小琴1*,2,刘明学3,杨 刚3,马佳林1,龚俊源1,1,陈 博1
(1.西南科技大学,,四川 绵阳 621010;2.西南科技大学,固体废物处理与资源化教育部重点实验室,四川 绵阳 621010;3.西南科技大学生命科学与工程学院,四川 绵阳 621010)
通过批次吸附实验及介观和谱学等表征方法,研究了大肠杆菌()粉末对水体中U(Ⅵ)的富集行为和吸附模型,并对其作用产物进行了详细分析.结果表明:大肠杆菌对初始浓度为50mg/L U(Ⅵ)溶液(pH=5)的吸附容量可达到mg/g.Langmuir等温模型和准二级动力学方程能较好的描述其吸附过程. FTIR、SEM-EDS、XRD分析结果表明:在与水体中U(VI)作用后,大肠杆菌表面检测出UO22+的红外特征峰(876.16cm-1)和U的能谱吸收峰(结合能=).UO22+主要与菌体表面的烷基、氨基、羧基、分子间氢键发生作用,重点与PO2-、P(OH)2、PO43-以及PO3-等含P基团进行络合配位,最终产物以CaU(PO4)2、Ca(UO2)2(PO4)2•H2O、NaUO2(PO3)3等铀的磷酸盐形式存在.
大肠杆菌;U(Ⅵ);热力学;动力学;FTIR;含P基团进行络合配位;SEM-EDS;XRD
在核工业的发展过程中,铀起到至关重要的作用,但在铀矿开采和铀矿加工阶段产生了大量的[1].在含铀废水中,U(Ⅳ)容易形成稳定的络合物而被沉淀,U(Ⅵ)通常以铀酰离子(UO22+)的形式存在,易迁移扩散[2],进入食物链后,将对人类健康和环境造成危害[3-5].利用微生物处理低浓度含铀废水具有效率高、成本低、耗能少的优点.近年来,很多学者对此展开研究[6].目前研究发现微生物对U(Ⅵ)的富集机理主要包括生物表面吸附、体内富集、氧化还原及生成无机微沉淀等[7-8,11-14,16-21],但国内就微生物与水体中U(Ⅵ)作用产物的研究报道很少.谭文发等[8]指出关于微生物与U(Ⅵ)溶液作用后的产物及减重方式有待进一步深入研究.
本文以大肠杆菌粉末作为研究对象,开展了菌体与U(Ⅵ)的宏观批次吸附实验,并利用FTIR、SEM-EDS、XRD等分析方法,研究了大肠杆菌对U(Ⅵ)的吸附性能、吸附模型以及作用产物和减重效果.旨在为微生物处理低浓度含铀废水提供理论参考和数据支撑.
1 材料与方法
1.1 实验设备和材料
1.1.1 测试仪器 各测试仪器名称、型号、生产厂家如表1所示.

表1 实验仪器Table 1 Laboratory apparatus
1.1.2 菌株和培养基 大肠杆菌()由西南科技大学生命科学与工程学院实验中心提供.菌种解冻后,接种到液体培养基中,在30℃、150r/min的恒温培养箱中振荡培养12h,得到活化菌体,通过平板划线法得到单个长势好的菌落,挑选茁壮的菌落接种到新的液体培养基中培养,重复此步骤3次.将纯化后的菌体接入到液体培养基中振荡(150r/min、30℃)培养24h.离心(6000r/min,10min)取沉淀的菌体,用去离子水清洗3遍,烘干(60℃),研磨(过100目筛)待用.
培养基成分:牛肉膏3g,蛋白胨10g,NaCl 5g,蒸馏水1000mL,pH:7.0~7.2.
1.1.3 铀溶液 称取2.1092g UO2(NO3)2×6H2O,少量水溶解后,加入10mL硝酸,移入1000mL容量瓶中,用水稀释至刻度,摇匀,得到1g/L的铀溶液.通过稀释得到实验所需浓度的铀溶液.0.1mol/L、1mol/L HCl,和0.1mol/L、1mol/L Na2CO3调节U(Ⅵ)溶液pH值.
1.2 实验方法
1.2.1 吸附实验 移取20mL一定浓度的U(Ⅵ)溶液,0.006g预备好的大肠杆菌于50mL锥形瓶中(每组设置3个平行样),置于摇床内恒温振荡(150r/min)吸附一定时间,离心(6000r/min、10min),取10ml上清液,通过偶氮胂Ⅲ分光光度法测定上清液中残余U(Ⅵ)浓度.利用式(1)、式(2)计算菌体对U(Ⅵ)的吸附率(%)和吸附量(mg/g).
式中:0为初始U(Ⅵ)浓度,mg/L;e为时刻剩余U(Ⅵ)浓度,mg/L;为溶液体积,L;为大肠杆菌干重,g.
1.2.2 机理分析 将吸附前和吸附作用1h后的大肠杆菌在60℃下烘至恒重,与KBr混合研磨压片,在4000~400cm-1范围内测定其红外光谱.
大肠杆菌与150mg/L U(Ⅵ)溶液作用一定时间后,离心收集菌体于烘箱中烘干至恒重.将菌体研磨分散于导电胶上,喷金处理后,对菌体表面进行.
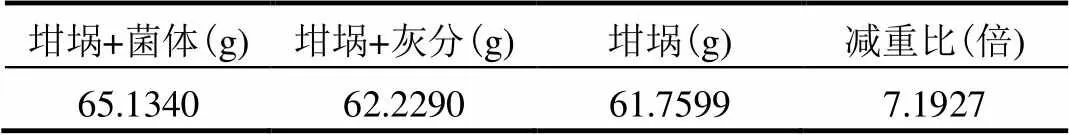
与U(Ⅵ)溶液中作用后的大肠杆菌炭化(加热搅拌至无烟状态),马弗炉中灼烧(800℃,4h).经XRD(=1.5406Å、=40kV、=40mA、2=0º~80º、步长为0.03342º)分析产物的物相,并通过式(3)计算灰化前后菌体的减重比(WDR).
式中:b为吸附后菌体质量,干重,g;a为灰化后灰分质量,g.
2 结果与分析
2.1 溶液pH值对吸附效果的影响
图1为大肠杆菌在不同pH值条件下对U(Ⅵ)的吸附结果:溶液pH值在3~5时,菌体对U(Ⅵ)的吸附能力随pH值的升高而增强.当溶液pH值大于5时,菌体对溶液中U(Ⅵ)的吸附能力降低.
图1 溶液pH值对大肠杆菌吸附U(Ⅵ)的影响
Fig.1 Effect of pH on adsorption of U(Ⅵ) byE.coli0(U)=50mg/L,=1h,=30℃,=0.006g,=20mL
利用Visual MINTEQ3.0模拟计算在不同pH值条件下,U(Ⅵ)初始浓度为50mg/L的溶液中的U(Ⅵ)离子的形态分布比例,结果如图2所示:溶液pH值在3~4时,Ⅵ)的形态主要为UO22+(86.57%~99.26%).pH值在4~5时,U(Ⅵ)的形态主要为UO22+、(UO2)2(OH)22+、UO2OH+、(UO2)3(OH)5+.当pH值在5~6时,U(Ⅵ)主要以(UO2)4(OH)7+、(UO2)3(OH)5+(57.28%~72.13%) 存在.
当pH=3时,溶液中U(Ⅵ)主要以UO22+的形式存在,但大量H+与UO竞争菌体表面活性吸附位点,菌体对U(Ⅵ)的去除率仅为21.97%.随着溶液pH值升高,溶液中游离H+减少.细胞壁官能团中会有较多H3O+解离下来进入溶液中,菌体表面出现更多能与UO22+发生络合作用的负电荷基团[9],吸附率呈增大趋势.在pH=5时,菌体对U(Ⅵ)的富集能力最强,吸附率和吸附量分别为77.97%、130.44mg/g.随着溶液pH值继续增大,UO22+的水解加剧,生成离子半径较大的(UO2)2(OH)22+、(UO2)3(OH)5+、(UO2)4(OH)7+.导致U(Ⅵ)与菌体表面吸附位点结合的空间位阻增大,当溶液pH=6时,菌体对U(Ⅵ)的去除率下降至61.78%.
2.2 时间对吸附效果的影响
图3为大肠杆菌对U(Ⅵ)的吸附效果与时间的关系:在吸附10min时,吸附率和吸附量分别为74.10%,122.93mg/L.在1~2h时,吸附率变化不明显,最终吸附率和吸附量分别为78.43%, 130.11mg/g.在前10min,菌体表面存在大量活性吸附位点,在静电作用或细胞表面官能团的配位作用下[10,14],菌体对溶液中U(Ⅵ)有较高的吸附速率.随吸附反应的进行,菌体上大量吸附位点被占用,溶液中U(Ⅵ)浓度降低,菌体对U(Ⅵ)的吸附速率下降.
2.3 菌体投加量对吸附效果的影响
图4为大肠杆菌浓度对吸附效果的影响:菌体对U(Ⅵ)的吸附量随菌体浓度的增大而降低,0()=0.05g/L时,吸附量等于276.89mg/g. U(Ⅵ)的去除率随菌体浓度的增大.0()=1g/L时,吸附率为89.37%.在菌体浓度大于0.3g/L时,吸附率增大趋势变得平缓.吸附位点的利用率明显降低,但其吸附量维持在132.34mg/g.故本实验研究选择菌体浓度为0.3g/L开展后续实验.
2.4 初始铀U(Ⅵ)浓度对吸附效果的影响
2.5 吸附热力学分析
2.5.1 吸附等温模型 Langmuir等温吸附模型表示吸附剂上的吸附位点是均匀分布的且与溶质进行单层表面覆盖吸附;Freundlich等温吸附方程表示多层吸附.Langmuir和Freundlich线性表达式(4)和式(5):
式中:m表示理论最大吸附量,mg/g;e表示平衡时吸附量,mg/g;e表示溶液中剩余U(Ⅵ)浓度, mg/L;a表示吸附位点与溶质结合稳定度.f是Freundlich拟合常数,表示吸附剂的吸附能力.为经验常数,表示U(Ⅵ)浓度对吸附效果的影响.
从图6和表2可以看出,在298K、303K、308K和313K时,Langmuir和Freundlich吸附模型均具有良好的线性关系,但拟合参数2(Langmuir) >2(Freundlich).U(Ⅵ)主要与大肠杆菌表面均匀分布的特定活性位点发生单层吸附[15].a值在0~0.1内、25.02 2.5.2 吸附热力学参数 由公式(6)、(7)计算反应的焓变(Δº)、反应物和产物之间熵的变化(Δº)、Gibb’s自由能变化(D).若Dº>0,则为吸热反应,反之为放热反应.若Δº>0说明系统混乱度增加.º<0,表明该吸附反应能自发进行,若Dº>0,则该吸附反应不能自发进行[11].(=/e,=8.314J/(mol·K). Do=Do-Do(7) 如表3所示:Δº>0、Δº>0、D<0.表明大肠杆菌对U(Ⅵ)的吸附反应具有自发性和吸热的特点,随着吸附反应的进行系统混乱度增加. 表2 大肠杆菌对U(Ⅵ)的吸附等温常数Table 2 Adsorption isotherm constants of uranium biosorption byE.col 根据公式(8)和公式(9)分别对大肠杆菌吸附U(VI)的过程进行了动力学拟合[12-13],公式(8)为准一级动力学方程,公式(9)为准二级动力学方程,和图7. ln(e-q)=lne-1(8) 式中:e和q分别表示吸附平衡时的吸附量和时刻的吸附量,mg/g;1(min-1)和2[g/(mg·min)]分别表示准一级和准二级动力学方程的速率常数. 表4 大肠杆菌对U(Ⅵ)的吸附动力学参数Table 4 Kinetic constants of uranium adsorption byE.col 从表4和图7可以看出,准二级动力学吸附模型可以更好地描述大肠杆菌对U(Ⅵ)的吸附过程,其线性相关系数2=0.9998.准二级动力学拟合得到的理论最大吸附量131.41mg/g与实验2.2所得的平衡吸附量129.74mg/g相当.准二级动力学模型是假设在吸附过程中,吸附速率由吸附剂表面未被占有的吸附空位数目的平方值决定的,且受化学吸附机理的控制,推测在吸附过程中存在化学吸附作用. 图8为大肠杆菌与U(Ⅵ)作用前后的傅利叶红外光谱图(4000~400cm-1),对吸附作用前后菌体的红外特征峰进行分属[9,14,16]. 3200~ 3800cm-1为缔合的—OH振动峰、分子间氢键及蛋白质中—NH2键伸缩振动. 2900~3000cm-1主要来自于细胞壁中蛋白质、脂类的—CH3、—CH2和—CH的对称、反对称伸缩振动峰.1470~1700cm-1为酰胺基酰胺Ⅰ带的C=O振动和醛酮COO-的反对称伸缩振动,酰胺Ⅱ带的N—H弯曲振动和C—N伸缩振动.1300~ 1470cm-1为—COOH的伸缩振动、—CH3的弯曲振动和—CH2的剪切运动. 1000~1300cm-1为碳水化合物或醇类C—O、C—H的伸缩振动,磷酸基团PO2-、P(OH)2对称和非对称.吸附铀后菌体3289.68cm-1的吸收峰位移到3429.91cm-1,推测—OH、蛋白质中-NH2可能参与吸附过程,在吸附过程中分子间作用力发生了改变.2927.10cm-1吸收峰为细胞蛋白质、脂类中烷基伸缩振动,在吸附前后位移不明显.酰胺基的1652.36cm-1和1541.44cm-1吸收峰位移到1633.67cm-1和1514.19cm-1,表明酰胺基可能与U(Ⅵ)作用.1075.92cm-1的吸收峰位移到1033.72cm-1,暗示细胞表面C—O、C—H可能与U(Ⅵ)作用.菌体1256.83cm-1处吸收峰消失,说明磷酸基团与U(VI)发生配位作用.在与U(Ⅵ)作用后,菌体表面出现UO22+的特征吸收峰(-1、876.16cm-1).刘明学[17]等的研究表明,920cm-1和922cm-1分别为水碳钠钙铀矿(Na2Ca(UO2) CO3×6H2O)、钙铀云母(Ca[(UO2)(PO4)]×6H2O)的反对称伸缩振动峰.结合本实验XRD分析结果,推测菌体919.80cm-1处的吸收峰为钙铀云母晶体. 图10为大肠杆菌与U(Ⅵ)作用后的X射线衍射结果,经与无机晶体结构数据库(ICSD)的PDF2标准卡片对比,大肠杆菌与U(Ⅵ)作用的主要产物为铀的磷酸盐,包括CaU(PO4)2、Ca(UO2)2(PO4)2×H2O、NaUO2(PO3)3.菌体上部分U(Ⅵ)被还原为U(Ⅳ),这与Kazy等[20]报道的绿脓杆菌与U(Ⅵ)作用后生成含铀磷酸盐的结果比较相似.菌体吸附U(Ⅵ)之后,经800℃灰化4h,其减重比为7.19.对富集U(Ⅵ)之后的菌体灰化处理,提高了铀的磷酸盐[CaU(PO4)2、Ca(UO2)2(PO4)2×H2O、NaUO2(PO3)3]在作用产物中的比例,使富集在菌体上的Ⅵ)转化为更加稳定的化合物,有利于对废液中U(Ⅵ)的富集和回收. 表5 大肠杆菌吸附U(Ⅵ)灰化减重Table 5 The weight reduction about adsorption of U(Ⅵ) byE.coli 3.1 在pH=5、0(U)=50mg/L的溶液中,大肠杆菌粉末可在前10min内完成74.10%的吸附率.最大吸附容量为276.89mg/g. 3.2 Langmuir等温模型和准二级动力学方程能较好的描述大肠杆菌对U(Ⅵ)的吸附过程,其过程具有吸热、系统混乱度增加、自发进行的特点. 3.3 溶液中U(Ⅵ)与大肠杆菌作用过程中,主要与菌体表面的烷基、氨基、羧基等基团作用,重点与含磷的基团(如PO2-、P(OH)2)络合配位. 3.4 U(Ⅵ)与大肠杆菌作用,最终生成铀的磷酸盐[CaU(PO4)2、Ca(UO2)2(PO4)2×H2O],菌体在灰化后出现新的物相[NaUO2(PO3)3]. Bai J, Yao H, Fan F, et al. Biosorption of uranium by chemically modified Rhodotorula glutinis [J]. Journal of Environmental Radioactivity, 2010,101(11):969-973. Yang Y, Wang S, Albrecht-Schmitt T E. Microbial dissolution and reduction of uranyl crystals by Shewanella oneidensis MR-1 [J]. Chemical Geology, 2014,387:59-65. Rahman R O A, Ibrahium H A, Hung Y. Liquid Radioactive Wastes Treatment: A Review [J]. Water, 2011,3(4):551-565. Anke M, Seeber O, Müller R, et al. Uranium transfer in the food chain from soil to plants, animals and man [J]. Chemie der Erde- Geochemistry, 2009,69:75-90. Xie S, Yang J, Chen C, et al. Study on biosorption kinetics and thermodynamics of uranium by Citrobacter freudii [J]. Journal of Environmental Radioactivity, 2008,99(1):126-133. Wang J, Hu X, Liu Y, et al. Biosorption of uranium (VI) by immobilized Aspergillus fumigatus beads [J]. Journal of Environmental Radioactivity, 2010,101(6):504-508. 王永华,谢水波,刘金香,等.奥奈达希瓦氏菌MR-1还原U(VI)的特性及影响因素 [J]. 中国环境科学, 2014,34(11):2942- 2949. 谭文发,吕俊文,唐东山.生物技术处理含铀废水的研究进展 [J]. 生物技术通报, 2015,(3):82-87. 刘小玲,陈晓明,宋 收,等.柠檬酸杆菌对U(Ⅵ)的去除效应及机理研究 [J]. 核农学报, 2015,(9):1774-1781. 马佳林,聂小琴,董发勤,等.三种微生物对铀的吸附行为研究 [J]. 中国环境科学, 2015,35(3):825-832. Xie S, Yang J, Chen C, et al. Study on biosorption kinetics and thermodynamics of uranium by Citrobacter freudii [J] Journal of Environmental Radioactivity, 2008,99(1):126-133. Benguella B. Benaissa Cadmium removal from aqueous solutions by chitin: kinetic and equilibrium studies [J]. Water Research, 2002,36:2463-2474. Bai J, Wu X, Fan F, et al.[J]. Enzyme and Microbial Technology, 2012,51(6/7):382-387. Li X, Ding C, Liao J, et al. Biosorption of uranium on Bacillus sp. dwc-2: preliminary investigation on mechanism [J]. Journal of Environmental Radioactivity, 2014,135:6-12. 张晓峰,陈迪云,彭 燕,等.沸石负载对叔丁基杯[4]芳烃乙酸对铀的吸附行为 [J]. 中国环境科学, 2015,35(6):1686-1692. Martins M, Faleiro M L, Da Costa A M R, et al. Mechanism of uranium (VI) removal by two anaerobic bacterial communities [J]. Journal of Hazardous Materials, 2010,184(1-3):89-96. 刘明学,张 东,康厚军,等.铀与酵母菌细胞表面相互作用研究 [J]. 高校地质学报, 2011,(1):53-58. Crist R H, Oberholser K. Nature of bonding between metallic ions and algal cell walls [J]. Environmental Science and Technology, 1981,15(10):1212-1217. Paterson-Beedle M, Readman J E, Hriljac J A, et al. Biorecovery of uranium from aqueous solutions at the expense of phytic acid [J]. Hydrometallurgy, 2010,104(3/4):524-528. Kazy S K, D'Souza S F, Sar P. Uranium and thorium sequestration by asp.: Mechanism and chemical characterization [J]. Journal of Hazardous Materials, 2009, 163(1):65-72. 黄 荣,聂小琴,董发勤,等.枯草芽孢杆菌与水体中U(Ⅵ)的作用机制 [J]. 化工学报, 2015,(2):764-772. * 责任作者, 助理研究员, xiaoqin_nie@163.com The adsorption mechanism and adsorptive products ofand uranium(VI) in water HUANG Rong1, QIN YI-lin1, NIE XIAO-qin1*, DONG Fa-qin2, LIU MING-xue3, YANG Gang3, MA Jia-lin1, GONG JUN-yuan1, HUANG WEN-bo1, CHEN Bo1 (1.Fundamental Science on Nuclear Wastes and Environmental Safety Laboratory, Southwest University of Science and Technology, Mianyang 621010, China;2.Key Laboratory of Solid Waste Treatment and Resource Recycle, Ministry of Education, Southwest University of Science and Technology, Mianyang 621010, China;3.School of Life Science and Engineering, Southwest University of Science and Technology, Mianyang 621010, China)., 2016,36(6):1780~1787 The accumulation behavior, adsorption model and adsorptive product for dryEscherichia colipowder adsorbing U(Ⅵ) were investigated by the batch absorption experiment, mesoscopic and spectroscopy characterization methods. The maximum biosorption capacity was 276.89mg/g when pH was 5and the initial U(Ⅵ) concentration was 50mg/L. The adsorption process could be well described by Langmuir isothermal model and the pseudo-second order model. FTIR (876.16cm-1, UO22+), SEM-EDS (2.4~4.4keV, U) and XRD results certified that U(Ⅵ) were successfully adsorbed on the cell surface of. UO22+mainly reacted with alkyl, amino, carboxyl and intermolecular hydrogen bond on the surface ofespecially complexing with P containing groups (PO2-, P(OH)2, PO43-and PO3-). After adsorption, U(Ⅵ) were transformed to uranium containing phosphate, such as CaU(PO4)2、Ca(UO2)2(PO4)2×H2O and NaUO2(PO3)3. ;U(Ⅵ);thermodynamics;kinetics;FTIR;the containing P functional groups;SEM-EDS;XRD X522 A 1000-6923(2016)06-1780-08 黄 荣(1994-),男,四川内江人,西南科技大学本科生,主要从事放射性污染生物修复方面的研究.发表论文2篇. 2015-12-10 国家重点基础研究发展计划(973)项目(2014CB846003);国家自然科学基金(41502316,41272371,41472310);核废物与环境安全国防重点学科实验室预先研究基金项目(15yyhk11);西南科技大学博士基金(15zx7109)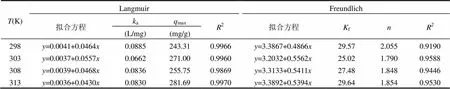
2.6 吸附动力学分析

2.7 红外光谱分析(FTIR)
2.8 扫描能谱分析(SEM-EDS)
2.9 作用产物(XRD)及减重分析
3 结论

