MG132对SH-SY5Y细胞Aβ水平的影响*
王 浩, 孙利利, 于 杨, 杨艳茹, 马 健, 陈 伟, 张继国△, 秦树存
(1泰山医学院药学院,山东泰安271016;2山东省高校动脉粥样硬化重点实验室,泰山医学院动脉粥样硬化研究所,山东泰安271000)
MG132对SH-SY5Y细胞Aβ水平的影响*
王 浩1, 孙利利1, 于 杨2, 杨艳茹1, 马 健1, 陈 伟1, 张继国1△, 秦树存2
(1泰山医学院药学院,山东泰安271016;2山东省高校动脉粥样硬化重点实验室,泰山医学院动脉粥样硬化研究所,山东泰安271000)
目的:观察蛋白酶体抑制剂MG132诱导SH-SY5Y细胞凋亡及调节β-淀粉样蛋白(beta-amyloid protein,Aβ)生成的作用,并对其机制进行探讨。方法:培养SH-SY5Y细胞,MG132对细胞进行处理,浓度分别为2.5 μmol/L、5 μmol/L和10 μmol/L,24 h后检测各项指标。MTT法检测细胞活力;流式细胞术检测细胞凋亡; ELISA法检测细胞Aβ1-40和Aβ1-42水平;Western blot检测淀粉样蛋白前体蛋白(amyloid precursor protein,APP)、β-分泌酶(BACE1)、早老蛋白1(presenilins 1,PS1)、早老蛋白2(presenilins 2,PS2)、nicastrin(NCT)和 α-分泌酶(ADAM10)蛋白表达。结果:经MG132处理后,细胞活力明显下降,诱导细胞凋亡,随剂量增加凋亡率分别为36.97%、46.20%、50.50%;细胞Aβ1-42和Aβ1-40蛋白水平明显上升;APP及Aβ代谢相关蛋白PS1、PS2和BACE1表达均出现剂量依赖性的增加,而ADAM10表达呈剂量依赖性降低;NCT水平变化不明显。结论:MG132能诱导神经细胞凋亡,通过影响Aβ生成途径关键蛋白而促进Aβ的产生,说明蛋白酶体活性下降可通过调节Aβ途径参与阿尔茨海默病的发生。
阿尔茨海默病;泛素-蛋白酶体系统;MG132;β-淀粉样蛋白;细胞凋亡
阿尔茨海默病(Alzheimer’s disease,AD)是中枢神经系统退行性疾病,随着社会人口老龄化加剧,发病率逐年增高,其发病机制尚不明确,也缺乏有效的治疗措施[1]。而淀粉样蛋白级联假说认为,β-淀粉样蛋白(β-amyloid protein,Aβ)是AD发病的关键分子[2]。泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)是真核细胞重要的细胞内蛋白质质量控制系统,具有调控特定蛋白质和去除错误折叠或其它不正常折叠蛋白质的重要功能,近年研究发现,UPS可能调节Aβ代谢,进而在AD发病过程起着重要作用[3-4],但其确切的作用及机制还未完全阐明。本课题组采用蛋白酶体抑制剂MG132抑制蛋白酶体活性,处理人神经母细胞瘤SH-SY5Y细胞,观察UPS受抑后对细胞活力、细胞凋亡,Aβ生成的影响,并初步探讨其机制,以期为阐明UPS在AD中的作用提供依据。
材料和方法
1 细胞
人神经母细胞瘤细胞系SH-SY5Y购于上海生命科学研究所。
2 主要试剂和仪器
蛋白酶体MG132(Sigma);完全1640培养基和Annexin V-FITC/PI细胞凋亡检测试剂盒(南京凯基生物公司);胎牛血清(杭州四季青公司);Aβ1-40和Aβ1-42ELISA试剂盒(蓝基生物公司);APP、BACE1、ADAM10、PS1、PS2和NCT抗体(Abcam)。CO2培养箱(SANYO);多功能酶标仪(Tecan INFINITE200);垂直电泳仪、电泳槽及转膜系统(Bio-Rad);流式细胞仪(BD)。
3 主要方法
3.1 细胞培养及给药 SH-SY5Y细胞置于含10%胎牛血清的DMEM培养基中,37℃、5%CO2的培养箱中培养,当细胞生长到80%融合时给药,给药处理24 h。除MTT实验中MG132浓度为1.25 μmol/L、2.5 μmol/L、5 μmol/L、10 μmol/L和15 μmol/L外,其余实验均为2.5 μmol/L、5 μmol/L和10 μmol/L。空白对照组给予等量的DMEM培养基。
3.2 MTT实验检测细胞活力[5]细胞培养于96孔板中,给药处理后,去培养基,每孔加入含MTT的培养基继续培养4 h,MTT终浓度为0.5 g/L,4 h后去除培养基,每孔加入DMSO 100 μL,室温摇床振荡10 min,酶标仪检测其吸光度,波长为490 nm,每组重复3孔。
3.3 流式细胞术检测细胞凋亡 细胞培养于6孔板中,给药处理后,用不含EDTA的胰蛋白酶消化后收集细胞,PBS清洗2次,离心去上清。500 μL缓冲液重悬细胞,调整细胞浓度为5×108/L,依次加入5 μL PI和5 μL Annexin V,5 min后,流式细胞仪检测细胞凋亡。每组重复3孔。
3.4 ELISA检测细胞Aβ1-40和Aβ1-42水平[6]细胞培养于6孔板中,给药处理后留取上清,用于测定Aβ1-40和Aβ1-42水平;胰酶消化后收集细胞,PBS清洗2次,采用反复冻融法裂解细胞,收集裂解液用于测定细胞内Aβ1-40和Aβ1-42水平,计算时将上清液及细胞裂解液中Aβ1-40和Aβ1-42含量分别相加,作为Aβ1-40和Aβ1-42的总含量。根据ELISA试剂盒说明书,采用竞争酶联免疫测定技术,样品与Aβ-HRP亲和素在预先包被抗人Aβ抗体的酶标板孔里,37℃反应1 h,然后再与HRP酶底物共同孵育,加入终止液后于酶标仪450 nm处测定吸光度。每组重复3孔。
3.5 Western blot检测蛋白水平[7]细胞培养于6孔板中,给药处理后,胰酶消化收集细胞,预冷PBS 洗2次,用含蛋白酶抑制剂的RIPA裂解液裂解细胞,冰上放置30 min,4℃ 12 000×g离心20 min,收集上清,BCA试剂盒测定蛋白浓度。取30 μg总蛋白进行SDS-PAGE,电转移至PVDF膜上,5%脱脂奶粉封闭2 h,相关Ⅰ抗室温孵育2 h,4℃过夜,Ⅱ抗室温孵育2 h,ECL于显影仪中曝光显影,实验重复3次。以β-actin为内参照,进行半定量分析,比值表示其相对量。
4 统计学方法
用SPSS 16.0软件进行统计学处理,数据用(mean±SD)表示,多组间比较采用单因素方差分析,组间两两比较应用SNK-q检验,以P<0.05为差异有统计学意义。
结果
1 MG132降低SH-SY5Y细胞活力
MTT实验结果显示,与空白对照组相比,加入MG132后的SH-SY5Y细胞活力明显下降(P<0.01),随着浓度的增加细胞活力分别下降了38.00%、47.22%、51.17%、52.00%和52.98%,表明MG132对SH-SY5Y细胞具有明显损伤作用,见图1。

Figure 1.MG132 reduced the viability of SH-SY5Y cells.Mean ±SD.n=3.*P<0.05,**P<0.01 vs control.图1 MG132降低SH-SY5Y细胞活力
2 MG132诱导SH-SY5Y细胞凋亡
流式细胞术结果显示,与空白对照组相比,MG132各浓度(2.5、5和10 μmo/L)组早期凋亡率和晚期凋亡率都明显增加,总凋亡率分别为36.97%、46.20%和50.50%,相比空白对照组的6.31%明显升高,说明MG 132能明显诱导SH-SY5Y细胞凋亡,见图2。
3 MG132提高SH-SY5Y细胞Aβ1-40和Aβ1-42的水平
与空白对照组比较,MG132各浓度组总的Aβ1-40和Aβ1-42水平都明显增高,且具有一定的剂量依赖性,说明MG132可提高Aβ水平,见图3。
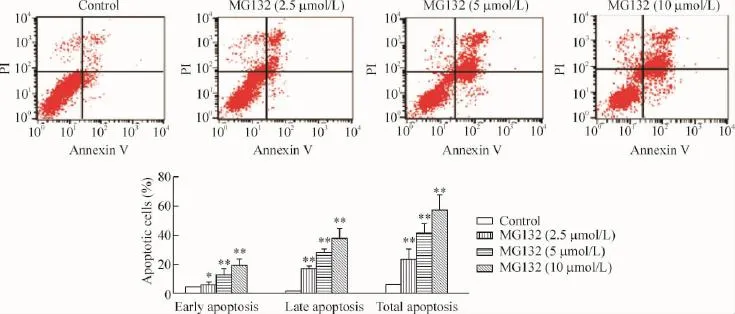
Figure 2.MG132 induced the apoptosis of SH-SY5Y cells.Mean±SD.n=3.*P<0.05,**P<0.01 vs control.图2 MG132诱导SH-SY5Y细胞凋亡
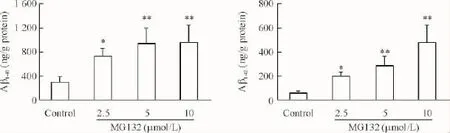
Figure 3.MG132 increased the level of Aβ in the SH-SY5Y cells.Mean±SD.n=3.*P<0.05,**P<0.01 vs control.图3 MG132提高SH-SY5Y细胞Aβ1-40和Aβ1-42水平
4 MG132调节与Aβ生成相关蛋白的表达
Aβ由APP水解产生,其水解酶为BACE1和γ-分泌酶[8]。与空白对照组相比,给予MG132后,APP 和BACE1蛋白表达明显增多。γ分泌酶是由4个亚基组成的复合蛋白,其中发挥重要作用的为PS1、PS2 和NCT[8]。与空白对照组相比,给予MG132后PS1 和PS2蛋白表达都明显增加,NCT虽然表达也有所增加,但无显著性统计学差异。ADAM10是使APP经非淀粉样途径水解的主要酶,经此途径水解不产生Aβ[8]。与空白对照组相比,给予 MG132后,ADAM10表达明显下降,见图4。
讨论
UPS是广泛存在于细胞内的一种蛋白质降解途径,对于维持各种细胞功能具有重要意义。UPS系统由泛素、泛素活化酶(ubiquitin activating enzyme,E1)、泛素结合酶(ubiquitin conjugating enzyme,E2)、泛素连接酶(ubiquitin ligase enzyme,E3)和26S蛋白酶体构成,其中酶主要负责底物蛋白的泛素化,而26S蛋白酶体负责识别泛素分子标记的蛋白底物并将其降解[9]。研究发现,UPS异常与多种神经变性疾病相关,如帕金森病、AD等[10]。尤其是UPS与AD的相关性,越来越受到研究者的关注。有研究发现在AD患者脑组织中蛋白酶体活性明显下降,尤其是与学习记忆密切相关的海马区;AD患者2个重要的病理学改变[由Aβ形成的老年斑(senile plaque,SP)和由磷酸化Tau蛋白形成的神经纤维缠结(neurofibrillary tangles,NFT)]中泛素积聚[11-12];也有研究发现泛素系统的紊乱及蛋白质质量控制系统的损害是AD发生的早期事件[13];说明UPS失调在AD发生过程中可能起着重要作用。所以有学者认为AD是蛋白质错误折叠性疾病,蛋白质质量控制失衡是导致AD发生直接或间接原因[14]。因此本课题组利用蛋白酶体活性抑制剂MG132对UPS在AD中的作用进行了研究,发现MG132处理SH-SY5Y细胞后,细胞活力随着MG132浓度的增高明显下降,细胞凋亡明显增加,表明蛋白酶体活性下降能诱导细胞损伤,说明正常的蛋白酶体活性是维持神经细胞活力及功能的重要因素。
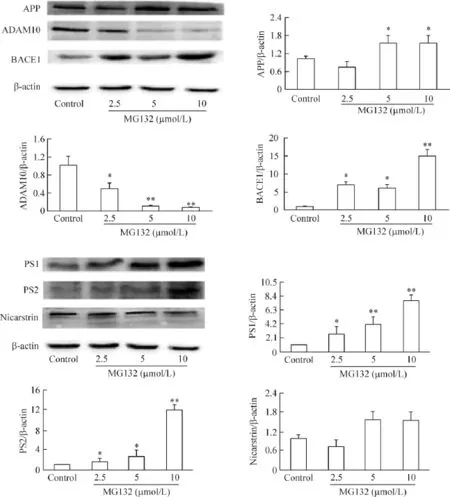
Figure 4.The effect of MG132 on the expression of the related proteins for Aβ generation in the SH-SY5Y cells.Mean±SD.n=3.*P<0.05,**P<0.01 vs control.图4 MG132影响与SH-SY5Y细胞Aβ生成相关蛋白的表达
基于Aβ建立的淀粉样蛋白级联假说认为Aβ在脑内沉积是AD病理改变的中心环节,可引发一系列病理过程,这些病理过程又进一步促进Aβ沉积,从而形成一种级联式放大效应[15]。而有研究发现UPS在Aβ的生成和代谢中发挥重要作用,可调控Aβ的水平[16]。在本研究中经不同浓度的MG132处理SH-SY5Y细胞后,Aβ1-40及Aβ1-42的水平都明显升高,也证实了此观点。同时本研究还对UPS系统调控Aβ水平的机制进行了初步研究。
Aβ是由APP通过酶降解产生[8,17]。APP的降解包括淀粉样肽源途径和非淀粉样肽源途径。淀粉样肽源途径是指APP在脑内经β-分泌酶和γ-分泌酶的作用生成具神经毒性的Aβ片段,非淀粉样肽源途径是指APP在α-分泌酶(如ADAM10)和γ-分泌酶的作用下从Aβ序列内部进行降解,生成sAPPα而避免Aβ的生成。生理状态下,APP主要经非淀粉样途径水解,少量经淀粉样途径产生 Aβ,而且sAPPα还具有神经营养和神经保护作用。而本研究发现,给予MG132后,BACE1水平明显升高,ADAM10水平则明显下降,说明UPS功能下降可改变生理的APP降解途径,使其更多的经淀粉样肽源途径降解。同时本研究也发现,给予MG132后APP水平明显升高,说明APP也可通过UPS系统进行降解,这与Shen等[5]的研究结论相符。本研究还对蛋白酶体活性被抑制后γ-分泌酶蛋白表达进行了研究,研究发现MG132明显提高γ-分泌酶蛋白复合物中活性蛋白PS1和PS2的表达,而对NCT的影响不明显。说明蛋白酶体活性降低引起的Aβ水平升高,可能也与UPS系统参与γ-分泌酶的代谢有关。
总之,本实验结果表明抑制蛋白酶体活性,可诱导神经细胞损伤和Aβ水平上升,其机制可能与其调节与Aβ生成相关的底物APP及α-分泌酶、β-分泌酶和γ-分泌酶相关组分有关,但对其深入的分子机制还有待进一步研究。
[1] Riederer BM,Leuba G,Vernay A,et al.The role of the ubiquitin proteasome system in Alzheimer’s disease[J].Exp Biol Med(Maywood),2011,236(3):268-276.
[2] Lopez Salon M,Pasquini L,Besio Moreno M,et al.Relationship between β-amyloid degradation and the 26S proteasome in neural cells[J].Exp Neurol,2003,180(2): 131-143.
[3] Sulistio YA,Heese K.The Ubiquitin-proteasome system and molecular chaperone deregulation in Alzheimer’s disease[J].Mol Neurobiol,2016,53(2):905-931.
[4] Panmanee J,Nopparat C,Chawanich N,et al.Melatonin regulates the transcription of βAPP-cleaving secretases mediated through melatonin receptors in human neuroblastoma SH-SY5Y cells[J].J Pineal Res,2015,59(3):308-320.
[5] Shen D,Coleman J,Chan E,et al.Novel cell-and tissue-based assays for detecting misfolded and aggregated protein accumulation within aggresomes and inclusion bodies[J].Cell Biochem Biophys,2011,60(3):173-185.
[6] Wang H,Yu Y,Chen W,et al.PLTP deficiency impairs learning and memory capabilities partially due to alteration of amyloid-beta metabolism in old mice[J].J Alzheimers Dis,2014,39(1):79-88.
[7] Wuwongse S,Cheng SS,Wong GT,et al.Effects of corticosterone and amyloid-beta on proteins essential for synaptic function:implications for depression and Alzheimer’s disease[J].Biochim Biophys Acta,2013,1832 (12):2245-2256.
[8] Xiao Q,Yan P,Ma X,et al.Neuronal-targeted TFEB accelerates lysosomal degradation of APP,reducing Aβ generation and amyloid plaque pathogenesis[J].J Neurosci,2015,35(35):12137-12151.
[9] Ullrich C,Mlekusch R,Kuschnig A,et al.Ubiquitin enzymes ubiquitin and proteasome activity in blood mononuclear cells of MCI,Alzheimer and Parkinson patients[J].Curr Alzheimer Res,2010,7(6):549-555.
[10]金雪佳.泛素-蛋白酶体系统在神经退行性疾病中的研究[J].药物生物技术,2015,22(4):366-368.
[11]Keck S,Nitsch R,Grune T,et al.Proteasome inhibition by paired helical filament-tau in brains of patients with Alzheimer’s disease[J].J Neurochem,2003,85(1): 115-122.
[12]Ii K,Ito H,Tanaka K,et al.Immunocytochemical co-localization of the proteasome in ubiquitinated structures in neurodegenerative diseases and the elderly[J].J Neuropathol Exp Neurol,1997,56(2):125-131.
[13]Gentier RJ,van Leeuwen FW.Misframed ubiquitin and impaired protein quality control:an early event in Alzheimer’s disease[J].Front Mol Neurosci,2015,8:47.
[14]Oddo S.The ubiquitin-proteasome system in Alzheimer’s disease[J].J Cell Mol Med,2008,12(2):363-373.
[15]Karran E,Mercken M,De Strooper B.The amyloid cascade hypothesis for Alzheimer’s disease:an appraisal for the development of therapeutics[J].Nat Rev Drug Discov,2011,10(9):698-712.
[16]Seo H,Isacson O.The hAPP-YAC transgenic model has elevated UPS activity in the frontal cortex similar to Alzheimer’s disease and Down’s syndrome[J].J Neurochem,2010,114(6):1819-1826.
[17]Wang H,Saunders AJ.The role of ubiquitin-proteasome in the metabolism of amyloid precursor protein(APP):implications for novel therapeutic strategies for Alzheimer’s disease[J].Discov Med,2014,18(97):41-50.
(责任编辑:陈妙玲,罗 森)
Effect of MG132 on Aβ generation in SH-SY5Y cells
WANG Hao1,SUN Li-li1,YU Yang2,YANG Yan-ru1,MA Jian1,CHEN Wei1,ZHANG Ji-guo1,QIN Shu-cun2
(1School of Pharmaceutical Science,Taishan Medical University,Taian 271016,China;2Key Laboratory of Atherosclerosis in Universities of Shandong,Institute of Atherosclerosis,Taishan Medical University,Taian 271000,China.E-mail:jgzhang@tsmc.edu.cn;shucunqin@hotmail.com)
AIM:To observe the influences of different concentrations of MG132 on apoptosis and beta-amyloid protein(Aβ)generation in SH-SY5Y cells,and to explore the underlying mechanism.METHODS:SHSY-5Y cells were incubated with MG132 for 24 h.The final concentrations of MG132 were 2.5,5 and 10 μmol/L.The cell viability was determined by MTT assay.The cell apoptosis was assessed by flow cytometry.The levels of Aβ were measured by ELISA.The relative protein levels were detected by Western blot.RESULTS:In the SH-SY5Y cells,MG132 reduced the cell viability,induced the cell apoptosis,increased the level of Aβ,and increased the expression of the related proteins for Aβ generation in a concentration-dependent manner.CONCLUSION:MG132 induces apoptosis and increases the levels of Aβ1-42and Aβ1-40by regulating the proteins related to Aβ generation in the SH-SY5Y cells.
Alzheimer’s disease;Ubiquitin-proteasome system;MG132;Beta-amyloid protein;Apoptosis
R363.2
A
10.3969/j.issn.1000-4718.2016.07.007
1000-4718(2016)07-1195-05
2015-12-08
2016-02-29
国家自然科学基金资助项目(No.81441111;No.81302202);山东省自然科学基金资助项目(No.ZR2011HM044);山东省卫生厅资助项目(No.2013WS0313);泰安市科技计划资助项目(No.2015NS2072)
△张继国 Tel:0538-6229836;E-mail:jgzhang@tsmc.edu.cn;秦树存 Tel:0538-6222986;E-mail:shucunqin@hotmail.com

