外源性硫化氢通过抑制JAK/STAT通路对抗高糖引起的人脐静脉内皮细胞损伤*
林佳琼, 陈景福, 廖静秋, 林 凯, 邓海鸥, 吴冬波, 吴 文△
(1南方医科大学,广东广州510515;2广东省人民医院,广东省医学科学院,广东省老年医学研究所东病区内分泌科,广东广州510080;3中山大学附属第一医院黄埔院区心内科,广东广州510700;4南方医科大学附属柳州医院内分泌科,广西柳州545007)
外源性硫化氢通过抑制JAK/STAT通路对抗高糖引起的人脐静脉内皮细胞损伤*
林佳琼1,2, 陈景福3, 廖静秋1,2, 林 凯2, 邓海鸥2, 吴冬波4, 吴 文2△
(1南方医科大学,广东广州510515;2广东省人民医院,广东省医学科学院,广东省老年医学研究所东病区内分泌科,广东广州510080;3中山大学附属第一医院黄埔院区心内科,广东广州510700;4南方医科大学附属柳州医院内分泌科,广西柳州545007)
目的:研究外源性硫化氢(H2S)能否通过调控Janus激酶/信号转导及转录激活因子(JAK/STAT)通路对抗高糖诱导的人脐静脉内皮细胞(HUVECs)损伤。方法:Western blot法测定JAK2、STAT3、cleaved caspase-3的蛋白水平;CCK-8法检测细胞存活率;罗丹明123染色荧光显微镜照相法检测线粒体膜电位(MMP);双氯荧光素(DCFH-DA)染色荧光显微镜照相法测定胞内活性氧(ROS)水平;超氧化物歧化酶(SOD)检测试剂盒检测SOD活性。结果:应用400 μmol/L硫氢化钠(NaHS,为H2S的供体)预处理HUVECs 30 min能明显地抑制高糖(40 mmol/L葡萄糖,HG)对p-JAK2和p-STAT3蛋白水平的上调作用。400 μmol/L NaHS预处理30 min或20 μmol/L JAK/STAT通路抑制剂AG490预处理30 min均能抑制高糖对HUVECs引起的损伤,使细胞存活率和SOD活性升高,cleaved caspase-3蛋白水平、ROS生成量及MMP丢失均减少。结论:外源性的H2S通过抑制JAK/STAT通路保护HUVECs对抗高糖引起的损伤。
硫化氢;JAK/STAT通路;高糖;人脐静脉内皮细胞
长期以来,硫化氢(hydrogen dulfide,H2S)被认为是一种具有臭鸡蛋气味的有毒气体。目前认为,哺乳动物体内如心血管系统能生成内源性H2S,它是一种新型气体信号分子,在多种心血管疾病中发挥重要的保护作用。用心肌梗塞的大鼠模型,Wangle等[1]证实 H2S能减轻心室功能障碍。近年,我们[2-3]和其他学者[4-5]证实,外源性的H2S能保护心肌细胞对抗高糖或化学性缺氧引起的损伤,其作用机制与调控核因子κB(nuclear factor-κB,NF-κB)等通路有关[2-4]。此外,外源性的H2S能够抑制高糖引起的血管内皮细胞功能失调[6]。
高血糖是导致糖尿病血管内皮功能异常及血管病变的重要启动因子之一[7]。高糖等可通过激活NF-κB[8]等信号通路损伤血管内皮细胞。Janus激酶/信号转导及转录激活因子(Janus kinase/signal transducer and activator of transcription,JAK/STAT)通路是细胞信号转导的重要通路之一,参与高糖对肾小球滤过膜细胞的损伤[9]。最近,我们证实,JAK/ STAT通路介导高糖引起人脐静脉内皮细胞HUVECs的多种损伤[10]。值得注意的是,外源性H2S能通过调控JAK/STAT通路对抗氧化应激引起的神经细胞损伤[11]。但是,H2S能否通过调控血管内皮细胞的JAK/STAT通路抑制高糖引起的损伤尚未见报道。
本文用人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)建立高糖损伤模型,重点研究外源性H2S对高糖激活HUVECs JAK/STAT通路的影响,观察外源性H2S通过调控JAK/STAT通路保护HUVECs对抗高糖引起的多种损伤的效应,为进一步阐明外源性H2S对血管内皮细胞的保护作用机制提供实验依据。
材料和方法
1 材料
硫氢化钠(NaHS)、DCFH-DA、罗丹明123(rhodamine 123,Rh123)和超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒购自 Sigma-Aldrich; CCK-8试剂盒购自Dojindo;DMEM(低糖)培养基购自HyClone;胎牛血清(fetal bovine serum,FBS)购自Gibco;JAK2抗体、p-JAK2抗体和p-STAT3抗体购自CellSignaling Technology;STAT3 抗 体、cleaved caspase-3抗体和 GAPDH 抗体购自 Proteintech; HUVECs购自广州吉妮欧公司。
2 方法
2.1 人脐静脉内皮细胞的体外培养 细胞培养在含10%FBS的低糖DMEM培养基,同时加入100 U青霉素、100 mg链霉素,置于5%CO2、37℃的温箱中培养。待细胞融合达80%后,用0.25%胰蛋白酶-EDTA消化,适度消化后加完全培养基终止胰蛋白酶的消化作用。用灭菌枪头将瓶壁细胞吹落形成细胞悬液。1 200 r/min离心5 min,弃上清,按1∶3传代。实验前换用无血清的DMEM培养液培养12 h,然后进行分组实验。
2.2 实验分组 实验分为6组:正常对照(control) 组;高糖(high glucose,HG)损伤组:应用40 mmol/L葡萄糖处理 HUVECs 24 h;NaHS+HG组:400 μmol/L NaHS预处理HUVECs 30 min,撤去,用PBS 洗2次,接着用40 mmol/L葡萄糖作用24 h;AG490 +HG组:20 μmol/L AG490(JAK/STAT通路抑制剂)作用于HUVECs 30 min,撤去,用PBS洗2次,接着用40 mmol/L葡萄糖作用24 h;AG490组:20 μmol/L AG490作用于HUVECs 30 min,撤去,用PBS 洗2次,无血清培养基DMEM培养24 h;NaHS组: 400 μmol/L NaHS预处理HUVECs 30 min,撤去,用PBS洗2次,无血清培养基DMEM培养24 h。
2.3 CCK-8测定细胞存活率 根据CCK-8试剂盒说明书检测 HUVECs活力。将HUVECs以每孔5 000细胞的密度接种于96孔板,当细胞生长80%时,给予上述不同处理。处理结束后,每孔加入无血清培养基稀释的CCK-8工作液100 μL,37℃孵育2 h,使用酶标仪检测各孔吸光度(A)值,波长设定为450 nm。按公式:细胞存活率(%)=处理组A/对照组A×100%,求出处理组细胞存活率,重复3次。
2.4 Western blot法检测蛋白的表达 将HUVECs接种于60mm培养皿中,贴壁生长至80%时给予不同处理因素,弃培养液,用预冷的PBS洗2次,各皿加入80 μL裂解液后置4℃裂解30 min,12 000 r/ min离心15 min,取上清,蛋白浓度采用BCA法进行测定。总蛋白经SDS-PAGE分离后,转移到PVDF膜上。用5%脱脂奶粉(TBST配置)封闭90 min,分别加入I抗(p-JAK2和JAK2为1∶2 000,p-STAT3和STAT3为1∶5 000,cleaved caspase-3为1∶1 000),4℃过夜,然后用 TBST洗10 min 3次,加入 II抗(1∶10 000),室温孵育60 min,然后再用TBST洗10 min 3次。ECL发光液将PVDF膜显色,凝胶成像系统扫描分析结果。
2.5 细胞内活性氧(reactive oxygen species,ROS)含量的检测 将HUVECs接种于24孔培养板中,当细胞生长贴壁生长至80%时,给予各实验组不同的处理因素后,弃培养液,PBS冲洗3次,风干。将HUVECs与10 μmol/L DCFH-DA于37℃孵育30 min,弃去,再用PBS冲洗3次,风干。在荧光显微镜下随机选取5个不重复区摄片,采用ImageJ 1.41软件分析各视野平均绿色荧光强度。
2.6 细胞线粒体膜电位(mitochondrial membranepotential,MMP)的测定 将HUVECs接种于24孔培养板中,贴壁生长至大约80%时,给予各实验组不同的处理因素,弃培养液,用PBS冲洗3次,风干。将HUVECs与10 μg/L Rh123于37℃避光孵育30 min,弃去,再用PBS冲洗3次,风干。在荧光显微镜下随机地选取5个不重复区摄片,用ImageJ 1.41软件分析各视野平均荧光强度。
2.7 SOD活性的检测 根据SOD检测试剂盒说明书的操作步骤,给予各实验组不同的处理因素后,弃培养液,用PBS冲洗,加入预冷的0.1 mol/L Tris/ HCl(pH 7.4)、0.5%Triton、5 mmol/L β-巯基乙醇以及0.1 g/L苯甲基氟磺酸裂解细胞,14 000×g离心5 min,取上清,使用酶标仪在450 nm波长下测定吸光度,计算样品浓度,重复3次。
3 统计学处理
用SPSS 20.0统计学软件进行统计分析。实验数据以均数±标准误(mean±SEM)表示,采用SNK-q检验(实验组组间比较)及Dunnett-t检验(实验组与对照组比较),以P<0.05为差异有统计学意义。
结果
1 外源性H2S和JAK/STAT通路抑制剂对抗高糖引起的细胞毒性
应用HG(40 mmol/L葡萄糖)处理HUVECs 24 h,可引起明显的细胞毒性,使细胞存活率降低,与对照组相比,差异具有统计学显著性(P<0.01)。为了观察JAK/STAT通路在HG降低细胞存活率的影响,我们观察了不同浓度(5 μmol/L~80 μmol/L)JAK/ STAT通路抑制剂AG490对HG诱导的细胞毒性的作用,结果显示:10 μmol/L、20 μmol/L、40 μmol/L 和80 μmol/L浓度的AG490预处理HUVECs 30 min均能拮抗HG的细胞毒性,使细胞存活率上升(P<0.05)。80 μmol/L AG490本身不引起细胞毒性。经统计学分析,浓度为20 μmol/L、40 μmol/L和80 μmol/L AG490等3组的抗细胞毒性作用无明显的差异。根据此结果,后续实验应用20 μmol/L的AG490为干预浓度。
此外,应用200 μmol/L、300 μmol/L、400 μmol/ L和500 μmol/L浓度的NaHS分别预处理HUVECs 30 min,均可使细胞存活率上升。500 μmol/L NaHS本身不引起细胞毒性。这说明外源性H2S能对抗高糖诱导的细胞毒性。根据此实验结果,后续实验应用400 μmol/L NaHS为干预浓度,见图1。
2 外源性H2S抑制高糖对人脐静脉内皮细胞JAK/ STAT通路的激活
如图2所示,应用HG处理HUVECs 9 h可明显地激活JAK2,表现为p-JAK2的蛋白水平明显升高,与对照组比较,差异有统计学显著性(P<0.05)。但是,在HG处理HUVECs之前,应用400 μmol/L硫氢化钠(NaHS,为H2S的供体)预处理30 min,可显著抑制HG对p-JAK2的激活作用,使p-JAK2减少,与HG组相比较,差异有统计学显著性(P<0.05)。另一方面,应用HG处理HUVECs 12 h可明显地上调p-STAT3的蛋白水平(P<0.05);然而,400 μmol/L NaHS预处理30 min能抑制HG对STAT3的激活作用,使p-STAT3的蛋白水平显著降低,与HG组比较,差异有统计学显著性(P<0.05)。

Figure 1.Inhibitor of JAK/STAT pathway and exogenous H2S protected HUVECs against HG-induced cytotoxicity.Mean±SEM.n=5.*P<0.05,**P<0.01 vs control group;#P<0.05 vs HG group.图1 JAK/STAT通路抑制剂和外源性H2S保护HUVECs对抗高糖引起的细胞毒性
3 外源性H2S和JAK/STAT通路抑制剂抑制高糖引起的人脐静脉内皮细胞凋亡
应用HG分别处理HUVECs 3 h、6 h、9 h、12 h和24 h均能促进cleaved caspase-3的水平增加,其中处理12 h时,cleaved caspase-3的蛋白水平最高。与对照组分别比较均有统计学显著性(P<0.01)。因此,后续实验以观察HG处理HUVECs 12 h为观察时点。
在HG处理HUVECs 12 h前应用400 μmol/L NaHS预处理 HUVECs 30 min能明显抑制HG对cleaved caspase-3蛋白水平的上调作用,与HG组比较,差异有统计学显著性(P<0.05)。
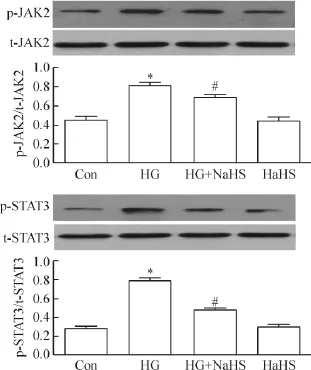
Figure 2.Exogenous H2S inhibited HG-induced activation of JAK/STAT pathway in HUVECs.Mean±SEM.n= 3.*P<0.05 vs control group;#P<0.05 vs HG group.图2 外源性H2S抑制高糖对人脐静脉内皮细胞JAK/ STAT通路的激活
另一方面,应用 20 μmol/L AG490预处理HUVECs 30 min能抑制HG对cleaved caspase-3蛋白水平的促进作用(P<0.05)。400 μmol/L NaHS或20 μmol/L AG490本身对cleaved caspase-3的基础水平无明显影响,见图3。
4 外源性H2S和JAK/STAT通路抑制剂减轻高糖对人脐静脉内皮细胞线粒体损伤
图4显示,应用HG处理HUVECs 24 h使细胞内反映MMP大小的Rh123平均荧光强度降低,两组比较差异有统计学显著性(P<0.05)。但是,应用400 μmol/L NaHS预处理 HUVECs 30 min或 20 μmol/L AG490预处理HUVECs 30 min均能使MMP上升(P<0.05)。400 μmol/L NaHS或20 μmol/L AG490本身不影响MMP的基础水平。这说明外源性H2S能减轻HG对线粒体的损伤。
5 外源性H2S和JAK/STAT通路抑制剂对抗高糖诱导的氧化应激
HG作用HUVECs 24 h可使胞内DCFH的MFI(为反映ROS水平的一个指标)显著增强,与正常对照组相比,差异有统计学显著性(P<0.05)。有意义的是,400 μmol/L NaHS预处理HUVECs 30 min或20 μmol/L AG490预处理HUVECs 30 min使MFI从(33.20±1.80)%降低至(23.86±1.90)%和(23.53 ±2.50)%。与HG组分别比较,差异有统计学显著性(P<0.05)。说明外源性H2S能抑制HG引起的氧化应激,见图5。
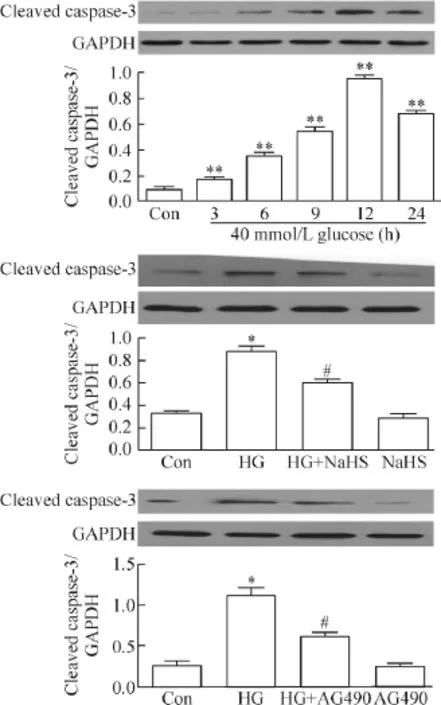
Figure 3.Exogenous H2S and the inhibitor of JAK/STAT pathway attenuated HG-induced apoptosis of HUVECs.Mean±SEM.n=3.*P<0.05,**P<0.01 vs control group;#P<0.05 vs HG group.图3 外源性H2S和JAK/STAT通路抑制剂抑制高糖引起的人脐静脉内皮细胞凋亡
6 外源性H2S和JAK/STAT通路抑制剂对抗高糖对SOD活性的抑制作用
HG作用HUVECs 24 h可使SOD的活性明显降低,与对照组相比,差异有统计学显著性(P<0.05)。但是,400 μmol/L NaHS预处理HUVECs 30 min或20 μmol/L AG490预处理HUVECs 30 min均能减轻HG对SOD活性的抑制作用,与HG组分别比较,差异有统计学显著性(P<0.05)。400 μmol/L NaHS 或20 μmol/L AG490本身对SOD的基础活性无明显影响,见图6。
讨论
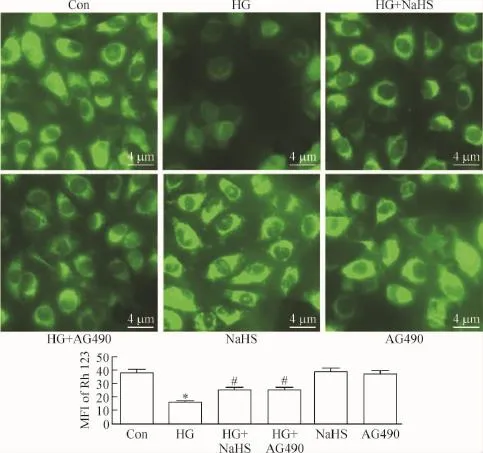
Figure 4.Exogenous H2S and the inhibitor of JAK/STAT pathway attenuated HG-induced MMP loss in HUVECs.Mean±SEM.n= 5.*P<0.05 vs control group;#P<0.05 vs HG group.图4 外源性H2S和JAK/STAT通路抑制剂减轻高糖对人脐静脉内皮细胞线粒体损伤
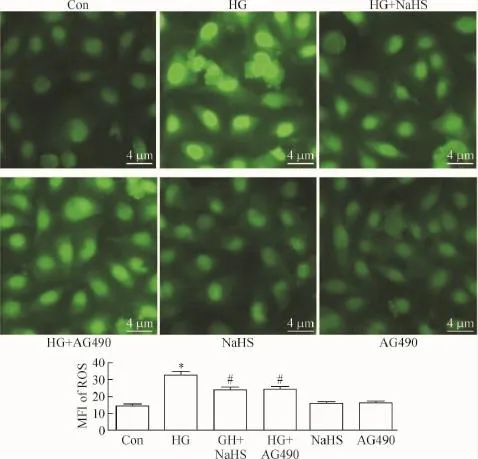
Figure 5.Exogenous H2S and the inhibitor of the JAK/STAT pathway decreased ROS production in HG-induced HUVECs.Mean± SEM.n=5.*P<0.05 vs control group;#P<0.05 vs HG group.图5 外源性H2S和JAK/STAT通路抑制剂保护人脐静脉内皮细胞对抗高糖引起的ROS生成
高血糖是引起糖尿病血管病变(diabetic angiopathy)的重要病理生理机制之一。本文在人脐静脉内皮细胞HUVECs模型再次证实,HG可激活HUVECs的JAK/STAT通路,表现为明显地增加p-JAK2 和p-STAT3的水平;同时伴有多种损伤,包括降低细胞存活率,增加细胞凋亡(cleaved caspase-3增多),促进氧化应激(胞内ROS生成增多和SOD活性降低)及线粒体损伤(MMP降低);应用JAK/STAT通路抑制剂AG490能阻断HG引起的上述效应,提示JAK/STAT通路介导HG引起HUVECs的多种损伤,这与前文的报道[10]相一致。
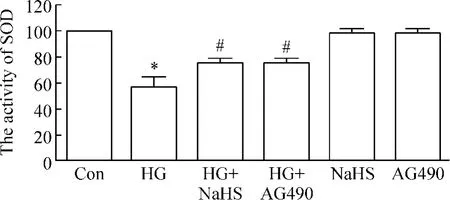
Figure 6.Exogenous H2S and the inhibitor of JAK/STAT pathway blocked the inhibitory effect of HG on SOD activity in HUVECs.Mean±SEM.n=6.*P<0.05 vs control group;#P<0.05 vs HG group.图6 外源性H2S和JAK/STAT通路抑制剂阻断高糖对HUVECs SOD活性的抑制作用
本文证实外源性H2S能明显抑制HG对HUVECs的JAK/STAT通路的激活作用,使p-JAK2和p-STAT3的水平降低。H2S是一种新型的气体信号分子,在血管中主要由胱硫醚γ-合成酶生成。越来越多的研究证实,H2S具有重要的心血管保护作用[1-6]。近年,H2S在糖尿病心血管并发症中的作用受到高度重视。这主要是基于下述的研究成果:(1) 在2型糖尿病患者与糖尿病动物模型,血中H2S浓度较低[6,12];(2)低浓度H2S与糖尿病血管炎症有关[12];(3)外源性H2S抑制HG引起的血管内皮细胞功能失调[6];(4)外源性H2S能减轻糖尿病大鼠由于缺血/再灌注引起的心肌损伤[13]。近年来我们证实,外源性H2S可通过抑制丝裂原激活蛋白激酶[2]和NF-κB[3]等信号通路保护心肌对抗HG引起的损伤。本文发现,外源性H2S也能抑制HG对HUVECs JAK/STAT通路的激活。上述的研究提示,在糖尿病血管并发症的病理生理机制中,内源性H2S对多种信号通路的调控作用减弱可能起着重要作用。
由于Suzuki等[6]报道H2S可通过保护线粒体功能对抗HG引起的血管内皮功能失调。因此,本研究进一步观察了外源性H2S对HG损伤HUVECs作用的影响。研究结果表明,与JAK/STAT通路抑制剂AG490的结果类似,外源性H2S能明显地保护HUVECs对抗HG引起的多种损伤,提示外源性H2S对抗HG诱导HUVECs多种损伤的作用机制之一可能与其抑制JAK/STAT通路有关。
[1] Wang X,Wang Q,Guo W,et al.Hydrogen sulfide attenuates cardiac dysfunction in a rat model of heart failure:a mechanism through cardiac mitochondrial protection[J].Biosci Rep,2011,31(2):87-98.
[2] Xu W,Wu W,Chen J,et al.Exogenous hydrogen sulfide protects H9c2 cardiac cells against high glucose-induced injury by inhibiting the activities of the p38 MAPK and ERK1/2 pathways[J].Int J Mol Med,2013,32(4): 917-925.
[3] Xu W,Chen J,Lin J,et al.Exogenous H2S protects H9c2 cardiac cells against high glucose-induced injury and inflammation by inhibiting the activation of the NF-κB and IL-1beta pathways[J].Int J Mol Med,2015,35(1): 177-186.
[4] 李建平,杨春涛,杨战利,等.CFTR氯通道在硫化氢诱导的心肌保护及细胞增殖中的作用[J].中国病理生理杂志,2009,25(6):1070-1075.
[5] 魏水生,廖新学,谭钰嫔,等.热休克蛋白90在硫化氢抗化学性缺氧诱导心肌细胞氧化应激损伤中的作用[J].中国病理生理杂志,2009,25(12):2329-2333.
[6] Suzuki K,Olah G,Modis K,et al.Hydrogen sulfide replacement therapy protects the vascular endothelium in hyperglycemia by preserving mitochondrial function[J].Proc Natl Acad Sci U S A,2011,108(33):13829-13834.
[7] Sena CM,Pereira AM,Seica R.Endothelial dysfunction: a major mediator of diabetic vascular disease[J].Biochim Biophys Acta,2013,1832(12):2216-2231.
[8] Brownlee M.Biochemistry and molecular cell biology of diabetic complications[J].Nature,2001,414(6865):813-820.
[9] Marrero MB,Banes-Berceli AK,Stern DM,et al.Role of the JAK/STAT signaling pathway in diabetic nephropathy [J].Am J Physiol Renal Physiol,2006,290(4):F762-F768.
[10]廖静秋,林佳琼,张伟杰,等.JAK/STAT通路在高糖诱导人脐静脉内皮细胞损伤中的作用[J].中国病理生理杂志,2016,32(1):392-397.
[11]Yu HM,Zhi JL,Cui Y,et al.Role of the JAK-STAT pathway in protection of hydrogen peroxide preconditioning against apoptosis induced by oxidative stress in PC12 cells [J].Apoptosis,2006,11(6):931-941.
[12]Jain SK,Bull R,Rains JL,et al.Low levels of hydrogen sulfide in the blood of diabetes patients and streptozotocintreated rats causes vascular inflammation?[J].Antioxid Redox Signal,2010,12(11):1333-1337.
[13]Gao Y,Yao X,Zhang Y,et al.The protective role of hydrogen sulfide in myocardial ischemia-reperfusion-induced injury in diabetic rats[J].Int J Cardiol,2011,152(2): 177-183.
(责任编辑:陈妙玲,罗 森)
Exogenous hydrogen sulfide attenuates high glucose-induced injury by inhibiting JAK/STAT pathway in human umbilical vein endothelial cells
LIN Jia-qiong1,2,CHEN Jing-fu3,LIAO Jing-qiu1,2,LIN Kai2,DENG Hai-ou2,WU Dong-bo4,WU Wen2
(1Southern Medical University,Guangzhou 510515,China;2Department of Endocrinology,East Ward,Guangdong Geriatric Institute,Guangdong Academy of Medical Sciences,Guangdong General Hospital,Guangzhou 510080,China;3Departments of Cardiac Care Unit,Huangpu Division of The First Affiliated Hospital,Sun Yat-sen University,Guangzhou 510700,China;4Department of Endocrinology,Affiliated Liuzhou Hospital of Southern Medical University,Liuzhou 545007,China.E-mail:wuwen1964@163.com)
AIM:To explore whether exogenous hydrogen sulfide(H2S)depresses high glucose(HG)-induced injury by modulating the Janus kinase/signal transducer and activator of transcription(JAK/STAT)pathway in human umbilical vein endothelial cells(HUVECs).METHODS:The protein levels of JAK2,STAT3 and cleaved caspase-3 were determined by Western blot.The cell viability was measured by CCK-8 assay.Mitochondrial membrane potential (MMP)was detected by rhodamine 123 staining followed by photofluorography.The intracellular level of reactive oxygen species(ROS)was analyzed by DCFH-DA staining followed by photofluorography.The activity of superoxide dismutase (SOD)was also measured.RESULTS:Pretreatment of the HUVECs with 400 μmol/L NaHS(a donor of H2S)for 30 min prior to exposure to 40 mmol/L glucose(HG)markedly attenuated HG-induced upregulation of the phosphorylation of JAK2 and STAT3.Pretreatment with 400 μmol/L NaHS for 30 min or with 20 μmol/L AG490(inhibitor of the JAK/STAT pathway)for 30 min attenuated the injury of HUVECs induced by HG,as indicated by the increases in cell viability and SOD activity,and decreases in the protein level of cleaved caspase-3,ROS generation and dissipation of MMP.CONCLUSION:Exogenous H2S protects HUVECs against HG-induced injury by inhibiting JAK/STAT pathway.
Hydrogen sulfide;JAK/STAT pathway;High glucose;Human umbilical vein endothelial cells
R363
A
10.3969/j.issn.1000-4718.2016.07.002
1000-4718(2016)07-1161-06
2016-02-17
2016-04-21
国家自然科学基金资助项目(No.81450062);广东省自然科学基金资助项目(No.2015A030313872)
△Tel:020-83827812;E-mail:wuwen1964@163.com

