原花青素单一活性成分B2对高糖作用下人内皮祖细胞的保护作用
王丽萍, 李 莉, 姚计文, 李 博
[1北京师范大学社区卫生服务中心(医院),北京100875;2北京市公安医院内科,北京100121;3北京市和平里医院心血管内科,北京100013]
原花青素单一活性成分B2对高糖作用下人内皮祖细胞的保护作用
王丽萍1△, 李 莉2, 姚计文3, 李 博3
[1北京师范大学社区卫生服务中心
(医院),北京100875;2北京市公安医院内科,北京100121;3北京市和平里医院心血管内科,北京100013]
目的:研究原花青素单一活性成分B2(PC-B2)对高糖环境下人内皮祖细胞(EPCs)的保护作用及其作用机制。方法:从健康人外周血中分离诱导培养人EPCs,并进行鉴定。将EPCs分为control组(PBS处理)、高渗对照组(25 mmol/L甘露醇处理)、高浓度30 mmol/L葡萄糖作用组以及不同浓度(2、10和50 mg/L)PC-B2与30 mmol/L葡萄糖共处理组。使用CCK-8法检测各组中EPCs活力的变化;同时检测各组EPCs中乳酸脱氢酶(LDH)、丙二醛(MDA)、超氧化物歧化酶(SOD)和还原型谷胱甘肽(GSH)水平;ELISA方法检测各组EPCs上清中一氧化氮(NO)、内皮素-1(ET-1)、细胞间黏附分子-1(ICAM-1)和血管细胞黏附分子-1(VCAM-1)的含量变化;流式细胞术检测各组中EPCs活性氧簇(ROS)生成和凋亡率变化;Western blot检测血管内皮生长因子(VEGF)和血管内皮生长因子受体-2(VEGFR-2)的表达情况。结果:与control组相比,高糖作用组中人EPCs的活力显著下降(P <0.05);LDH漏出量以及MDA、ET-1、ICAM-1和VCAM-1含量均显著升高(P<0.05);而SOD和GSH活性以及NO含量显著降低(P<0.05);细胞中ROS含量和凋亡率显著上升(P<0.05);EPCs中VEGF和VEGFR-2表达量显著降低(P<0.05)。与高糖作用组相比,不同浓度PC-B2作用组EPCs活力均明显回升(P<0.05);LDH漏出量以及MDA、ET-1、ICAM-1和VCAM-1含量均逐渐下降(P<0.05);SOD和GSH活性以及NO含量均显著上升(P<0.05);细胞中ROS生成和凋亡率逐渐下降(P<0.05);而EPCs中VEGF和VEGFR-2表达量也随之逐渐上升,并具有浓度依赖性(P<0.05)。结论:PC-B2能够提升高糖作用下人EPCs活力,减少高糖引起的氧化损伤,恢复EPCs正常功能,降低高糖诱导的炎症因子和细胞凋亡,从而对人EPCs发挥保护作用,并可通过诱导VEGFR-2和VEGF表达发挥作用。
人内皮祖细胞;高糖;原花青素B2;氧化应激;细胞凋亡;血管内皮生长因子
近年研究表明,80%的糖尿病患者都会出现全身小血管或血管病变,产生血管损伤并发症,同时糖尿病患者心血管并发症是导致其死亡和致残的主要原因[1]。糖尿病患者容易产生血管并发症,主要是由于其血管内高血糖水平使血管内皮结构产生改变,生理功能丧失导致血管损伤[2]。内皮祖细胞(endothelial progenitor cells,EPCs)是血管内皮细胞的前体细胞,能够从骨髓动员到外周血对损伤血管进行修复。研究表明糖尿病能够导致外周血EPCs数量的减少及功能障碍,其血管并发症的发生发展与EPCs功能受损密切相关,但如何保护高糖环境中EPCs的研究尚少见[3]。原花青素(proanthocyanidins,PC)是一类广泛存在于植物中的黄烷醇单体及其聚合物的天然多酚化合物,是花青素类物质的聚合物[4]。PC广泛存在于葡萄籽、银杏、大黄、松树和柏树等天然植物的根茎叶果实中,因其具有水溶性,易于被机体吸收,而比番茄红素、虾青素等其它脂溶性强抗氧化剂受到更广泛和有效的关注[5]。而原花青素B2(PC-B2)是PC中主要的活性成分,目前关注较少且其作为单一成分发挥作用及机制尚未见[6]。因此本研究利用高糖作用于人EPCs,观察单一成分PC-B2对高糖作用下人EPCs的影响,并从抗氧化应激和细胞凋亡等方面揭示其能否对EPCs发挥保护作用。
材料和方法
1 试剂和材料
M199细胞培养基和0.25%EDTA胰酶购自HyClone;胎牛血清、谷氨酰胺、谷丙酸钠和Endogro细胞因子购自Gibco;原花青素单体活性成分B2(纯度99.9%)、人淋巴细胞分离液、D-Hanks溶液和双氢罗丹明123购自Sigma;葡萄糖和20%甘露醇购自西南药业公司;乳酸脱氢酶(lactate dehydrogenase, LDH)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)和还原型谷胱甘肽(glutathione,GSH)测定试剂盒购自南京建成生物技术研究所;内皮素-1(endothelin,ET-1)、一氧化氮(nitric oxide,NO)、细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)和血管细胞黏附分子-1 (vascular cell adhesion molecule-1,VCAM-1)的ELISA检测试剂盒购自武汉华美生物公司;CCK-8检测试剂盒和Annexin V/PI细胞凋亡检测试剂盒购自北京鼎国生物技术公司;FITC标记的单克隆鼠抗人CD133、CD34、CD31和FIK-1抗体购自BD;多克隆兔抗人血管内皮生长因子(vascular endothelial growth factor,VEGF)、血管内皮生长因子受体-2(vascular endothelial growth factor receptor-2,VEGFR-2)和 βactin I抗购自Abcam;HRP标记的山羊抗兔IgG的II抗和ECL化学发光试剂盒购自北京中杉金桥公司。
2 主要方法
2.1 人EPCs的分离培养鉴定 取健康人捐献外周,血用等体积人淋巴细胞分离液混匀后置于50 mL离心管中,密度梯度离心20 min,分离得到中间层人外周血单核细胞层。用D-Hanks溶液洗涤2次后,弃去上清,用含10%胎牛血清、1%谷氨酰胺和谷丙酸钠、0.1%Endogro细胞因子的M199完全培养基重悬细胞,接种于胶原预先包被的细胞培养板中,37℃、5%CO2培养箱中进行培养。培养至24 h时,更换细胞培养基去掉未贴壁细胞。后每3 d更换培养基,贴壁细胞继续培养,在倒置显微镜下观察人EPCs的生长状态。将连续培养14 d的EPCs细胞接种于6孔板中,继续培养24 h后去除上清培养基,PBS洗涤 2遍后,先加入 100 μL的 DiI-Ac-LDL (1∶100)稀释液,37℃孵育4 h后,PBS洗涤3次后次用4%多聚甲醛固定30 min,后加入100 μL的FITC-UEA-1(1∶500)在37℃孵育2 h。用PBS洗涤细胞后在荧光显微镜下观察为UEA和LDL双染色阳性细胞即为正在分化的人EPCs。同时收集诱导培养的EPCs稀释浓度为1×109/L,分别避光孵育FITC标记的单克隆鼠抗人CD133、CD34、CD31和FIK-1抗体30 min后,PBS洗涤1次,进行流式细胞术检测细胞中CD133、CD34、CD31和FIK-1阳性表达率以鉴定人EPCs。
2.2 CCK-8方法检测EPCs的活力 将分离诱导培养至14 d的人EPCs经含0.25%EDTA的胰酶消化后,调整细胞浓度为2×108/L,接种于96孔细胞培养板中,培养6 h细胞贴壁后更换不同培养基,细胞分组为:加入与溶剂等量PBS的EPCs完全培养基为对照组(control组);加入含25 mmol/L甘露醇的EPCs完全培养基作为高渗对照组(hypertonic组);加入含高浓度30 mmol/L葡萄糖的EPCs完全培养基单独培养组(高糖组);同时加入含不同浓度(2、10 和50 mg/L)PC-B2和30 mmol/L葡萄糖的EPCs完全培养基共培养组。在分别继续培养24和48 h后,分别在每孔中加入10 μL的CCk-8溶液,继续在细胞培养箱中培养2 h后用酶标仪检测每组细胞在450 nm波长时的吸光度(A)值。
2.3 细胞中LDH、MDA、SOD和GSH的检测 将诱导培养至14 d的人EPCs以5×108/L按照上述同样分组种植于6孔板中,经不同培养基继续培养48 h。收集各组EPCs培养后上清液,按照试剂盒说明利用比色法测定各组经不同处理后EPCs中LDH的漏出量,同时收集各组细胞,利用强RIPA细胞裂解液提取各组EPCs中总蛋白,按照试剂盒说明测定EPCs 中MDA含量以及SOD和GSH活性变化。
2.4 ELISA方法检测细胞培养上清液中NO、ET-1、ICAM-1和VCAM-1的含量 收集各组EPCs细胞经不同培养基诱导处理48 h后的上清液,在-20℃冻存备用。利用酶联免疫标记法(ELISA)试剂盒说明书分别检测各组EPCs分泌的功能相关因子NO、ET-1和炎症相关因子ICAM-1、VCAM-1含量。
2.5 流式细胞术检测活性氧簇(reactive oxygen species,ROS)生成和细胞凋亡 在各组EPCs经不同处理48 h后,用0.25%的EDTA胰酶消化离心并收集细胞,并用PBS重悬浓度为1×109/L,每组取出250 μL的悬液,先用1 μmol/L的双氢罗丹明123避光孵育30 min,PBS洗涤1次后用150 μL PBS重悬细胞,各组细胞中活性氧自由基能够将双氢罗丹明123氧化成罗丹明123发出荧光,利用流式细胞术检测各组细胞中ROS含量。另外,用FITC标记的Annexin V和PI各5 μL与EPCs混匀后在室温下避光孵育20 min,后用PBS洗涤1次,离心收集细胞并用150 μL PBS重悬,立即用流式细胞仪检测各组EPCs经不同处理后的凋亡情况。
2.6 Western blot检测EPCs中VEGFR-2和VEGF的表达 收集各组经处理并培养结束的EPCs,用PBS洗涤1次后,利用强RIPA细胞裂解液提取各组EPCs中总蛋白,BCA试剂盒测定各组细胞中总蛋白浓度。每组中取出30 μg总蛋白进行12%SDSPAGE,电泳1.5 h后进行半干法转膜,用含5%脱脂奶粉的TBST缓冲液封闭30 min后分别孵育多克隆兔抗人VEGFR-2、VEGF和β-actin(均按照1∶1 000稀释)于4℃下孵育过夜。后用TBST洗涤3次后,用辣根过氧化物酶HRP标记的山羊抗兔IgG II抗(1∶5 000)在室温下孵育2 h后,TBST洗涤3次后,加入ECL化学发光试剂显影,用凝胶扫描系统显影曝光并拍照,并用Quantity One软件分析各组细胞中目的蛋白相对表达量。
3 统计学处理
所有数据利用SPSS 13.0软件进行统计分析,结果用均数±标准差(mean±SD)表示,组间比较采用单因素方差分析(one-way ANOVA),用SNK-q进行均数之间的两两比较,以P<0.05为差异具有统计学意义。
结果
1 人EPCs的培养鉴定结果
从健康人外周血中分离诱导的EPCs,在培养14 d时生长状态良好,细胞变大变圆,呈“铺路石子”状,见图1。对贴壁生长的EPCs进行DiI-ac-LDL和FITC-UEA-1荧光标记,以对EPCs进行鉴定,在荧光显微镜下观察发现绿色荧光标记细胞为FITC-UEA-1阳性的人EPCs细胞;红色荧光标记细胞为经DiI-ac-LDL处理的人EPCs;而呈黄色细胞为双荧光阳性细胞,即为正在分化的人EPCs。同时利用流式细胞术对诱导培养的人EPCs细胞特异性标记指标进行检测,发现其中 14 d时细胞的 CD133阳性率达86.6%,CD34阳性率达 86.8%,FIK-1阳性率达93.2%,CD31阳性率仅14.7%,而培养21 d时细胞中CD31阳性率上升为80.9%,说明从健康人外周血中可分离诱导培养人EPCs并得以鉴定。
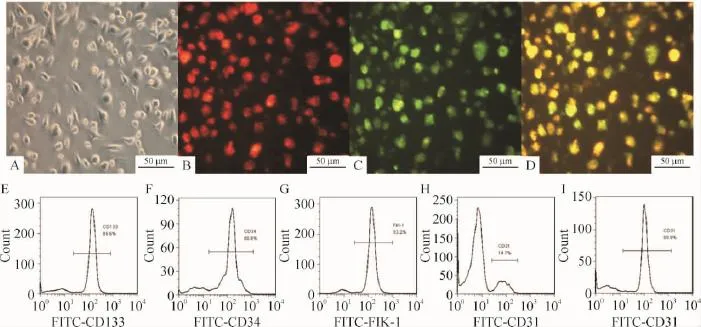
Figure 1.Culture and identification of human EPCs.A:human EPCs cultured for 14 d;B:FITC-UEA-1 positive cells;C:DiI-ac-LDL positive cells;D:double positive cells;E:the EPCs positive rate marked by CD133 at 14 d;F:the EPCs positive rate marked by CD34 at 14 d;G:the EPCs positive rate marked by FIK-1 at 14 d;H:the EPCs positive rate marked by CD31 at 14 d;I:the EPCs positive rate marked by CD31 at 21 d.图1 人EPCs的细胞培养和鉴定
2 PC-B2对高糖作用下人EPCs活力的影响
通过CCK-8实验检测发现,在单独高糖作用下人EPCs的细胞活力明显受抑制,而经不同浓度PCB2同时处理培养能够显著提高人EPCs的细胞活力。由图2可见,与control组相比,hypertonic组中人EPCs培养24 h和48 h的A值无明显变化,而高糖作用组中人EPCs的A值均显著下降(P<0.05);而与高糖作用组相比,在24 h时各浓度PC-B2组中,除2 mg/L组EPCs的A值上升不明显,10和50 mg/ L组中EPCs的A值均显著上升(P<0.05);在48 h时,各浓度PC-B2作用组中EPCs的A值均显著上升(P<0.05)。因此,选择PC-B2作用于人EPCs 48 h进行研究。
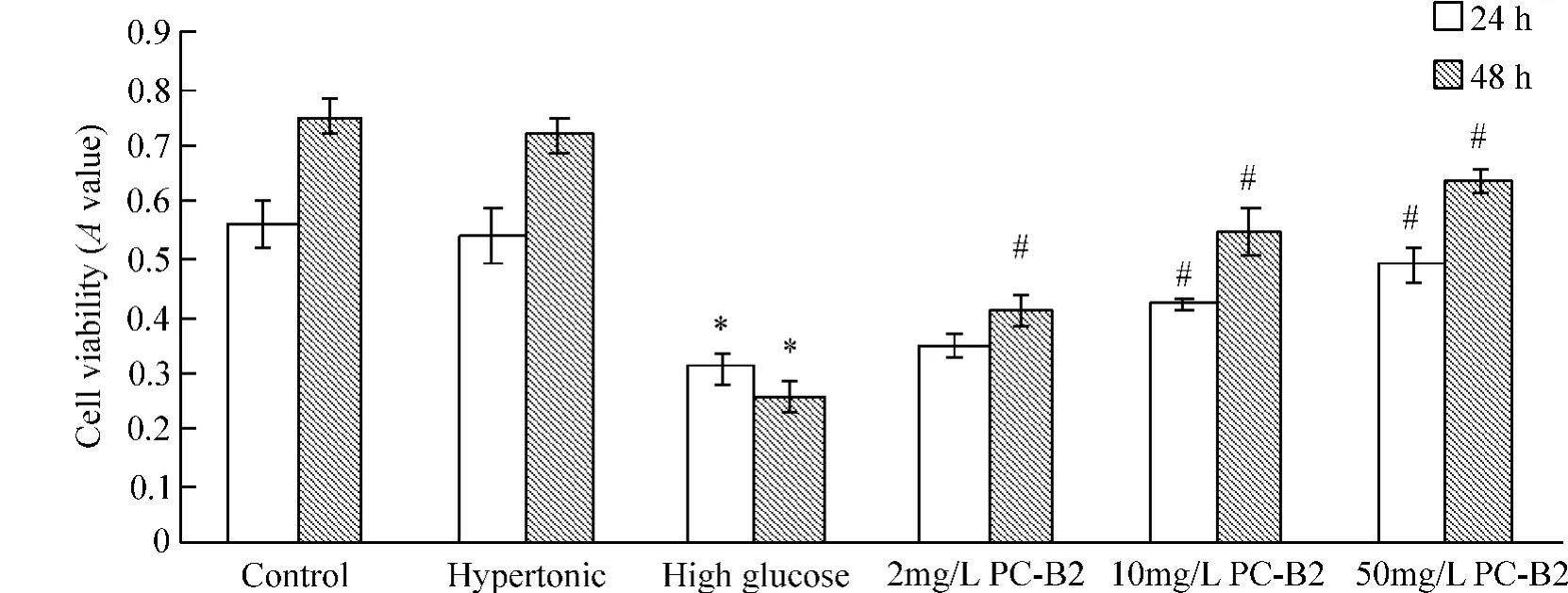
Figure 2.The effect of PC-B2 on the viability of human EPCs treated with high glucose detected by CCK-8 assay.Mean±SD.n=9.*P<0.05 vs control group;#P<0.05 vs high glucose group.图2 CCK-8方法检测PC-B2对高糖作用下人EPCs活力的影响
3 PC-B2对高糖作用下人EPCs中LDH、MDA、SOD和GSH水平的影响
PC-B2能够降低高糖作用下人EPCs中LDH漏出量和MDA含量,并提升SOD和GSH活性,结果见表1。与control组相比,hypertonic组中人EPCs细胞中LDH、MDA、SOD和GSH均无明显变化,单独高糖作用下人EPCs细胞中LDH漏出量和MDA含量均显著增加(P<0.05),而SOD和GSH活性则显著下降(P<0.05);在不同浓度的PC-B2同时作用时,与高糖组相比,各PC-B2组EPCs的LDH漏出量和MDA含量均逐渐下降(P<0.05);2 mg/L组EPCs 中SOD和GSH活性有所上升,但不显著,而10和50 mg/L组EPCs中SOD和GSH活性则显著回升,趋于正常水平(P<0.05)。
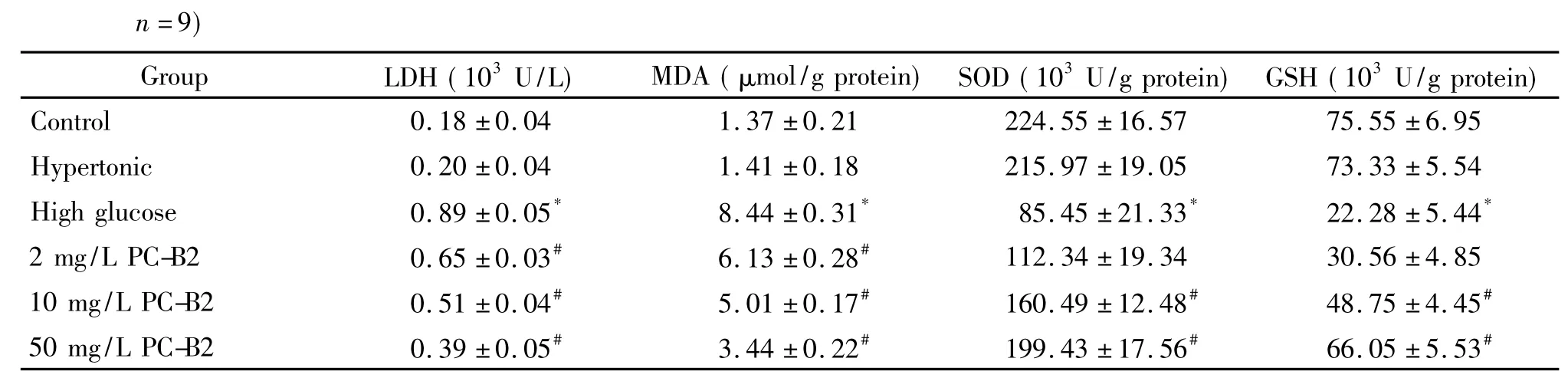
表1 PC-B2对高糖作用下人EPCs中LDH、MDA、SOD和GSH水平的影响Table 1.The effect of PC-B2 on the levels of LDH,MDA,SOD and GSH in the human EPCs treated with high glucose(Mean±SD.
4 PC-B2对高糖作用下人EPCs培养上清中NO、ET-1、ICAM-1和VCAM-1含量的影响
检测发现,PC-B2能够显著增加高糖作用下人EPCs培养上清中的NO含量,而减少ET-1、ICAM-1 和VCAM-1的含量,如表2所示。与control组相比,hypertonic组中人 EPCs培养上清中的 NO、ET-1、ICAM-1和VCAM-1含量均无明显变化,但单独高糖作用组EPCs培养上清中NO含量显著下降(P<0.05);而ET-1和炎性因子ICAM-1、VCAM-1的含量则显著上升(P<0.05)。与高糖组相比,不同浓度PC-B2作用组EPCs培养上清中的NO含量逐渐回升(P<0.05);而ET-1、ICAM-1和VCAM-1的含量则逐渐下降(P<0.05)。
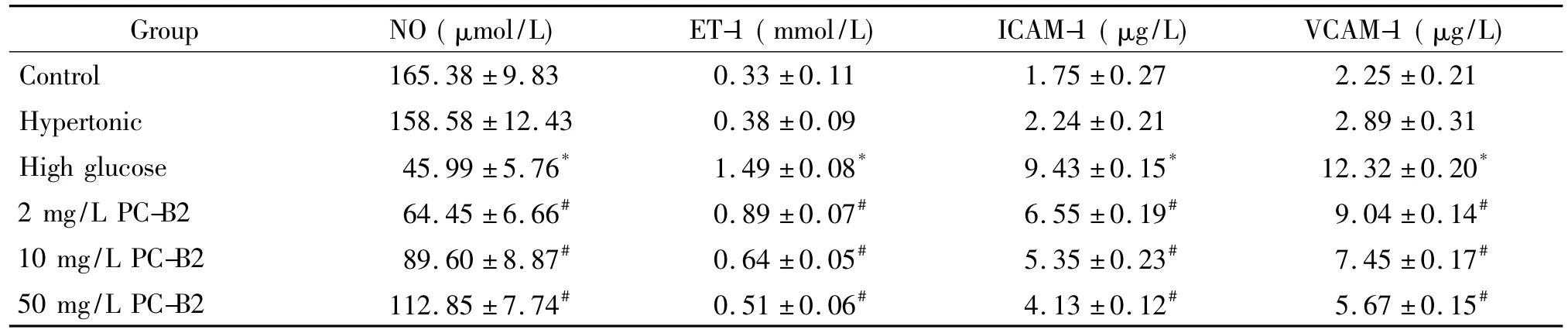
表2 PC-B2对高糖作用下人EPCs培养上清中NO、ET-1、ICAM-1和VCAM-1含量的影响Table 2.The effect of PC-B2 on the production of NO,ET-1,ICAM-1 and VCAM-1 in the culture supernatant of human EPCs treated with high glucose(Mean±SD.n=9)
5 PC-B2对高糖作用下人EPCs中ROS含量的影响
通过流式细胞术检测发现,单独高糖作用显著诱导人EPCs中ROS的产生,而PC-B2能够逐渐减少高糖诱导下人EPCs中ROS含量,见图3。与control组相比,hypertonic组中人EPCs的ROS含量无明显变化,但高糖单独作用组EPCs中ROS阳性率显著上升(P<0.05);而与高糖组相比,不同浓度PCB2同时作用组EPCs中ROS阳性率逐渐下降,并具有浓度效应(P<0.05)。
6 PC-B2对高糖作用下人EPCs凋亡的影响
通过流式细胞术检测发现,单独高糖作用显著诱导人EPCs凋亡,而PC-B2能够显著减少高糖作用下人EPCs凋亡,见图4。与control组相比,hypertonic组人EPCs凋亡率无明显变化,高糖单独作用组EPCs凋亡率显著上升(P<0.05);而与高糖组相比,不同浓度PC-B2同时作用组EPCs凋亡率逐渐下降,并具有浓度效应(P<0.05)。
7 PC-B2对高糖作用下人EPCs中VEGFR-2和VEGF表达的影响
通过Western blot检测发现,在高糖作用下人EPCs中VEGFR-2和VEGF表达均显著下降;而PCB2作用能够提升各组人EPCs中VEGFR-2和VEGF的表达,见图5。与control组相比,高糖单独作用组EPCs中VEGFR-2和VEGF表达均显著降低(P<0.05);而与高糖组相比,各不同浓度PC-B2同时作用组中VEGFR-2和VEGF表达均逐渐回升,并具有浓度依赖性(P<0.05)。

Figure 3.The effect of PC-B2 on ROS production in human EPCs treated with high glucose detected by flow cytometry.Mean±SD.n=9.*P<0.05 vs control group;#P<0.05 vs high glucose group.图3 流式细胞术检测PC-B2对高糖作用下人EPCs中ROS生成的影响
讨论
原花青素是目前国际公认的一种新型天然高效抗氧化剂,其自然资源丰富,来源广泛,安全高效且无毒副作用,大量研究表明其具有很强的抗氧化和清除氧自由基能力,在防治癌症、心血管疾病、抗辐射、调节免疫等各方面均具有显著功效[7]。而单一活性成分B2是原花青素的主要成分,由2个单体(儿茶素或表儿茶素)键合而成,在原花青素的8种异构体中PC-B2具有最强的活性[8]。目前的研究主要集中在原花青素的作用机制中,但关于其作用是否主要通过活性最强的成分PC-B2发挥尚未知。糖尿病作为严重危害人类健康的疾病之一,呈逐渐上升趋势,由于其患者血管中血糖水平高,容易诱发各种心血管并发症[9]。EPCs作为血管内皮细胞的前体细胞,能够被CD34、CD133和FIK-1特异性标记,而分化成内皮细胞后被CD31标记,其细胞功能的发挥对血管损伤修复和新生具有重要意义,同时与动脉粥样硬化、冠心病等心血管疾病治疗和预后均相关[10]。而有研究表明高糖能够抑制内皮祖细胞的增殖、迁移,进而影响血管的损伤修复,推测糖尿病患者容易发生血管病变,也可能与EPCs受损相关[11]。因此,本研究利用高糖作用于人EPCs以模拟糖尿病人血管中动员的内皮祖细胞所处环境状态,以揭示高糖对人EPCs的损伤作用及PC-B2能否对高糖下人EPCs发挥保护作用。同时本研究中设置甘露醇高渗对照组,发现高渗因素对人EPCs细胞各项指标无明显影响,说明人EPCs细胞功能的变化主要由高糖因素引起,而与渗透压的改变无关。通过CCK-8检测发现,高糖能够显著降低人EPCs细胞活力,而PC-B2能够逐渐提升高糖作用下EPCs的细胞活力,并具有浓度和时间效应,表明PC-B2能够降低高糖对人EPCs的损伤作用。
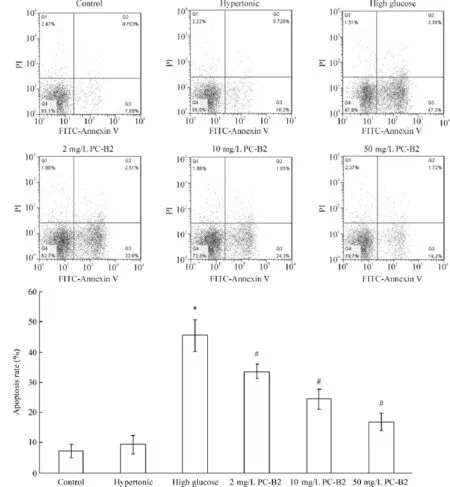
Figure 4.The effect of PC-B2 on the apoptosis of human EPCs treated with high glucose detected by flow cytometry.Mean±SD.n= 9.*P<0.05 vs control group;#P<0.05 vs high glucose group.图4 流式细胞术检测PC-B2对高糖作用下人EPCs凋亡的影响
糖尿病患者心血管并发症发生的病理原因,与其血管内高糖环境下细胞极易受到氧化应激损伤密不可分[12]。LDH在细胞糖代谢中起重要作用。其漏出量多少直接反映细胞膜完整性和细胞受损伤程度,而MDA作为脂质过氧化的产物,常作为检测机体抗氧化功能的代表指标之一[13]。SOD和GSH都是机体内重要活性氧自由基清除剂和抗氧化剂,可通过其活力高低反映机体抗氧化、清除氧自由基的能力[14]。本研究中高糖作用组中EPCs细胞LDH漏出量和MDA含量显著上升,而SOD和GSH活性显著下降,说明高糖环境能够诱导人EPCs的细胞膜损伤和氧化损伤,而使细胞发生病理变化并降低其抗氧化能力。而当PC-B2同时作用于人EPCs时,细胞中LDH漏出量和MDA含量逐渐下降,SOD和GSH活性逐渐回升,趋于正常水平,说明PC-B2能够减少人EPCs细胞抗氧化系统受高糖损伤,维持细胞完整性和抗氧化能力。NO作为血管内皮细胞释放的重要舒血管因子,可反映EPCs分化内皮细胞的功能强弱;ET-1是机体内强收缩血管物质,在血管损伤时显著上升[15]。研究表明糖尿病患者血管细胞 ET-1、NO分泌的失调,促进糖尿病血管并发症的发生,成为动脉粥样硬化的重要因素[16]。另有研究表明高糖对动脉血管的损伤机制中,炎症相关因子ICAM-1和VCAM-1炎症扮演着重要作用,高糖能够通过诱导炎症反应损伤血管内皮细胞[17]。本研究中高糖组EPCs细胞的NO生成显著下降而ET-1、ICAM-1和VCAM-1分泌量显著上升,说明高糖能够使人EPCs细胞正常分泌功能失调并诱发炎症反应,从而加速血管损伤和动脉粥样硬化的产生。PC-B2与高糖同时作用于人EPCs时,NO含量逐渐上升而 ET-1、ICAM-1和VCAM-1的分泌含量逐渐下降,表明PCB2能够调节高糖作用下人EPCs中NO和ET-1的分泌功能,并降低炎症反应以维持高糖作用下EPCs的正常生理功能。

Figure 5.The effect of PC-B2 on the expression of VEGFR-2 and VEGF in human EPCs treated with high glucose detected by Western blot.Mean±SD.n=9.*P<0.05 vs control group;#P<0.05 vs high glucose group.图5 Western blot检测PC-B2对高糖作用下人EPCs中VEGFR-2和VEGF表达的影响
研究表明,血管内高糖水平诱导内皮细胞氧化应激反应增加,使细胞结构和功能受损,并最终导致细胞凋亡[18]。糖尿病患者心血管并发症和动脉粥样硬化发生率显著高于正常人也是因为其血管内细胞在高糖环境中容易发生凋亡[19]。本研究中也发现高糖作用下人EPCs细胞的凋亡率显著上升,直接验证高糖环境对人EPCs的损伤作用;而不同浓度PC-B2同时作用组中EPCs的凋亡率则显著下降,说明PCB2在高糖环境中能够发挥保护人 EPCs的作用。VEGF是一种能够促进血管生成的血管内皮细胞因子,常作为EPCs细胞培养的诱导因子。Guo等[20]研究已表明VEGF能够直接促进EPCs细胞增殖、迁移并促进EPCs细胞发挥修复损伤血管的功能。而VEGFR-2是血管内皮生长因子的受体之一,主要在生理或病理损伤时与VEGF结合发挥作用,研究表明EPCs细胞中表达的VEGFR-2被激活后,能够调控细胞增殖,并维持细胞正常生理功能[21]。本研究中高糖作用组人EPCs细胞中VEGF和VEGFR-2相对表达量显著下降,说明高糖可能通过降低VEGF 和VEGFR-2的表达而对血管中EPCs造成损伤。当不同浓度PC-B2与高糖同时作用于人EPCs时,细胞中VEGF和VEGFR-2表达量能够逐渐上升,显著高于高糖组,说明PC-B2能够通过诱导VEGF和VEG-FR-2的表达,从而对人EPCs细胞发挥保护作用。
综上所述,本研究首次发现单一活性成分PC-B2能够提升高糖作用下人EPCs细胞增殖活力,降低高糖引起的氧化损伤,恢复EPCs正常分泌功能,降低高糖诱导的炎症因子的分泌和细胞凋亡,从而对人EPCs发挥保护作用,并可通过诱导 VEGFR-2和VEGF表达发挥作用。通过本研究对于临床利用天然抗氧化剂PC-B2防治高血糖引起的心血管并发症具有重要意义,可为糖尿病性血管损伤修复、动脉粥样硬化治疗等提供新的思路和理论依据。
[1] 申虎威,李 燕,邢 莉,等.血糖波动与糖尿病大血管病变的相关研究[J].中国病理生理杂志,2010,26 (7):1311-1315.
[2] 刘江月.梓醇对糖尿病大鼠主动脉的保护作用与抗氧化机制研究[J].中国病理生理杂志,2014,30(6): 1023-1028.
[3] Rajasekar P,ONeill CL,Eeles L,et al.Epigenetic changes in endothelial progenitors as a possible cellular basis for glycemic memory in diabetic vascular complications [J].J Diabetes Res,2015,2015:436879.
[4] Pons Z,Guerrero L,Margalef M,et al.Effect of low molecular grape seed proanthocyanidins on blood pressure and lipid homeostasis in cafeteria diet-fed rats[J].J Physiol Biochem,2014,70(2):629-637.
[5] 王 萌,马艺萍,李亚伟,等.葡萄籽寡聚体原花青素对大鼠酒精性肝损伤及脑功能障碍的保护作用[J].世界华人消化杂志,2013,21(16):1480-1486.
[6] Muthenna P,Raghu G,Kumar PA,et al.Effect of cinnamon and its procyanidin-B2 enriched fraction on diabetic nephropathy in rats[J].Chem Biol Interact,2014,222C: 68-76.
[7] Derksen A,Hensel A,Hafezi W,et al.3-O-Galloylated procyanidins from Rumex acetosa L.inhibit the attachment of influenza A virus[J].PLoS One,2014,9(10): e110089.
[8] Shilpi A,Parbin S,Sengupta D,et al.Mechanisms of DNA methyltransferase-inhibitor interactions:procyanidin B2 shows new promise for therapeutic intervention of cancer[J].Chem Biol Interact,2015,233:122-138.
[9] Patel VB,Nirmal P,Oudit GY.Role of angiotensin-converting enzyme 2(ACE2)in diabetic cardiovascular complications[J].Clin Sci,2014,126(7):471-482.
[10]Kim KA,Shin YJ,Kim JH,et al.Dysfunction of endothelial progenitor cells under diabetic conditions and its underlying mechanisms[J].Arch Pharm Res,2012,35 (2):223-234.
[11]Jing L,Yao YY,Dai QM,et al.Erythropoietin attenuates cardiac dysfunction by increasing myocardial angiogenesis and inhibiting interstitial fibrosis in diabetic rats[J].Cardiovasc Diabetol,2012,11:105.
[12]Shen GX.Oxidative stress and diabetic cardiovascular disorders:roles of mitochondria and NADPH oxidase[J].Can J Physiol Pharmacol,2010,88(3):241-248.
[13]Shen GX.Mitochondrial dysfunction,oxidative stress and diabetic cardiovascular disorders[J].Cardiovasc Hematol Disord Drug Targets,2012,12(2):106-112.
[14]Blanc SL,Villarroel P,Candia V,et al.Type 2 diabetic patients and their offspring show altered parameters of iron status,oxidative stress and genes related to mitochondrial activity[J].Biometals,2012,25(4):725-735.
[15]王诗才,陈太军,黄美松,等.脑源性神经营养因子保护H2O2诱导的氧化损伤血管内皮细胞[J].中国病理生理杂志,2015,31(8):1384-1394.
[16]叶 辉,修世国,刘艳丽.OSAHS并发2型糖尿病患者血浆ET-1和血清NO测定及其与血糖和睡眠呼吸暂停指数的相关性分析[J].吉林大学学报:医学版,2010,36(6):1126-1129.
[17]Ki-Hyung K,Kyeong PJ,Young-Whan C,et al.Hexane extract of aged black garlic reduces cell proliferation and attenuates the expression of ICAM-1 and VCAM-1 in TNF-α-activated human endometrial stromal cells[J].Int J Mol Med,2013,32(1):67-78.
[18] Nauta A,Seidel C,Deveza L,et al.Adipose-derived stromal cells overexpressing vascular endothelial growth factor accelerate mouse excisional wound healing[J].Mol The J Am Soc Gene Ther,2013,21(2):445-455.
[19]Mather KJ.The vascular endothelium in diabetes:a therapeutic target?[J].Rev Endocrine Metab Disorders,2013,14(1):87-99.
[20]Guo S,Yang X,Cheng Y,et al.bFGF and PDGF-BB have a synergistic effect on the proliferation,migration and VEGF release of endothelial progenitor cells[J].Cell Biol Int,2011,35(5):545-551.
[21]Advani A,Connelly KA,Advani SL,et al.Role of the eNOS-NO system in regulating the antiproteinuric effects of VEGF receptor 2 inhibition in diabetes[J].Can J Diabetes,2013,2013:201475.
(责任编辑:卢 萍,罗 森)
Protective effect of procyanidin single active ingredient B2 on human endothelial progenitor cells under high glucose stimulation
WANG Li-ping1,LI Li2,YAO Ji-wen3,LI Bo3
[1Beijing Normal University Community Health Service Center
(Hospital),Beijing 100875,China;2Department of Internal Medicine,Beijing Police Hospital,Beijing 100121,China;3Department of Cardiology,Beijing Hepingli Hospital,Beijing 100013,China.E-mail:keyanxiangmu1@163.com]
AIM:To study the protective effect of procyanidin single active ingredient B2(PC-B2)on human endothelial progenitor cells(EPCs)stimulated with high glucose.METHODS:The human EPCs were isolated from peripheral blood of healthy people and identified.The EPCs were divided into control group(PBS treatment),hypertonic control group(25 mmol/L mannitol treatment),high glucose(30 mmol/L)group,and different concentrations(2,10 and 50 mg/L)of PC-B2+30 mmol/L glucose groups.The viability of EPCs was detected by CCK-8 assay.The levels of LDH,MDA,SOD and GSH in the EPCs were detected.The changes of NO,ET-1,ICAM-1 and VCAM-1 in the EPCs cultured medium were measured by ELISA.The cell apoptotic rate and reactive oxygen species(ROS)in the EPCs were analyzed by flow cytometry.The expression of VEGF and VEGFR-2 in the EPCs were determined by Western blot.RESULTS:Compared with control group,the viability of human EPCs was decreased significantly in 30 mmol/L glucose group(P<0.05).The LDH leakage,MDA content and the releases of ET-1,ICAM-1 and VCAM-1 were induced signifi-cantly(P<0.05),but SOD and GSH activity and NO production were decreased significantly(P<0.05).The ROS and cell apoptotic rate were increased significantly(P<0.05).The expression of VEGF and VEGFR-2 in the EPCs were decreased(P<0.05).When human EPCs were treated with different concentrations of PC-B2 and 30 mmol/L glucose,the viability was obviously rebounded(P<0.05),the LDH leakage,MDA content and the releases of ET-1,ICAM-1 and VCAM-1 were decreased gradually(P<0.05),the SOD,GSH activity and NO production were increased significantly (P<0.05),the ROS and cell apoptotic rate were decreased significantly(P<0.05),and the expression of VEGF and VEGFR-2 in the EPCs was increased gradually(P<0.05).CONCLUSION:PC-B2 enhances the viability of human EPCs under high glucose condition,reduces high glucose-induced oxidative damage,restores the EPCs normal function,and reduces the releases of inflammatory cytokines and apoptosis,thus playing a protective effect on human EPCs through inducing the expression of VEGF and VEGFR-2.
Human endothelial progenitor cells;High glucose;Procyanidin B2;Oxidative stress;Apoptosis; Vascular endothelial growth factor
R363
A
10.3969/j.issn.1000-4718.2016.07.005
1000-4718(2016)07-1180-09
2015-12-08
2016-01-21
△Tel:010-58805431;E-mail:keyanxiangmu1@163.com

