辽宁地区腹泻患者大肠杆菌分离株II型不耐热肠毒素的检测及测序分析
袁超文,江馗语,张力国,刘文鑫
辽宁地区腹泻患者大肠杆菌分离株II型不耐热肠毒素的检测及测序分析
袁超文1,江馗语2,张力国2,刘文鑫3
目的对辽宁地区人源性腹泻样本中致病性大肠杆菌(PathogenicEscherichiacoli)的毒力因子进行检测,掌握产II型不耐热肠毒素(Type II heat labile enterotoxin, LT-II)大肠杆菌在我国北方地区的流行现状并阐明LT-II与其他致病因子间的关系。方法于2014年3月至2015年3月收集辽宁地区人源性腹泻粪便样品,用麦康凯培养基和生化试验的方法分离出大肠杆菌,并用多重PCR方法对毒力基因(elt-II、elt-I、sta、stb、K88、K99等)进行检测,对分离到的LT-II阳性大肠杆菌中elt-II基因进行测序及分型。结果354份腹泻样品中共分离到携带有毒力因子的大肠杆菌139株,检出率为39.2%。毒力因子阳性大肠杆菌中,有12株携带elt-II(8.6%)基因。在12株携带elt-II的大肠杆菌中,2株单独携带elt-II,6株携带F1,1株携带K88,1株携带astA,2株携带irp2/astA;测序结果表明12株elt-II阳性大肠杆菌中有10株携带elt-IIc1亚型,2株携带elt-IIc4亚型。结论在引起人源性腹泻的毒力因子中有大肠杆菌II型不耐热肠毒的存在,且主要以LT-IIc1为主要流行型。
大肠杆菌 II型不耐热肠毒素;PCR检测;测序分析
致病性大肠杆菌(pathogenicE.coli)是引起人类和动物肠内外疾病的重要病原微生物,其中肠产肠毒素大肠杆菌(enterotoxigenicE.coli, ETEC)更是引起婴幼儿、幼龄动物和旅行者腹泻的主要病原菌[1]。肠毒素和菌毛是ETEC发挥致病作用的主要活性物质。首先,致病菌经口进入人或动物体的肠道后,通过菌毛(F1、K88、K99、987P、F18、F41)或非菌毛粘附素(AIDA-1、Paa)发挥定植作用将菌体固定在肠壁上,然后,ETEC可单独或同时合成耐热肠毒素(heat-stable enterotoxin,ST)或不耐热肠毒素(heat-labile enterotoxin,LT)刺激肠上皮细胞分泌出大量的电解质和水,最终导致机体腹泻[2-3]。致病性大肠杆菌除了产生肠毒素及菌毛外,还可以表达其他毒力因子,如非菌毛黏附素、毒力岛(pathogenicity islands,PAIs)、志贺毒素(Shiga toxin)、细胞外丝氨酸转运蛋白酶(Serine Extracellular Protease Autotransporter, sepA);肠聚集性大肠杆菌热稳定肠毒素1(astA)等。这些毒力因子可单独或协同存在于致病性大肠杆菌中,产生致病作用[4]。
大肠杆菌II型不耐热肠毒素(Type II heat labile enterotoxin,LT-II)于1983年首次被国外学者分离并命名,其后的很长一段时间里,对该毒素的研究一直未见进展,直到近几年,研究者才把目光重新放在该毒素上[5-6]。LT-II根据其氨基酸序列的不同可被分为3个亚型,即LT-IIa、LT-IIb和LT-IIc,其中LT-IIc家族又包含LT-IIc1、LT-IIc2、LT-IIc3、LT-IIc4、LT-IIc5、LT-IIc6这6个分型[7]。目前,该毒素已在奶牛、人、水牛、肉牛、山羊和非哺乳动物(鸵鸟)的腹泻粪便中相继分离出来,经证明该毒素具有很强的致病力,可以使人或动物发生严重的水样腹泻[8-9]。
同大肠杆菌I型不耐热肠毒素(LT-I)相比,LT-II的国内外研究尚处于起步阶段,之前的研究中,本研究团队首次分离到了牛源的产LT-II大肠杆菌,并对其进行了序列分析[10]。本研究中,继续深入研究人源腹泻大肠杆菌中LT-II的流行情况,通过对沈阳地区婴幼儿腹泻样品中LT-II毒力基因和其他主要致病基因进行流行病学检测,阐明目前LT-II的流行趋势及其与其他毒力基因的相互关系,为大肠杆菌腹泻疾病的预防和控制提供科学依据。
1 材料与方法
1.1试剂及参考菌株大肠杆菌参考菌株C83903(K88+, LT-I+,stb+,astA+),C83920(K99+, F41+,sta+),C83915(987P+,sta+), C83684(F18ab+,stx2e+),购自中国兽医药品监察所;大肠杆菌HD-16-A(stx1+)、HD-49-A(ler+,eae+,hlyA+)、HD-03-C(ler+,sepA+)、HD-12-B(F1+,irp2+)、HD-13-A(sta+,stx2+,astA+)、HD-50-B(CS31A+,astA+)及DH5a为本研究室保存;OS-1(lt-II+)由美国Baffalo大学Terry教授馈赠、Trans 2k plus II DNA Marker、pMD18-Tsimple vector购自宝生物工程(大连)有限公司;EasyTaqDNA聚合酶、dNTPs(2.5 mmol/L)、DNA胶回收试剂盒、大肠杆菌生化微量管均购自全式金生物公司。
1.2菌株分离及鉴定收集辽宁地区2014年9月至2015年3月沈阳市妇幼保健医院、中国医科大学附属第二医院、中国医科大学附属第四医院354例感染性腹泻病人的粪便样品,感染性腹泻病例定义为每日排便3次或以上,且大便性状有改变(呈稀便、水样便、粘脓便或脓血便等)的门诊病例,无菌收集样品至EP管中并于12 h内将样品无菌划线接种到麦康凯琼脂平板上,37 ℃培养18 h后生长出典型的粉红色菌落, 菌落经涂片镜检为革兰阴性杆菌后进行纯培养,将其再次划线于MC琼脂平板上,37 ℃培养18 h,选取单菌落接种于LB液体培养基中,37 ℃震荡培养18 h,将菌液保存于20%甘油环境中并进行生化试验检测[11]。
1.3DNA模板的制备将保存于-20 ℃的大肠杆菌待测样品和本研究所用的模板菌株分别接种于麦康凯琼脂平板,37 ℃培养18~24 h。然后挑取单个菌落接种于LB液体培养基中,37 ℃ 200 r/min 振荡培养16~18 h。取1 mL培养物,经10 000×g离心5 min,去上清,加入100 μL灭菌去离子水重悬,100 ℃煮沸10 min后立即置冰浴中冷却5 min,10 000×g离心5 min,取上清于-4 ℃保存作为DNA模板备用[12]。
1.4大肠杆菌的PCR检测应用PCR方法(单重或多重)检测菌毛基因(K88、K99、987P、F1、F18、F41)、非菌毛粘附素基因(AIDA-I、paa、eae)、肠毒素基因(sta、stb、elt-I、elt-II)、志贺毒素基因(stx1、stx2、stx2e)、HPI和LEE毒力岛基因、hlyA、afa8(afa8D、afa8E)、sepA和astA等基因。应用Primer 5.0软件重新为elt-II设计引物,而elt-II、sta、stb;irp2、eae;stx1、stx2e、stx2;K88、F41、K99、987P;AIDA-I、paa和afaD、afaE分别用多重PCR进行检测,其余则使用单重PCR检测,所得扩增产物经0.8%琼脂糖凝胶电泳鉴定(表1)。
表1PCR扩增引物
Tab.1The PCR primers for amplification reaction
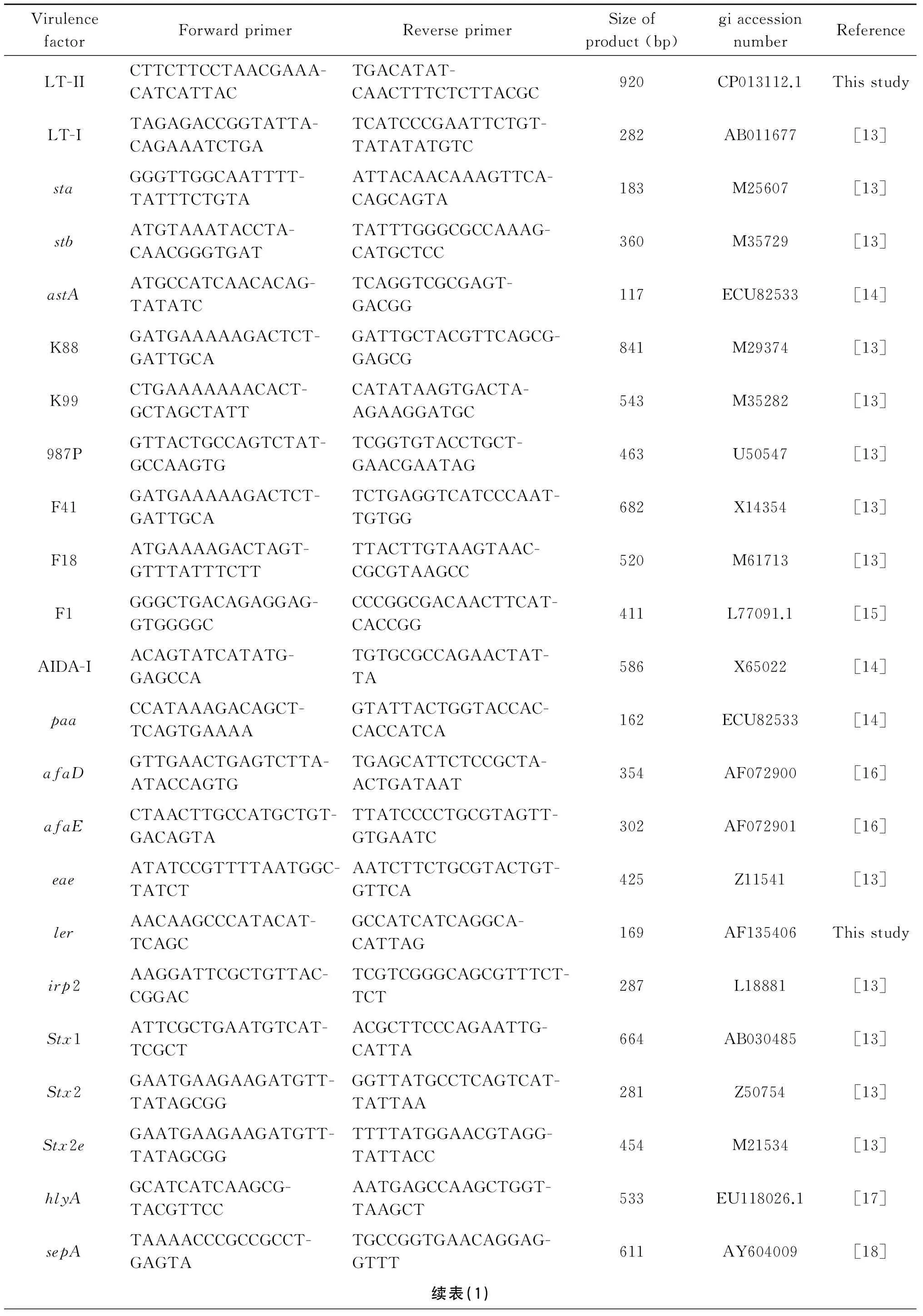
VirulencefactorForwardprimerReverseprimerSizeofproduct(bp)giaccessionnumberReferenceLT-IICTTCTTCCTAACGAAA-CATCATTACTGACATAT-CAACTTTCTCTTACGC920CP013112.1ThisstudyLT-ITAGAGACCGGTATTA-CAGAAATCTGATCATCCCGAATTCTGT-TATATATGTC282AB011677[13]staGGGTTGGCAATTTT-TATTTCTGTAATTACAACAAAGTTCA-CAGCAGTA183M25607[13]stbATGTAAATACCTA-CAACGGGTGATTATTTGGGCGCCAAAG-CATGCTCC360M35729[13]astAATGCCATCAACACAG-TATATCTCAGGTCGCGAGT-GACGG117ECU82533[14]K88GATGAAAAAGACTCT-GATTGCAGATTGCTACGTTCAGCG-GAGCG841M29374[13]K99CTGAAAAAAACACT-GCTAGCTATTCATATAAGTGACTA-AGAAGGATGC543M35282[13]987PGTTACTGCCAGTCTAT-GCCAAGTGTCGGTGTACCTGCT-GAACGAATAG463U50547[13]F41GATGAAAAAGACTCT-GATTGCATCTGAGGTCATCCCAAT-TGTGG682X14354[13]F18ATGAAAAGACTAGT-GTTTATTTCTTTTACTTGTAAGTAAC-CGCGTAAGCC520M61713[13]F1GGGCTGACAGAGGAG-GTGGGGCCCCGGCGACAACTTCAT-CACCGG411L77091.1[15]AIDA-IACAGTATCATATG-GAGCCATGTGCGCCAGAACTAT-TA586X65022[14]paaCCATAAAGACAGCT-TCAGTGAAAAGTATTACTGGTACCAC-CACCATCA162ECU82533[14]afaDGTTGAACTGAGTCTTA-ATACCAGTGTGAGCATTCTCCGCTA-ACTGATAAT354AF072900[16]afaECTAACTTGCCATGCTGT-GACAGTATTATCCCCTGCGTAGTT-GTGAATC302AF072901[16]eaeATATCCGTTTTAATGGC-TATCTAATCTTCTGCGTACTGT-GTTCA425Z11541[13]lerAACAAGCCCATACAT-TCAGCGCCATCATCAGGCA-CATTAG169AF135406Thisstudyirp2AAGGATTCGCTGTTAC-CGGACTCGTCGGGCAGCGTTTCT-TCT287L18881[13]Stx1ATTCGCTGAATGTCAT-TCGCTACGCTTCCCAGAATTG-CATTA664AB030485[13]Stx2GAATGAAGAAGATGTT-TATAGCGGGGTTATGCCTCAGTCAT-TATTAA281Z50754[13]Stx2eGAATGAAGAAGATGTT-TATAGCGGTTTTATGGAACGTAGG-TATTACC454M21534[13]hlyAGCATCATCAAGCG-TACGTTCCAATGAGCCAAGCTGGT-TAAGCT533EU118026.1[17]sepATAAAACCCGCCGCCT-GAGTATGCCGGTGAACAGGAG-GTTT611AY604009[18]续表(1)
1.5LT-II的克隆测序及分析根据GenBank所公布的所有elt-II序列,应用Primer 5.0软件设计8对特异性引物,可分别用于扩增elt-IIa,elt-IIb,elt-IIc1,elt-IIc2,elt-IIc3,elt-IIc4,elt-IIc5,elt-IIc6的全长操纵子(见表1)。利用以上8对引物分别扩增所分离到的12株产elt-II毒素大肠杆菌。所得PCR扩增产物经1.0%琼脂糖凝胶电泳鉴定,连接于pMD18-Tsimple载体上,转化DH5α感受态细胞并送英骏生物技术有限公司测序。将测序结果与GenBank公布的序列进行交叉比对并分析。
2 结 果
2.1细菌分离培养及生化鉴定2014-2015年,从沈阳市妇幼保健医院、中国医科大学附属第二医院、中国医科大学附属第四医院共采集354例感染性腹泻病例的粪便样品,无菌划线于麦康凯琼脂固体培养基上分离纯化,随机挑取大小不一、表面光滑、边缘整齐、圆形、隆起的红色菌落扩大培养;经纯化培养细菌用革兰氏染色镜检,可见有大量散在排列、两端钝圆、形态均一、无芽胞的中等大小红色杆菌;经大肠杆菌生化微量管检测并判定后,最终得到大肠杆菌312株。
2.2大肠杆菌毒力基因的检测对生化鉴定得到的312株大肠杆菌菌株进行黏附因子(F1、K88、K99、987p、F41、F18、AIDA-1、Paa、afaE-8)、毒素(elt-II、sta、stb、elt-I、stx1、stx2、stx2e、astA、afaD-8)、毒力岛(eae、ler、irp2)、hlyA、sepA基因的PCR检测,检测前验证各阳性模板和PCR引物特异性(见图1)。检测后合并同一粪便样本克隆出的相同菌株,最后分离到致病性大肠杆菌139株。在分离的139株致病性大肠杆菌中58.3%(81株)携带至少一种菌毛或非菌毛黏附素,其中以F1(66/139)的检出率最高,其次是afaE-8(11/139)和K88(4/139)。没有检测到K99、987P、F18和F41菌毛相关基因;139株致病性大肠杆菌中有105(75.5%)株携带至少一种毒素。其中以astA(39/139)检出率最高,其次是elt-II(12/139)、sta(9/139)和stb(5/139)。没有检测到elt-I和stx2e基因。对于检测的毒力岛基因,irp2基因在人源大肠杆菌上普遍流行,检出率高23.1%(32/139),相较之下,ler和eae基因的检出率分别为7.2%(10/139)、4.3%(6/139),其他相关毒力基因检测率则较低(表2)。
2.3LT-II与其他毒力基因的相关性本研究中大肠杆菌elt-II基因的检出率高达8.6%(12/139),其中单独携带elt-II基因的有2株(1.4%);6株携带F1菌毛,1株携带K88菌毛,1株携带astA和2株携带irp2/astA基因。此外,根据结果还显示出F1菌毛检测率高并普遍存在于人源致病性大肠杆菌上,该菌毛可单独携带elt-II、sta和stb等毒力基因;K88菌毛常在人源与动物源肠致病性大肠杆菌中存在,是引起人和动物大肠杆菌性腹泻的重要菌毛之一,而本研究中也检测到1株elt-II和K88的组合。
表2LT-II及其相关毒力因子的检测率
Tab.2Prevalence of the LT-II and its relationship with other virulence factors
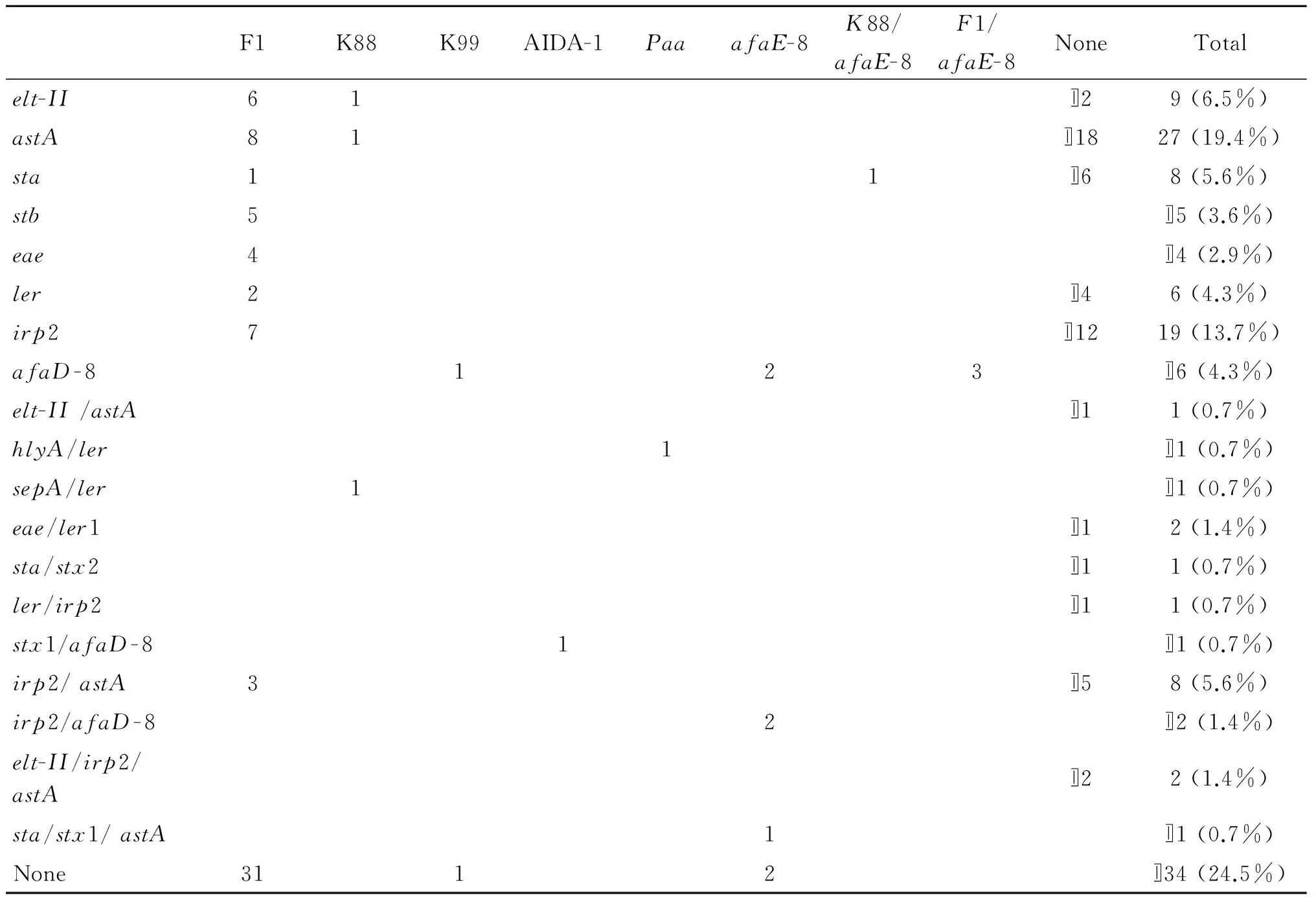
F1K88K99AIDA-1PaaafaE-8K88/afaE-8F1/afaE-8NoneTotalelt-II61〛29(6.5%)astA81〛1827(19.4%)sta11〛68(5.6%)stb5〛5(3.6%)eae4〛4(2.9%)ler2〛46(4.3%)irp27〛1219(13.7%)afaD-8123〛6(4.3%)elt-II/astA〛11(0.7%)hlyA/ler1〛1(0.7%)sepA/ler1〛1(0.7%)eae/ler1〛12(1.4%)sta/stx2〛11(0.7%)ler/irp2〛11(0.7%)stx1/afaD-81〛1(0.7%)irp2/astA3〛58(5.6%)irp2/afaD-82〛2(1.4%)elt-II/irp2/astA〛22(1.4%)sta/stx1/astA1〛1(0.7%)None3112〛34(24.5%)
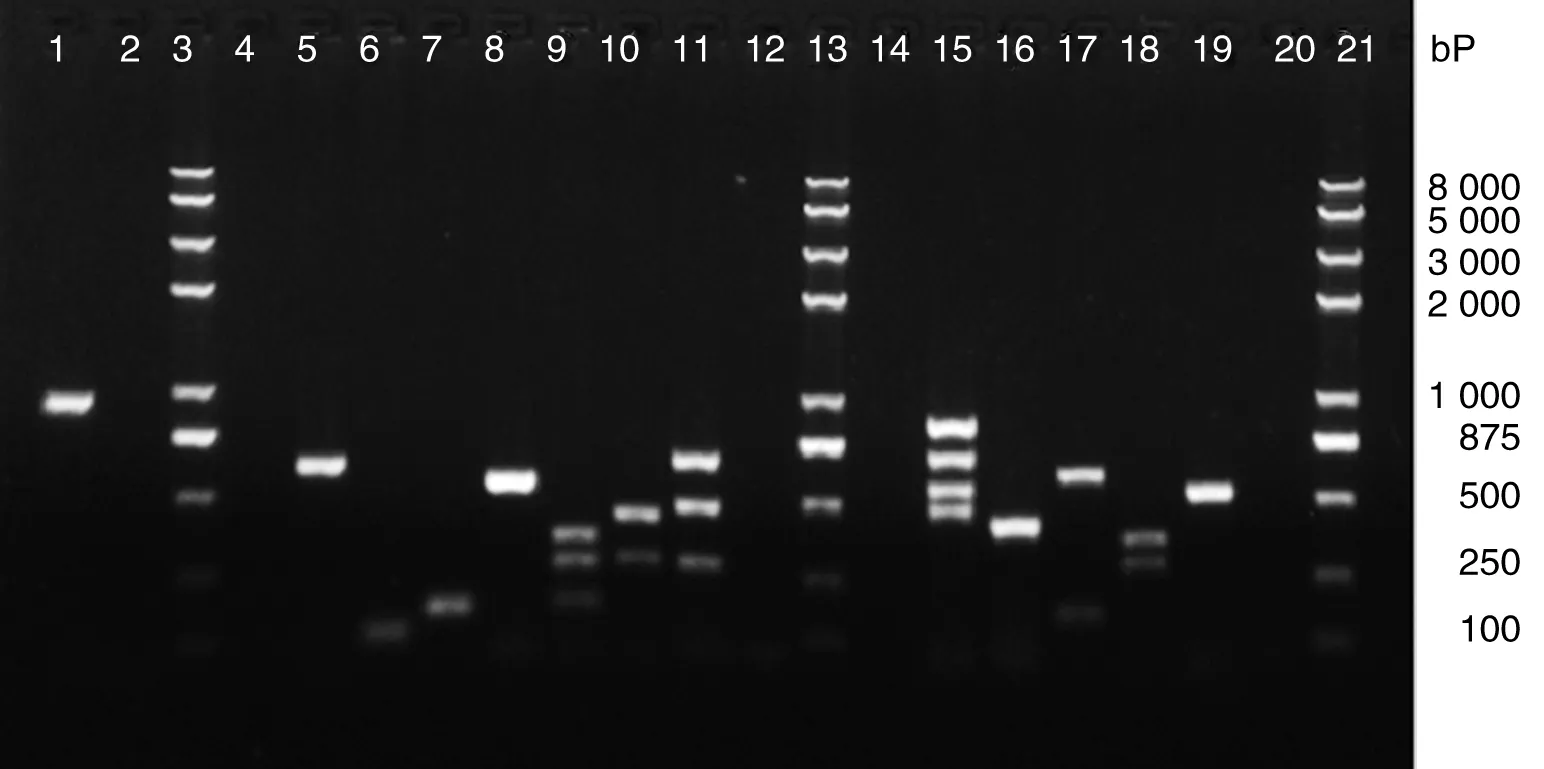
1: positive for elt-II; 2, 4, 12, 14, 20: negative control; 3, 13, 21: Tran2K Plus II DNA marker; 5-8: positive for sepA gene, astA gene, ler gene, hlyA gene, respectively; 9: positive for stb, elt-I and sta genes, respectively; 10: positive for LEE and HPI islands, respectively; 11: positive for stx1, stx2e and stx2 genes, respectively; 15: positive for K88, F41, K99 and 987P genes, respectively; 16: positive for F1 gene; 17:positive for AIDA-I and paa genes, respectively; 18: positive for afaD and afaE genes, respectively; 19: positive for F18 gene.图1 PCR扩增结果Fig.1 Result from the PCR amplification
2.4LT-II毒素基因的测序分型 用表1中设计8对分别扩增elt-IIa,elt-IIb,elt-IIc1,elt-IIc2,elt-IIc3,elt-IIc4,elt-IIc5,elt-IIc6基因的特异性引物,以分离到的12株elt-II阳性大肠杆菌为模板进行PCR反应,胶回收基因片段与PMD18-T simple载体连接测序结果显示,有10株携带elt-IIc1毒力基因,2株携带elt-IIc4毒力基因。将PCR产物测序后与GenBank中的参考序列进行比对, 其同源性为100%(图2)。
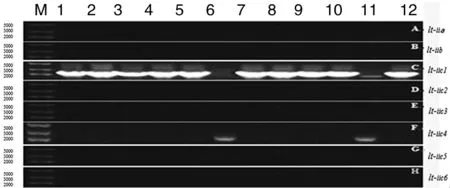
M:Trans DNA 8000 Marker; 1-12, PCR products of LT-II positive of E. coli strains, respectively; -, PCR negative control. A-H, the specific PCR products of elt-IIa, elt-IIb, elt-IIc, elt-IIc2, elt-IIc3, elt-IIc4, elt-IIc5 and elt-IIc6 genes, respectively.图2 LT-II各亚型的PCR检测结果 Fig.2 Result of PCR detection to each subtype of elt-II
3 讨 论
致泻性大肠杆菌是引起婴幼儿腹泻的主要病原之一,给发展中国家或不发达国家的儿童健康带来极大的威胁[19]。本研究对大肠杆菌可能携带的常见菌毛或非菌毛黏附因子进行检测,结果显示,在婴幼儿腹泻样品中有elt-II基因的存在,但却未检测到elt-I基因,有研究认为致病性大肠杆菌所携带的毒力因子流行情况复杂,即便在相同地区,不同的年份所分离到致病性大肠杆菌所携带的毒力因子是不同的;即使是在相同时间段,不同国家地区所分离到的致病性大肠杆菌所携带的毒力因子也是不同的[4]。故而本次流行病学调查中,所有菌株elt-I均阴性。而所分离的12株阳性LT-II大肠杆菌中,仅有2株单独携带elt-II基因,共有6株携带有F1菌毛基因,1株携带有K88菌毛基因,这似乎表明LT-II发挥毒性作用主要与F1菌毛密切相关,携带有菌毛和elt-II基因的致病性大肠杆菌进入机体内后,菌毛便可发挥黏附作用使细菌特异性的与小肠细胞上的受体牢固结合,最终促使LT-II发挥生物学作用引起严重腹泻。目前关于F1菌毛的研究仍处于不完善阶段,只有该菌毛G蛋白研究较为深入,对于该菌毛其他结构蛋白的进一步研究可对揭示LT-II如何发挥毒性作用起着重要的意义。此外,本研究中irp2的检出率高达23.1%,且有1株为同时携带astA和elt-II基因,irp2作为HPI毒力岛核心保守区的主要结构基因,与铁摄取能力密切相关,应予以高度重视。
elt-II基因于1983年首次成功分离至今,30多年来只有少数学者从事该毒素的研究工作,并且研究大多集中在elt-IIa和elt-IIb。直到近几年,有学者陆续的从埃及、英国等国家的人和动物粪便中分离到elt-II基因[20]。LT-IIc家族自2010年首次被分离发现并且命名以来,已有很多专家学者对其开展相关研究,并且通过在南美各地LT-IIc家族已逐渐取代了LT-IIa和LT-IIb成为了主要流行致病基因。本研究通过对沈阳地区进行流行病学调查发现该毒素目前的流行趋势以LT-IIc家族为主,并无LT-IIa和LT-IIb出现,似乎预示着随着时间的推移LT-IIa、LT-IIb毒力基因或已经逐渐消失,并与国外报道的流行趋势一致。与此同时,Jobling等人通过对elt-IIa、elt-IIb和elt-IIc家族8种基因的基因进化分析,其结果表明,LT-IIc家族是近年来进化出的一支不同与LT-IIa和LT-IIb的新型不耐热肠毒素,其氨基酸同源性与后者相差较大,与之结合的受体类型也有很大的区别,蛋白结构和生物学功能却十分类似[7]。尽管LT-IIc家族含有6种或者甚至更多的亚型,其氨基酸序列的同源性却高达96%以上,因此其结构和功能上都无太大的异同,并且随着时间和空间的推移,不排除会有更多新类型的LT-II出现的可能,及时有效的对腹泻病例病原检测对食品安全和疾病防控都具有重要的意义。
[1] Qadri F, Svennerholm AM, Faruque AS, et al. EnterotoxigenicEscherichiacoliin developing countries: epidemiology, microbiology, clinical features, treatment, and prevention[J]. Clin Microbiol Rev, 2005, 18(3): 465-483.
[2] Kaper JB, Nataro JP, Mobley HL. PathogenicEscherichiacoli[J]. Nat Rev Microbiol, 2004, 2(2): 123-140.
[3] Sanchez J, Holmgren J. Virulence factors, pathogenesis and vaccine protection in cholera and ETEC diarrhea[J]. Curr Opin Immunol, 2005, 17(4): 388-398.
[4] Liu W, Yuan C, Meng X, et al. Frequency of virulence factors inEscherichiacoliisolated from suckling pigs with diarrhoea in China[J]. Vet J, 2014, 199(2): 286-289.
[5] Green BA, Neill RJ, Ruyechan WT, et al. Evidence that a new enterotoxin ofEscherichiacoliwhich activates adenylate cyclase in eucaryotic target cells is not plasmid mediated[J]. Infect Immun, 1983, 41(1): 383-390.
[6] Nawar HF, Greene CJ, Lee CH, et al. LT-IIc, a new member of the type II heat-labile enterotoxin family, exhibits potent immunomodulatory properties that are different from those induced by LT-IIa or LT-IIb[J]. Vaccine, 2011, 29(4): 721-727.
[7] Jobling MG, Holmes RK. Type II heat-labile enterotoxins from 50 diverseEscherichiacoliisolates belong almost exclusively to the LT-IIc family and may be prophage encoded[J]. PLoS One, 2012, 7(1): e29898.
[8] Casey TA, Connell TD, Holmes RK, et al. Evaluation of heat-labile enterotoxins type IIa and type IIb in the pathogenicity of enterotoxigenicEscherichiacolifor neonatal pigs[J]. Vet Microbiol, 2012, 159(1/2): 83-89.
[9] Guth BE, Pickett CL, Twiddy EM, et al. Production of type II heat-labile enterotoxin byEscherichiacoliisolated from food and human feces[J]. Infect Immun, 1986, 54(2): 587-589.
[10] Yuan CW, Liu WX, Guan WK, et al. Isolation of type II heat labile enterotoxin producingEscherichiacoliand preparation of the recombinant toxin[J]. Acta Veterinariaet Zootechnica Sinica, 2014, 45 (8):1336-1341. DOI: 10. 11843/j. issn. 0366-6964.2014.08.019 (in Chinese)
袁超文,刘文鑫,关玮琨,等. 牛源产II型不耐热肠毒素大肠杆菌的分离鉴定及重组毒素制备[J]. 畜牧兽医学报, 2014, 45 (8):1336-1341.
[11] Zhou LM, Wang B, Liang Y, et al. Monitoring on infectious diarrheal disease in Daxing district of Beijing, 2010-2011[J]. Capital J Public Hlth, 2013, 7(3): 124-126. (in Chinese)
周丽敏,王斌,梁赢,等. 2010-2011年北京市大兴区感染性腹泻监测[J]. 首都公共卫生, 2013,7 (3):124-126.
[12] Meng XQ, Yuan CW, Liu WX, et al. Multiplex PCR detection on enterotoxin genes in enterotoxigenicEschrichiacoli[J]. Chin J Zoonoses, 2015, 31(1): 6-10. DOI: 10. 3969/cjz.j.issn.1002-2694.2015.01.002 (in Chinese)
孟相秋,袁超文,刘文鑫,等. 大肠杆菌肠毒素基因多重PCR检测方法的建立[J]. 中国人兽共患病学报, 2015, 31(1): 6-10.
[13] Cheng D, Sun H, Xu J, et al. PCR detection of virulence factor genes inEscherichiacoliisolates from weaned piglets with edema disease and/or diarrhea in China[J]. Vet Microbiol, 2006, 115(4): 320-328.
[14] Zhang W, Zhao M, Ruesch L, et al. Prevalence of virulence genes inEscherichiacolistrains recently isolated from young pigs with diarrhea in the US[J]. Vet Microbiol, 2007, 123(1-3): 145-152.
[15] Vu KH, Holoda E, Pilipcinec E, et al. Serotypes, virulence genes, and PFGE profiles ofEscherichiacoliisolated from pigs with postweaning diarrhoea in Slovakia[J]. BMC Vet Res, 2006, 2: 10.
[16] Lalioui L, Jouve M, Gounon P, et al. Molecular cloning and characterization of the afa-7 and afa-8 gene clusters encoding afimbrial adhesins inEscherichiacolistrains associated with diarrhea or septicemia in calves[J]. Infect Immun, 1999, 67(10): 5048-5059.
[17] Paton AW, Paton JC. Direct detection and characterization of Shiga toxigenicEscherichiacoliby multiplex PCR for stx1, stx2, eae, ehxA, and saa[J]. J Clin Microbiol, 2002, 40(1): 271-274.
[18] Boerlin P, Travis R, Gyles CL, et al. Antimicrobial resistance and virulence genes ofEscherichiacoliisolates from swine in Ontario[J]. Appl Environ Microbiol, 2005, 71(11): 6753-6761.
[19] Clements ML, Levine MM, Black RE, et al. Lactobacillus prophylaxis for diarrhea due to enterotoxigenicEscherichiacoli[J]. Antimicrob Agents Chemother, 1981, 20(1): 104-108.
[20] Nawar HF, King-Lyons ND, Hu JC, et al. LT-IIc, a new member of the type II heat-labile enterotoxin family encoded by anEscherichiacolistrain obtained from a nonmammalian host[J]. Infect Immun, 2010, 78(11): 4705-4713.
Sequence analysis on type II heat labile enterotoxin ofEscherichiacolifrom diarrhaea patients in Liaoning Province, China
YUAN Chao-wen1, JIANG Kui-yu2, ZHANG Li-guo2, LIU Wen-xin3
(1.CollegeofLifeandHealthSciences,NortheastUniversity,Shenyang110819,China;2.LiaoningCenterforAnimalDiseaseEmergency,Shenyang110161,China;3.LaboratoryofHematology,theAffiliatedHospitalofGuangdongMedicalCollege,Zhanjiang524001,China)
In this study, we aimed to investigate the prevalence of type II heat labile enterotoxin (LT-II) producing PathogenicEscherichiacoli, and to further analyzed the relationship betweenelt-IIand other virulence factors. From 2014 to 2015, a total of 354 human fecal samples were collected from Liaoning Province, and then 354E.colistrains were isolated from the fecal samples by using MacConkey agar and biochemical test. The isolated strains were further detected by using PCR method for detecting the virulence factors (elt-II,elt-I,sta,stb, K88, K99, etc.), and theelt-IIgene was sequenced in LT-II positiveEscherichiacoli. Results showed that 139(39.2%) virulence factor positiveE.coliwere isolated from 354 fecal samples. Of the 139 virulence factor positiveE.coli, 12(8.6%) harbored theelt-IIgene. Of the 12elt-IIpositive strains, 2 harbored theelt-IIas the only virulence factor, 6 harbored F1 besides theelt-IIgene, 1 harbored K88 besides theelt-IIgene, 1 harboredastAbesides theelt-IIgene, and 2 harboredirp2/astAbesides theelt-IIgene. The result of sequencing showed that 10 of the 12elt-IIpositive strains harbored theelt-IIc1 subtype, and 2 of the 12elt-IIpositive strains harbored theelt-IIc4 subtype. Results indicated that LT-II existed in human resource fecal samples, and LT-IIc1 was the mainly subtype.
Escherichiacolielt-II; PCR detection; sequencing and analysis
Liu Wen-xin, Email: liuwenxin2009@163.com
刘文鑫, Email: liuwenxin2009@163.com
1.东北大学生命科学与健康学院,沈阳110819;2.辽宁省重大动物疫情应急中心,沈阳110161;3.广东医学院附属医院,血液疾病研究中心,湛江524001
R183.3
A
1002-2694(2016)07-0644-07
2015-10-15;
2016-04-23
DOI:10.3969/j.issn.1002-2694.2016.07.011

