携带BARF1基因的重组巨细胞病毒的构建
张长风,于 魁,朱丽华,李淑英
携带BARF1基因的重组巨细胞病毒的构建
张长风1,2,于魁2,朱丽华2,李淑英2
目的依据细菌人工染色体(Bacterial artificial chromosome,BAC)能够克隆大段DNA病毒的特点,通过galk为基础的同源重组,将EB病毒编码BARF1基因插入巨细胞病毒(cytomegalovirus,CMV),构建重组病毒。方法PCR扩增带有巨细胞病毒UL57基因左右同源臂的galk及BARF1基因片段,经过电转化,进行同源重组,经含有galk培养基及脱galk培养基筛选,获得带有BARF1的巨细胞病毒细菌人工染色体克隆,提取质粒,转染到ARPE-19细胞,观察带有BARF1基因的巨细胞病毒对ARPE-19细胞的影响。结果感染带有BARF1基因的巨细胞病毒的ARPE-19细胞形态由原来的长梭形变为变圆、肿胀、胞浆颗粒增多,并且细胞生长失去接触抑制,出现重叠生长现象。结论建立了携带BARF1基因的重组巨细胞病毒;同时表明利用细菌人工染色体,可方便地对病毒基因组进行准确操作。
同源重组;电转化;细菌人工染色体
细菌人工染色体(bacterial artificial chromosome,BAC)的发展,是DNA病毒基因结构、功能及疫苗研究领域的一项重大突破。利用细菌人工染色体进行克隆,病毒能够在细菌细胞内稳定传播,也能在细菌细胞内进行同源重组;并且病毒细菌人工染色体中,任何要求的基因重组或突变,都能够迅速容易地实现,这种基因改变能在病毒重组前加以验证,因此,细菌人工染色体的建立为重组病毒的构建、病毒基因功能的研究带来了极大的方便[1-5]。本项研究利用人巨细胞病毒(Human cytomegalovirus,HCMV)的细菌人工染色体能够克隆大段DNA病毒的特点,通过以galk为基础的同源重组,将EB病毒编码BARF1基因插入HCMV,构建重组病毒。为进一步探讨病毒基因结构、功能和新型疫苗的开发奠定基础。
1 材 料
1.2质粒pgalk和pBARF1质粒,巨细胞病毒细菌人工染色体是一种对人无致病作用的巨细胞病毒株的细菌人工染色体(Towne bacterial artificial chromosome system,T-BAC),含有巨细胞病毒的全部基因组及氯霉素抗性基因;都为本室保存。
1.31×M9培养基(1 L)将Na2HPO4(6 g)、KH2PO4(3 g)、NH4Cl(1 g)和NaCl(0.5 g)溶解于1 L 双蒸水中,高压灭菌备用。1.4M63培养基(5×M63)将(NH4)2SO4(10 g)、KH2PO4(68 g)和FeSO4·7H2O(2.5 mg)溶解于1 L双蒸水中,用KOH 调节pH=7,高压灭菌备用。
1.5用M63配制galk培养板1) 取7.5 g琼脂于400 mL 双蒸水中,高压灭菌备用;2) 添加 100 mL已经高压灭菌的5×M63培养液和0.5 mL 1 mol/L MgSO4·7 H2O ;3) 在 50 ℃ 水浴冷却至50 ℃,添加5 mL 20%无菌半乳糖,2.5 mL无菌D-生物素(0.2 mg/mL), 2.25 mL 无菌L-亮氨酸(10 mg/mL), 500 μL无菌氯霉素 (12.5 mg/mL);4) 混匀倒平板(每块平板大约25 mL)。
1.6用M63制备脱galk培养板将上述2.5制备培养基中的5 mL 20%无菌半乳糖,更换为5 mL 20%无菌2-脱氧-D-半乳糖,此外,添加2.0 mL 50%无菌甘油, 混匀倒平板即可。
2 操作步骤
2.1SW102电感受态细胞的制备常规方法制备SW102电转感受态细胞,-80 ℃保存。
2.2制备含有巨细胞病毒细菌人工染色体(T-BAC)的SW102细胞将T-BAC质粒DNA电转到SW102电感受态细胞,转移到1 mL LB培养液,32 ℃孵育1 h;离心,用1×M9液洗涤沉淀2次,涂布于含有氯霉素的LB琼脂培养基,32 ℃ 培养1 d后,有克隆形成,挑选4个克隆,提取质粒DNA,PCR(用巨细胞病毒开放读码框UL57引物:Forward: 5′-agacgtcgtgcgtcaaacat-3′;Reverse: 5′-Aacggtcgcataacgagaga-3′产物210 bp)鉴定。并将其命名为SW102-T-BAC。制备SW102-T-BAC电感受态细胞,-80 ℃保存备用。
2.3PCR扩增带有巨细胞病毒开放读码框UL57左右同源臂的galk基因依据GenBank提供的Towne.基因序列(FJ616285.1),设计带有巨细胞病毒开放读码框UL57左右同源臂的galk引物:Galk-Forward,GtataaaattcactcagtggcggcgtagccattgtcttccgttcatccaccatgCCTGTTGACAATTAA-TCATCGGCA;Reverse,Gagaaaagccgcgggccccaccggcgctagcgcggttagttcctcgtggct TCAGCACTGTCCTGCTCCTT,产物约1 400 bp。以pgalk质粒DNA为模板,用所设计galk引物,PCR扩增带有巨细胞病毒开放读码框UL57左右同源臂的galk基因,PCR产物经1.0%的琼脂糖凝胶电泳后,切胶,回收纯化。
2.4Galk基因插入带巨细胞病毒开放读码框UL57将已纯化带有巨细胞病毒开放读码框UL57左右同源臂的galk基因电转到SW102-T-BAC感受态细胞,然后转移到含有1 mL LB 的培养液,在32 ℃摇床孵育1 h,离心,用1×M9液洗涤沉淀2次,取沉淀涂布于步骤2.5中用M63配制的galk培养板,32 ℃培养3 d后有克隆形成;挑选3个克隆,提取质粒DNA,PCR(所用引物:Forward: 5′-agacgtcgtgcgtcaaacat-3′;Reverse: 5′-Aacggtcgcataacgagaga-3′,产物1 400 bp)检测galk。将其命名为SW102-T-galk-BAC。制备SW102-T-galK-BAC感受态细胞。
2.5用BARF1代替galk基因可为任何感兴趣的基因突变, 在这里我们用BARF1标记Towne的UL57,即BARF1基因。
2.3 病例诊治和上报情况 2007-2017年,全市医疗机构诊断报告疟疾病例6 167例,其中实验室确诊病例5 545例,占89.91%,临床诊断病例614例,占9.96%,疑似病例6例,占0.10%,带虫者2例,占0.03%。消除疟疾行动计划实施后规范了疟疾诊断报告,2012年之后均为实验室确诊病例。其中,综合医院报告1 198例,占19.43%,疾控中心报告2 727例,占44.22%,卫生院报告2 190例,占35.51%,民营医院及其他报告52例,占0.84%。病例诊断后24 h内报告6 096例,报告及时率98.85%。
2.5.1PCR扩增带有Towne开放读码框UL57左右同源臂的BARF1依据GenBank提供的EB病毒基因序列(NC_009334),设计引物:BARF1-Forward: 5′-Gtataaaattcactcagtggcggcgtagccattgtc-ttccgttcatccaccatg atggccaggttcatcgctcag-3′BARF1-Reverse: 5′-Gagaaaagccgcgggccccaccggcgctagcgcg-gttagttcctcgtggct ttattgcgacaagtatccag-3′,产物771 bp,以pBARF1质粒为模板,用所设计引物PCR扩增BARF1。PCR产物经1.0%的琼脂糖凝胶电泳后,切胶,回收纯化。
2.5.2基因BARF1替代galk取上述纯化PCR产物与SW102-T-galk-BAC感受态细胞混合,电转化,然后转移到含有1 mL LB的培养液,在32 ℃摇床孵育4.5 h(可通过这样长时间孵育,获得重组基因BARF1的质粒,使其他不需要质粒丢失),离心,用1×M9液洗涤沉淀2次,将沉淀混悬于1 mL M9培养液中,取100 μL,再分别进行10倍及100倍稀释后涂布于步骤2.6中用M63配制的脱galk培养板,32 ℃培养3 d后有克隆形成;挑选3个克隆,提取质粒DNA,PCR(所用引物:Forward: 5′-agacgtcgtgcgtcaaacat-3′;Reverse: 5′-Aacggtcgcataacgagaga-3′,产物876 bp)检测BARF1基因。将其命名为SW102-T-BARF1-BAC。
2.6转染接种ARPE-19细胞于6孔反应板,置于5% CO2的37 ℃温箱中培养,待其生长到汇合度约为60%时,分别用SW102-T-BAC和SW102-T-BARF1-BAC质粒转染。1)取4.5 μg大提质粒,用无血清的DMEM细胞培养液稀释至150 μL。2)取18 μL转染试剂,用无血清的DMEM细胞培养液稀释至300 μL。3)将二者混合均匀,室温放置20 min。4)SW102-T-BAC的混合物添加到6孔板(分别标记1,2,3,4,5,6)的1,2孔细胞,3,4孔细胞添加SW102-T-BARF1-BAC,5,6孔为原来的细胞作对照。5)24 h后更换细胞培养液;然后每2~3 d换1次细胞培养液;每天显微镜下观察细胞生长状况。待细胞长满六孔板后,更换到10 cm培养皿培养,继续观察。2.7转染细胞中基因BARF1表达的检测待10 cm培养皿的细胞长满后,收集转染与未转染的细胞,分别提取细胞的蛋白,用Western blot检测BARF1蛋白的表达。
3 结 果
3.1SW102-T-BAC的检测将T-BAC DNA电转到SW102感受态细胞,从含有氯霉素(12.5 mg/mL)LB琼脂平板中,挑选3个克隆,提取质粒DNA,PCR扩增后,经琼脂糖凝胶电泳检测到大小为210 bp的产物,图1中:1是以无菌水为模板的阴性对照;2-4分别是以挑选的3个克隆所提取质粒DNA为模板的PCR扩增后产物,结果表明与预期的结果相一致,说明所挑选克隆是正确的。将其命名为SW102-T-BAC。
3.2PCR扩增带有巨细胞病毒开放读码框UL57左右同源臂的galk基因以质粒pgalk为模板,PCR 扩增带有Towne开放读码框UL57左右同源臂的galk基因片段,经1.0%的琼脂糖凝胶电泳观察到大约1 400 bp的产物,图2中:3是阴性对照;1与2分别是PCR扩增的带有Towne开放读码框UL57左右同源臂的galk基因,所得片段大小与预期的结果相一致,表明所扩增片段正确。
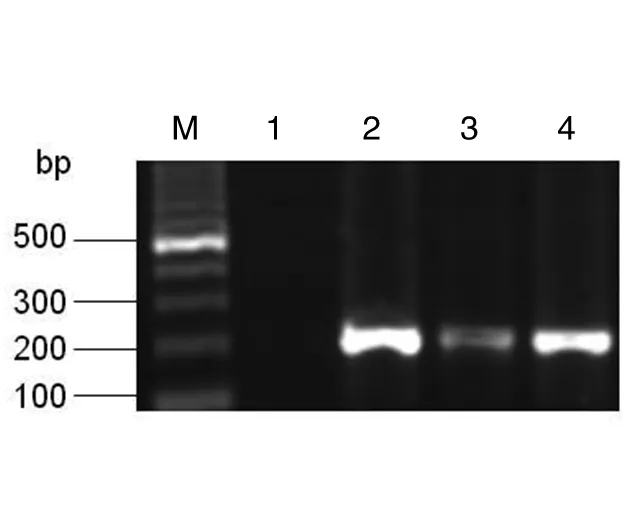
图1 PCR检测SW102-T-BAC克隆Fig.1 Detection of SW102-T-BAC clones by PCR
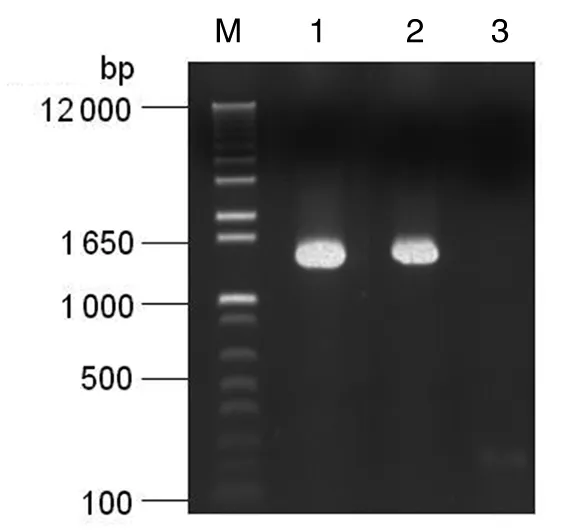
图2 PCR扩增galk基因片段Fig.2 Galk gene amplified by PCR

图3 克隆galk基因至SW102-T-BAC的检测Fig.3 Detection of galk from SW102-T-galk-BAC
3.3克隆galk基因至SW102-T-BAC将所扩增带有Towne开放读码框UL57左右同源臂的galk基因片段电转到SW102-T-BAC感受态细胞,经氯霉素抗性筛选3 d后,挑选5个克隆,提取其质粒DNA,PCR 扩增后,经1.0%的琼脂糖凝胶电泳观察到大约1 400 bp的产物,图3中:6为阴性对照;1-5分别是带有Towne开放读码框UL57左右同源臂的galk片段电转到感受态细胞后,经抗性筛选,所挑选5个克隆提取其质粒DNA后,PCR 检测的结果,所得片段大小与预期的结果相一致,表明galk已克隆至SW102-T-BAC。将其命名为SW102-T-galk-BAC。
3.4PCR扩增带有Towne开放读码框UL57左右同源臂的BARF1基因以质粒pBARF1为模板,PCR 扩增带有Towne开放读码框UL57左右同源臂的BARF1基因片段,经1.0%的琼脂糖凝胶电泳观察到大约771 bp的产物,图4中:5为阴性对照;1-4分别是PCR扩增带有Towne开放读码框UL57左右同源臂的BARF1基因,所得片段大小与预期的结果相一致,表明所扩增片段正确。

图4 PCR扩增BARF1基因Fig.4 BARF1 gene amplified by PCR

图5 BARF1基因代替galk突变的检测Fig.5 Detection of BARF1 instead of galK mutation

图7 Western blot鉴定BARF1的表达状况Fig.7 Detection of BARF1 by western blot
3.5基因BARF1替代galk将已纯化带有带有Towne开放读码框UL57左右同源臂的BARF1基因片段电转到SW102-T-galk-BAC感受态细胞后,涂布于M63配制的脱galk培养板中,经氯霉素抗性基因筛选,32 ℃培养3 d后有克隆形成;挑选4个克隆,提取质粒DNA,PCR检测BARF1基因,所得产物大小876 bp,图5中:5为阴性对照;1-4 分别是BARF1基因脱galk后挑选的4个克隆,质粒提取后PCR检测的结果,与预期的结果相一致,表明BARF1基因代替了galk,测序结果正确。将其命名为SW102-T-BARF1-BAC。
3.6转染分别将SW102-T-BAC和SW102-T-BARF1-BAC质粒转染ARPE-19细胞,显微镜下观察:被病毒感染的细胞的形态逐渐发生改变,随着时间的延长,细胞形态改变越来越明显,大约培养20 d,被转染细胞和未转染细胞相比:转染携带BARF1基因的巨细胞病毒的细胞形态由原来的长梭形变为变园、肿胀、胞浆颗粒增多,细胞相互间的走向失去正常规律性,细胞失去接触抑制现象,并且重叠生长,出现了肿瘤细胞生长的特点(图6A,6B,6C)。

图6A 未转染的ARPE-19细胞Fig.6A Non-transfected ARPE-19 cells

图6B 转染SW102-T-BAC的ARPE-19细胞Fig.6B ARPE-19 cells of transfected SW102-T-BAC

图6C 转染SW102-T-BARF1-BAC的细胞Fig.6C ARPE-19 cells of transfected SW102-T-BARF1-BAC
3.7病毒转染细胞后BARF1表达状况的检测分别收集转染与未转染的细胞,分别提取细胞的蛋白,用Western blot检测BARF1蛋白的表达。结果显示,未转染细胞和转染SW102-T-BAC细胞提取蛋白的结果都为阴性;阳性对照B95-8细胞与转染SW102-T-BARF1-BAC细胞提取蛋白后,Western blot结果都得到约为31 kD的产物,图7中:1-4分别是从未转染细胞中提取蛋白、从转染SW102-T-BAC 的细胞中提取蛋白、从 B95-8 细胞中提取蛋白及从转染SW102-T-BARF1-BAC细胞中提取蛋白后,Western blot检测BARF1的结果;表明携带BARF1基因的重组巨细胞病毒构建成功。
4 讨 论
Towne病毒株是经过HCMV反复感染细胞后分离得到的,该病毒株已失去人体内复制与扩散的能力,不具有致病性,但在体外细胞培养过程中仍能生长繁殖,该病毒株是试验研究最常用病毒株,其基因组为240 kb的双链DNA病毒,包括166个开放读码框(open reading frame,ORF),由于基因组巨大这一特点,传统分子克隆技术很难对其基因加以改造。但近年来,随着CMV细菌人工染色体的构建,CMV-BAC允许CMV基因组中的目标基因快速、高效突变,并形成CMV定向表达异源抗原[6,7]。BAC克隆的病毒可以在细菌细胞内保持稳定及传播,并可容易地操作病毒基因组,任何要求的重组都可以在细菌细胞内轻松、快速地完成[8-11]。为病毒基因结构、功能的研究及其疫苗的开发奠定了基础。
SW102株是通过改良DY380而构建的大肠杆菌细胞株[12-14],是半乳糖操纵子中的半乳糖(galk)基因缺陷株。当SW102株培养在半乳糖为唯一碳源的培养基时,需添加galk才能生长。在这种情况下,它取代了感兴趣的基因,galk可以补充有缺陷的细菌galk基因,在含有半乳糖的培养基中成长。当病毒细菌人工人色体中的galk被BARF1基因所取代时,利用含有galk任何克隆的反选原则,在培养基中添加2-脱氧半乳糖进行负选择,这样可以通过反选,将BARF1基因选择出来。这样以galk为基础,能够高度特异、有效地进行BARF1基因(或其他感兴趣基因)重组。
BARF1是EB病毒(Epstein-Barr virus,EBV) 编码的致癌基因,在EBV阳性肿瘤发生、发展过程中可能起重要作用[15-16]。本项研究结果显示:利用人巨细胞病毒细菌人工染色体,通过 galk为基础的选择与反选,获得了携带EB病毒编码BARF1基因的重组人巨细胞病毒,并且该重组病毒转染ARPE-19细胞后,表现出肿瘤细胞生长的特点,表明通过BARF1基因可克隆至人巨细胞病毒,使人巨细胞病毒进行定向突变产生有感染性的子代病毒,进而研究该突变病毒对表型的影响。
[1] Dunn W, Chou C, Li H, et al. Functional profiling of a human cytomegalovirus genome[J]. Proc Natl Acad Sci U S A, 2003, 100(24): 14223-14228.
[2] Murphy E, Yu D, Grimwood J, et al. Coding potential of laboratory and clinical strains of human cytomegalovirus[J]. Proc Natl Acad Sci U S A, 2003, 100(25): 14976-14981.
[3] Yu D, Silva MC, Shenk T. Functional map of human cytomegalovirus AD169 defined by global mutational analysis[J]. Proc Natl Acad Sci U S A, 2003, 100(21): 12396-12401.
[4] Dolan A, Cunningham C, Hector RD, et al. Genetic content of wild-type human cytomegalovirus[J]. J Gen Virol, 2004, 85(pt5): 1301-1312.
[5] Warden C, Tang Q, Zhu H. Herpesvirus BACs: past, present, and future[J]. J Biomed Biotechnol, 2011, 2011: 124595.
[6] Karrer U, Wagner M, Sierro S, et al. Expansion of protective CD8+Tcell responses driven by recombinant cytomegaloviruses[J]. J Virol, 2004, 78(5): 2255-2264.
[7] Dulal K, Silver B, Zhu H. Use of recombination-mediated genetic engineering for construction of rescue human cytomegalovirus bacterial artificial chromosome clones[J]. J Biomed Biotechnol, 2012, 2012: 357147.
[8] Xu G, Smith T, Grey F, et al. Cytomegalovirus-based cancer vaccines expressing TRP2 induce rejection of melanoma in mice[J]. Biochem Biophys Res Commun, 2013, 437(2): 287-291.
[9] Dekhtiarenko I, Jarvis MA, Ruzsics Z, et al. The context of gene expression defines the immunodominance hierarchy of cytomegalovirus antigens[J]. J Immunol, 2013, 190(7): 3399-3409.
[10] Trsan T, Busche A, Abram M, et al. Superior induction and maintenance of protective cd8 t cells in mice infected with mouse cytomegalovirus vector expressing RAE-1γ[J]. Proc Natl Acad Sci U S A, 2013, 110(41): 16550-16555.
[11] Tsuda Y, Caposio P, Parkins CJ, et al. A replicating cytomegalovirus-based vaccine encoding a single Ebola virus nucleoprotein CTL epitope confersprotection against Ebola virus[J]. PLoS Negl Trop Dis, 2011, 5(8): e1275.
[12] Yu D, Ellis HM, Lee EC, et al. An efficient recombination system for chromosome engineering inEscherichiacoli[J]. Proc Natl Acad Sci U S A, 2000, 97(11): 5978-5983.
[13] Zhang Y, Muyrers JP, Testa G, et al. DNA cloning by homologous recombination inEscherichiacoli[J]. Nat Biotechno, 2000, 18(12): 1314-1317.
[14] Zhang Z, HuangY, Zhu H. A highly efficient protocol of generating and analyzing VZV ORF deletion mutants based on a newly developed luciferase VZV BAC system[J]. J Virol Methods, 2008, 148(1-2): 197-204.
[15] Seto E, Yang L, Middeldorp J, et al. Epstein Barr virus (EBV) encodedBARF1 gene is expressed in nasopharyngeal carcinoma and EBV associated gastric carcinoma tissues in the absence of lytic gene expression[J]. J Med Virol, 2005, 76(1): 82-88.
[16] Fiorini S, Ooka T. Secretion of Epstein Barr virus encoded BARF1 oncoprotein from latently infected B cells[J]. Virol J, 2008, 5(70): 1186-1743.
Construction of the recombinant cytomegalovirus carryingBARF1 gene
ZHANG Chang-feng1,2, YU Kui2, ZHU Li-hua2, LI Shu-ying2
(1.InstituteofMedicalBiotechnology,ChineseAcademyofMedicalSciences,Beijing100050,China;2.SchoolofBasicMedicalSciences,NorthChinaUniversityofScienceandTechnology/HebeiKeyLaboratoryforChronicDiseases,TangshanKeyLaboratoryforPreclinicalandBasicResearchonChronicDiseases,Tangshan063000,China)
The purpose of this study is to establish recombinant cytomegalovirus carryingBARF1 gene, which based on characteristics of bacterial artificial chromosome can clone a large segment DNA virus through homologous recombination on basis of galk. Galk andBARF1 gene fragment with 50 bp homologous arms of cytomegalovirus UL57 was amplified by PCR, respectively. The clones of recombinant cytomegalovirus carryingBARF1 gene was obtained after electroporation through homologous recombination and selection in medium containing galk and replacing galk forBARF1 gene in 2-deoxy-galactose medium. The plasmids of recombinant cytomegalovirus bacterial artificial chromosome containing BARF1 were transfected into ARPE-19 cells after the plasmids extracted from clones. The morphology of cells infected recombinant virus was changed from the original long fusiform to round, swelling, and full of cytoplasm particles. The cells of infected recombinant virus grow overlapping and lost contact inhibition. These results indicated that recombinant cytomegalovirus carryingBARF1 gene was established, and the virus genome can be operated accurately using bacterial artificial chromosomes.
homologous recombination; electroporation; bacterial artificial chromosome (BAC)
Supported by the Project of Science and Technology for Overseas Scholars of Hebei Province (No. C201400559)
Li Shu-ying, Email: lsy5001@sina.com
李淑英,Email:lsy5001@sina.com
1.中国医学科学院北京协和医学院医药生物技术研究所,北京100050;2.华北理工大学基础医学院(河北省慢性疾病重点实验室,唐山市慢性病临床基础研究重点实验室),唐山063000
R373.1
A
1002-2694(2016)07-0595-05
2015-11-02;
2016-05-26
DOI:10.3969/j.issn.1002-2694.2016.07.001
河北省留学人员科技活动资助项目(No.C20140059)
——紫 苏

