江西口岸及国检监管区鼠类感染钩端螺旋体的检测及基因序列分析
赵明惠,徐铁龙,张 强,胡 婷,王建军,刘开明,廖 芸
江西口岸及国检监管区鼠类感染钩端螺旋体的检测及基因序列分析
赵明惠,徐铁龙,张强,胡婷,王建军,刘开明,廖芸
目的为了解江西省口岸及国检监管区鼠类携带的钩端螺旋体情况,2015年7-12月,对江西省2个一类口岸和9个国检监管区捕获的鼠类携带的钩端螺旋体进行了检测。方法采用荧光定量PCR和特异性PCR扩增两种方法对样本进行检测。结果研究发现捕获的107只鼠类中存在12例致病性钩端螺旋体阳性,阳性率为11.2%。包括褐家鼠6只,黄毛鼠3只,黄胸鼠1只,社鼠2只,分布在昌北机场、康替龙国检监管区、南丰国检监管区、鹰潭国检监管区和瑞金国检监管区。同源性对比和系统进化分析显示,12例钩端螺旋体中11例为问号钩端螺旋体,另1例为博氏钩端螺旋体。结论在江西口岸及国检监管区鼠类中存在问号钩端螺旋体和博氏钩端螺旋体感染。两种PCR检测方法均可适用于口岸及国检监管区对钩端螺旋体的检测,防止相应传染病在口岸的爆发与传播,保卫口岸安全。
口岸;国检监管区;鼠类;钩端螺旋体
钩端螺旋体(Leptospira,简称钩体)是一种丝状、柱形、螺旋盘绕而致密的病原微生物。钩体在世界范围内广泛分布,可引起人兽共患钩端螺旋体病(leptospirosis,简称钩体病)[1]。该病的早期症状包括高烧、流口水、眼睛红肿及“茶色”尿液,如病菌入侵肾脏、肺和心脏可危及生命[2]。急性患者常因弥漫性肺出血(pulmonary diffuse hemorrhage,PHD)而死亡[3]。鼠和啮齿动物是其主要传染源,其他动物如猪、牛、羊、马、狼、蛇、蛙等均可成为传染源,但它们携带菌的情况和传染作用等因地而异[4-6]。钩体病是我国危害最大的鼠传疾病之一,其发病高峰时期患病人数多达10万,自1955年本病被列入法定报告传染病以来,全国累计报告已经几百万病例[7]。由于我国经济的快速发展,对外经济贸易和人口的往来日益频繁,这便加剧了钩体病等鼠传疾病在全球范围的传播。为了有效地控制钩体病的流行,必须加强宿主动物间钩体的流行病学监测。目前,实验室检测成为诊断钩体病的重要手段。由于直接镜检阳性检出率低,菌量过低时容易漏检,而且分离培养时间较长,容易被污染,因此,在钩体的早期诊断上具有一定的局限性。聚合酶链反应(PCR)技术具有特异性强和灵敏度高等特点,适用于大量标本的流行病学调查和钩体病的早期监测[8-9]。本研究使用荧光定量PCR和特异性PCR扩增两种方法,对江西口岸和国检监管区捕获的鼠类样本进行钩端螺旋体的检测,通过基因序列分析初步了解钩端螺旋体的种类,做好口岸风险评估,防止相应传染病在口岸的爆发与传播,保卫口岸安全。现将结果报告如下。
1 材料与方法
1.1实验材料
1.1.1鼠种类2015年7月至12月,从江西省2个一类口岸和9个国检监管区共捕获活鼠107只,鼠种组成和分布见表1。
表12015年7-12月在江西省口岸及国检监管区捕获的鼠种类及分布
Tab.1Species and distributions of the rats captured from Jiangxi Ports and supervision areas during July to December 2015
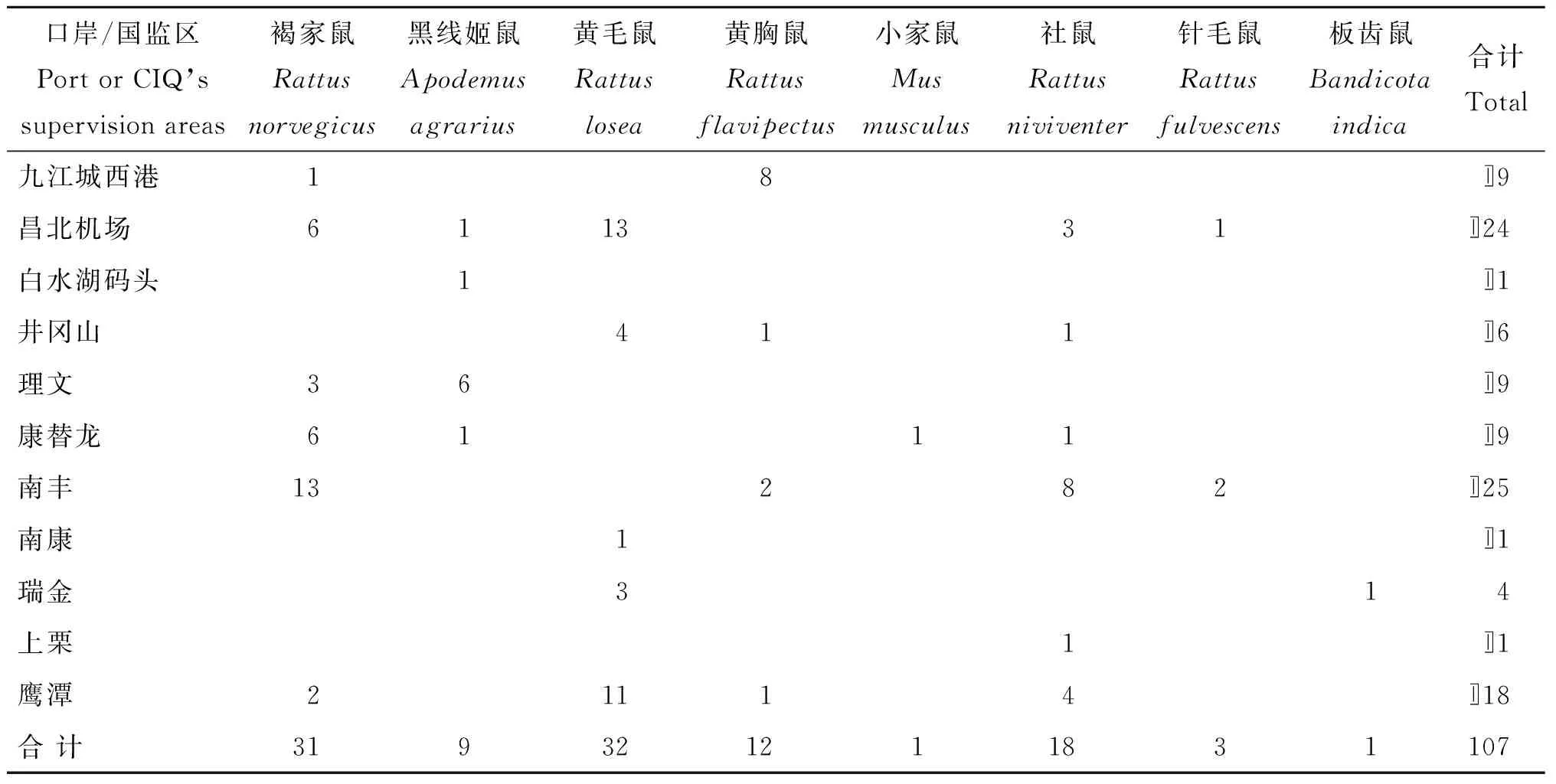
口岸/国监区PortorCIQ’ssupervisionareas褐家鼠Rattusnorvegicus黑线姬鼠Apodemusagrarius黄毛鼠Rattuslosea黄胸鼠Rattusflavipectus小家鼠Musmusculus社鼠Rattusniviventer针毛鼠Rattusfulvescens板齿鼠Bandicotaindica合计Total九江城西港18〛9昌北机场611331〛24白水湖码头1〛1井冈山411〛6理文36〛9康替龙6111〛9南丰13282〛25南康1〛1瑞金314上栗1〛1鹰潭21114〛18合计319321211831107
1.1.2试剂核酸提取试剂盒购自凯杰生物公司,荧光定量PCR检测试剂盒购自上海之江生物公司,Taq DNA酶Mix和100 bp DNA Marker 购自康为世纪生物公司;琼脂糖和染色剂购自上海生工生物公司。
1.1.3设备全自动核酸提取仪为凯杰QIAcube HT型号,生物样本匀质仪为奥盛公司Bioprep-24型号,荧光定量PCR仪为伯乐CFX96Touch型号,普通PCR仪为伯乐T100型号,凝胶成像系统为伯乐GelDoc XR系统。
1.2实验方法
1.2.1DNA的提取无菌条件下在生物安全柜内提取鼠肾组织50 mg左右,放入装有研磨珠和450 μL ATL裂解液的研磨管中,使用生物样品均质仪进行研磨匀浆,12 000 r/min离心2 min后,上机提取DNA。提取试剂采用凯杰公司的核酸提取试剂盒(货号:54161),按照说明书操作,提取出来的DNA放在-20 ℃冰箱保存。
1.2.2荧光定量PCR检测对提取出来的DNA首先用上海之江公司的钩端螺旋体核酸检测试剂盒进行病原体检测,按照说明书操作。
1.2.3特异性PCR扩增根据相关文献[10-11],合成钩端螺旋体sec Y和23S rRNA基因引物,对样本进行特异性扩增,引物见表2。反应体系为Taq酶 mix 12.5 μL,上游引物和下游引物各1 μL,DNA模板2 μL,最后加ddH2O补足到25 μL。反应条件是95 ℃,5 min,之后95 ℃ 30 s;55 ℃ 1 min;72 ℃ 1 min,反应35个循环,最后72 ℃ 10 min。PCR产物经1.5%琼脂糖凝胶电泳,出现特异性条带送生工公司测序。
表2钩端螺旋体特异性PCR扩增引物
Tab.2Two pairs of specific primers used to amplify Leptospira

引物Primers序列(5'→3')Sequence(5'→3')片段大小Length(bp)SecY-FCTGAATCGCTGTATAAAAGTSecY-RGGAAAACAAATGGTCGGAAG28523s-FGACCCGAAGCCTGTCGAG23s-RGCCATGCTTAGTCCCGATTAC484
1.2.4基因序列分析将得到的片段序列在NCBI-BLAST平台进行同源性比对,选择同源性接近的钩端螺旋体为代表株进行种系进化分析。利用Mega 6软件构建系统进化树。
2 结 果
2.1荧光定量PCR检测结果对107只鼠进行钩端螺旋体荧光检测,共发现12例阳性,总的阳性率为11.2%。其中,褐家鼠6只,在总捕获的褐家鼠中所占比重为19.4%;黄毛鼠3只,所占比重为9.4%;黄胸鼠1只,所占比重为8.3%;社鼠2只,所占比重为11.1%。阳性钩端螺旋体样本来源地分布见表3,荧光曲线见图1。
表3阳性钩端螺旋体样本来源地分布
Tab.3Distribution of the positive Leptospira

来源地Origin褐家鼠Rattusnorvegicus黄毛鼠Rattuslosea黄胸鼠Rattusflavipectus社鼠Rattusniviventer合计Total康替龙33南丰1124鹰潭11昌北机场123瑞金11合计631212
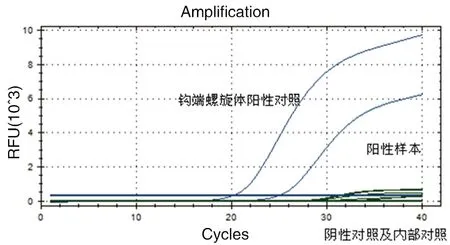
图1 荧光定量PCR检测结果图Fig.1 Results of fluorogenic quantitative PCR
2.2特异性PCR扩增结果对107只鼠肾组织样品进行sec Y基因和23S rRNA基因特异性扩增,结果与实时定量PCR结果一致,共发现12例阳性,扩增片段电泳检测与预期大小一致,见图2。

M: 100 bp Marker. 1: 23S rRNA negative control; 2: 23S rRNA positive specimen; 3: sec Y negative control; 4: sec Y positive specimen.图2 特异性PCR扩增结果Fig.2 Results of specific PCR
2.3基因进化树分析将测序所得的阳性样本序列在NCBI-BLAST平台进行同源性比对。建立基于sec Y基因和23S rRNA基因序列的系统进化树(图3,4)。结果显示,12例阳性样本中有11例为问号钩端螺旋体,其23S rRNA 基因与8株问号钩端螺旋体聚在一起,sec Y基因也与8株问号钩端螺旋体聚在一起;1例为博氏钩端螺旋体,其23S rRNA 基因与2株博氏钩端螺旋体聚在一起,sec Y基因与4株博氏钩端螺旋体聚在一起。两个基因片段得到的同源性对比结果一致。

The dots were the 12 cases of positive Leptospira.图3 钩端螺旋体sec Y基因系统进化树Fig.3 Phylogenic tree of Leptospira sec Y gene
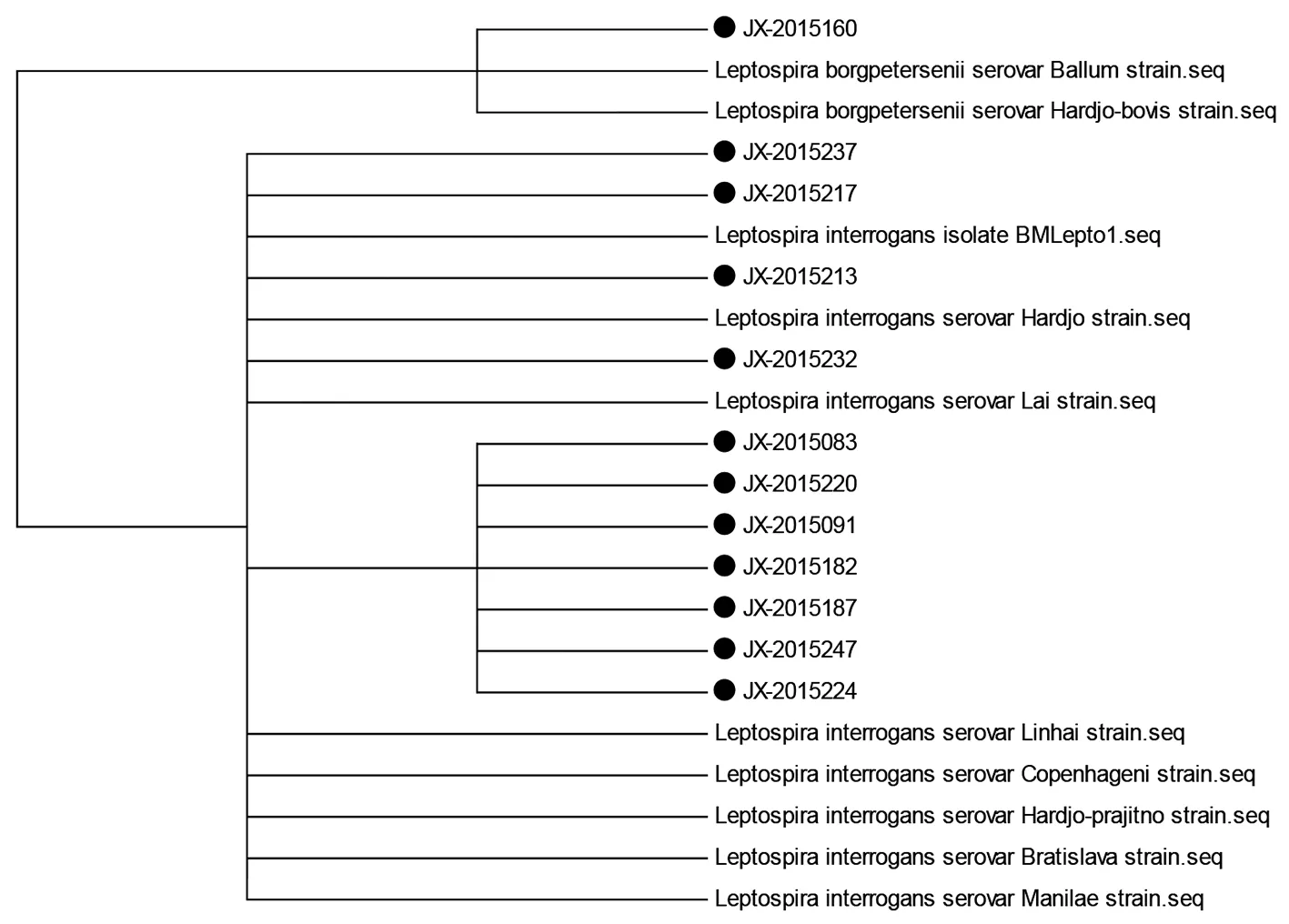
The dots were the 12 cases of positive Leptospira.图4 钩端螺旋体23S rRNA基因系统进化树Fig.4 Phylogenic tree of Leptospira 23S rRNA gene
3 讨 论
由致病性钩端螺旋体引起的钩端螺旋体病是一种人兽共患病,对动物和人类健康都产生重大的威胁。尽管目前还没有全球患病人数的精确统计,近期,WHO给出了一个估计数据,即每年将近500 000患有严重的钩端螺旋体病[12-13]。口岸及国检监管区作为出入境的特殊区域,其出入境人员相对复杂,环境相对特殊,因此,在这些区域对捕获的鼠类样品进行钩端螺旋体感染情况监测,不仅能够了解口岸区域钩体的传播规律,也能有效的防止钩端螺旋体病从口岸的传入和传出。目前,PCR检测方法,因其检测周期短,灵敏度高,已经普遍应用于实验室钩端螺旋体的检测[10,14]。本研究采用实时定量PCR方法和特异性PCR扩增方法对江西省2个口岸和9个国检监管区捕获的107只鼠肾样本进行了致病性钩端螺旋体的检测,共发现12例阳性,分别来自昌北机场、康替龙国检监管区、南丰国检监管区、鹰潭国检监管区和瑞金国检监管区,总的阳性率达11.2%。其中,褐家鼠阳性率最高,达所捕获褐家鼠总数的19.4%。其次是社鼠,阳性率为11.1%,黄毛鼠和黄胸鼠的阳性率也将近10%。就口岸而言,昌北机场口岸阳性率为12.5%(3/24),其他四个国检监管区的阳性率分别为康替龙国检监管区33.3%(3/9),瑞金国检监管区25%(1/4),南丰国检监管区16%(4/25),鹰潭国检监管区5.6%(1/18)。由此可以看出,在江西口岸及国检监管区鼠类携带的钩端螺旋体阳性率很高,因此有必要在这些阳性区域内实施必要的灭鼠防鼠措施,防治钩端螺旋体病在鼠与人类之间的传播,保障口岸安全。
两种PCR检测方法所得结果一致。荧光定量PCR检测精度高,周期短,操作简单,也有成品试剂盒可用于检测,适用于口岸一线对钩端螺旋体的快速检测;特异性PCR扩增方法可以特异性扩增钩端螺旋体的某个片段基因,阳性扩增产物经测序可以分析出钩端螺旋体的种类,适用于对钩端螺旋体血清型的进一步研究。本研究发现的12例钩端螺旋体经同源性对比和聚类分析,结果为11例问号钩端螺旋体和1例博氏钩端螺旋体。2个基因同源性对比结果一致。其中,博氏钩端螺旋体来自鹰潭国检监管区,其他问号钩端螺旋体则来自其他4个口岸及国检监管区。说明江西口岸及国检监管区鼠类感染的钩端螺旋体为问号钩端螺旋体和博氏钩端螺旋体。
[1] Xu J, Guo XK, Jiang SC. Advances of the research on pathogenesis of Leptospira[J]. Inter J Epidemiol Infect Dis, 2006, 33(3): 167-170. (in Chinese)
徐静,郭晓奎,姜叙诚. 钩端螺旋体致病机制的研究进展[J].国际流行病学传染病学杂志,2006,33(3):167-170.
[2] Feng YF, Xing J, Gong W, et al. Investigation ofLeptospirainfection in three new experimental animals by PCR methods[J]. Chin J Comp Med, 2014, 24(8): 31-35. (in Chinese)
冯育芳,邢进,巩薇,等.应用PCR方法对3种新型实验动物钩端螺旋体感染情况的调查研究[J].中国比较医学杂志,2014,24(8):31-35.
[3] Kobayashi Y. Human leptospirosis: management and prognosis[J]. J Postgrad Med, 2005, 51(3): 201-204.
[4] Li ZL, Sun JM, Jiang LP, et al. Application of InvA-PCR in leptospirosis detection in Pan′an[J]. Chin J Hlth Lab Technol, 2012, 22(10): 2360-2363. (in Chinese)
李钟梁,孙继明,姜理平,等. InvA-PCR应用于磐安县钩端螺旋体病检测的研究[J].中国卫生检验杂志, 2012, 22(10):2360-2363.
[5] Smythe LD, Smith IL, Smith GA, et al. A quantitative PCR (TaqMan) assay for pathogenicLeptospiraspp[J]. BMC Infect Dis, 2002, 2: 13.
[6] Anne MS, Jens AH, Sabrina S, et al.Leptospiraspp. in rodents and shrews in Germany[J]. Int J Environ Res Public Hlth, 2014, 11: 7562-7574.
[7] Jiang LP, Meng Z, Cheng SY, et al. Development and application of a PCR method for detection ofLeptospirain Zhejiang Province[J]. Chin J Hlth Lab Technol, 2007, 17(8): 1392-1394. (in Chinese)
姜理平,孟真,程苏云,等. 浙江省钩端螺旋体PCR检测方法建立与应用[J].中国卫生检验杂志, 2007, 17(8): 1392-1394.
[8] Yan SP, Liu FQ, Chen LZ. Research progress of PCR detection technology of leptospirosis[J]. Chin J Nat Med, 2009, 11(4): 313-316. (in Chinese)
颜仕鹏,刘富强,陈立章.钩端螺旋体病PCR检测技术的研究进展[J].中国自然医学杂志, 2009, 11(4): 313-316.
[9] Lei JB, Wang LH, Zhang Y, et al. Analysis ofLeptospiradetection using two kinds of PCR[J]. Chin J Hlth Lab Technol, 2008, 18(6) :1209-1210. (in Chinese)
雷金宝,王黎洪,张英,等. 二种PCR检测方法应用于钩端螺旋体检测结果分析[J].中国卫生检验杂志,2008,18(6):1209-1210.
[10] Hu Q, Ma SJ, Zou CY, et al. Detection and phylogenetic analysis ofLeptospiraspp. carried by rodents[J]. J Pathog Biol, 2015, 10(5): 427-429. (in Chinese)
胡群,马思杰,邹春颖,等.鼠类感染钩端螺旋体的PCR检测和基因序列分析[J].中国病原生物学杂志, 2015, 10(5):427-429.
[11] Jin WE, Jiang LP, Chen XF. Development and application of PCR detection forLeptospirain Quzhou[J]. Dis Surveill, 2007, 22(11): 726-729. (in Chinese)
金莞尔,姜理平,陈旭富.浙江省衢州市应用聚合酶链反应检测钩端螺旋体效果评价[J]. 疾病监测, 2007, 22(11):726-729.
[12] Abela RB, Sikkema R, Hartskeerl RA. Estimating the burden of human leptospirosis[J]. Int J Antimicrob Agents, 2010, 36 (Suppl 1): S5-S7.
[13] Jason SL, Michael AM, Joseph M V, et al. Leptospiral pathogenomics[J]. Pathogens, 2014, 3: 280-308.
[14] Tan ZM, Tang FY, Zhou L. Rapid detection of pathogenicLeptospiraspp. by quantitative real-time PCR[J]. Chin J Hlth Lab Technol, 2011, 21(7): 1701-1702. (in Chinese)
谈忠鸣,汤奋扬,周璐. Real-time PCR快速检测钩端螺旋体方法的建立[J].中国卫生检验杂志,2011,21(7):1701-1702.
Detection and sequencing analysis ofLeptospiracarried by rats from Jiangxi Port and Entry-Exit Inspection and Quarantine Bureau’s supervision areas
ZHAO Ming-hui, XU Tie-long, ZHANG Qiang, HU Ting,WANG Jian-jun, LIU Kai-ming, LIAO Yun
(JiangxiInternationalTravelHealthcareCenter,Nanchang330002,China)
To detect theLeptospiracarried by rats in Jiangxi Ports and Entry-Exit Inspection and Quarantine Bureau’s (CIQ) supervision areas, rats captured from 2 ports and 9 supervision areas of Jiangxi were tested during July to December, 2015. Fluorescent quantitative PCR and specificity PCR amplification were used to test the samples. There were 12 positive cases ofLeptospiraamong the 107 rats (11.2%), including 6 cases ofRattusnorvegicus, 3 cases ofRattuslosea, 1 case ofRattusflavipectusand 2 cases ofRattusniviventer, which were captured from Changbei airport, Kangtilong, Nanfeng, Yingtan and Ruijin CIQ’s supervision areas. Homology comparison and phylogenetic analysis showed that there were 11 cases ofLeptospirainterrogansand 1 case ofLeptospiraborgpetersenii. Therefore, the study could confirm the existence ofLeptospirainterrogansandLeptospiraborgpeterseniiin Jiangxi Ports and CIQ’s supervision areas. And those two kinds of PCR detection methods could be applied to theLeptospiradetection in ports and supervision areas.
port; entry-exit inspection and quarantine bureau’s supervision areas; rats;Leptospira
Liao Yun, Email: zhihan1214@sina.com
廖芸, Email:zhihan1214@sina.com
江西国际旅行卫生保健中心,南昌330002
R377.5
B
1002-2694(2016)07-0674-05
2016-01-07;
2016-04-11
DOI:10.3969/j.issn.1002-2694.2016.07.017

