Helicobacter suis感染小鼠模型的建立及其意义
杨若明,杨 林,田字彬,于亚男,毛 涛,李晓宇,张帅庆
Helicobacter suis感染小鼠模型的建立及其意义
杨若明,杨林,田字彬,于亚男,毛涛,李晓宇,张帅庆
目的建立Helicobactersuis(H.suis)感染小鼠模型并探究其意义。方法将40只雌性C57BL/6小鼠随机分为模型组和对照组,模型组给予0.5 mL猪胃黏膜匀浆液(经PCR检测确定存在H.suis)灌胃,对照组给予0.5 mL PBS溶液灌胃。灌胃1个月及3个月后,各处死两组中半数小鼠,取其胃黏膜组织,分别行PCR、HE染色检测H.suis在小鼠胃内的定植与胃黏膜淋巴滤泡形成情况。结果灌胃所用猪胃黏膜匀浆液中存在H.suis;H.suis可以在小鼠胃内定植,并且3个月后仍存在;感染H.suis1个月及3个月后的小鼠胃黏膜均有淋巴滤泡的形成,并且后者的淋巴滤泡较前者明显增大。结论成功建立了H.suis感染C57BL/6小鼠模型,H.suis可以诱导胃黏膜淋巴滤泡的形成,可能在胃黏膜相关淋巴组织(MALT)淋巴瘤的发生过程中发挥重要作用。
H.suis;猪胃;动物模型;淋巴滤泡
Supported by the National Natural Science Foundation of China (No. 81572320)
海尔曼螺杆菌(Helicobacterheilmannii,Hh)是除幽门螺杆菌(Helicobacterpylori,H.pylori)外最常见的定植于人类胃黏膜的螺旋杆菌,通过16Sr RNA基因序列分析可将其分为两型[1]:其中感染人类的大部分为1型(约占78.5%),为单独的菌种,与猪胃黏膜中分离得到的猪螺杆菌(Helicobactersuis,H.suis)有高度的同源性,可视为同一菌种[2];2型代表了定植于猫与犬胃内的一组细菌,包括H.felis,H.bizzozeronii,H.salomonis,H.cynogastricus,H.baculiformis和H.heilmanniisp.nov等。H.suis能自然定植于人和诸多动物胃内并具有致病性,为人兽共患病病原菌。国外研究已发现,来源于食蟹猴胃内的H.suis可稳定定植于小鼠胃内,感染6个月后可使绝大多数小鼠胃中出现MALT淋巴瘤特征性的淋巴上皮病变(lymphoepithelial lesion, LEL)[3]。因此H.suis可作为H.pylori研究的替代工具,用于阐明螺杆菌与特异宿主之间的相互作用关系,为研究胃MALT淋巴瘤的发病机制提供了一个重要途径。由于H.suis在猪胃中的自然感染率较高(可达60%以上)[2,4],且该菌在体外生长环境特殊,营养要求高,难以稳定培养,因此本研究拟从自然感染的猪胃中获得H.suis并感染小鼠建立动物模型,为螺杆菌致病机制的研究提供理论基础。
1 材料和方法
1.1实验动物8周龄雌性SPF级C57BL/6野生型小鼠40只,体质量约18~20 g,购自济南朋悦实验动物繁育有限公司,饲养于青岛大学附属医院动物实验室(SPF级),温度20 ~22 ℃,湿度60%~70%,每日照明12 h(8∶00-20∶00),饲料及饮水均经高温高压灭菌处理。
1.2细菌的获取10只猪胃购自青岛市某屠宰场,用无菌大剪刀沿胃大弯剪开,以自来水仔细冲洗干净后,用无菌载玻片分别刮取10只猪胃充血发红炎性病变区域的粘液层及表层胃黏膜组织,然后各自收集于无菌离心管中,再加入适量无菌磷酸盐缓冲液(phosphate buffer saline, PBS),充分研磨匀浆后各自定容为2.0 mL备用。
1.3主要试剂组织DNA提取试剂盒购自北京天根生化科技有限公司,PCR相关试剂购自大连宝生物工程有限公司。
1.4猪胃中H.suis的检测各自取10只猪胃黏膜匀浆液0.5 mL置于1.5 mL离心管中,用组织DNA提取试剂盒提取总DNA(提取方法参照说明书)。PCR引物序列见表1,由上海生工生物工程股份有限公司合成。采用25 μL反应体系,每管依次加入Premix Tap酶12.5 μL、无菌双蒸水8.5 μL、dNTP 2.0 μL及上下游引物各1.0 μL。H.suis16S rRNA引物、H.pylori16S rRNA引物及螺杆菌多重引物分别用于特异性检测H.suis、H.pylori及其他常见螺杆菌 (H.felis,H.bizzozeronii和H.Salomonis)的存在。94 ℃预变性2 min后,以下条件PCR扩增:94 ℃ 2 min,55 ℃ 30 s,72 ℃ 1 min,35个循环,72 ℃再延伸1 min。PCR反应阳性对照以已经鉴定为H.suis的DNA为模板,空白对照以无菌双蒸水替代模板。然后用2%琼脂糖凝胶电泳检测PCR产物,确定H.suis及其他主要螺杆菌的存在情况。
表1本研究中所用的PCR引物和扩增产物大小
Tab.1PCR primers used in this study and the PCR product sizes

TargetgenesPrimersequencesAmplifiedproductlength(bp)H.suis-16SrRNA433Forward5'-TTGGGAGGCTTTGTCTTTCCA-3'Reverse5'-GATTAGCTCTGCCTCGCGGCT-3'H.pylori-16SrRNA119Forward5'-TGCGAAGTGGAGCCAATCTT-3'Reverse5'-GGAACGTATTCACCGCAACA-3'H.felis,H.bizzozeroniiandH.salomonis16SrRNA73Forward5'-TGCGTAGGCGGGGTTGTAAG-3'Reverse5'-CAGAGTTGTAGTTTCAAATGC-3'
1.5感染模型构建C57BL/6小鼠随机分为模型组和对照组,每组各20只。小鼠先适应性喂养1周,禁食禁水4 h。将6只经PCR检测证明存在H.suis的猪胃黏膜匀浆液混匀后,给予模型组每只小鼠0.5 mL猪胃黏膜匀浆液灌胃,对照组每只小鼠接受0.5 mL无菌PBS溶液灌胃,灌胃后禁食禁水4 h。
1.6小鼠胃组织的处理 各组小鼠灌胃1个月及3个月后,分别处死半数小鼠,取全胃沿胃大弯剪开,以无菌PBS溶液冲洗胃内容物;取一半胃组织刮取黏膜层用于提取DNA行PCR反应。另一半胃组织经10%甲醛固定后石蜡包埋,10 μm连续切片,行苏木精-伊红(HE)染色后检测小鼠胃黏膜淋巴滤泡形成情况。
2 结 果
2.1猪胃黏膜中H.suis的存在情况分别从10只猪胃黏膜匀浆液中提取DNA,以H.suis特异性16S rRNA引物行PCR,其中6只猪胃可扩增出433 bp的目的条带,其余4只猪胃及空白对照组的检测结果为阴性,未扩增出相应条带(见图1)。以H.pylori特异性16S rRNA引物和其他螺杆菌 (H.Felis,H.bizzozeronii和H.Salomonis) 多重引物及无菌双蒸水行空白对照检测,其结果均为阴性,未扩增出相应条带。以上结果表明用于建立感染模型的猪胃中只存在H.suis这一常见的致病性螺杆菌。本实验中H.suis在猪胃中的感染率高达60%,与相关文献报道基本一致[2,4]。

H. suis 16S rRNA gene by PCR amplification; M: DNA marker; 1: Positive control, H. suis; 2,3,4,5,6,7,8,9,10,11: pig gastric mucosa; 12: blank control, Sterile double distilled water. 图1 10只猪胃黏膜中H. suis的鉴定结果Fig.1 Identification of H. suis in pig gastric mucosa
2.2小鼠胃黏膜中H.suis定植情况造模组小鼠接受猪胃黏膜匀浆液灌胃1个月与3个月后,分别取胃黏膜匀浆提取DNA,以H.suis特异性16S rRNA引物行PCR,均能扩增出约433 bp的目的条带。以H.pylori特异性16S rRNA引物和其他螺杆菌 (H.felis,H.bizzozeronii和H.Salomonis) 多重引物及无菌双蒸水行空白对照检测,其结果均为阴性,未扩增出相应条带(图2、3)。表明来源于猪黏膜的H.suis可在小鼠胃内定植,3个月后仍稳定存在,未被清除。
2.3小鼠胃黏膜病理组织学变化小鼠感染H.suis1个月及3个月后,其胃黏膜中均检测到淋巴滤泡形成,且3个月时淋巴滤泡的大小较1个月时明显增大。而对照组未检测到胃淋巴滤泡的形成 (图4)。
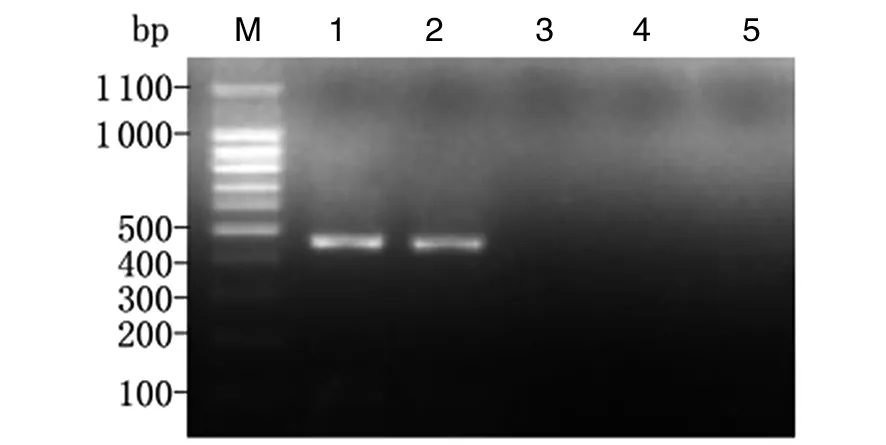
1, 2: H. suis 16S rRNA gene by PCR amplification; 3: H. pylori 16S rRNA gene by PCR amplification; 4: H. felis, H. bizzozeronii and H. salomonis special 16S rRNA gene by PCR amplification. M: DNA marker; 1: Positive control, H. suis; 2,3,4: mice gastric mucosa; 5: blank control, sterile double distilled water.图2 感染H. suis 1个月后小鼠胃黏膜中H. suis的鉴定结果Fig.2 Identification of H. suis in the gastric mucosa of mice at 1 month postinfection
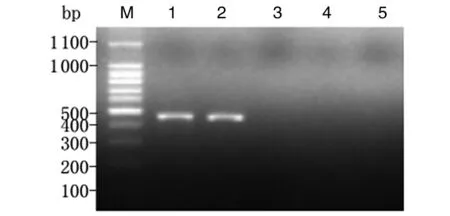
1, 2: H. suis 16S rRNA gene by PCR amplification; 3: H. pylori 16S rRNA gene by PCR amplification; 4: H. felis, H. bizzozeronii and H. salomonis special 16S rRNA gene by PCR amplification. M: DNA marker; 1: Positive control, H. suis; 2, 3, 4: mice gastric mucosa; 5: blank control, sterile double distilled water.图3 感染H.suis 3个月后小鼠胃黏膜中H. suis的鉴定结果Fig.3 Identification of H. suis in the gastric mucosa of mice at 3 months after H. suis infection
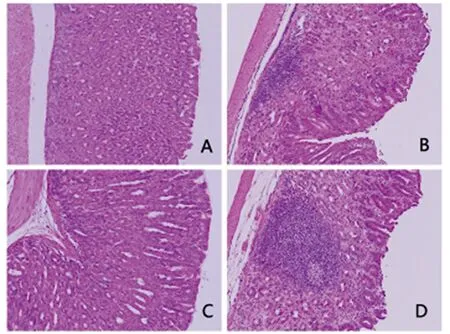
A: control group at 1 month after PBS solution treatment;B: model group at 1 month after H. suis infection;C: control group at 3 months after PBS solution treatment;D: model group at 3 months after H. suis infection.图4 各组小鼠胃黏膜组织病理学表现(HE 染色,×200)Fig.4 Pathological changes in the gastric mucosa of mice in each group (HE staining, ×200)
3 讨 论
H.pylori感染与慢性胃炎、消化性溃疡、胃癌以及胃MALT淋巴瘤的发病密切相关[5]。为了探究其发病机制,国内外学者对H.pylori感染动物模型进行了大量的研究,但未经改良的H.pylori菌株难以长期定植于动物胃内,极大阻碍了H.pylori发病机制的进一步研究。Kim等人研究发现感染H.pylori80周的小鼠只是诱导出增生性胃炎、慢性萎缩性胃炎等癌前病变,并未出现胃癌[6],这说明单纯H.pylori感染致癌的周期可能很长。而作为胃内的第2种螺杆菌,H.suis可稳定定植于小鼠胃内,较H.pylori更适用于胃MALT淋巴瘤发病机制的研究。H.suis感染后诱发的胃黏膜免疫反应以Th1为主[7],而Th1型免疫反应在C57BL/6小鼠中占优势,且此类小鼠其遗传背景明确、个体差异小、价格便宜、操作简单,各种处理因素容易控制,故本实验选用C57BL/6小鼠为造模对象。
既往国内外大部分海尔曼螺杆菌的研究都集中于个案报道和流行病学调查。有学者报道经胃镜检查可从患者胃粘膜活检标本中获得海尔曼螺杆菌,进而感染小鼠建立模型。但由于海尔曼螺杆菌(Hh)在人群中感染率较低(我国约为5%~11%)[8],因此通过内镜获取该菌较为困难。另外,Hh有着广泛的动物宿主,目前在猪、犬、猫、鼠、雪貂及包括人类的灵长类动物胃内均可检测出Hh[9]。感染者多与家畜与宠物,如猪、犬、猫等有密切接触史,这些动物可作为Hh传播的贮存库,人类与其直接接触是导致感染Hh的危险因素[10-11]。有研究报道屠宰后的猪胃中60%以上可检测到H.suis[2,4],其在生猪肉中可持续存活48 h以上,而在水中可存活4 d以上,因此接触被污染的生猪肉及水源可能也是感染H.suis的途径[12],猪胃有望成为获取该菌的重要来源。相关报道表明采用PCR法检测H.suis16S rRNA证实该菌存在的敏感性和特异性均优于免疫组化、尿素酶试验及姬姆萨染色等方法[13],本实验采用PCR法在大部分猪胃及感染后 1个月与3个月的小鼠胃粘膜中均检测到H.suis的存在,表明H.suis在猪胃中自然感染率较高,且未合并其他常见致病性螺杆菌的感染。H.suis可长期稳定定植于小鼠胃内,保证了建立小鼠感染模型的可行性。
螺杆菌感染胃黏膜后可激活上皮细胞和固有免疫细胞,诱导炎症因子的产生,作用于间质细胞使其分泌趋化因子,募集淋巴细胞形成获得性的MALT。H.suis可以直接引起慢性炎症,也可以通过驱动胃上皮细胞坏死,导致细胞内容物的释放,进而间接促进炎症[14]。慢性炎症的长期刺激可导致淋巴细胞的克隆生长,形成以B细胞为主的MALT淋巴瘤[15]。在人类,H.suis主要定植于胃窦部, 位于黏液层、上皮细胞表面和胃小凹深部;而在本研究中我们发现,感染H.suis1个月后,小鼠胃窦粘膜层及粘膜下层有大量淋巴细胞聚集,形成了淋巴滤泡,且其大小随着感染时间的延长而增加,说明该模型可模拟人类感染H.suis后的病理变化。目前胃MALT淋巴瘤的发病率有逐年增高的趋势,深入研究Helicobacter感染后MALT形成的机制并进行相应的干预,对预防胃MALT淋巴瘤的发生具有重要意义。
综上所述,H.suis感染C57BL/6小鼠模型的建立可成功诱导胃黏膜淋巴滤泡的形成,为我们进一步研究胃MALT淋巴瘤的发病机制奠定了基础。虽然既往有H.suis分离成功的个例报道[16],但多数学者在相同条件下重复试验均告失败,无法进行鉴定。故目前认为H.suis在体外难以稳定培养;本研究所用的细菌也来自猪胃,未经纯化。因此,为更好的研究H.suis在消化系统疾病中的具体致病机理,成功体外分离培养该菌并获取纯化菌株是今后努力的方向。
[1] O’Rourke JL, Solnick JV, Neilan BA, et al. Description of ‘CandidatusHelicobacterheilmannii’ based on DNA sequence analysis of 16S rRNA and urease genes[J].Int J Syst Evol Microbiol, 2004, 54(Pt 6): 2203-2211. DOI: 10.1099/ijs.0.63117-0
[2] De Groote D, van Doorn LJ, Ducatelle R, et al. ‘CandidatusHelicobactersuis’, a gastric helicobacter from pigs, and its phylogenetic relatedness to other gastrospirilla[J].Int J Syst Bacteriol, 1999, 49(Pt 4): 1769-1777.
[3] Nakamura M, Murayama SY, Serizawa H, et al. “CandidatusHelicobacterheilmannii” from a cynomolgus monkey induces gastric mucosa-associated lymphoid tissue lymphomas in C57BL/6 mice[J]. Infect Immun, 2007, 75(3): 1214-1222. DOI: 10.1128/ial.01459-06
[4] Baele M, Decostere A, Vandamme P, et al. Isolation and characterization ofHelicobactersuissp. nov. from pig stomachs[J]. Int J Syst Evol Microbiol, 2008, 58(6): 1350-1358. DOI: 10.1099/ijs.0.65133-0
[5] Ahn HJ, Lee DS.Helicobacterpyloriin gastric carcinogenesis[J]. World J Gastrointest Oncol, 2015, 7(12): 455-465. DOI: 10.4251/wjgo.v7.i12.455
[6] Kim DH, Kim SW, Song YJ, et al. Long-term evaluation of mice model infected withHelicobacterpylori: focus on gastric pathology including gastric cancer[J]. Aliment Pharmacol Ther, 2003, 18(Suppl 1): 14-23. DOI: 10.1046/j.1365-2036.18.s1.4.x
[7] Mimura T, Yoshida M, Nishiumi S, et al. IFN-γ plays an essential role in the pathogenesis of gastric lymphoid follicles formation caused byHelicobactersuisinfection[J]. Fems Immunol Med Mic, 2011, 63(1): 25-34. DOI: 10.1111/j.1574-695x.2011.00823.x
[8] Liu J, He L, Haesebrouck F, et al. Prevalence of coinfection with gastric non-HelicobacterpyloriHelicobacter(NHPH) species inHelicobacterpylori-infected patients suffering from gastric disease in Beijing, China[J]. Helicobacter, 2015, 20(4): 284-290. DOI: 10.1111/hel.12201
[9] Haesebrouck F, Pasmans F, Flahou B, et al. Gastric helicobacters in domestic animals and nonhuman primates and their significance for human health[J].Clin Microbiol Rev, 2009, 22(2): 202-223. DOI:10.1128/cmr.00041-08
[10] van Loon S, Bart A, den Hertog EJ, et al.Helicobacterheilmanniigastritis caused by cat to child transmission[J]. J Pediatr Gastroenterol Nutr, 2003, 36(3): 407-409. DOI:10.1097/00005176-200303000-00021
[11] Svec A, Kordas P, Pavlis Z, et al. High prevalence ofHelicobacterheilmannii-associated gastritis in a small, predominantly rural area: further evidence in support of a zoonosis?[J]. Scand J Gastroenterol, 2000, 35(9): 925-928. DOI:10.1080/003655200750022968
[12] De Cooman L, Flahou B, Houf K, et al. Survival ofHelicobactersuisbacteria in retail pig meat[J]. Int J Food Microbiol, 2013, 166(1): 164-167. DOI:10.1016/j.ijfoodmicro.2013.05.020
[13] Groote DD, Ducatelle R, Van Doorn LJ, et al. Detection of “CandidatusHelicobactersuis” in gastric samples of pigs by PCR: comparison with other invasive diagnostic techniques[J]. J Clin Microbiol, 2000, 38(3): 1131-1135.
[14] Flahou B, Haesebrouck F, Pasmans F, et al.Helicobactersuiscauses severe gastric pathology in mouse and Mongolian gerbil models of human gastric disease[J]. PLoS ONE, 2010, 5(11): e14083-e14083. DOI: 10.1371/journal.pone.0014083
[15] Randall TD, Mebius RE. The development and function of mucosal lymphoid tissues: a balancing act with micro-organisms[J]. Mucosal Immunol, 2014, 7(3): 455-466. DOI: 10.1038/mi.2014.11
[16] Joosten M, Blaecher C, Flahou B, et al. Diversity in bacterium-host interactions within the speciesHelicobacterheilmanniisensu stricto[J]. Vet Res, 2013, 44(1): 65-75. DOI: 10.1186/1297-9716-44-65
Establishment of mice model withHelicobactersuisinfection and its significance
YANG Ruo-ming, YANG Lin, TIAN Zi-bin, YU Ya-nan,MAO Tao, LI Xiao-yu, ZHANG Shuai-qing
(DepartmentofGastroenterology,theAffiliatedHospitalofQingdaoUniversity,Qingdao266003,China)
The aim of this study was to establish mice model withHelicobactersuis(H.suis) infection and explore its significance. A total of 40 female C57BL/6 mice were randomly divided into model group and control group. The mice in model group were given 0.5 mL pig gastric mucosal homogenates containingH.suisby gavage, while the mice in control group were given the same amount of PBS. After 1 month and 3 months, half of each group were randomly sacrificed and their gastric mucosa were taken out for PCR and HE staining respectively to detect theH.suiscolonization and the formation of lymphoid follicles in the stomach. Results showed thatH.suisexisted in pig gastric mucosal homogenates used for gavage and could colonize in the stomach of mice, which also existed at 3 months postinfection. The formation of gastric lymphoid follicles was detected in the stomachs of mice at 1 month and 3 months afterH.suisformation, and the size of follicles at 3 months postinfection increased significantly compared with that at 1 month postinfection. In conclusion, a mouse model ofH.suisinfection was established successfully.H.suisinfection can induce the formation of lymphatic follicles in C57BL/6 mice. Therefore it may play an important role in the development of gastric mucosa-associated lymphoid tissue (MALT) Lymphoma.
H.suis; pig stomach; mice model; lymphoid follicles
Yang Lin, Email: bobotony@126.com
杨林,Email:bobotony@126.com
青岛大学附属医院消化内科,青岛266003
R378
A
1002-2694(2016)07-0604-04
2016-02-24;
2016-06-19
DOI:10.3969/j.issn.1002-2694.2016.07.003
国家自然科学基金面上项目(No. 81572320)资助

