O3∶K6血清型副溶血性弧菌三重PCR检测方法的建立
张云怡,梅玲玲,张俊彦,占 利,陈建才,陈鸿鹄,张 政,杨 勇
O3∶K6血清型副溶血性弧菌三重PCR检测方法的建立
张云怡,梅玲玲,张俊彦,占利,陈建才,陈鸿鹄,张政,杨勇
目的建立副溶血性弧菌O3∶K6血清型三重PCR检测方法。方法基于副溶血性弧菌种特异性基因toxR, O3血清群特异性基因vp0209,K6血清型特异性基因vp0230,建立O3∶K6血清型副溶血性弧菌三重PCR检测方法。对该方法的检测特异性和灵敏度进行分析。结果与结论该方法对O3∶K6血清型副溶血性弧菌具有很好的检测特异性,灵敏度可以达到102CFU/PCR反应体系。
副溶血性弧菌;O3∶K6血清型;三重PCR
副溶血性弧菌为革兰氏阴性杆菌或稍弯曲弧菌,主要存在于近海的海水、海底沉积物和鱼类、贝类等海产品中。自1950年被发现以来,该菌已经成为世界范围内因食用污染海产品而导致食物中毒的最主要的致病菌[1-2]。感染患者有腹泻、腹痛、恶心、发烧等典型胃肠炎和食物中毒症状[3]。在我国沿海地区,副溶血性弧菌引起的食源性疾病暴发在全部食源性疾病暴发中已占首位[4]。
副溶血性弧菌属于典型的多血清型致病菌,1996年在印度爆发了大规模副溶血性弧菌感染引发的流行病事件,并且迅速传播到了亚洲、南美洲、北美洲、非洲和欧洲的多个国家,波及上万民众。其中50%的临床分离株属于O3∶K6 血清型[5-6]。在全球传播过程中,O3∶K6 血清型快速进化出20多种衍生血清型(包括O4∶K68, O1∶K25,O1∶KUT等)。此后的研究发现副溶血性弧菌的某些血清型在临床和环境分离株中都存在,而某些血清型目前发现只存在于环境分离株中,说明某些血清型菌株与人类疾病的相关性更强[7],在我国的副溶血性弧菌临床分离株中,O3∶K6和O4∶K8血清型菌株占据主导地位。目前,副溶血性弧菌的血清学分型方法是使用O-抗原和K-抗原的特异性抗血清和菌体进行玻片凝集反应,但存在交叉凝集反应,菌株血清型难以判断;检测O血清群时,需通过高温高压去除胞外荚膜,过程繁琐耗时;某些分离菌株经过多次荚膜处理仍不能正常凝集,因此无法判断其O血清群;临床分离株中常有K抗原生长不良的现象,也会导致无法凝集分型等问题。在本文中,我们建立了O3∶K6血清型的三重PCR检测方法。该方法不需要荚膜处理过程;基于检测对象为核酸,可以避免因K抗原生长不良而导致的K抗原无法检出的问题,是玻片凝集检测法的有效补充。
1 材 料
1.1菌株本文中所使用的标准菌株:EscherichiacoliATCC25922、PseudomonasaeruginosaATCC27853、StaphylococcusaureusATCC25923、ListeriamonocytogenesCMCC54006、VibriovulnificusATCC27526、Salmonellaenteritidis ATCC50041,ShigellaflexneriATCC12022、BacilluscereusATCC11778。不同血清型的副溶血性弧菌分离菌株V.parahemolyticuszj12W297(O1∶K20)、V.parahemolyticuszj12W269(O1∶K25)、V.parahemolyticuszj12W211(O1∶K26)、V.parahemolyticuszj12W239(O1∶K32)、V.parahemolyticuszj11W202(O1∶K38)、V.parahemolyticuszj12W238(O2∶K3)、V.parahemolyticuszj12W210(O2∶K28)、V.parahemolyticuszj12Y73(O3∶K5)、V.parahemolyticuszj12W06(O3∶K6)、V.parahemolyticuszj13Y174(O3∶K29)、V.parahemolyticuszj13W113(O3∶K33)、V.parahemolyticuszj12W68(O3∶K54)、V.parahemolyticuszj12W176(O3∶K56)、V.parahemolyticuszj12Y74(O4∶K8)、V.parahemolyticuszj12W219(O4∶K34)、V.parahemolyticuszj13W14(O4∶K42)、V.parahemolyticuszj12Y6(O4∶K68)、V.parahemolyticuszj13W118(O5∶K17)、V.parahemolyticuszj12W107(O5∶K30)、V.parahemolyticuszj12W134(O6∶K46)、V.parahemolyticuszj13W16(O7∶KUT)、V.parahemolyticuszj12W225(O8∶KUT)、V.parahemolyticuszj11W211(O9∶KUT)、V.parahemolyticuszj13W27(O10∶K24)、V.parahemolyticuszj12W155(O11∶KUT)均为本实验室保存菌株。
2 方 法
2.1DNA提取和多重PCRDNA模板使用热裂解方法提取。多重PCR扩增引物:vp-0209 F:GCATCAACCCCATTTCAACTT,vp-0209 R:TTCCATACTTGGGTTGAGTTTTC;vp-toxR F: GTCTTCTGACGCAATCGTTG,vp-toxR R: ATACGAGTGGTTGCTGTCATG;vp-0230 F: TCCTGTTGTGATAAAGTTGGCATT,vp-0230 R: CCGAATCAAGAACTAACCCACA。引物委托上海生物工程有限公司合成。PCR扩增使用TaKaRa TaqTM(TaKaRa,China)体系:Taq 酶 0.625U,10 × PCR缓冲液 2.5 μL, MgCl2溶液1.5 mmol/L,d NTP混合液各0.2 mmol/L,上下游引物各0.4 μmol/L,DNA模板2 μL,无菌去离子水补足至25 μL。反应条件为: 95 ℃,2 min; 95 ℃,30 s;56 ℃,30 s;72 ℃,1 min;30个循环。PCR产物使用1%(w/v)琼脂糖凝胶电泳进行分离,使用Bio-Rad ChemiDoc MP凝胶成像系统(Bio-Rad,USA)进行图像分析。根据电泳条带判断结果,若观察到3个目的条带(vp0209: 240 bp、toxR: 368 bp、 vp0230:623 bp),则待测样品为O3∶K6血清型副溶血性弧菌,若观察到vp0209、toxR 两个基因扩增条带,则待测样品为O3血清群副溶血性弧菌,若观察到toxR单个条带,则待测样品为未知血清型副溶血性弧菌,若无任何条带则不是副溶血性弧菌。
2.2检测特异性分析选择大肠埃希氏菌、铜绿假单胞菌、金黄色葡萄球菌、单增李斯特菌、创伤弧菌、沙门氏菌,志贺氏菌、蜡样芽孢杆菌标准菌株,不同血清型副溶血性弧菌菌株进行三重PCR方法检测特异性分析,上述菌株信息见材料和方法1部分。
2.3检测灵敏度分析副溶血性弧菌zj2012W6菌株(O3∶K6)接种至营养琼脂培养基上,37 ℃过夜培养,取适量菌重悬于生理盐水中制成菌悬液,使用平板浇注法进行菌落计数,根据菌落计数结果,将菌悬液分别稀释至105、104、103、102、10CFU/ PCR反应体系。分别进行多重PCR反应,确定该多重PCR检测方法的灵敏度。
2.4多重PCR对副溶血性弧菌食源性和临床分离菌株的检测使用该多重PCR检测方法对2011-2013年浙江省各地收集的食源性和临床分离的50株O3∶K6血清型副溶血性弧菌菌株和50株非O3∶K6血清型副溶血性弧菌菌株进行检测。
3 结 果
3.1vp0209、vp0230基因特异性分析vp0209、vp0230在副溶血性弧菌中均为糖基转移酶编码基因,在以不同血清型副溶血性弧菌DNA为模版进行PCR扩增过程中,vp0209、vp0230基因分别表现出O3、K6血清型特异性(图1)。
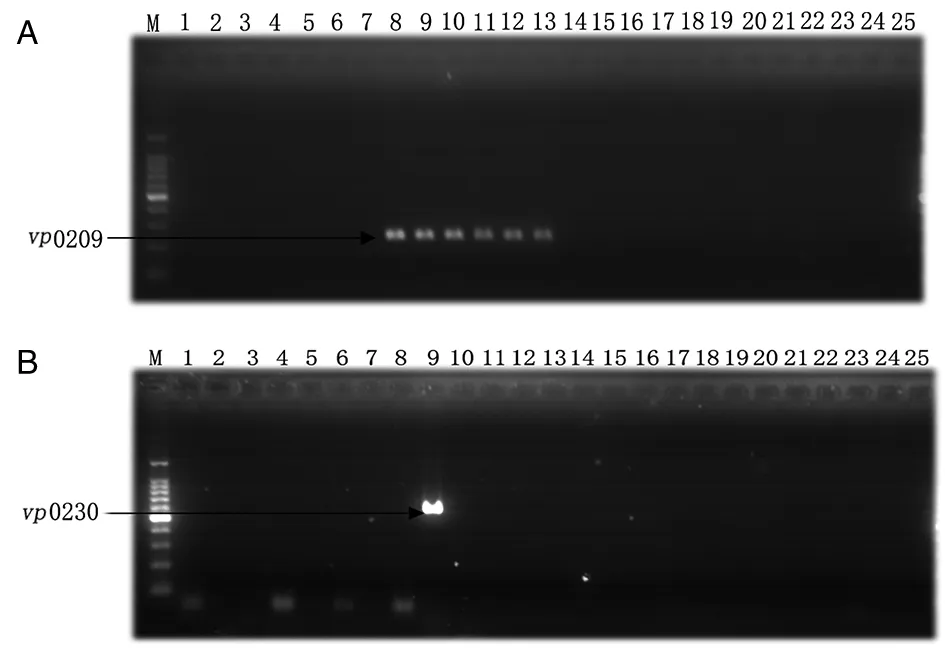
A: vp0209 gene; B: vp0230 gene; M: 100 bp Ladder; lines 1-25: V.parahemolyticus zj12W297(O1∶K20), V.parahemolyticus zj12W269(O1∶K25), V.parahemolyticus zj12W211(O1∶K26), V.parahemolyticus zj12W239(O1∶K32), V.parahemolyticus zj11W202(O1∶K38), V.parahemolyticus zj12W238(O2∶K3), V.parahemolyticus zj12W210(O2∶K28), V.parahemolyticus zj12Y73(O3∶K5), V.parahemolyticus zj12W06(O3∶K6), V.parahemolyticus zj13Y174(O3∶K29), V.parahemolyticus zj13W113(O3∶K33), V.parahemolyticus zj12W68(O3∶K54), V.parahemolyticus zj12W176(O3∶K56), V.parahemolyticus zj12Y74(O4∶K8), V.parahemolyticus zj12W219(O4∶K34), V.parahemolyticus zj13W14(O4∶K42), V.parahemolyticus zj12Y6(O4∶K68), V.parahemolyticus zj13W118(O5∶K17), V.parahemolyticus zj12W107(O5∶K30), V.parahemolyticus zj12W134(O6∶K46), V.parahemolyticus zj13W16(O7∶KUT), V.parahemolyticus zj12W225(O8∶KUT), V.parahemolyticus zj11W211(O9∶KUT), V.parahemolyticus zj13W27(O10∶K24), V.parahemolyticus zj12W155(O11∶KUT).图1 不同血清型副溶血性弧菌vp0209、vp0230基因扩增产物Fig.1 PCR products of vp0209, vp0230 genes from V. parahemolyticus with various serotypes
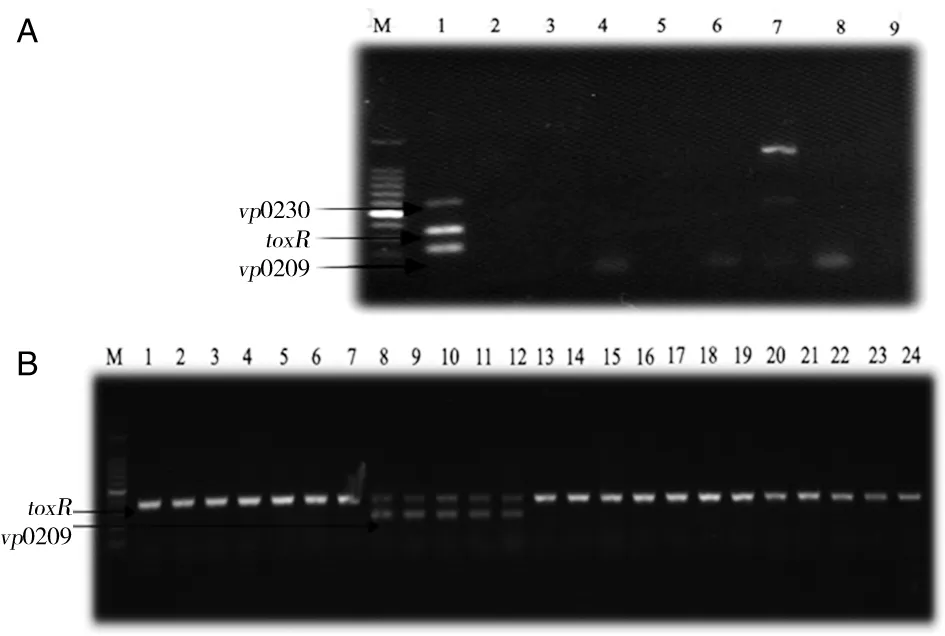
M: 100 bp Ladder; A: lines 1-9: V.parahemolyticus zj12W06, Escherichia coli ATCC25922, Pseudomonas aeruginosa ATCC27853, Staphylococcus aureus ATCC25923, Listeria monocytogenes CMCC54006, Vibrio vulnificus ATCC27526, Salmonella enteritidis ATCC50041,Shigella flexneri ATCC12022, Bacillus cereus ATCC11778; B: lines 1-24 V.parahemolyticus zj12W297(O1∶K20), V.parahemolyticus zj12W269(O1∶K25), V.parahemolyticus zj12W211(O1∶K26), V.parahemolyticus zj12W239(O1∶K32), V.parahemolyticus zj11W202(O1∶K38), V.parahemolyticus zj12W238(O2∶K3), V.parahemolyticus zj12W210(O2∶K28), V.parahemolyticus zj12Y73(O3∶K5), V.parahemolyticus zj13Y174(O3∶K29), V.parahemolyticus zj13W113(O3∶K33), V.parahemolyticus zj12W68(O3∶K54), V.parahemolyticus zj12W176(O3∶K56), V.parahemolyticus zj12Y74(O4∶K8), V.parahemolyticus zj12W219(O4∶K34), V.parahemolyticus zj13W14(O4∶K42), V.parahemolyticus zj12Y6(O4∶K68), V.parahemolyticus zj13W118(O5∶K17), V.parahemolyticus zj12W107(O5∶K30), V.parahemolyticus zj12W134(O6∶K46), V.parahemolyticus zj13W16(O7∶KUT), V.parahemolyticus zj12W225(O8∶KUT), V.parahemolyticus zj11W211(O9∶KUT), V.parahemolyticus zj13W27(O10∶K24), V.parahemolyticus zj12W155(O11∶KUT).图2 不同菌株vp0209、vp0230、toxR基因三重PCR产物琼脂糖凝胶电泳图Fig.2 Triplex PCR products of vp0209, vp0230, toxR genes of various bacteria strains
3.2三重PCR检测特异性分析当以大肠埃希氏菌、铜绿假单胞菌、金黄色葡萄球菌、单增李斯特菌、创伤弧菌、沙门氏菌、志贺氏菌、蜡样芽孢杆菌标准菌株的DNA为模板进行PCR扩增时,3个目的条带均未检出,PCR检测结果为阴性(图2A)。O3∶K6血清型副溶血性弧菌(zj2012W6)3个基因的目的条带均检出。以不同血清型副溶血性弧菌DNA为模板,5株O3群副溶血性弧菌有toxR、vp0209目的条带检出,其他血清型副溶血性弧菌均只有toxR基因检出(图2B)。该三重PCR方法对O3∶K6血清型副溶血性弧菌具有较好的检测特异性。
3.3三重PCR检测灵敏度分析105、104、103、102CFU/反应体系均可检出3个目的基因条带,10CFU/反应体系中没有目的条带检出(图3),该方法的检测灵敏度为102CFU/反应体系。

M: 100 bp Ladder; lines: 1-5 the concentration of DNA template were 105, 104, 103, 102, 10 CFU/reaction system,respectively.图3 三重PCR灵敏度检测Fig.3 Detection sensitivity of triplex PCR
3.4三重PCR对副溶血性弧菌食源性和临床分离菌株的检测使用该PCR检测方法对2011-2013年浙江省各地分离的食源性和临床副溶血性弧菌进行检测,其中50株O3∶K6血清型菌株,50株非O3∶K6血清型菌株。结果显示O3∶K6血清型菌株均显示阳性,非O3∶K6血清型菌株均为阴性,符合率达到100%。图4、图5分别为部分O3∶K6血清型菌株和非O3∶K6血清型菌株PCR产物检测电泳图。
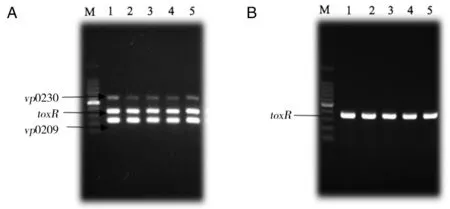
A: O3:K6 serotype strains; B: non-O3:K6 serotype strains; M: 100 bp Ladder; A lines 1-5: O3:K6 serotype strains; B lines 1-5: non-O3:K6 serotype strains.图4 部分副溶血性弧菌三重PCR产物琼脂糖凝胶电泳图Fig.4 Triplex PCR products of V. parahemolyticus strains
4 讨 论
血清学分型是对副溶血性弧菌致病性和流行性风险评估的重要参数。在我国2008年修订的《食品卫生微生物学检验—副溶血性弧菌检验国家标准GB/T 4789.7-2008》中,血清学分型成为副溶血性弧菌的常规检测项目。副溶血性弧菌血清型众多,目前共有13个O血清群和70个K血清型[8],副溶血性弧菌的血清学分型是以脂多糖(LPS)O-抗原和荚膜多糖(CPS)K-抗原的双抗原系统为基础进行。目前。常用的血清型鉴定方法是玻片凝集法,根据凝集情况判断菌株血清型。该方法已经在食品卫生检验、临床检验、科研等相关领域广泛应用。但是在分型工作中也存在一些问题,针对这些问题,我们拟建立血清型的PCR检测方法。本文中建立的O3∶K6血清型三重PCR检测方法基于副溶血性弧菌种特异性基因toxR、O3血清群特异基因vp0209和K6血清型特异基因vp0230,可以同时检
测菌株的种、O3血清群和K6血清型。该方法操作简便快捷,整个过程可在2 h内完成。单个菌落即可进行检测,检测灵敏度达到102CFU/反应体系。具有较高的准确度和灵敏度。是目前广泛使用的血清玻片凝集方法的补充。
[1] Yeung PS, Boor KJ. Epidemiology, pathogenesis, and prevention of foodborneVibrioparahaemolyticusinfections[J]. Foodborne Pathog Dis, 2004, 10(1): 74-88. DOI: 10.1089/153531404323143594
[2] Su YC, Liu C. Vibrio parahaemolyticus: a concern of seafood safety[J]. Food Microbiol, 2007, 5(24): 549-558. DOI: 10.1016/j.fm.2007.01.005
[3] Kodama T, Hiyoshi H, Kazuyoshi G, et al. Identification of two translocon proteins ofVibrioparahaemolyticustype III secretion system 2[J]. Infect Immun, 2008, 1(9): 4282-4289. DOI:10.1128/IAI.01738-07
[4] Chen HY, Chen M, Sheng YY, et al. Distribution of serotype, ribotype and virulence gene ofVibrioparahaemolyticusisolated from foodborne disease outbreaks[J]. Chin J Food Hyg, 2011, 10(2): 114-118. (in Chinese)
陈洪友,陈敏,盛跃颖.副溶血性弧菌食源性疾病暴发分离株的血清型、核糖型及毒力基因研究[J].中国食品卫生杂志, 2011, 10(2):114-118.
[5] Nair GB, Ramamurthy T, Bhattacharya SK, et al. Global dissemination ofVibrioparahaemolyticusserotype O3∶K6 and its serovariants[J]. Clin Microbiol Rev, 2007, 20(1): 39-48. DOI:10.1128/CMR.00025-06
[6] Nair GB, Hormazabal JC. TheVibrioparahaemolyticuspandemic[J]. Rev Chilena Infectol, 2005, 22(2): 125-130. DOI: 10.4067/S0716-10182005000200002
[7] Caburlotto G, Gennari M, Ghidini V, et al. Serological and molecular characterization ofVibrioparahaemolyticusmarine strains carrying pandemic genetic markers[J]. ISME J, 2010, 4(8): 1071-1074. DOI: 10.1038/ismej.2010.34
[8] Okura M, Osawa R, Tokunaga A, et al. Genetic analyses of the putative O and K antigen gene clusters of pandemicVibrioparahaemolyticus[J]. Microbiol Immunol, 2008, 52(5): 251-264. DOI: 10.1111/j.1348-0421.2008.00027.x
Triplex PCR method forVibrioparahemolyticusserotype O3∶K6 strains detection
ZHANG Yun-yi, MEI Ling-ling, ZHANG Jun-yan, ZHAN Li, CHEN Jian-cai,CHEN Hong-hu, ZHANG Zhen, YANG Yong
(ZhejiangProvincialCenterforDiseasePreventionandControl,Hangzhou310005,China)
Based on theVibrioparahemolyticusspecies specific genetoxR, the serogroup O3 specific genevp0209 and the serovar K6 specific genevp0230, a triplex PCR method was developed to detectVibrioparahemolyticusserotype O3∶K6 strains. High detection specificity was demonstrated and detection limit attained 102CFU/PCR reaction.
Vibrioparahemolyticus;O3∶K6 serotype;triplex PCR
Supported by the Public Welfare Project of Zhejiang Province (No. 2015C37058)
Mei Ling-ling, Email: llmei@cdc.zj.cn
梅玲玲,Email:llmei@cdc.zj.cn
浙江省疾病预防控制中心,杭州310005
R378.3
A
1002-2694(2016)07-0632-04
2016-04-28;
2016-06-21
DOI:10.3969/j.issn.1002-2694.2016.07.008
浙江省公益类科技计划项目(No.2015C37058)

