人羊膜间充质干细胞体外传代培养对染色体核型的影响
崔冬冰 范安然 何志旭,2* 舒莉萍
1.贵州医科大学组织工程与干细胞实验中心(贵阳,550004);2.贵州医科大学附属医学院儿科学教研室;3.贵州医科大学免疫学教研室
·基础研究·
人羊膜间充质干细胞体外传代培养对染色体核型的影响
崔冬冰1范安然1何志旭1,2*舒莉萍3
1.贵州医科大学组织工程与干细胞实验中心(贵阳,550004);2.贵州医科大学附属医学院儿科学教研室;3.贵州医科大学免疫学教研室
目的:分离培养人羊膜间充质干细胞(hAMSCs)并进行体外长期传代培养,通过对连续传代的细胞形态、膜表面标志、增殖、分化特性以及染色体核型进行研究,以观察体外培养对该细胞的影响,为其储备和临床应用提供实验依据。方法: 无菌条件下从新鲜人胎盘组织分离羊膜,采用组织贴壁法分离培养hAMSCs,并对原代细胞~P11代细胞利用流式细胞技术检测其膜表面标志物;取P3~P4代细胞向神经细胞和成骨细胞诱导,免疫组化染色、PCR检测基因表达情况;采用染色体G显带法制备染色体核型。结果: hAMSCs形态似长梭型,呈流水状生长,细胞活性高,冻存复苏后仍能保持正常形态,并可在体外稳定扩增,细胞生长曲线呈“S”型; 细胞高表达CD90、CD73、CD44、CD105;细胞经诱导后可以向神经细胞和成骨细胞分化,神经元特异性烯醇化酶和成骨细胞矿化结节检测为阳性,PCR检测巢蛋白和骨桥蛋白基因表达为阳性; P3~P10代的hAMSCs染色体核型均为正常二倍体核型。结论:hAMSCs在体外经数代培养后能保持间充质干细胞的外显和遗传特性,并且未见染色体核型异常改变。
羊膜间充质干细胞;传代培养;核型
间充质干细胞(MSCs)是干细胞家族的重要成员,来源于发育早期的中胚层和外胚层,是具有自我更新和多向分化潜能的成体干细胞,因具有组织修复、免疫调控、支持造血、免疫原性低、易于分离培养、体外能大量扩增及冻存等特点而受到关注,是干细胞研究及应用的热点[1]。细胞治疗的安全性检测方法包括:体外培养试验、裸鼠接种试验、高级灵长类动物移植试验、急性毒性反应、慢性毒性反应和器官组织学上的异物产生等[2]。由于体外培养环境与体内环境不同,在连续传代扩增的条件下,MSCs能否保持其生物学特性,染色体是否会发生变化,是其应用的重要评估指标。目前,对于hAMSCs在体外培养过程中遗传学稳定性的研究结果并不一致,也未见持续性的研究分析[3-4]。本研究通过对人羊膜间充质干细胞(hAMSCs)体外连续传代培养细胞形态学、分化特性及染色体核型的分析,以观察体外培养对该细胞的影响,为其储备和临床应用提供实验依据。
1 材料与方法
1.1 材料来源
羊膜取自健康足月新生儿剖宫产手术后,经家属和产妇知情同意并签署《胎盘处理协议书》后捐献所得。
1.2 主要材料与仪器设备
L-DMEM(Gibco)、胎牛血清FBS(Hyclone)、胰蛋白酶(Hyclone)、神经细胞预诱导剂(H-DMEM培养基、1mmol/l β-巯基乙醇)、神经细胞诱导剂(H-DMEM、 2%DMSO、200μmol/l丁羟基茴香醚)、成骨诱导分化培养液(H-DMEM培养基、10mmol/l β-甘油磷酸钠、50mg/l V-C、10-8mol/l地塞米松)、Human MSC Analysis Kit(BD 562245)、PCR试剂盒、引物(TaKaRa公司)、细胞培养瓶(NEST)、超净工作台(苏州净化)、CO2培养箱( Thermo )、流式细胞仪(Backman MoFlo XDP)、倒置显微镜(Nikon TE-2000)、低温冷冻离心机(eppendorf 5810)、PCR仪(eppendorf AG22331)、染色体核型分析系统(Leica)等。
1.3 hAMSCs分离和培养
无菌条件下将脐带根部的胎盘剪下,剥离羊膜,用无菌NS清洗数次直至液体清亮,将其转移至青霉素小瓶中用眼科剪剪成约0.2~0.5mm,记为P0代。转入T75细胞培养瓶中,每瓶放置10~15个组织块,间隔0.5cm,加入约2.5~3ml培养液,置于37℃,5%CO2培养箱中培养。当见组织块周围有细胞爬出后,隔天换液1次;细胞呈片状生长时,可挑出羊膜组织块并移入新的T75细胞培养瓶中,继续培养。培养瓶用PBS清洗后,加入胰蛋白酶溶液,当见细胞皱缩、变圆,立即加入培养液中止消化,用吸管反复吹打瓶壁,使细胞脱落并转移至15ml离心管中,800rpm离心3min,沉淀用培养液重悬,移至细胞培养瓶中培养,记为P1;当传代细胞融合达到90%时可再次传代,记为P2、P3…Pn。
1.4 hAMSCs的鉴定
1.4.1 免疫表型鉴定 取P0~P11代细胞用流式细胞仪检测细胞膜表面分子:CD73-APC、CD90-FITC、CD44-PE、CD105-Cy5.5和CD11b-PE、CD19-PE、CD34-PE、CD45-PE、HLA-DR-PE。
1.4.2 细胞增殖特性 取P3~P10细胞按照1.0×106个/cm2接种于24孔板;次日长成单层后,每日取1孔计数活细胞数,连续7日;每代细胞重复5次,绘制增殖曲线。
1.4.3 分化潜能及其鉴定 消化体外扩增的P3、P10细胞,按2.0×103/cm2接种于六孔板中;待细胞贴壁后,将培养液分别换成神经细胞诱导剂(H-DMEM培养基、2%DMSO、200μmol/l BHA)和成骨细胞诱导剂(H-DMEM培养基、10mmol/l β-甘油磷酸钠、50mg/l V-C、8mol/l地塞米松),分别培养4~6h和14d,免疫组化法检测NSE和茜素红染色检测成骨细胞矿化结节。
1.4.4 PCR检测 分别收集诱导6h的神经细胞、诱导14d的成骨细胞和未诱导细胞,提取总RNA,逆转录为cDNA, PCR仪扩增,按试剂盒操作说明进行。正反引物及扩增产物的长度如下:Nest检测引物:F:5'-ctggagctgcaattccctaggaccc-3';R:5'-gtgagacctctagaaaaagaggct-3'(791bp;Osteopontin 检测引物F: 5'-ttcagacccttccaagtaagtcca-3';R: 5'-tacatatgtaagtgatgtagttat-3'(782bp) ,扩增产物用1.0%琼脂糖凝胶电泳显影。
2 结果
2.1 细胞形态
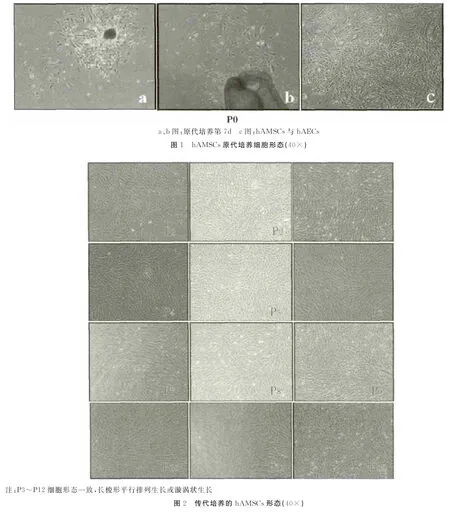
培养7d左右可见组织块周围有细胞,贴壁生长,形态为短粗梭形或三角形(图1-a、b)。可形成细胞集落,约培养15d细胞融合达70%~80%。原代培养时有羊膜上皮细胞(hAEC),形态为卵圆形,铺路石样(图1-c),传代后可去除。hAMSCs传代后增殖迅速,形态一致,呈长梭状平行排列生长或漩涡状生长(图2),并能在体外连续传代15代以上。
2.2 hAMSCs流式细胞学检测
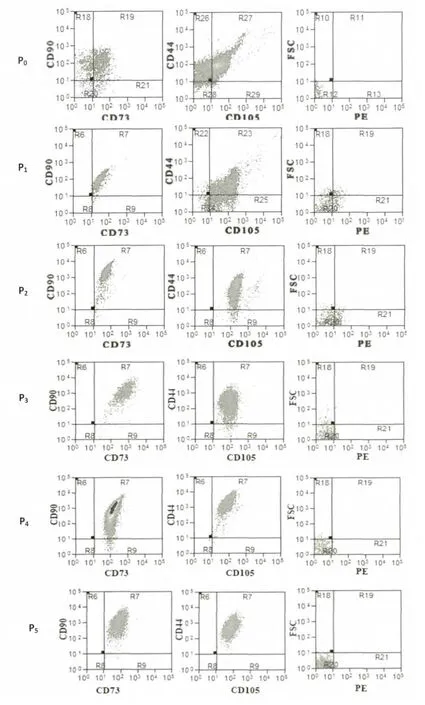
从流式检测的结果可见:P0代细胞CD90、CD73、CD44、CD105的阳性表达较低,P1代后逐渐增加,P2~P8代细胞则稳定高表达CD90、CD73、CD44、CD105,P9~P11代细胞的阳性表达稍低,而所有代次的细胞均不表达CD11b、CD19、CD34、CD45、HLA-DR(图3)。

2.3 hAMSCs细胞增殖实验
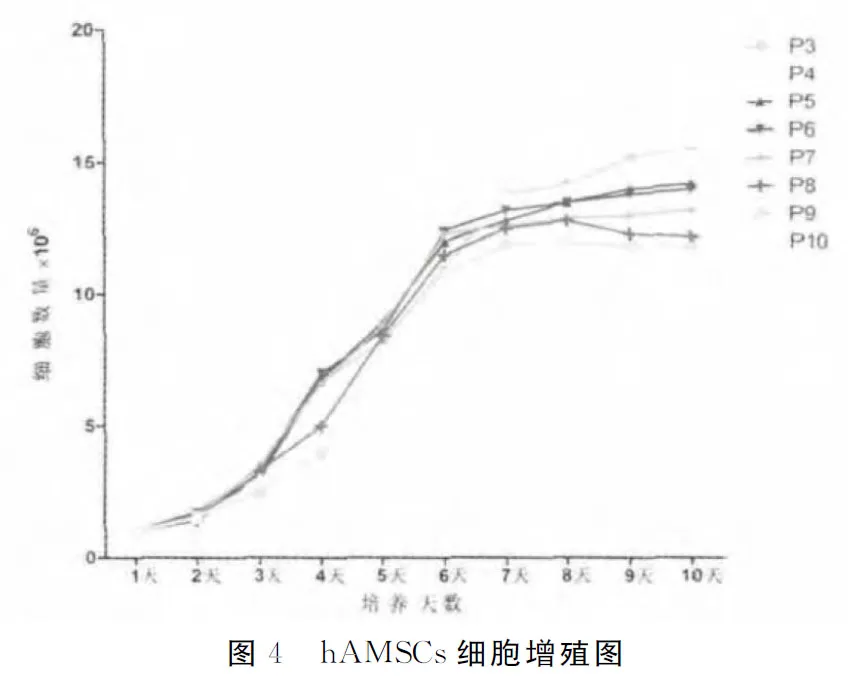
如图4所示,P3~P10传代细胞生长曲线总体上呈“S”形,即第1~2d为潜伏期,细胞缓慢贴壁生长,第3d进入对数生长期,达到增殖高峰,持续约4d,到第7d进入生长平台期。提示传代细胞生长速度快,增殖能力强,符合MSCs的生长特点。
2.4 hAMSCs分化实验
如图5所示,a图为对照组,是未进行诱导分化的细胞;b 图为将该细胞向神经细胞诱导4h后,细胞变短,体积变小,出现双极或多极,免疫组化检测NSE,染色为黄色;c图是向成骨细胞诱导分化的结果,细胞被诱导14d后,汇合聚集后呈多层重叠生长,形成成骨细胞特有的矿化结节,周围折光性增强,茜素红染色呈红色。

2.5 PCR检测结果
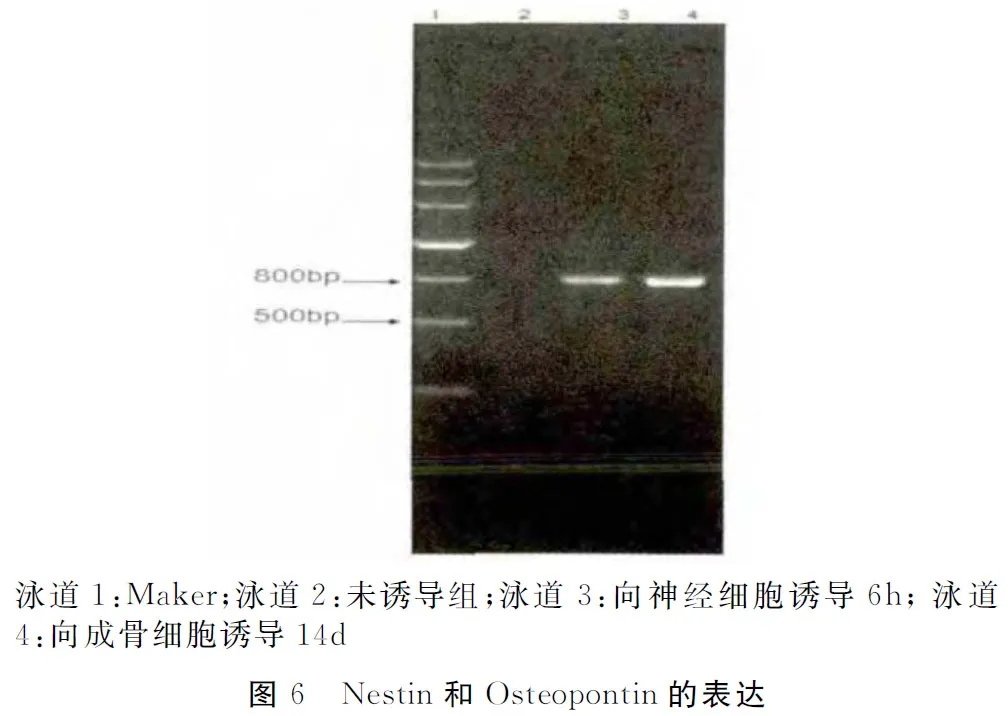
细胞被诱导后PCR检测结果显示:Nestin和Osteopontin检测均呈阳性,第3、4泳道分别可见分子量为791bp和782bp阳性反应带(图6)。而未诱导分化的细胞不表达该基因。
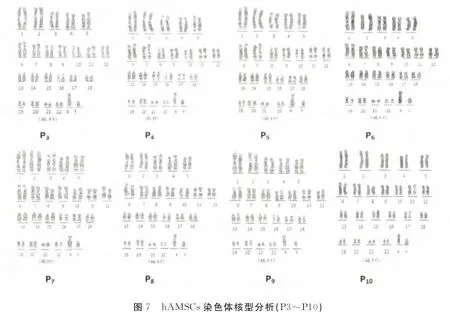
2.6 染色体核型分析
P3~P10代的hAMSCs染色体核型均为正常二倍体核型,未见染色体重复、缺失、易位等异常改变核型。
3 讨论
干细胞是一类具有自我复制能力的多潜能细胞,在一定条件下可以分化成多种功能细胞。由于具有增殖和分化的特性,干细胞作为“种子”细胞可参与细胞替代和组织再生。干细胞给某些疑难疾病的治疗带来了希望,受到广泛关注。间充质干细胞属于成体干细胞,因其来源广泛,在围产期组织如脐血、胎盘、羊水和脐带中含量丰富,易于获得,不受伦理学限制等优势而受到研究者的青睐。
间充质干细胞的分离培养已有很多报道,但是尚缺乏统一的遗传标志以及后续功能与应用的深入研究[5-6],尤其是关于人源的羊膜间充质干细胞。就培养方法而言,目前主要有两种:酶消化法和组织块法,所分离培养出的MSCs形态特征、生长曲线、细胞表面标记物等无明显差异。但操作方面各有利弊:酶消化法耗时较短,但成本较高,过程繁琐,污染概率大,同时消化时间的长短也影响细胞的活性。而组织块法所获得的细胞形态均一,增殖能力强,但细胞爬出的时间较长。与传统的组织块法不同的是,本研究将羊膜组织块接种于培养瓶底部后,自然干燥1~2h,使其紧贴培养瓶底部,然后再加入培养液培养,避免了组织块漂浮。实验证实这种方法能够缩短细胞长出的时间,提高获得细胞的数量。
间充质干细胞是最具有应用前景的干细胞之一,目前国内外已开展了包括骨关节疾病、肝硬化、GVHD、脊髓损伤[7]及退行性神经系统疾病和糖尿病等多项临床应用研究。我国已出台了《关于干细胞制剂质量控制及临床前研究指导原则》[8], 意味着间充质干细胞的广泛应用即将成为可能。但是,体外培养都只能是模拟体内细胞的生长环境,与体内环境相比仍有很大区别,因而连续传代扩增的条件下,细胞的遗传信息是否会发生改变,是临床应用安全性的重要指标。美国FDA关于MSCs安全性评估体系中提出了染色体核型检测要求,同时,核型分析的异常结果比癌基因的表达特异性更高[9]。因此在应用细胞进行治疗前,染色体核型分析非常重要。大量研究表明,许多肿瘤的发生、发展与染色体核型的变化密切相关[10]。hAMSCs经体外长期传代后,细胞染色体是否会发生改变,以往文献报道中大多只选择了少数几个代次进行分析,多代次的报道较少[11]。本研究对P3~P11代hAMSCs的染色体核型分析结果提示,经体外传代培养并未引起hAMSCs细胞染色体核型改变。另外从本研究的流式结果看出,原代培养的细胞就具有了间充质干细胞的特性,而且在后续的培养过程中,这种特性可以稳定维持,但是稳定持续时间还有待进一步研究。
[1] Marolt D,Augst A,Freed LE ,et a1. Bone and cartilage tissue constructs grownusing human bone marrow stromal cells,silk scaffolds and rotating bioreactors[J].Biomaterials, 2006, 27(36):6138-6149.
[2] 李六金,李秦,施新猷,等.五种动物传代细胞系对裸鼠的致瘤性[J].第四军医大学学报,2000, 21(6): 738-740.
[3] Stewart MC,Stewart AA.Mesenchymal stem cells: characteristics,sources,and mechanisms of action[J]. Vet Clin N Am Equine Pract,2011,27( 2) : 254-261.
[4] Hua JL,Qiu BP,Zhu HJ,et al. Multipotent mesenchymal stem cells (MSCs) from human umbilical cord: Potential differentiation of germ cells[J]. Afric J of Biochem Res,2011, 5(4):113-123.
[5] 付蒙,张艳梅,王佃亮,等.人羊膜间充质干细胞的生物学特性及临床前研究[J]. 中国生物工程杂志,2011,31 ( 12 ) : 115-119.
[6] 丛姗, 宋瑾, 张惠娟, 等.人羊膜间充质干细胞(hAMSCs)的分离、体外培养及诱导分化[J].农业生物技术学报, 2015, 23(1): 20-31.
[7] Beatrice Dionigi, Azra Ahmed, David Zurakowski,et al.Partial or complete coverage of experimental spina bifida by simple intra-amniotic injection of concentrated amniotic mesenchymal stem cells[J].Journal of Pediatric Surgery, 2015,50 : 69-73.
[8] 《干细胞制剂质量控制及临床前研究指导原则》[s].国家卫生计生委(2015)
[9] 张立新,陈亚宝,叶军,等.脐带间充质干细胞染色体核型制备及安全评估[J].海南医学,2012,23(13):11-12.
[10] Frrhling S, Drhner H. Chromosomal abnormalities in cancer[J]. NEngl J Med, 2008, 359(2): 722-734.
[11] Ra JC,Shin IS,Kim SH,et al.Safety of intravenous infusion of human adipose tissue-derived mesenchymal stem cells in animals and humans[J].Stem Cells Dev, 2011,20( 8):1297-1308.
[责任编辑:王丽娜]
The effects of human amniotic mesenchymal stem cells in vitro culture on chromosome karyotype
CUI Dongbing1, FAN Anran1, HE Zhixu1,2*, SHU Liping3
1.TheCenterofStemCellandTissueEngineeringResearch,GuizhouMedicalUniversity,Guiyang550004;2.DepartmentofPediatrics,theAffiliatedHospitalofGuizhouMedicalUniversity; 3.Departmentofimmunology,GuizhouMedicalUniversit
*Correspondingauthor:HEZhixu,Email:hzx@gmc.edu.cn
Objective: After isolated and established human amniotic mesenchymal stem cells (hAMSCs), and cultured for long-term in vitro, then to study in vitro subculture influence on hAMSCs by observing morphology of hAMSCs, the membrane surface marks, proliferation and differentiation, and its chromosome karyotype. And to provide the experimental evidences for reserving and clinical application of hAMSCs. Methods: The hAMSCs were isolated from human placenta tissues through tissue attachment culture methods. The immunophenotypes were detected by flow cytometry. The cells were induced to differentiate into nerves and osteoblasts by different culture system. The osteopontin and nestin genes were measured by PCR and Karyotype analysis was carried out with chromosome Giemsa banding method. Results: hAMSCs were dominated as long spindle cells and had grown in water shaped with high cell activity. After cryopreservation, hAMSCs could be recovered normal morphology, proliferated stably and showed typical 'S' curve of propagation. Positive expression of CD90, CD73, CD44and CD105 in hAMSCs were all high. After induction, hAMSCs could be differentiated into the nerve cell and osteoblast. The cells had positive of alizarin red staining and neuron specific enolase. Nestin and osteopontin genes were also positive in these cells. The chromosome karyotype of hAMSCs kept normal dipoid karyotype after P3 to P10 in vitro culture. Conclusion: After several generations in vitro subculture, hAMSCs can keep explicit features, genetic characteristics of mesenchymal stem cells and has no any change in chromosome karyotype.
Amniotic mesenchymal stem cells; Subculture; Karyotype
贵州省科学技术厅贵阳医学院联合基金计划项目 黔科合LH字[2014]7078
2015-11-27
2016-03-15
10.3969/j.issn.1004-8189. 2016.04
*通讯作者:hzx@gmc.edu.cn

