中药肝损伤的流行特点、风险因素及评价
宋海波,韩 玲(.国家食品药品监督管理总局药品评价中心,北京 00045;.国家食品药品监督管理总局药品审评中心,北京 00038)
中药毒理学前沿—肝毒性
中药肝损伤的流行特点、风险因素及评价
宋海波1,韩 玲2
(1.国家食品药品监督管理总局药品评价中心,北京 100045;2.国家食品药品监督管理总局药品审评中心,北京 100038)

宋海波,国家食品药品监督管理总局药品评价中心暨国家药品不良反应监测中心主任药师,主要从事中药上市后安全性评价研究。主持或参与重大新药创制、国家自然科学基金、中医药行业科研专项等省部级课题8项,获全国商业科技进步一等及二等奖各1项,山东省科技进步三等奖1项,其他科技进步奖2项;申请发明专利5项,其中2项已授权;主持完成的项目获新药证书7项;在国内外发表文章40余篇,参编专著3部。现任中国毒理学会中药及天然药物毒理专委会常委/副秘书长、中国药理学会药源性疾病学专委会肝病学组副组长等学术职务。
近年来,中药及天然药物肝损伤的报道不断增多,中药致肝损伤的风险日益引起国内外的关注。本文对中药肝损伤流行特点、风险因素和临床特点等方面进行了讨论,对目前在中药肝损伤研究及认识方面的误区进行了剖析,并结合中药及临床使用特点,提出了中药肝毒性预测、基础及临床安全性评价方面建议关注和研究的内容,以期为中药肝毒性的科学评价提供参考。
中药;药物性肝损伤;风险因素;安全性评价
DOl:10.3867/j.issn.1000-3002.2016.04.001
肝参与了大多数药物的代谢过程,某些药物或其代谢产物对肝存在直接毒性或异质反应,会导致药物性肝损伤(drug induced liver injury,DILI)的发生。数十年来,DILI一直是药物撤市的主要原因[1],1975-2007年期间因肝毒性而撤市的药物占全部撤市药物的32%[2]。而涉及植物药(草药)及膳食补充剂(herbal and dietary supplements,HDS)的DILI病例数量也逐年增长[3-4]。研究显示,美国有9%和西班牙有11%的DILI与植物药有关[5]。
中药(traditional Chinese medicine,TCM)在临床应用日益广泛,TCM致DILI(TCM-DILI)的报道也有一定增多。截至2015年底,国家食品药品监督管理总局共发布涉及TCM口服制剂的药品不良反应通报14期〔共15个(类)品种〕,其中涉及肝损伤不良反应的品种占60%,以肝损伤主要风险的品种占40%。本文结合文献报道梳理了TCM-DILI的风险因素及临床特点,对目前TCM-DILI认识中的误区及评价中的问题进行了初步探讨,结合TCMDILI的特点提出了开展评价时建议关注的内容。
1 药物性肝损伤流行特点
DILI按发病机制不同分为固有型DILI和特异质型DILI(idiosyncratic DILI,I-DILI),前者与药物剂量有关,后者涉及遗传代谢因素,具有不可预测性;按受损靶细胞类型分为肝细胞损伤型、胆汁淤积型、混合型和肝血管损伤型[6]。国内外开展的DILI流行病学调查一般基于全国或地区人群、门诊或住院患者及不良反应(adverse reaction,ADR)监测系统,基于门诊或住院患者的DILI研究受医院专业特长及患者就诊情况的影响较大。ADR监测数据一般来自自发报告系统(spontaneous report⁃ing system,SAS),较多病例诊疗信息不全,难以判断肝损伤与药物的相关性,漏报病例较多[7]。
1.1发病情况
1.1.1一般人群或地区人群
文献引用较多的主要有2项基于人群的前瞻性研究。法国对居住在讷韦尔(Nevers)地区的人群开展了1项为期3年(1997.11-2000.11)的调查,81 301名居民中共观察到35例DILI,DILI的粗发生率(crude incidence rate,CR)为每年13.9±2.4/ 10万,其中男性10.4±3.0/10万,女性17.1±3.6/10万;对应的标化发生率为8.1±1.5/10万,标化发生率男/女比率在<49岁(0.86,0.26~2.90)和>49岁(2.62,1.00~6.92)无统计学差异[7]。冰岛开展了1项为期两年(2010-2011年)的调查,该研究排除了对乙酰氨基酚中毒的患者,DILI的CR为每年19.1/10万(95%可信区间,15.4~23.3),75%DILI病例由单个处方药引起,涉及药物中最常见的为阿莫西林克拉维酸(22%),肝毒性风险最高的品种有硫唑嘌呤和英夫利单抗(infliximab),涉及HDS的DILI约占16%[8]。
另外,对西班牙南部地区人群的1项为期10年(1994.04-2004.08)的研究中共确诊461例DILI,估算发生率为每年34.2±10.7/10万(1998-2003年),严重肝ADR(危及生命、需要住院或延长住院时间、导致永久残疾或死亡)的发生率为每年16.6±6.7/10万,抗感染药物(占32%)是DILI的最常见的原因,阿莫西林克拉维酸是DILI报告例数最多的药物,9例DILI与植物药有关[9]。Hisamochi等[10]采用问卷调查的形式对日本中津市(居民86 000人)的DILI发生情况进行了研究,共收集到DILI患者104例(1964-2008年),其中涉及植物药的DILI约占3.80%。
目前尚未见国内开展基于人群的DILI发病情况调查及TCM-DILI发生率研究的文献报道。
1.1.2住院及(或)门诊患者
中南大学湘雅二医院4年期间(2001-2014年)收治的388 365例住院患者中469例被诊断为DILI,CR为每年92.95/10万,其中与TCM-DILI占36.01%[11]。韩国开展了1项为期2年(2005.05-2007.05)的全国性DILI调查,共纳入371例确诊病例,涉及植物药或健康食品、偏方的DILI分别占27.5%,13.7%和8.6%,外推发病率为每年12/10万;DILI是急性肝炎最常见的原因,植物药是DILI的主要诱发药物[12]。对韩国植物药DILI相关文献的分析显示,植物药DILI的发生率为0.71%,其中前瞻性研究为0.99%,回顾性研究为0.51%[5]。庆熙大学韩医院2012-2014年收治的1169例患者(住院时间>1周,入院时肝功能检查正常)中11例患者药后被诊断为DILI,其中5例DILI单用植物药,1例合用植物药和化学药物(chemical medicine,CM),估算该医院麻黄DILI的发生率约为1.15%(3/261),黄芩、半夏和淮山药DILI的发生率分别为0.47%(3/687),0.15%(1/659)和0.17%(1/579)[13]。
日本开展了1项为期10年(1997-2006年)的全国性DILI回顾性研究,采用问卷调查的方式收集DILI病例1676例,其中涉及植物药的DILI约占7.10%[14]。Wai[15]对新加坡国立大学医院胃肠科收治的DILI患者开展了1项为期12个月的前瞻性研究,共收集到DILI 29例,其中15例涉及TCM(占52%)。
1.1.3药物性肝损伤监测数据
美国DILI网络数据库数据显示,美国HDS导致的DILI逐年增长,2004-2005年、2006-2007年、2008-2009年和2010-2012年涉及HDS的DILI所占的比例分别为7%,13%,17%和19%,10年期间增长了约2倍[4]。
CFDA先后通报了壮骨关节丸、白蚀丸和痔血胶囊等TCM的肝损伤ADR。2014年,CFDA发布药品ADR通报,提示关注口服何首乌及其成方制剂的肝损伤风险,并结合ADR监测数据分析了其致肝损伤的风险因素,包括超剂量、长期连续用药、炮制不规范、敏感人群用药以及与其他可导致肝损伤药品合用等[16]。何首乌属于传统安全无毒的TCM,其肝损伤风险的通报引起了社会广泛关注。
1.2涉及药物
目前各国已上市的药物中具有潜在肝毒性的>1100种[17]。在欧美发达国家,非甾体抗炎药和抗感染药物是导致DILI的常见原因,涉及HDS的DILI增长较快[6]。在我国,抗结核药、TCM、抗微生物药(抗生素等)和抗肿瘤药是诱发DILI的常见原因,涉及TCM相关产品的DILI近年来报道较多(表1和表2)。
TCM及植物药在东亚各国应用较多,DILI病因中涉及TCM及植物药的比例在不同研究间差异较大。日本的研究结果一般认为不超过10%(1.8%~9.1%)[10,14,18];韩国的研究显示,植物药和偏方分别占27.5%和8.6%[12];新加坡的研究显示>50%[15](表3)。
国内1项全国多中心急性DILI研究收集了16家大型医院收治的1142例DILI确诊病例,其中涉及TCM的占21.45%[19]。多名学者开展的DILI文献研究显示,2003年以来,我国DILI涉及药物中TCM及相关产品所占比例逐年增长,2011年之前涉及TCM及相关产品的DILI一般处于第2和3位[20-23],2012年之后其所占比例已排名居前[24-26](表1)。2014-2015年国内主要肝病杂志相关报道显示,涉及TCM及相关产品的DILI占20.8%~62.1%,基本排在首位[27-35](表2)。
文献报道中涉及DILI较多的TCM及植物药主要有何首乌及其制剂、白鲜皮、雷公藤、黄药子、补骨脂和三七等,也有大黄、番泻叶、泽泻、蛇毒草、蜂胶和芦荟等致DILI的文献报道,较多文献未提供涉及TCM的具体名称[26]。欧美文献报道较多的主要有叶芽南芥(Atractylis gummifera)、一种升麻属(Cimicifuga)黑升麻(black cohosh)、鼠李(Cas⁃cara)、麻黄、金不换和栀子(Fractus Gardenia fruit)等[4]。墨西哥涉及DILI的草药主要有野甘草(Scoparia dulcis L.)、酸橙(Citrus aurantium L.)、迷迭香(Rosmarinus officinalis L.)和木贼(Equise⁃tum hyemale L.)等[36]。

表1 国内药物性肝损伤(DILI)文献研究情况
2 药物性肝损伤风险因素
2.1患者因素
肝对药物的易感性受年龄影响,通常老年人和儿童更易发生DILI。不同研究间性别、年龄分布存在一定的差异,可能与参加研究医院收治的患者人群、治疗特长及用药习惯等有关,也可能源于不同地区用药人群的遗传代谢差异。
2.1.1性别及年龄
文献多认为成年患者DILI的发病率与年龄呈正相关,女性为DILI的风险因素。法国的流行病学调查结果显示,49岁以后的DILI患者中女性发病率为男性的2.62倍[7];丹麦的全国性调查资料显示,急性DILI约占所有急性肝损伤住院病例的10%,>55岁女性为易患人群[19];冰岛开展的全国DILI流行病学调查中,女性约占56%,DILI的标化发病率随年龄增加而急剧增长[8]。Mi等[37]对1994.04-2007.08西班牙的603例DILI病例进行了分析,女性患者相对预后较差,暴发性肝衰竭/肝移植的比例相对较高(P<0.01)。Fountain等[38]对异烟肼DILI风险因素的分析发现,>49岁患者DILI风险增加。美国对急性肝衰竭(acute liver failure,ALF)的研究收到患者308例,其中女性占73%[39]。日、韩和新加坡等开展的研究也显示,DILI患者以女性为主(表3)。2014-2015年国内主要肝病杂志发表的相关文献中,DILI患者以女性居多,与国外研究结果基本一致(表2)。
也有部分研究未能证实上述结果[20-24]。Zhou等[40]对1994-2011年发表的相关文献进行了研究。结果显示,DILI患者中男性占54.1%。Wei等[41]采用Logistic多因素回归分析法对影响抗结核药物DILI的危险因素进行了研究,未发现年龄、性别分布的差异。韩国的文献研究显示,植物药DILI患者中以男性为主(P<0.01)[5]。
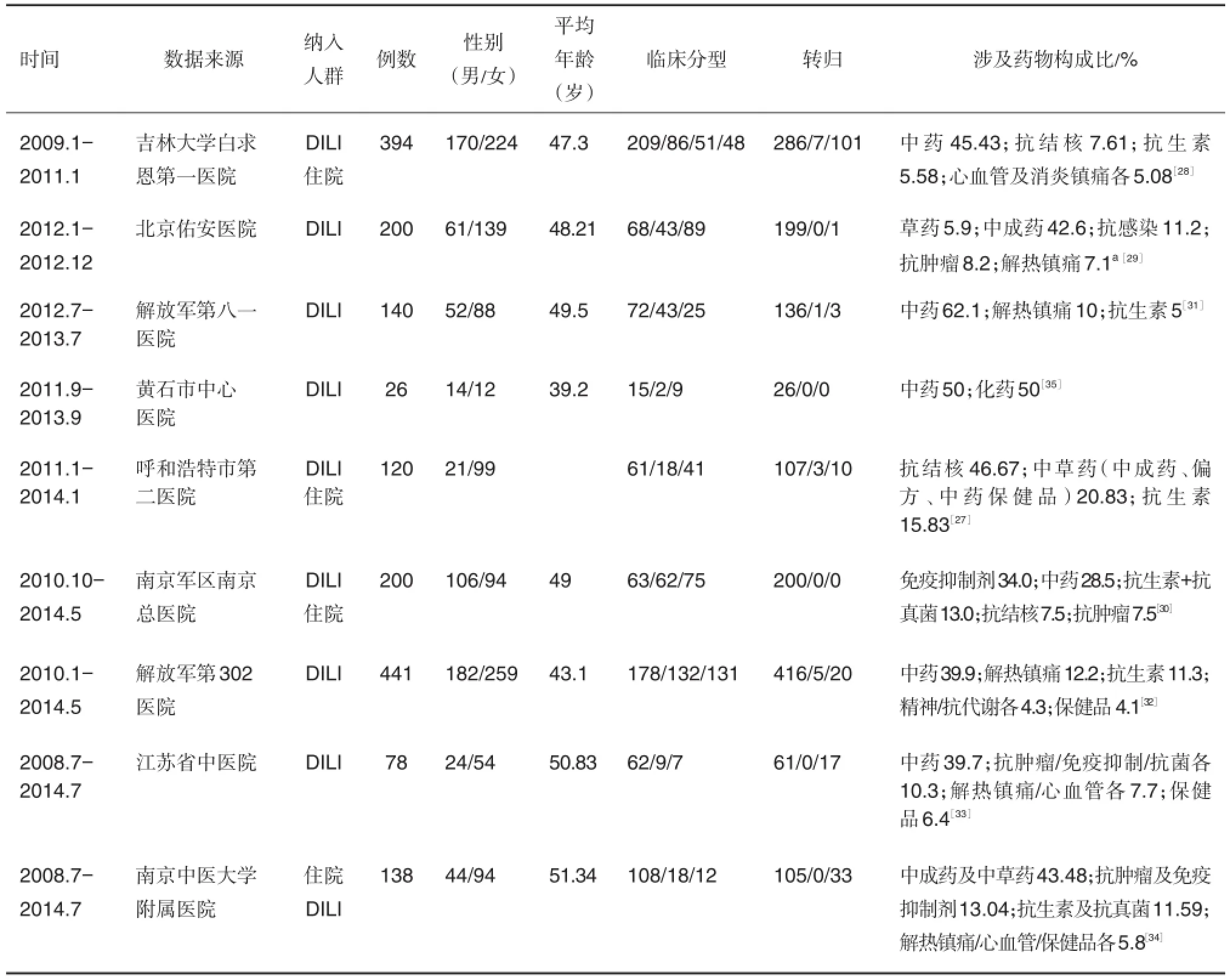
表2 2014-2015年主要肝病杂志报道药物性肝损伤情况
我国老年人群中DILI占肝病的比例约为20%。因急性肝病入院的老年患者中40%被诊断为DILI[42]。Wang等[21]对涉及老年DILI患者的国内文献进行了检索分析,发现男女比例为2.04∶1。
Onji等[18]分析了老年DILI患者的特征:①合并用药较多;②用药时间不确定;③DILI发病潜伏期较长;④主要是胆汁淤积型;⑤发生DILI后多数病例治疗意愿较强;⑥住院时间较长;⑦>75岁DILI患者仅少数评分达到“极可能”。
2.1.2基础疾病
患者基础疾病也是DILI发生的影响因素。Chen等[43]的研究显示,导致TCM-DILI主要涉及恶性肿瘤、风湿病和银屑病等疾病的治疗;Liu等[33]观察到的TCM-DILI主要涉及保健类,脾胃、妇、心脏及皮肤科用药;Dai等[44]的研究发现,感染性疾病是引起儿童重度DILI的主要原因。韩国的研究显示,植物药DILI主要涉及高血压、血脂异常、脑出血和良性前列腺增生的治疗药物[13]。
肝病是DILI的风险因素。Maddukuri等[4]研究显示,约40%慢性肝病患者使用HDS,与正常人群相比,特殊人群使用后出现肝脏毒性的风险更高,且更易出现不良后果。Zhu等[45]对DILI合并乙型病毒性肝炎患者的临床特点进行了分析,DILI合并乙肝在中老年男性易发,肝损伤以重度为主,多表现为混合型。Cai[24]研究显示,乙肝表面抗原阳性、有脂肪肝等肝基础疾病的高龄患者为DILI高危人群。
2.1.3遗传因素
目前,国内外对DILI遗传因素的研究重点主要在人白细胞抗原(human leukocyte antigen,HLA)和细胞色素P450酶(cytochrome P450,CYP)的基因多态性。参与药物代谢的酶,如CYP1A2、CPYP2A6和尿苷二磷酸葡萄糖醛酸转移酶等出现基因变异可增加药物DILI的风险。
N-乙酰转移酶的基因多态性与异烟肼等的DILI发生有关,检测N-乙酰转移酶的基因分型有助于确定抗结核治疗方案中异烟肼的适宜剂量[46]。尿苷二磷酸葡萄糖醛酸转移酶-2B7、CYP2C8和ABCC2(ATP结合盒转运体C2)的等位基因变异,可增加双氯芬酸活性代谢产物的产量,提高机体对双氯芬酸肝毒性的易感性;谷胱甘肽巯基转移酶GSTM1基因的缺失可增加抗结核药的肝毒性[47];启动子区域孕烷X受体的基因多态性可影响药物I相或Ⅱ相代谢酶(如CYP、谷胱甘肽-S-转移酶和转运体等)的转录,增加氟氯西林肝毒性风险,而HLAB*5701等位基因变异可使氟氯西林致DILI风险增加81倍[48]。许多药物的DILI与HLA的变异有关,如希美加群与DRB1*0701、噻氯匹定与HLAA* 3303及罗美昔布(lumiracoxib)与DRB1*0701等[49],DRB1*1501e、DQB1*0602单倍型的患者对阿莫西林克拉维酸所致DILI敏感性增加[2]。
2.2药物因素
西方国家主要将HDS用于健美、减肥、抗抑郁、提高性功能、增强免疫及保护关节等[4]。美国的一项调查[50]显示,>21%的成年人使用植物药,主要用于一些慢性疾病,如风湿病症(26%)、哮喘(24%)、人类免疫缺陷病毒感染(22%)、肝疾病(21%)及乳腺癌(12%)等。草药在印度、墨西哥、日和韩等国的应用也较为广泛[36]。据商务部的统计数据,TCM在国内药品零售所占比重>25%[51]。

表3 国外传统药物、膳食补充剂、健康食品药物性肝损伤文献报道
2.2.1剂量和疗程
剂量和疗程是影响DILI发生及转归的重要因素[24]。超剂量使用是对乙酰氨基酚诱发DILI的主要原因[2],瑞典ADR监测数据显示日剂量≥50mg的药物致严重DILI的风险明显高于日剂量≤10mg的药物(13.2%vs 2.0%,P<0.05)[52]。用药疗程过长也会增加DILI的风险,氟氯西林和阿莫西林克拉维酸所致DILI与疗程呈正相关。CFDA对何首乌及其成方制剂致DILI的风险因素进行了分析,认为超剂量、长期连续用药会增加其风险[16]。
2.2.2联合用药及再激发
联合使用多种存在肝毒性风险的药物可增加DILI的风险。监测数据显示,合用其他可导致肝损伤药品时何首乌及其成方制剂DILI风险可能增加[16]。有研究显示,TCM-DILI发病后所需治疗时间与服用药味的数量有关,单方用药者平均治疗时间(20.8±12.5)明显短于复方用药者(37.1±18.6),(P<0.05)[53]。国外研究亦证实,抗结核药物与唑类抗真菌药、甲氨蝶呤、抗痉挛药、氟烷等药物存在肝毒性协同作用[6]。
再激发反应有助于判断药物与肝损伤的关联性,是DILI的重要诊断指标。患者再次用药出现再激发反应时,病情往往较首次激发进展更快,程度更重,甚至出现致命反应。故美国胃肠病学学会(ACG)组织起草的DILI指南中强烈建议,既往有DILI病史的患者不应再次暴露于同一药物,除非因疾病危及生命而无其他药物可供选择[54]。
Lucena等[55]在西班牙DILI登记系统中筛选出9例(1.21%)复发病例,8例表现为肝细胞型,其中7例2次DILI发作涉及药物结构类似、作用靶标相同或属同类药物;DILI再次发作时病程明显缩短;至少有6例患者临床表现与自身免疫性肝炎类似。
TCM致DILI起病多隐匿,难以判断DILI与药物的关联性,易因再次用药导致再激发反应。监测数据及文献分析显示,临床存在何首乌DILI再激发甚至三重激发的病例,再次激发后患者病情较首次加重,住院时间延长[16]。
2.2.3代谢因素
药物的理化性质及代谢特性也会影响DILI的发生。剂量≥每天100 mg且脂溶性较强(辛醇-水分配系数(logP值)≥3)的药物可能存在较高的肝毒性风险[56],主要经肝代谢(>50%)的药物更易出现DILI和肝衰竭[2]。
当代谢相关的肝CYP450酶被抑制时,需由该酶代谢的药物如存在肝毒性,其风险将明显增加。他汀类药物主要经CYP3A4代谢,与CYP3A4抑制剂合用时DILI风险明显增加[57]。中药血脂康含他汀类成分,临床应注意避免与CYP3A4抑制剂合用,以减少DILI的发生。CYP2C19为大黄酸的主要代谢酶,可将其代谢为肝毒性活性代谢产物,加入CYP2C19抑制剂后其作用可被拮抗[58]。
2.3质量因素
混伪品及质量因素可能是TCM-DILI病例增加的原因之一。Wai等[59]对新加坡国立大学医院收治的DILI涉及药物进行了研究,31例DILI中17例使用了TCM,5例使用了马来传统药物。对17例DILI患者使用的31种TCM进行检测,其中29%存在质量问题(添加化药成分或重金属超标等)。该国的另一项研究显示,质量不合格植物药占2%(2080个标本中48个重金属超标)。在我国台湾,对8个主要医疗中心的2609个中草药制剂进行检测,其中27%存在质量问题[59]。
美国加州检测结果显示,进口的251种植物药制剂中7%含有未申报的药物成分〔如麻黄碱、马来酸氯苯那敏(扑尔敏)、甲睾酮和非那西汀等〕,24种重金属超标,23种掺杂有多种非法或有害成分;德国中医医院的317批中草药中3.5%重金属超标[60]。沙特阿拉伯的检测结果显示,不合格植物药制品(主要是重金属超标、添加化学药成分、细菌污染或含有其他有毒物质等)约占3%[61]。
2.4辨证施治因素
TCM是以传统中医理论为指导的药物。制备过程通过炮制、配伍减毒,临床用药讲究辨证施治、中病即止,可有效避免DILI等严重ADR的发生。研究显示,当归与黄药子配伍(2∶1)可减少后者肝毒性;茵陈蒿汤中的其他药味可减轻栀子(栀子苷)的肝毒性;甘草、白芍与雷公藤相配伍可减轻后者肝毒性[62]。规范炮制可有效控制何首乌肝毒性[63-64]。
DILI可归属于中医学的“胁痛”、“黄疸”、“积聚”范畴,其病位在肝,与脾、胃、胆、心、肾等脏腑密切相关,病机关键为肝失疏泄、脾失健运[65]。临床用药时存在衷西参中、轻方(方剂)重药(中药)的现象,以西医西药的思维方式来使用TCM,将清热解毒理解为杀菌、抗病毒,将中医补肝肾药物理解为治疗肝病、肾病[66],且用药时不知随证加减,辨证论治不到位,增加了TCM-DILI的风险。日本研究显示,有汉方医专家出诊的富山医科药科大学和汉药诊疗部门诊患者中汉方药导致肝损害的发生率仅为0.1%;而对小柴胡汤售后调查显示,其肝损害发生率为0.64%[67]。
3 中药-药物性肝损伤临床特点
TCM多为复方制剂,临床多与其他药物联合使用,与肝损伤的关联性较难判断。多数TCM作用和缓,所致DILI潜伏期较长,部分病例发病较隐匿,一般无剂量依赖性,有些病例甚至无明显临床症状及体征,仅表现为肝生化指标的异常,临床诊断较为困难。
少数TCM肝毒性相对较强,主要含有生物碱类〔吡咯里西啶类生物碱(pyrrolizidine alkaloids)等〕、皂苷类(薯蓣皂苷等)、毒蛋白类(如蓖麻毒蛋白等)、重金属类(如铅、汞)或挥发油类(如薄荷油等)等成分[68-69],多数TCM肝毒性物质基础不明确。
3.1临床表现及分型
TCM导致的肝损伤主要表现为肝实质性损害及肝血管性损害,前者主要包括急性药物性肝炎、亚急性药物性肝炎、慢性药物性肝炎和药物性肝衰竭,后者主要包括肝小静脉闭塞症和肝静脉血栓。两者的致病中草药类别、发病机制、临床特点及治疗均有所不同。肝血管性损害主要与千里光、土三七、黄药子等中草药含有吡咯里西啶生物碱有关[1,70]。
多数文献研究显示,TCM-DILI以女性为主[14,32,71-72],临床分型主要为肝细胞型[14,32,53,71-73]。与CM所致DILI相比(一般在首次服药后4 d至3个月发病),TCM-DILI发病潜伏期相对较长[32,74],恶心、呕吐、厌食等症状发生频次相对较高[14,74];也有文献报道,患者以乏力、黄疸为主要表现[75]。TCM-DILI发生皮疹的比例较CM-DILI低(1.1%vs 5.2%,P<0.05),而脾肿大比例较后者高(78.4%vs 46.2%,P<0.01)[32]。TCM-DILI的实验室及病理检查一般无明显特异性,有报道总胆红素、谷丙转氨酶和谷草转氨酶等指标相对较高[33]。老年患者受基础疾病影响,胆汁淤积型和混合型比例较高[18,76],涉及心血管系统用药、抗核抗体阳性及药物性肝硬化构成的比例明显高于中青年组(P<0.01)[77-78]。
3.2严重程度及转归
TCM-DILI的严重程度及转归文献报道不一。国外有文献报道其死亡率较低(中草药0%,膳食补充剂1.2%,其他药物4.2%)[14],用药后DILI的发生率与CM类似[5]。也有文献报道,HDS致ALF例数超过对乙酰氨基酚[79],非健美类HDS的全因死亡率达4%,严重病例比例明显高于常规药物(13%vs 3%)[4]。
国内有文献报道,TCM-DILI预后较差[33],可出现肝衰竭,个别患者需要肝移植,严重者甚至导致死亡[35]。也有文献报道TCM-DILI多属轻、中度[80-81],预后相对较好[82]。Dai等[44]的研究发现,感染性疾病是引起儿童重度DILI的主要原因,退热药、TCM及感冒药是最重要的诱因,伴有多脏器功能障碍的DILI患儿病死率达92.86%,未合并其他器官损害的患儿治愈率达83.3%,说明重度肝损害患儿有无肝性脑病及多脏器功能障碍等严重合并症是影响预后的重要因素。
美国17家三级医疗中心组成ALF研究协作组对308例ALF患者进行了研究[39],过量服用对乙酰氨基酚是ALF最常见的原因(占39%),DILI是ALF的主要原因之一(占13%),嗜肝病毒感染(甲肝、乙肝)约占12%。而在我国嗜肝病毒感染仍是导致ALF的主要病因,DILI及乙醇所致ALF逐年增长[83]。
相当数量的DILI会发展为慢性肝损伤。国外研究显示,14%DILI患者肝生化检查持续异常[84]。国内研究数据显示,约6.0%的DILI患者可发展为慢性肝损伤[85],其中近半数涉及TCM[86]。
4 中药-药物性肝损伤研究中的问题及要点
鉴于DILI发生率相对较低,即便是因肝毒性撤市的药物,其导致严重肝ADR(导致患者死亡或肝移植)的发生率多低于万分之一[1];潜伏期较长,很难判断DILI与用药的关联性[87];临床表现与已知的其他肝脏疾病类似,目前尚缺乏特异性的DILI诊断指标,需结合可疑药物应用史、临床特征和肝脏生化学指标动态改变的特点、药物再激发反应、其他肝损伤病因的排除等进行综合分析[1];发病机制亦较复杂,迄今尚未充分阐明[6]。因此,药物上市前研究常常难以观察到肝ADR,批准上市在大量人群中使用后,其肝毒性才逐渐暴露。
TCM多为复方制剂,成分复杂,多联合用药,作用相对和缓,肝毒性往往涉及多种成分和机制的综合效应,严重肝ADR的发生率相对更低,作用机制更为复杂。即便在上市后阶段,TCM-DILI的诊断及评价仍是安全性评价的难点。
4.1对中药-药物性肝损伤风险的认识
近年来,TCM的肝毒性风险逐渐成为社会关注的热点。由于TCM多与CM联合使用,涉及因素复杂;目前临床使用的DILI诊断标准主要针对CM,据此常难以判断TCM与DILI的关联性,临床对TCMDILI的认识呈两极化趋势。
过度夸大TCM-DILI风险。①临床存在“非西即中”的倾向,将无法确认原因的肝损伤均归因于TCM[88];②将三级医院的统计数据作为TCM-DILI的发病数据,DILI诊断属排除性诊断,需完成详细的实验室检查,排除其他原因导致的肝损伤后方能确诊;基层医院多不具备确诊条件,往往需转至上级医院诊治,三级医院的统计数据中涉及药品类别及严重程度的分布与TCM-DILI的实际存在差别;③将涉及天然属性产品的DILI均按TCM-DILI统计,如个别文献将含植物组分的染发剂(含多种肝毒性化学成分)所致DILI按TCM-DILI统计;某文献记载涉及DILI的TCM中三分之一不属于TCM,其中CM占13.3%,中西复方制剂占2.2%,食品占17.8%;另有20%据名称不能判断其属于TCM。不严谨的研究数据夸大了TCM-DILI的风险。
过度迷信TCM及天然药物的安全性。国外调查数据显示,59%的美国成年人错误的认为HDS是安全的[50],91%的香港居民认为TCM是安全的;亚洲国家的医疗专业人中也有较大比例认为TCM无毒[59],临床诊断时由于相信TCM的安全性往往错误的将其从DILI的病因中排除,或因未能问诊到TCM的用药史,延误了DILI的诊断与治疗;也表现为TCM-DILI出现再激发甚至三重激发的病例较多,再激发后患者病情加重。这可能是多项研究中TCM-DILI严重病例较多的原因。
4.2中药-药物性肝损伤的诊断
临床中常用因果关系评价法(Roussel Uclaf Causality Aassessment Method,RUCAM)量表判断药物与DILI的关联性,由于TCM的肝毒性一般未在药品说明书中标注(属于量表的加分项),采用RUCAM法可能会低估TCM的风险,故以CM为对象的DILI诊断标准用于TCM时往往误诊率较高,有必要针对TCM特点及临床实际制订针对性强的诊断标准。
Kamisako[74]对比了日本1989-1998年和1997-2006年开展的2项全国性DILI调查的数据,发现植物药DILI由4.7%增至7.1%,膳食补充剂由0.7%大幅增至10%。文献作者认为其原因可能是1997-2006年的调查应用了DDW-J 2004诊断标准,该标准较适用于植物药及膳食补充剂DILI的诊断。
近年来,国外涉及HDS的DILI增长迅速,诊断标准及临床指南中针对HDS的特点也增加了相关内容。ACG发布了全球首个I-DILI临床指南[54,87],该指南在因果关系评估中建议考虑地理环境、生长条件和制造工艺改变对HDS成分的影响,HDS成分或浓度也可能随时间而发生改变;此外,HDS产品中可能包含标签中未标注的成分(如污染物或添加剂)。考虑到以上因素对HDS成分的影响,该指南推荐使用专家意见程序(structured expert opinion process,SEOP)代替RUCAM评估HDS肝毒性。此外,指南建议将SAS(如FDA的MEDWATCH系统)作为疑似HDS肝毒性病例收集的重要手段。
国内也针对TCM的特点开展了相关诊断标准的制订工作。肖小河和李秀惠等组织制订了《中草药相关肝损伤临床诊疗指南》,并作为团体标准由中华中医药学会发布[89]。该指南包括中草药致肝损伤术语和定义、流行病学、临床表现和分型、鉴别诊断策略和方法、诊断标准、治疗原则和预防等14项内容,以及9项推荐意见[90]。《指南》充分考虑了中草药临床应用的复杂性,对指导中草药肝损伤客观辨识完整证据链的整合构建,规范中草药相关肝损伤诊断和治疗,引导中草药相关肝损伤评价与研究有较大意义。
4.3中药-药物性肝损伤的研究及评价
4.3.1毒性筛选及预测
随着对DILI发病机制和规律认识的深入,国内外逐步探索使用多种方法预测药物的肝毒性,并取得了一定进展。Chen等[56]发现每天剂量≥100 mg且辛醇-水分配系数(logP值)≥3的药物可能存在较高的肝毒性风险,可作为药物肝毒性的预测指标。对179种口服制剂的分析结果显示,符合上述规则的药物中85%存在肝毒性,15种药物中有14种因肝毒性撤市。Schadt等[91]研究了一种肝毒性预测系统,该系统包括药物活性代谢产物的生成、人胆盐输出泵(BSEP)的抑制、线粒体和细胞毒性等方面的信息,对39种化合物进行测试结果显示其准确度、灵敏度和特异性分别达到79%,76%和82%。
药物活性代谢产物与肝细胞大分子的共价结合(covalent binding,CB)可能为I-DILI的发生机制之一,Usui等[92]的研究发现,单独CB值不足以评估药物DILI风险,而CB值与最大日剂量的乘积可反映肝的药物暴露水平,可作为I-DILI风险的评估指标。Huang等[93]依据已有肝毒性数据库建立了定量构效关系(quantitative structure-activity relation⁃ship)模型。经嵌套10倍交叉验证,该模型准确度、灵敏度和特异性分别达到79.1%,91.2%和53.8%;91种常用草药的评估结果显示,该模型准确度达到87%;利用该模型在台湾TCM数据库筛选出潜在肝毒性物质6853种,其中100种已得到公开文献证实。
此外,也可考虑选择离体肝灌流、肝切片和原代肝细胞等方法,采用毒理学替代法对药物潜在的肝毒性进行筛选及评价。
4.3.2动物实验
由于存在种属差异,动物实验的肝毒性评价结果有时与临床实际存在较大差距。据估计,对人体有肝毒性的化合物中有38%~51%在动物实验中观察不到肝毒性[1]。TCM由于其成分复杂,作用和缓,DILI发病涉及的遗传因素、基础疾病、联合用药等在动物实验中难以复制;某些TCM-DILI与长期用药有关,可能超过动物实验的给药周期;TCM所致的DILI多属异质型,由于其存在不可预测性,常与剂量无关,采用正常动物一般难以观察到肝毒性。故采用动物实验评价TCM的肝毒性时,应结合其特点,必要时应考虑延长给药周期,或考虑选择异质肝损伤动物模型,以科学反映TCM的肝毒性风险。
在TCM、天然药物临床前动物实验阶段,肝毒性问题是研发失败的主要原因之一,因此,在TCM新药研发的早期尽早发现受试物的潜在肝毒性是毒理学研究的重要内容,应引起重视。在中药新药的立项阶段应充分收集相关安全性信息,包括处方中各药味毒性成分的毒理学研究信息、临床应用的不良反应报道及其新药工艺的选择等,重视安全性实验设计,尽早发现受试物肝毒性的信号[94]。
此外,目前申请临床试验的TCM,尽管要求必须进行动物的安全性评价,但复方制剂,由于较难进行药代动力学研究或选择其中所含成分的药动学研究可能不能全面反映复方的体内代谢过程[95],敏感动物的筛选也成为评价的障碍,因此,仅仅通过一种啮齿类动物进行重复给药的毒性实验可能并不能暴露出药物的潜在肝毒性。
肝固有免疫系统细胞因子失衡可能在I-DILI的发病中起到关键作用[96]。Goto等[97]在原代培养大鼠肝巨噬细胞孵育液中加入肝毒性(对乙酰氨基酚等)或无肝毒性(左氧氟沙星等)化合物,同时加入脂多糖(lipopolysaccarides,LPS)孵育24 h,并与不加LPS组对照比较。结果显示,肝毒性物质可刺激LPS诱导的促炎细胞因子白细胞介素1β(inter⁃leukin-1β,IL-1β)分泌,抑制LPS诱导的抗炎细胞因子IL-6和IL-10的分泌,对LPS诱导的肿瘤坏死因子α分泌则无明显影响。
何首乌含二苯乙烯苷和蒽醌类等成分,经规范炮制后所含二苯乙烯苷含量一般明显降低[63,98],其肝毒性也明显降低[16]。大剂量(75.6 g·kg-1)的何首乌对正常大鼠无明显肝毒性[99],大剂量二苯乙烯苷(折合临床剂量60~120倍)对大鼠有一定的肝毒性[100];而采用内毒素I-DILI动物模型进行研究,2倍临床等效剂量(1.08 g·kg-1)的何首乌即可导致明显的肝功能损伤[99]。二苯乙烯苷有免疫调节作用,蒽醌类体外研究显示存在一定的细胞毒性[101],提示何首乌肝毒性作用机制可能与多种成分引起的肝固有免疫系统细胞因子失衡有关。
4.3.3临床研究
药品严重肝ADR的发生率大多低于万分之一[1],按照3S原则,一般需30 000例才能确保观察到1例。我国药品上市前研究一般只要求开展数百例的临床研究,新药监测期内开展的Ⅳ期临床最低要求是2000例。上市前受样本量、观察周期和研究费用等限制,一般很难观察到此类ADR。如已有证据显示,新药所含药味或组分可导致严重的DILI,可考虑适当增加上市前临床研究样本量以满足评价需求。科学的上市前临床研究能发现药物可能存在的严重肝毒性[1]。
肝生化指标的改变并不代表药物存在明显的肝毒性,更值得关注的是转氨酶升高的幅度与速度。某些药物(如他汀类、肝素等)会引起转氨酶一过性升高,一般是正常上限值(upper limits of normal,ULN)的3~5倍,却几乎不会进展为严重肝损伤;服用他克林的患者50%会出现谷丙转氨酶(GPT)升高,停药或减量后基本可恢复正常[1]。何首乌及其成方制剂所致肝损伤一般属轻、中度,多呈可逆性,预后多较好,也有严重肝损伤的个案报告;其肝损伤作用机制、物质基础及风险程度等仍有待于进一步研究[16]。用药后转氨酶升高>3×ULN较为常见,如对照组正常,则应注意是否存在肝损伤信号;如转氨酶大幅度(10~15×ULN)快速升高,则提示药物可能有潜在的肝毒性;如伴有血浆凝血酶原时间或国际标准化比值延长,则存在导致严重肝损伤的可能[1]。而总胆红素持续升高伴转氨酶下降(胆酶分离)或白蛋白、凝血功能的降低,一般提示肝损伤较重[6]。
临床研究时应特别关注Hy′s Law病例,即转氨酶升高〔谷草转氨酶(GOT)或(GPT)>3×ULN〕且并伴有其他原因无法解释的总胆红素升高(总胆红素>2×ULN而碱性磷酸酶正常),符合该标准的病例出现严重DILI(死亡或肝移植)的概率>10%[1]。在样本量足够的前提下,临床研究时发现1例即值得关注,发现2例则药物大规模应用于临床时有较大概率出现严重DILI。曲格列酮、溴芬酸和希美检(ximelagatran)加群等多个药物的研究结果[1]及其他临床实践均验证了Hy′s Law的预测价值[9,11-12]。
4.3.4不良反应监测
由于严重DILI较为罕见,TCM-DILI的评价多难以在上市前完成,上市后可结合TCM特点,开展大规模的监测研究。其中被动监测因可发现罕见的严重ADR,在TCM-DILI的研究评价中具有较高的应用价值。
目前国内外逐步应用数据挖掘(data mining)方法在SAS被动监测数据中检测药品风险信号,或结合文献及主动监测数据开展信号挖掘研究。该法依据非均衡性测量法的理论,可筛选出其他研究方法难以发现的风险信号。常用的挖掘方法有成比例不良反应报告比值法(proportional ADR report⁃ing ratio,PRR)、报告比例比法(reporting odds ra⁃tio,ROR),贝叶斯可信区间神经网络传递法(bayesian confidence propagation neural net⁃work method,BCPNN)和英国药物及保健品管理局(Medicines and Healthcare Products Regulatory agency,MHRA)法等。国外采用累积PRR法描绘FDA不良事件报告系统(FDA′s adverse eventreporting system,FAERS)数据库中DILI特征,快速识别新上市药品潜在的肝毒性[102]。采用ROR法对FAERS数据库中涉及新上市口服抗凝剂的DILI报告进行了分析,检测出利伐沙班(rivaroxaban)与ALF的风险信号(ALF:n=25,ROR=2.08,95%CI 1.34,3.08)[103]。采用FAERS数据库信号挖据和文献综述相结合的方法评估了抗真菌药的DILI风险,涉及抗真菌药的肝损伤报告占2.9%(共1964例,其中112例ALF),11种全身性抗真菌药(酮康唑、特比萘芬及三唑类新药伏立康唑、泊沙康唑等)存在肝损伤风险信号[104],提示抗真菌药肝毒性较为普遍。
作者结合TCM特点,采用PRR和ROR法对ADR监测数据进行了分析。结果显示,补骨脂-肝损伤信号检测值(95%CI)分别为12.98(11.70~14.39)和12.40(11.22~13.69),提示存在补骨脂致肝损伤的风险信号[105]。进一步的研究显示,日剂量>4 g和2~4 g的制剂(以补骨脂计)肝损伤ADR的构成比分别为<2 g的4.74和2.61倍,显示肝损伤风险与剂量呈正相关。服用剂量相同、组方不同的补骨脂口服制剂,肝损伤ADR构成比差别较大,提示可能存在毒性协同或配伍减毒作用。此外,炮制及制备工艺、基础疾病等因素对肝损伤的发生也有一定影响。
5 展望
TCM在中国药品销售额中所占比重>25%[51],美国成年人使用草药治疗的比例>21%(21%~71%)[50],墨西哥临床使用的草药>4500种[36]。药用植物也是候选新药的重要来源,1/3的新药源于植物成分或其衍生物,大蒜、银杏、锯棕榈和贯叶金丝桃等的临床疗效已取得基于随机对照试验的系统评价证据[50]。
与CM类似,DILI也是TCM最值得关注的安全性问题之一。近年来,许多草药及TCM(如卡瓦、麻黄和金不换等)因肝毒性被限制使用或禁用[106]。由于TCM成分复杂,绝大多数TCM肝毒性的物质基础、风险程度及作用机制尚不明确,极大的限制了TCM的发展及临床应用。故有必要结合TCM特点,开展大规模药物流行病学研究及系统地安全性评价,取得相关安全性证据,有效控制其风险。
5.1开展药物性肝损伤流行病学研究
发病率是评估DILI风险程度的关键指标。获取多种TCM的DILI发病率数据,综合评估TCMDILI总体风险的有效途径是开展大规模DILI流行病学研究,特别是基于人群的流行病学研究。通过研究,既可以全面掌握TCM单个品种及总体的DILI发病率,也可获取CM-DILI的发病率数据,两者进行平行对比,可全面、科学、客观地描绘TCM-DILI的风险程度及特征(发病率、严重程度及转归等),是扭转目前国内外对TCM-DILI认识误区的有力手段。
5.2构建中药肝毒性大数据平台
与CM不同,TCM大多源于已有临床应用基础的药用植物、动物、矿物等。目前,TCM新药研发的主要路线包括从现有TCM中提取有效成分或有效部位、新的复方制剂和改变已上市TCM的剂型或给药途径,即已上市的TCM或其组方药味、有效部位、有效成分是TCM新药的主要候选目标。
除注册分类为2和3的TCM新药外,其他各类TCM新药的组方药味、有效部位或有效成分均已在临床使用,已有直接或间接的临床安全性、有效性研究数据。汇总已有的TCM安全性研究数据,依据TCM组方药味、有效部位或成分进行聚类分析,既可为含相同组分TCM的安全用药提供参考,也可用于指引TCM新药的研发,降低TCM新药的研发风险[107]。
同样,在上市前评价阶段,如发现某一TCM新药的组方药味、有效成分或有效部位存在肝毒性风险,也可作为信号用于指引含相同药味或成分TCM的上市后评价。TCM上市前评价结果互为指引、互为佐证。
此外,汇总TCM上市前后的安全性研究数据,以及涉及肝毒性的TCM成分信息,并据此构建TCM肝毒性大数据平台,结合计算毒理学、网络毒理学等新兴学科方法,有助于早期预测TCM肝毒性,减少TCM新药研发及临床应用风险。
[1] FDA.Guidance for industry drug-induced liver in⁃jury:premarketing clinical evaluation[EB/OL]. (2009-07-01)[2016-03-31].http://www.fda.gov/ OHRMS/DOCKETS/98fr/07d-0396-gdl0001.pdf.
[2] Aithal GP.Drug-induced liver injury[J].Medicine,2015,43(10):590-593.
[3] Björnsson ES.Drug-induced liver injury:an over⁃view over the most critical compounds[J].Arch Toxicol,2015,89(3):327-334.
[4] Maddukuri VC,Bonkovsky HL.Herbal and dietary supplement hepatotoxicity[J].Clin Liver Dis,2014,4(1):1-3.
[5] Oh SJ,Cho JH,Son CG.Systematic review of the incidence of herbal drug-induced liver injury in Korea[J].J Ethnopharmacol,2015,159(1):253-256.
[6] Yu LC,Mao YM,Chen CW.Guidelines for themanagement of drug-induced liver injury[J].J Clin Hepatol(临床肝胆病杂志),2015,31(11):1752-1769.
[7] Sgro C,Clinard F,Ouazir K,Chanay H,Allard C,Guilleminet C,et al.Incidence of drug-induced hepatic injuries:a French population-based study[J].Hepatology,2002,36(2):451-455.
[8] Björnsson ES,Bergmann OM,Björnsson HK,Kvaran RB,Olafsson S.Incidence,presentation,and outcomes in patients with drug-induced liver injury in the general population of Iceland[J]. Gastroenterology,2013,144(7):1419-1425.
[9] Andrade RJ,Lucena MI,Fernández MC,Pelaez G,Pachkoria K,García-Ruiz E,et al.Drug-in⁃duced liver injury:an analysis of 461 incidences submitted to the Spanish registry over a 10-year period[J].Gastroenterology,2005,129(2):512-521.
[10] Hisamochi A,Kumashiro R,Sata M.Do the na⁃tional survey results reflect the state of drug-in⁃duced liver injury in a single local city in which there is no hospital having Members of the Board of Councilors of the Japan Society of Hep⁃atology?Results of a questionnaire survey con⁃ducted in a local city[J].Hepatol Res,2011,41 (3):225-232.
[11] Ou P,Chen Y,Li B,Zhang M,Liu X,Li F,et al.Causes,clinical features and outcomes of drug-induced liver injury in hospitalized patients in a Chinese tertiary care hospital[J].Springer⁃plus,2015,4:802.
[12] Suk KT,Kim DJ,Kim CH,Park SH,Yoon JH,Kim YS,et al.A prospective nationwide study of drug-induced liver injury in Korea[J].Am J Gas⁃troenterol,2012,107(9):1380-1387.
[13] Woo HJ,Kim HY,Choi ES,Cho YH,Kim Y,Lee JH,et al.Drug-induced liver injury:a 2-year retrospective study of 1169 hospitalized patients in a single medical center[J].Phytomedicine,2015,22(13):1201-1205.
[14] Takikawa H,Murata Y,Horiike N,Fukui H,Onji M.Drug-induced liver injury in Japan:an analysis of 1676 cases between 1997 and 2006 [J].Hepatol Res,2009,39(5):427-431.
[15] Wai CT.Presentation of drug-induced liver injury in Singapore[J].Singapore Med J,2006,47 (2):116-120.
[16]CFDA.Beware of the potential risk of liver inju⁃ry induced by Heshouwu and it's preparations of oraladministration[EB/OL].(2014-07-16)[2016-03-31].http://www.cfda.gov.cn/WS01/ CL0078/102903.html.
[17] Shen T,Duan ZJ,Zhuang H.Epidemiology of drug-induced liver injury[J].Chin Hepatol(肝脏),2015,20(10):819-823.
[18] Onji M,Fujioka S,Takeuchi Y,Takaki T,Osawa T,Yamamoto K,et al.Clinical characteristics of drug-induced liver injury in the elderly[J].Hepa⁃tol Res,2009,39(6):546-552.
[19] Xu JM.A multicenter surveyonhospitalin patients with drug-induced acute liver injury in China[J].Chin J Dig(中华消化杂志),2007,27 (7):439-442.
[20] Lin JY,Zhang Y.Clinical features of drug-induced liver injury:a review of Chinese literatures 2007-2011[J].Chin J Gen Pract(中华全科医师杂志),2013,12(5):361-365.
[21] Wang YZ,Zhang Y.Clinical features of druginduced liver injury in the elderly:a review of Chinese literatures 2006-2011[J].Chin J Gastro⁃enterol Hepatol(胃肠病学和肝病学杂志),2012,21(5):473-476.
[22] Zhang YM,Zhuang J,ChenRL.Literature review on drug induced liver injury[J].Drug Evaluation(药品评价),2012,9(35):30-31
[23] Wu XN,You H,Jia JD.Clinical features of druginduced liver injury:a review of Chinese literatures 2003-2007[J].Chin Hepatol(肝脏),2008,13 (6):463-466.
[24] Cai LQ.The cases analysis of drug-induced liver injury[J].Strait Pharm J(海峡药学),2014,26 (7):183-185.
[25] Zhang ZF,Zhao G.Chronological evolvement of the etiology of drug-induced liver injury in China:a meta-analysis[J].Med Philos(医学与哲学),2013,34(20):8-13.
[26] Xu CY,Wang FW,Sun ZG,Chen LP.Meta analysis on rates of drug-induced liver injury by Chinese herbal medicines in China[J].J Emer⁃gency TCM(中国中医急症),2014,23(11):1988-1989,2043.
[27] ChenJG,WangYZ.Clinicalanalysison120cases with drug-induced liver injury[J].Chin Hepatol(肝脏),2014,19(10):772-774.
[28] Qi YB,Qiu L,Jiang HL,Zhang R,Hu YL.Clinical characteristics of drug-induced liver injury:an analysis of 394 cases[J].J Clin Hepatol(临床肝胆病杂志),2014,30(5):438-441.
[29] Zhang CP,Cui XL,Wang YM.Retrospective analysis of 200 patients with drug induced liver injury[J].Chin Hepatol(肝脏),2014,19(7):483-486.
[30] Shi H,Wei J,Wang ZK,Wang SD,Yang MF,Lu YK,et al.Common agents in patients with drug-induced liver injury and observation of ther⁃apeutic efficacy of ursodeoxycholic acid[J].J Pract Hepatol(实用肝脏病杂志),2015,18(1):34-37.
[31] Hao KY,Yu LC,He CL,Wang MR,Wang SM,Li X.RUCAM Scale-based diagnosis,clinical features and prognosis of 140 cases of drug-in⁃duced liver injury[J].Chin J Hepatol(中华肝脏病杂志),2014,22(12):938-941.
[32] Yao YJ,Liu HL,Zhu B,Liu WS,Zang H,Li C,et al.Analysis of clinical features and pathologi⁃cal change in 441 patients with drug-induced liv⁃er injuries[J].J Pract Hepatol(实用肝脏病杂志),2015,18(3):286-289.
[33] Liu LN,Chen W,Guo HY,Lu Y,He J,Sun ZG. Comparative study on clinical characteristics of 78 cases with drug-induced liver injury caused by traditional Chinese medicine or Western med⁃icine[J].Chin J Liver Dis:Electronic Version(中国肝脏病杂志:电子版),2015,7(1):46-50.
[34] Liu LN,Zhao JX,Lu WT,Chen GM,Chen W. Prognostic factors in patients with drug-induced liver injuries[J].J Pract Hepatol(实用肝脏病杂志),2015,18(2):160-163.
[35] Yan YL,Zhou L.The mechanism,diagnosis and management of liver injury induced by traditonal Chinese medicine[J].Chin Hepatol(肝脏),2014,19(9):684-686.
[36] Valdivia-Correa B,Gómez-Gutiérrez C,Uribe M,Méndez-Sánchez N.Herbal medicine in Mexico:a cause of hepatotoxicity.a critical review[J].Int J Mol Sci,2016,17(2):235-244.
[37] Mi LA,Andrade R,Kaplowitz N,García-Cortes M,Fernández M,Romero-Gomez M,et al. Phenotypic characterization of idiosyncratic druginduced liver injury:the influence of age and sex [J].Hepatology,2009,49(6):2001-2009.
[38] Fountain FF,Tolley E,Chrisman CR,Self TH. Isoniazid hepatotoxicity associated with treat⁃ment of latent tuberculosis infection:a 7-year evaluation from a public health tuberculosis clinic [J].Chest,2005,128(1):116-123.
[39] OstapowiczG,FontanaRJ,SchiødtFV,Larson A,Davern TJ,Han SH,et al.Results of a prospective study of acute liver failure at 17 tertiary care centers in the United States[J]. Ann Intern Med,2002,137(12):947-954.
[40] Zhou Y,Yang L,Liao Z,He X,Zhou Y,Guo H. Epidemiology of drug-induced liver injury in China:a systematic analysis of the Chinese liter⁃ature including 21,789 patients[J].Eur J Gas⁃troenterol Hepatol,2013,25(7):825-829.
[41] Wei AN,Fang Y,Liang GT,Yu YH,Kuang HB,Wen WP.Analysis of clinical risk factors associ⁃ated with anti-tuberculosis drug-inducing liver in⁃jury[J].J Clin Pulm Med(临床肺科杂志),2015,20(9):1556-1559.
[42] Li ZQ,Hu M,Xue RG.Drug-induced liver injury in elderly persons[J].J Pract Hepatol(实用肝脏病杂志),2015,18(6):575-577.
[43] Chen CM,Chang B,Zhang D,Xiang GQ,He XH,Wang BY.Etiology and injury types of drug-in⁃duced liver indury in Shenyang[J].World Chin J Digestol(世界华人消化杂志),2008,16(22):2525-2528.
[44] Dai DL,Wen FQ,Cai HB,Zhou SM.Clinical analysis of severe liver damage in children[J].J ClinPediatr(临床儿科杂志),2015,33(10):846-849.
[45] Zhu Y,Wang P,Yin T.Clinical characters analy⁃sis of patients with drug-induced liver injury com⁃bined with hepatitis B[J].China Pharm(中国药师),2014,17(10):1702-1704.
[46] Aithal GP.Pharmacogenetic testing in idiosyn⁃cratic drug-induced liver injury:current role in clinical practice[J].Liver Int,2015,35(7):1801-1808.
[47] Tang N,Deng R,Wang Y,Lin M,Li H,Qiu Y,et al.GSTM1 and GSTT1 null polymorphisms andsusceptibilitytoanti-tuberculosisdruginduced liver injury:a meta-analysis[J].Int J Tuberc Lung Dis,2013,17(1):17-25.
[48] Phillips EJ,Mallal SA.HLA-B*5701 and flucloxa⁃cillin associated drug-induced liver disease[J]. AIDS,2013,27(3):491-492.
[49]Tujios S,Fontana RJ.Mechanisms of drug-in⁃duced liver injury:from bedside to bench[J].Nat Rev Gastroenterol Hepatol,2011,8(4):202-211.
[50] Bent S,Ko R.Commonly used herbal medicines in the United States:a review[J].Am J Med,2004,116(7):478-485.
[51]Ministry of Commerce of the Prople′s Republic of China.The 2014 pharmaceutical distribution indurstry to statitical analysis reports[EB/OL]. (2015-06-18)[2016-03-31].http://sczxs.mof⁃com.gov.cn/article/dyplwz/bh/201506/20150601 017235.shtml.
[52] Lammert C,Einarsson S,Saha C,Niklasson A,Bjornsson E,Chalasani N.Relationship betweendaily dose of oral medicationsand idiosyncratic drug-induced liver injury[J].Hepatology,2008,47(6):2003-2009.
[53] Lee WJ,Kim HW,Lee HY,Son CG.Systemat⁃ic review on herb-induced liver injury in Korea [J].Food Chem Toxicol,2015,84:47-54.
[54] Chalasani NP,Hayashi PH,Bonkovsky HL,Navarro VJ,Lee WM,Fontana RJ,et al.ACG clinical guideline:the diagnosis and manage⁃ment of idiosyncratic drug-induced liver injury [J].Am J Gastroenterol,2014,109(7):950-966.
[55] Lucena MI1,Kaplowitz N,Hallal H,Castiella A,García-Bengoechea M,Otazua P,et al.Recur⁃rent drug-induced liver injury(DILI)with differ⁃ent drugs in the Spanish Registry:the dilemma of the relationship to autoimmune hepatitis[J].J Hepatol,2011,55(4):820-827.
[56] Chen M,Borlak J,Tong W.High lipophilicity and high daily dose of oral medications are asso⁃ciated with significant risk for drug-induced liver injury[J].Hepatology,2013,58(1):388-396.
[57] Zhong X,Zhang YT,Ji LW,Hu X,Cheng G. Investigation of the co-administration of simvas⁃tatin or atorvastatin with cytochrome P4503A4 in⁃hibitors or inducers in cardiology ward[J].Chin J Drug Appl Monit(中国药物应用与监测),2013,10(4):189-192.
[58] He LN,Yang AH,Cui TY,Zhai YR,Zhang FL,Chen JX,et al.Reactive metabolite activation by CYP2C19-mediated rhein hepatotoxicity[J]. Xenobiotica,2015,45(4):361-372.
[59] Wai CT,Tan BH,Chan CL,Sutedja DS,Lee YM,Khor C,et al.Drug-induced liver injury at an Asian center:a prospective study[J].Liver Int,2007,27(4):465-474.
[60] Ernst E.Toxic heavy metals and undeclared drugs in Asian herbal medicines[J].Trends Pharma⁃col Sci,2002,23(3):136-139.
[61] Bogusz MJ,Al Tufail M,Hassan H.How natural are‘natural herbal remedies’? A Saudi per⁃spective[J].Adverse Drug React Toxicol Rev,2002,21(4):219-229.
[62] Jiao YT,Gao J,Ren B,Li X,Hu Y,Zhang W,et al.Hepatotoxicity and nephrotoxicity of Chi⁃nese herbal medicine and their countermeasures [J].World Chin Med(世界中医药),2014,9 (1):124-127.
[63] Cui HR,Bai ZF,Song HB,Jia TZ,Wang JB,Xiao XH.Investigation of potential toxic factors for fleece-flower root:from perspective of pro⁃ cessingmethodsevolution[J].ChinJChin Mater Med(中国中药杂志),2016,41(2):334-339.
[64] Song HB,Du XX,Guo XX,Ren JT,Yang L,Pang Y. Safety and risk factor analysis on Radix Polygo⁃ni Multiflori base on ancient traditional Chinese medicine literatures[J].Chin J Chin Mater Med(中国中药杂志),2015,40(5):985-988.
[65] Jia R,Lu BP.The etiology and pathogenesis of drug-induced liver injury[J].TCM Res,2011,24(1):32-33.
[66] Chen C.Negative effect of the large recipe of Chinese herbal medicine to liver diseases[J]. Chin Gen Pract(中国全科医学),2010,13(34):3929-3930.
[67] Wan GS,Zhang LX.Traditional herbal medi⁃cines(″Kampo″)and drug-inducedliver dis⁃ease[J].Prog Jpn Med(日本医学介绍),2006,27(6):264.
[68] Huang DL,Xiang J,Liu XD,Zhang M.Advances in the research of traditional Chinese medicine induced liver injury[J].Strait Pharm J(海峡药学),2012,24(10):13-15.
[69] WangJL,ZhouCF.ResearchprogressofChinese herbal medicine and traditional Chinese medicine resulting in liver injury[J].China J Chin Mater Med(中国中药杂志),2011,36(23):3371-3374.
[70] Li C.Progress in research of herbal induced liver damage[J].J Pract Hepatol(实用肝脏病杂志),2013,16(3):278-281.
[71] Teng GJ,Liang QS,Sun Y,Chang BX,Zhang W,Zhao J,et al.Clinical features and pathological analysis of 165 patients with liver injury induced by Chinese herbal medicine[J].Chin Arch Tra⁃dit Chin Med,2014,32(4):913-916.
[72] Lee BM,Lee WC,Jang JY,Ahn P,Kim JN,Jeong SW,et al.Clinical features of drug-in⁃duced liver injury according to etiology[J].J Korean Med Sci,2015,30(12):1815-1820.
[73] Liu R,Liu YY,Wei Y.The liver damage induced by treatment of psoriasis with traditional Chinese medicine:a clinical analysis[J].Jilin Med J(吉林医学),2006,27(3):285-286.
[74] Kamisako T.Present status of drug-induced liver injury(Dili)in Japan:is a proposed diagnostic scale useful?[J].Hepatol Res,2009,39(10):949-950.
[75] Xu HY.The comparative clinical study on druginduced liver injury by chemical medicine and traditional Chinese medicine[J].Guide China Med(中国医药指南),2013,11(27):368-369.
[76] Zhang CP.Retrospective analysis of 45 patients with drug induced liver injury in the elderly[J]. Chin J Pharmacoepidemiol(药物流行病学杂志),2015,24(5):285-288.
[77] Wang YZ,Zhang Y.Clinical analysis of drug-in⁃duced liver injury in the elderly[J].China Med Her(中国医药导报),2012,9(14):80-82.
[78] Zhang W,Teng GJ,Li BS,Sun Y,Chang BX,Zhao J,et al.Clinical features and pathological analysis of 72 elderly patients with drug-induced liver injury[J].Chin J Pharmacoepidemiol(药物流行病学杂志),2013,22(5):242-245.
[79] Estes JD,Stolpman D,Olyaei A,Corless CL,Ham JM,Schwartz JM,et al.High prevalence of potentially hepatotoxic herbal supplement use in patients with fulminant hepatic failure[J]. Arch Surg,2003,138(8):852-858.
[80] Lu WT,Li J,Ou N,Liu Y,Guo XJ,Wang J,et al. An analysis of 72 cases with liver disease causedbytraditionalChinesemedicine[J]. Jiangsu Med J(江苏医药),2007,33(6):546-547.
[81] Guo YJ,Li JT,Chang ZJ.Clinical analysis of 92 patients with liver injury induced by traditional Chinese medicine[J].J Pract Hepatol(实用肝脏病杂志),2009,12(6):453-454.
[82] Sun YQ,Wu X,Gong M,Liu HH,Zhang N,Jing J,et al.The clinical analysis of 77 patients with hepatitis induced by traditional Chinese medicine[J].Chin Hepatol(肝脏),2013,18 (12):827-828.
[83] Zhang Y,Nie QH.Analysis of complications and death causes of 1892 patients with liver failure [J].J Pract Hepatol(实用肝脏病杂志),2014,17 (2):129-132.
[84] Chalasani N,Fontana RJ,Bonkovsky HL,Wat⁃kins PB,Davern T,Serrano J,et al.Causes,clinical features,and outcomes from a prospec⁃tive study of drug-induced liver injury in the Unit⁃ed States[J].Gastroenterology,2008,135(6):1924-1934.
[85] Hou FQ,Zeng Z,Wang GQ.Hospital admis⁃sions for drug-induced liver injury:clinical fea⁃tures,therapy,and outcomes[J].Cell Biochem Biophys,2012,64(2):77-83.
[86] Zhu WJ,Zhao XY,Ma H.Advancement in chronic drug-induced liver injury[J].Chin J Hepatol(中华肝脏病杂志),2015,23(9):718-720.
[87] Ming YN,Liu XL,Mao YM.A brief introduction of ACG clinical guideline:the diagnosis and management of idiosyncratic drug-induced liver injury[J].Chin Hepatol(肝脏),2014,19(8):564-569.
[88] Wang GB,Xiao XH,Du XX,Zou ZS,Song HB,Guo XX.Identification and early diagnosis for traditional Chinese medicine-induced liver injury based on translational toxicology[J].China J Chin Mater Med,2014,39(1):5-9.
[89] Hu B.The diagnosis and management guideline of herb-induced liver injury released[N].China News TCM(中国中医药报).2016-03-18(1).
[90] T/CACM 005-2016.Guideline for Diagnosis and Treatment of Herb-induced Liver Injury[S].
[91] Schadt S,Simon S,Kustermann S,Boess F,Mcginnis C,Brink A,et al.Minimizing Dili risk in drug discovery-a screening tool for drug can⁃didates[J].Toxicol In Vitro,2015,30(1 Pt B):429-437.
[92] Usui T,Mise M,Hashizume T,Yabuki M,Komuro S. Evaluation of the potential for drug-induced liver injury based on in vitro covalent binding to human liver proteins[J].Drug Metab Dispos,2009,37 (12):2383-2392.
[93] Huang SH,Tung CW,Fülöp F,Li JH.Develop⁃ing a QSAR model for hepatotoxicity screening of the active compounds in traditional Chinese medicines[J].Food Chem Toxicol,2015,78:71-77.
[94]Han L.Hepatitis toxicity of traditional drugs and relevant preclinical safety evaluation s[J].World Sci Technol-Mod TCM(世界科学技术——中医药现代化),2010,12(1):25-27.
[95] Han L.Current situation and consideration of pharmacokinetic study on multiple components of traditional Chinese medicine[J].China J Chin Mater Med(中国中药杂志),2008,33(21):2442-2448.
[96] Pieters R.Role of the immune system in Dili;les⁃sons learned from animal studies[J].Toxicol Lett,2015,238(2,Suppl):S40.
[97] Goto S,Deguchi J,Nishio N,Nomura N,Funabashi H.Hepatotoxicants induce cytokine imbalance in response to innate immune system [J].J Toxicol Sci,2015,40(3):389-404.
[98] Chen QT,Zhuo LH,Xu W,HUANG ZH,Qiu XH. Contentchangesof5componentsin Polygohum muhiflorum during processing[J]. Chin J Exp Trad Med Form(中国实验方剂学杂志),2012,18(5):66-71.
[99] Li CY,Li XF,Tu C,Li N,Ma ZJ,Pang JY,et al. The idiosyncratic hepatotoxicity of Polygonum multiflorum based on endotoxin model[J].ActaPharmaceu Sin(药学学报),2015,50(1):28-33.
[100] Hu XQ,Zhuo J,Li YL,Wang JS,Wang L.Ef⁃fects of stilbene glucoside from Polygonum Multi⁃florumThunb.onhepaticenzymesand se⁃rum albumin of rats[J].Liaoning J TCM,2011,38(5):988-990.
[101] Yu J,Xie J,Mao XJ,Wang MJ,Li N,Wang J,et al.Hepatoxicity of major constituents and ex⁃tractions of Radix Polygoni Multiflori and Radix Polygoni Multiflori Praeparata[J].J Ethnophar⁃macol,2011,137(3):1291-1299.
[102]Brinker AD,Lyndly J,Tonning J,Moeny D,Levine JG,Avigan MI.Profiling cumulative pro⁃portional reporting ratios of drug-induced liver in⁃jury in the FDA Adverse Event Reporting Sys⁃tem(FAERS) database[J].DrugSafety,2013,36(12):1169-1178.
[103] Raschi E,Poluzzi E,Koci A,Salvo F,Pariente A,Biselli M,et al.Liver injury with novel oral antico⁃agulants:assessing post-marketing reports in the US Food and Drug Administration adverse event reporting system[J].Br J Clin Pharmacol,2015,80(2):285-293.
[104]Raschi E,Poluzzi E,Koci A,Caraceni P,De Ponti F.Assessing liver injury associated with antimycotics: conciseliteraturereviewand clues from data mining of the FAERS database [J].World J Hepatol,2014,6(8):601-612.
[105]Song HB.The risk signals and safety characteris⁃tics based on analysis of the adverse reaction monitoring data of buguzhi[C]//Proceedings of the 7th National Congress of Toxicology,Chinese Society of Toxicology(CSOT-Ⅶ)and 8th Hubei Science and Technology Forum,2015:144.
[106]Bunchorntavakul C,Reddy KR.Review article:herbal and dietary supplement hepatotoxicity[J]. Aliment Pharmacol Ther,2013,37(1):3-17.
[107]Song HB,Du XX,Ren JT,Guo XX,Yang L,Pang Y.Enlightenment of adverse drug reaction monitoring on safety evaluation of traditional Chinese medicines[J].China J Chin Mater Med(中国中药杂志),2015,40(8):1620-1623.
(本文编辑:齐春会 贺云霞)
Epidemiologic characteristics,risk factors and safety evaluation of traditional Chinese medicine induced liver injury
SONG Hai-bo1,HAN Ling2
(1.Center for Drug Reevaluation,China Food and Drug Administration,Beijing 100045,China;2.Center for Drug Evaluation,China Food and Drug Administration,Beijing 100038,China)
There have been increasing reports on liver injury induced by traditional Chinese medicine (TCM)and natural medicine in recent years.The risk of liver injury induced by TCMs has attracted more attention at home and abroad.In this paper,epidemiologic characteristics,risk factors,clinical features of TCMs induced liver injury were discussed.The myth about research and safety evaluation of TCMs induced liver injury was analyzed.Based on the property of TCMs and characteristics of their clinical use,this paper proposed the priorities of basic and clinical safety evaluation of TCMs induced liver toxicity.It is hoped that this study may provide reference for scientific evaluation of liver toxicity of TCMs.
traditional Chinese medicine;drug-induced liver injury;risk factors;safety evaluation
The project supported by National Mega-project of Science Research of China for New Drug Development (2015ZX09501004-001);State Administration of Traditional Chinese Medicine Industry Scientific Research Special Project(201507004);and National Natural Science Foundation of China(81470849)
SONG Hai-bo,Tel:(010)68586147,E-mail:songhiabo@cdr-adr.org.cn
R285.1
A
1000-3002-(2016)04-0291-15
国家“重大新药创制”科技重大专项(2015ZX0950 1004-001);中医药行业科研专项(201507004);国家自然科学基金(81470849)
宋海波,E-mail:songhaibo@cdr-adr.org.cn
2016-03-28接受日期:2016-04-10)

