Ⅱ型胶原糖胺聚糖复合支架对hUCMSCs成软骨诱导的实验研究*
蔡第心,何鹏举,谭洪波,丁 晶,余开富,张 颖,周田华,杨 军,徐永清△
(1.昆明医科大学骨科,昆明 650000;2.成都军区昆明总医院骨科,昆明 650000)
Ⅱ型胶原糖胺聚糖复合支架对hUCMSCs成软骨诱导的实验研究*
蔡第心1,何鹏举2,谭洪波2,丁晶2,余开富2,张颖2,周田华2,杨军2,徐永清2△
(1.昆明医科大学骨科,昆明 650000;2.成都军区昆明总医院骨科,昆明 650000)
目的探讨以人脐带间充质干细胞(hUCMSCs)作为软骨组织工程种子细胞,Ⅱ型胶原复合糖胺聚糖支架材料作为细胞载体及其细胞-支架复合体成软骨的可行性。方法制备Ⅱ型胶原复合糖胺聚糖多孔支架,电镜观察测定支架材料的孔径、孔隙率和亲水性,对支架材料进行相应的组织学分析。培养鉴定P3代的hUCMSCs,将hUCMSCs混悬液接种到Ⅱ型胶原复合糖胺聚糖支架上,不加诱导剂进行培养,3周后取出样品行甲苯胺蓝、番红精O染色,Ⅱ型胶原免疫组织化学染色及扫描电镜观察。结果第3代hUCMSCs高度表达CD29、CD105等间充质细胞标志,几乎不表达CD34等内皮细胞、造血细胞标志。Ⅱ型胶原复合糖胺聚糖支架材料呈白色多孔泡沫状,孔隙率为(91.8±2.17)%,孔径110~230 μm,分布均匀,相互贯通。吸水膨胀率为(213.71±1.31)%,亲水性良好。甲苯胺蓝、番红精O及Ⅱ型胶原免疫组织化学染色呈阳性。细胞-支架复合体在培养过程中可观察到有软骨样组织形成并逐步增多,甲苯胺蓝、番红精O及Ⅱ型胶原免疫组织化学染色均呈阳性,电镜观察显示细胞在支架上增殖活跃,与材料黏附紧密,可见软骨样细胞及其周围大量交错连接的胶原纤维。结论hUCMSCs与Ⅱ型胶原复合糖胺聚糖支架材料复合,可在体外不经诱导而初步构建组织工程软骨,为软骨损伤的修复奠定了一定的实验基础。
人脐带间充质干细胞;种子细胞;糖胺聚糖;支架;组织工程软骨
因创伤、肿瘤、结核及痛风等代谢性疾病引起软骨缺损,从而导致的关节疼痛、关节活动受限,是骨科亟待解决的难题之一。目前,临床上常见的治疗方法如自体软骨膜及骨膜移植、自体/异体骨软骨移植等修复的软骨大多为纤维软骨,耐磨性差[1],在生物和机械性能上与透明软骨有着很大差别,应用效果不佳[2-3]。Vasiliadis等[4]发现,从人体非负重区取一小块软骨在体外培养3周后,移植入缺损区并覆盖上骨膜,可以生成以Ⅱ型胶原为主的透明软骨,在此基础上衍生出了一种新的软骨修复技术——基质诱导的自体软骨细胞移植(matrix-induced autologous chondrocytes implantation,MACI)。MACI将软骨细胞接种培养到生物相容性较好的三维生物材料支架上,再将其移植到缺损处修复软骨缺损。但是,软骨细胞的增殖潜力有限,经过几次体外的传代培养后会逐渐去分化,失去软骨细胞表型和再分化能力。间充质干细胞(mesenchymal stem cells,MSCs)具有自我更新和多向分化的潜能,在组织工程细胞治疗及基因治疗等方面具有广阔的研究及应用背景,被称为是软骨组织工程中最具研究价值的种子细胞[5]。Kasemkijwattana等[6]将骨髓MSCs移植到胶原支架上以治疗骨性关节炎患者,取得了满意的效果。单纯的充质干细胞在体外诱导成软骨的能力有限,并不能满足组织工程化软骨构建及软骨缺损修复的要求。因此,构建组织工程软骨不仅仅要有合适的种子细胞,还必须选择一个合适的支架材料,为MSCs的黏附、生长提供必要的三维空间。本实验在以往的研究基础上,通过对软骨组织进行脱细胞处理,制备多孔的Ⅱ型胶原复合糖胺聚糖软骨支架材料,并将人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUCMSCs)移植到支架材料上,不使用诱导剂让hUCMSCs向软骨细胞分化,在支架材料上构建组织工程化软骨,为制备仿生组织工程化软骨,以及构建更加复杂的组织工程关节创造条件,并为之提供实验基础。
1 材料与方法
1.1细胞株来源原代hUCMSCs由成都军区昆明总医院临床试验科细胞室提供。
1.2方法
1.2.1hUCMSCs的培养及鉴定将hUCMSCs转移至细胞培养瓶中,向培养瓶中加入含有10%胎牛血清(FBS)、100 U/mL青霉素、100 mg/L链霉素的DMEM/F-12培养基,在5% CO2、37 ℃恒温、4%湿度的细胞培养箱中静置培养,每日在显微镜下观察细胞的生长情况。3 d后进行首次细胞换液,弃去未贴壁的细胞,此后3~4 d更换1次培养液。待细胞生长至贴壁覆盖约80%~90%时,用0.25%胰蛋白酶/乙二胺四乙酸(EDTA)消化液消化,按1∶3比例进行传代,将细胞分装入新的培养瓶当中,置于5% CO2、37 ℃恒温、4%湿度的细胞培养箱中静置培养,每日在显微镜下观察细胞生长、增殖情况及其形态变化。采用流式细胞仪检测细胞表面标志物对hUCMSCs进行鉴定:分别取原代、第3代的细胞,用1∶1的2.5 g/L胰蛋白酶及0.2 g/L EDTA消化液消化,离心机1 200 r/min离心8 min,磷酸盐缓冲液(PBS)重悬细胞,制成细胞浓度为1×106/mL的细胞悬液,分别加入小鼠抗人单克隆抗体CD29-藻红蛋白(PE)、CD44-PE、CD90-PE、CD105-PE、CD34-PE、CD45-PE等各10 μL,充分摇匀,室温下反应30 min,每管再加入PBS 1.5 mL,1 200 r/min离心5 min,弃上清液,每管加入PBS 100 μL重悬细胞,最后上机进行流式细胞仪检测。
1.2.2Ⅱ型胶原糖胺聚糖支架的制作及鉴定在无菌洁净工作台上,用手术刀片切取新鲜的猪膝关节透明软骨制作软骨片,用4 ℃保存的PBS冲洗切取的猪膝关节软骨片多次,之后将其放入含有蛋白酶抑制剂的Tris-HCl溶液中备用。将软骨片置入搅拌器中,加入适量的冷藏的Tris-HCl缓冲液,3 000 r/min搅拌15 min,将得到的软骨浆置入无菌容器内,分别加入配制好的Triton X-100液、蛋白酶抑制剂、消化酶液[1 U/mL牛胰核糖核酸酶A(RNase A)和50 U/mL脱氧核糖核酸酶Ⅰ(DNase Ⅰ)混合液],不断地搅拌使其充分混匀,37 ℃过夜后,将其置于恒温振荡机(37 ℃)上震荡24 h。将消化酶处理后的软骨浆液置入高速离心机,7 000 r/min,4 ℃离心8 min,弃上清液,PBS彻底冲洗,将离心、冲洗步骤重复5次。去除多次离心、PBS冲洗后离心管内的上清液,将脱细胞后的软骨基质浆液用PBS稀释,浓度调制为30%,分别置于6孔培养板、24孔培养板内,将培养板置于冰冻干燥机中,-20 ℃预冻36 h,待其基本成形后,-80 ℃下冰冻干燥24 h。将支架材料刀片切割后扫描电镜下观察,测定支架材料的孔径、孔隙率和亲水性。进行支架材料的苏木精-伊红(HE)染色、番红精O染色、甲苯胺蓝染色和Ⅱ型胶原免疫组织化学检测,并在镜下观察。
1.2.3Ⅱ型胶原糖胺聚糖支架对hUCMSCs成软骨的诱导将hUCMSCs培养至第3代,用0.25%胰蛋白酶/EDTA消化液消化,1 200 r/min离心5 min,收集细胞,将细胞浓度调至2×107/mL。将钴-60放射消毒灭菌后的Ⅱ型胶原复合糖胺聚糖支架置于培养板内,用注射器慢慢地将hUCMSCs悬液注射到支架材料上,使细胞均匀地覆盖整个支架材料,加入含10% FBS的DMEM/F-12培养基,使培养基完全浸润支架,放入5% CO2、37 ℃恒温、4%湿度的细胞培养箱中静置培养,每日在显微镜下观察细胞的黏附、生长、增殖及分化情况,3~4 d换1次,培养时间为12周。培养3周后取出部分标本,用10%的甲醛固定24 h,梯度乙醇脱水,然后用石蜡包埋,切片(5 μm厚度),进行HE染色、甲苯胺蓝染色和Ⅱ型胶原免疫组织化学检测,并在镜下观察。将hUCMSCs在Ⅱ型胶原及糖胺聚糖复合支架材料培养12周后取出,进行扫描电镜观察细胞的生长、繁殖及分化情况。
2 结 果
2.1hUCMSCs的形态观察及表面标志物测定传代后的细胞生长能力明显增强,显微镜下细胞呈均一的梭形生长,类似于成纤维细胞,呈典型的漩涡状排列生长,细胞在传代过程中形态并无明显变化,在细胞传至第3代时剩下形态较为单一的细胞(图1A),适用于流式细胞仪检测。流式细胞仪检测hUCMSCs免疫表型,结果显示:原代培养的hUCMSCs已经开始高表达CD44、CD90、CD105,但是仍有一定程度地表达CD34、CD45,而第3代的hUCMSCs则高度表达CD29、CD105等间充质细胞标志,几乎不表达CD34等内皮细胞、造血细胞标志(图1B、C、D)。
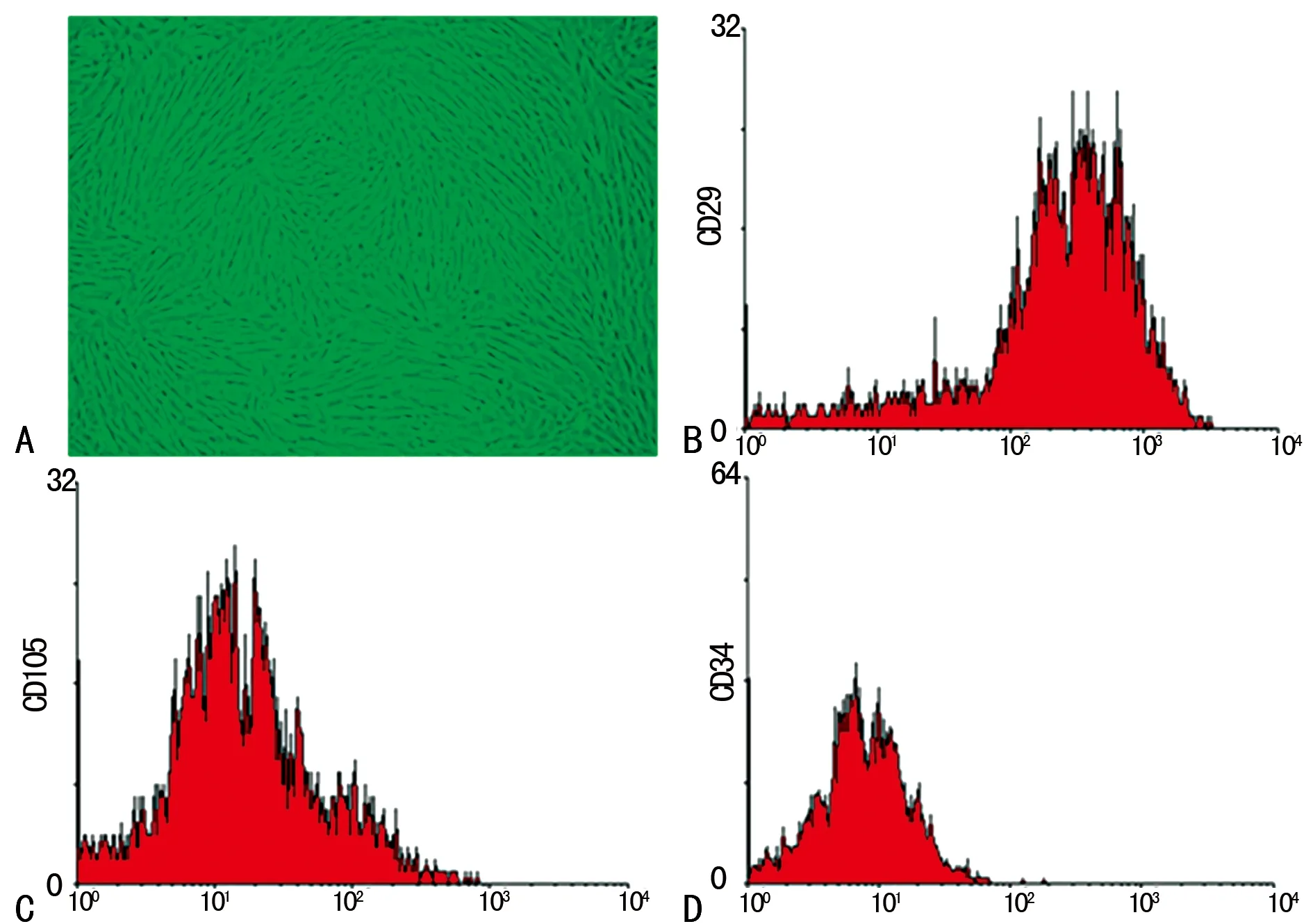
图1 第3代hUCMSCs的形态及免疫表型
2.2Ⅱ型胶原糖胺聚糖支架的形态观察及鉴定制作好的Ⅱ型胶原复合糖胺聚糖复合支架材料为白色、多孔的泡沫状圆柱体,可见支架材料的表面孔隙较多,刀片切开可见支架材料内部孔隙分布均匀,孔隙之间相互贯通(图2A、B)。Ⅱ型胶原复合糖胺聚糖复合支架在扫描电镜下观察可见支架呈多孔泡沫状,孔隙分布均匀,材料内空隙相互连通,孔径平均,孔径值在110~230 μm之间(图2C)。支架孔隙率为(91.80±2.17)%,满足软骨组织工程学支架材料孔隙率的要求。支架吸水膨胀率为(213.71±1.31)%,显示支架亲水性良好。支架材料HE染色镜下观察显示:支架材料呈多孔、多孔泡沫状结构,孔径均匀,孔隙之间相互贯通(图3A);甲苯胺蓝染色阳性提示:支架材料中有糖胺聚糖存在(图3B);番红精O染色阳性提示:支架材料中已无细胞成分存在(图3C);Ⅱ型胶原免疫组织化学染色阳性提示:将软骨脱细胞处理后Ⅱ型胶原得到了极大的保存,它与糖胺聚糖是该支架材料的主要成分(图3D)。
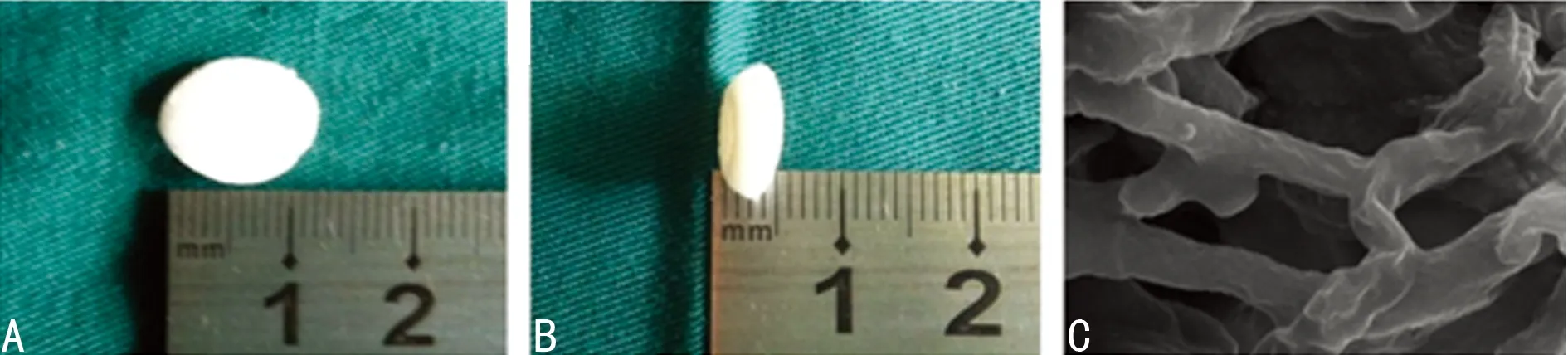
A:正面;B:侧面;C:电镜扫描(×5 000)。
图2支架材料正侧面及电镜扫描结果

A:HE染色(×200);B:甲苯胺蓝染色(×200);C:番红精O染色(×200);D:Ⅱ型胶原免疫组织化学染色(×200)。
图3Ⅱ型胶原复合糖胺聚糖复合支架材料染色观察结果
2.3Ⅱ型胶原糖胺聚糖支架对hUCMSCs成软骨的诱导hUCMSCs在Ⅱ型胶原糖胺聚糖复合支架材料中培养3周后,即可肉眼观察到支架材料表面有白色“软骨样”组织形成;第4周后,可明显观察到支架材料表面白色“软骨样”组织随着培养时间延长较前明显增多;第10周时,可观察到白色“软骨样”组织覆盖整个支架材料表面;培养满12周后取出观察为:乳白色软骨样组织,表面光滑,体积较支架材料稍增大,标本的弹性可,质稍软(图4)。诱导3周后的标本HE染色:镜下可以观察到支架表面黏附细胞数量较多,表明支架对细胞的黏附能力较强,并有片状软骨陷窝状结构,有类软骨样组织形成(图5A);甲苯胺蓝染色:呈强阳性反应,证明细胞外有大量胶原成分及糖胺聚糖生成(图5B);Ⅱ型胶原免疫组织化学检测结果显示:呈强阳性,说明有大量的软骨细胞特异性成分(Ⅱ型胶原)生成(图5C)。在扫描电镜观察下可见:细胞在支架材料上生长良好,与材料黏附紧密,细胞分裂增殖活跃,可见软骨样细胞及其周围大量的胶原纤维,胶原纤维相互交错连接(图5D)。

图4 接种了hUCMSCs的Ⅱ型胶原糖胺聚糖支架体外成软骨过程
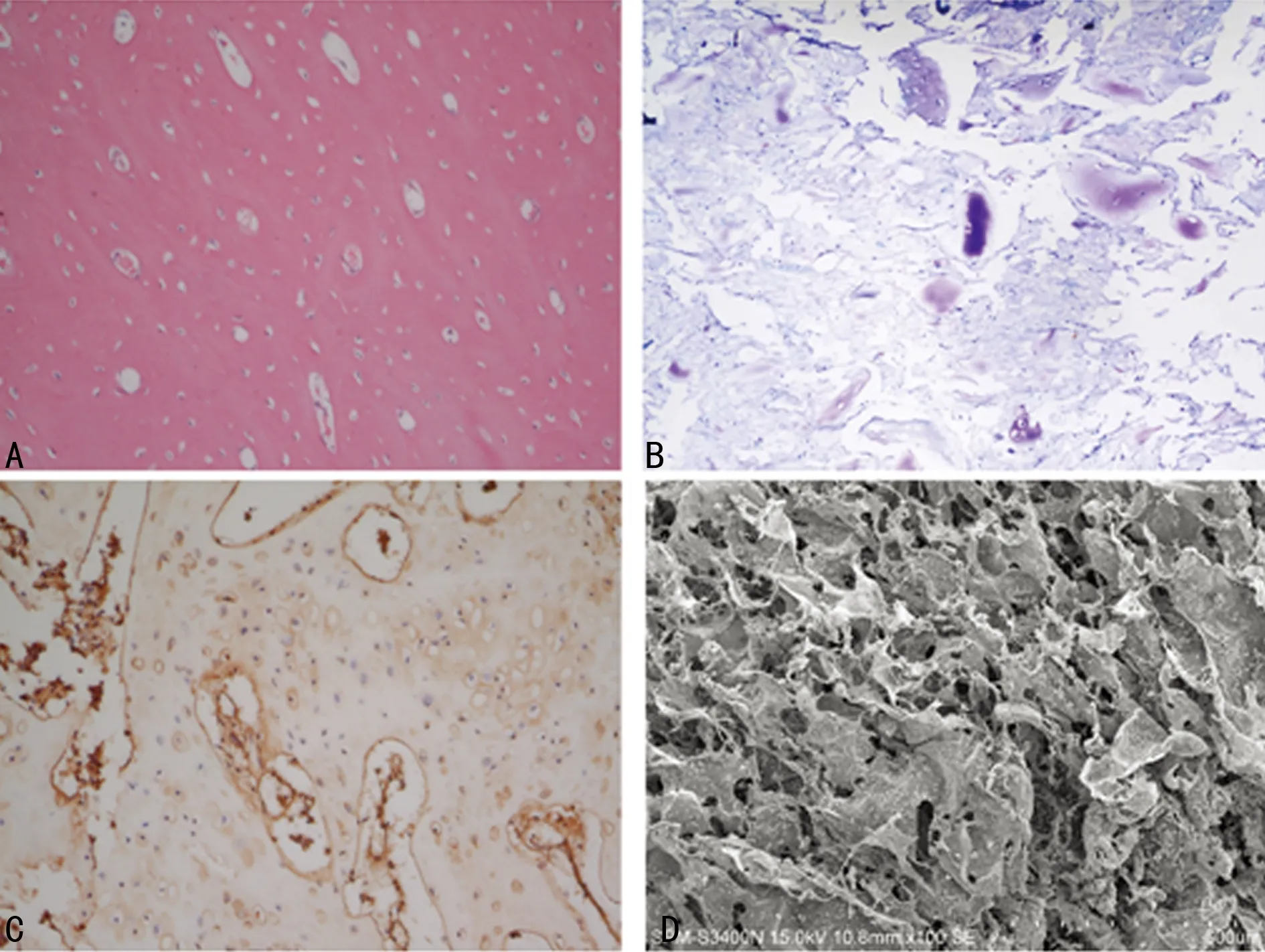
A:HE染色(×200);B:甲苯胺蓝染色(×200);C:Ⅱ型胶原免疫组织化学染色(×200);D:扫描电镜观察(×100)。
图5接种了hUCMSCs的Ⅱ型胶原糖胺聚糖支架(诱导3周)的染色观察结果
3 讨 论
目前,MSCs在软骨损伤修复方面已经有了广泛的应用,研究证实其具备向软骨细胞分化的能力[7-8]。将各种来源的MSCs与软骨细胞进行共培养显示,其能分泌各种生物活性分子来促进软骨细胞的增殖和细胞外基质的形成[9-10]。MSCs具有免疫调节特性,包括抑制细胞的增殖和分化,免疫调节其他的免疫细胞如自然杀伤细胞和巨噬细胞[11]。因此,如果要在临床上广泛使用MSCs,需要进行仔细的调查,行敏感测试,以确保达到安全的细胞治疗的目的[12]。经过多年的研究证实:hUCMSCs增殖、分化能力更强,免疫原性更低,安全性高,适合于广泛的临床运用[13]。本实验证明了hUCMSCs是可以在短时间内快速扩增的,培养出来的细胞也可以正常稳定地传代,细胞形态及其增殖能力没有明显改变。流式细胞仪检测结果表明:hUCMSCs高度表达CD29和CD105,几乎不表达造血干细胞标志物,这与骨髓来源的MSCs相似,是目前较理想的软骨组织工程种子细胞。
为了使MSCs向软骨细胞定向分化,一般是在培养时加入各种生物活性分子如转化生长因子β、骨形态发生蛋白、胰岛素样生长因子等进行诱导[14]。近年来有研究表明,天然软骨来源的细胞外基质支架能在没有外源性生长因子干预的条件下,诱导多能干细胞的成软骨分化,认为直接的细胞-细胞外基质相互作用能显著影响干细胞的表型表达和分化[15]。将MSCs培养于Ⅱ型胶原三维支架中,在没有转化生长因子-β1等生物活性分子的干预和诱导下,Ⅱ型胶原能够上调SRY相关高迁移率组基因9(SRY-related high mobility group-box gene 9,Sox9)、Ⅱ型胶原、聚集蛋白聚糖(aggrecan,AGG)、软骨寡聚基质蛋白 (cartilage oligomeric matrix protein,COMP)和Ⅹ型胶原(collagen type Ⅹ,coll 10)的mRNA表达,促进MSCs的软骨细胞相关表型表达,促进细胞合成Ⅱ型胶原和糖胺聚糖,诱导其成软骨,这也表明MSCs能对特定的细胞外基质环境做出反应[16]。虽然关于生物活性分子对MSCs分化调节机制的研究很多,但是对细胞外基质如何调节MSCs分化机制的研究很少。一个可能的机制就是细胞外基质通过整合素受体对MSCs进行分化调控,整合素受体是介导细胞和其外环境的跨膜受体,阻断特定的整合素受体后,可观察到MSCs的成软骨分化被抑制[17]。
将hUCMSCs与合适的生物材料支架复合,模拟天然软骨细胞外基质结构和生化环境,可能进一步提高其成软骨分化潜能。本实验将P3代hUCMSCs接种到Ⅱ型胶原及糖胺聚糖复合支架上,并在体外进行非诱导剂下的培养。天然软骨来源的细胞外基质支架材料在经过实验验证后证实,该材料的成分与结构和天然软骨类似,所以能够更好地模拟软骨细胞的细胞外基质环境,有利于软骨细胞的生长、增殖及表型维持。因此,它可以作为未来软骨组织工程研究的一个方向。本实验培养出的软骨组织标本HE染色、甲苯胺蓝染色及Ⅱ型胶原免疫组织化学检测均为阳性,镜下可以观察到片状软骨陷窝状结构,有类软骨样组织形成,细胞外有大量Ⅱ型胶原成分及糖胺聚糖生成。但是,本实验培养出的软骨在力学性能上欠佳,质软。因此,如何在非诱导条件下,使hUCMSCs能够在体外构建更为成熟的组织工程软骨还需要进一步的研究。笔者构建的组织工程软骨在体外培养时间较短,长期培养后hUCMSCs是否会出现去分化现象,移植入体内后是否可以形成软骨组织尚不清楚,这也需要进一步的研究。但是笔者确信,随着研究的不断深入,组织工程软骨必会表现出其良好的应用前景。
综上所述,本文hUCMSCs经检测显示符合MSCs的基本生物学特性,可以作为软骨组织工程良好的种子细胞来源,而Ⅱ型胶原复合糖胺聚糖支架材料具备适合细胞生长、增殖的孔径和孔隙率,亲水性及生物相容性良好,可以作为软骨组织工程良好的细胞载体,将两者复合可在体外不经诱导而初步构建组织工程软骨,为软骨损伤的修复奠定了一定的实验基础。
[1]Hunziker EB.The elusive path to cartilage regeneration[J].Adv Mater,2009,21(32/33):3419-3424.
[2]Grande DA,Sgaglione NA.Regenerative medicine: self-directed articular resurfacing: a new paradigm[J].Nat Rev Rheumatol,2010,6(12):677-678.
[3]Kreuz PC,Steinwachs MR,Erggelet C,et al.Results after microfracture of full-thickness chondral defects in different compartments in the knee[J].Osteoarthritis Cartilage,2006,14(11):1119-1125.
[4]Vasiliadis HS,Wasiak J.Autologous chondrocyte implantation for full thickness articular cartilage defects of the knee[J].Cochrane Database Syst Rev,2010(10):CD003323.
[5]Grässel S,Lorenz J.Tissue-engineering strategies to repair chondral and osteochondral tissue in osteoarthritis: use of mesenchymal stem cells[J].Curr Rheumatol Rep,2014,16(10):452.
[6]Kasemkijwattana C,Hongeng S,Kesprayura S,et al.Autologous bone marrow mesenchymal stem cells implantation for cartilage defects: two cases report[J].J Med Assoc Thai,2011,94(3):395-400.
[7]Wang Y,Yuan M,Guo QY,et al.Mesenchymal stem cells for treating articular cartilage defects and osteoarthritis[J].Cell Transplant,2015,24(9):1661-1678.
[8]Ko JY,Kim KI,Park S,et al.In vitro chondrogenesis and in vivo repair of osteochondral defect with human induced pluripotent stem cells[J].Biomaterials,2014,35(11):3571-3581.
[9]Wu L,Prins HJ,Helder MN,et al.Trophic effects of mesenchymal stem cells in chondrocyte co-cultures are independent of culture conditions and cell sources[J].Tissue Eng Part A,2012,18(15/16):1542-1551.
[10]Caplan AI.Adult mesenchymal stem cells for tissue engineering versus regenerative medicine[J].J Cell Physiol,2007,213(2):341-347.
[11]Yi T,Song SU.Immunomodulatory properties of mesenchymal stem cells and their therapeutic applications[J].Arch Pharm Res,2012,35(2):213-221.
[12]Duarte DM,Cornélio DA,Corado C,et al.Chromosomal characterization of cryopreserved mesenchymal stem cells from the human subendothelium umbilical cord vein[J].Regen Med,2012,7(2):147-157.
[13]Majore I,Moretti P,Stahl F,et al.Growth and differentiation properties of mesenchymal stromal cell populations derived from whole human umbilical cord[J].Stem Cell Rev,2011,7(1):17-31.
[14]Murphy MK,Huey DJ,Hu JC,et al.TGF-β1,GDF-5,and BMP-2 stimulation induces chondrogenesis in expanded human articular chondrocytes and marrow-derived stromal cells[J].Stem Cells,2015,33(3):762-773.
[15]Cheng NC,Estes BT,Awad HA,et al.Chondrogenic differentiation of adipose-derived adult stem cells by a porous scaffold derived from native articular cartilage extracellular matrix[J].Tissue Eng Part A,2009,15(2):231-241.
[16]Bosnakovski D,Mizuno M,Kim G,et al.Chondrogenic differentiation of bovine bone marrow mesenchymal stem cells (MSCs) in different hydrogels: influence of collagen type Ⅱ extracellular matrix on MSC chondrogenesis[J].Biotechnol Bioeng,2006,93(6):1152-1163.
[17]Shakibaei M.Inhibition of chondrogenesis by integrin antibody in vitro[J].Exp Cell Res,1998,240(1):95-106.
Experimental research of type Ⅱ collagen composite glycosaminoglycan scaffold in hUCMSCs chondrogenic induction*
CaiDixin1,HePengju2,TanHongbo2,DingJing2,YuKaifu2,ZhangYing2,ZhouTianhua2,YangJun2,XuYongqing2△
(1.DepartmentofOrthopedics,KunmingMedicalUniversity,Kunming,Yunnan650000,China;2.DepartmentofOrthopedics,KunmingGeneralHospitalofChengduMilitaryRegion,Kunming,Yunnan650000,China)
ObjectiveTo investigate the chondrogenic feasibility of the human umbilical cord derived mesenchymal stem cells(hUCMSCs)as cartilage tissue engineering seed cells,type Ⅱ collagen composite glycosaminoglycan scaffold as the cellular carrier and cell-scaffold complex.MethodsThe type Ⅱ collagen composite glycosaminoglycan scaffolds was prepared.The pore diameter,porosity and hydrophilia of scaffold materials were observed and measured by electronic microscope.The corresponding histological analysis on the scaffold materials was performed.hUCMSCs of P3 generation were cultured and identified.The hUCMSCs suspension was inoculated in the type Ⅱ collagen composite glycosaminoglycan scaffold for conducting culture without adding inducer.The samples were taken out after 3 weeks and performed the toluidine blue and safranin O staining,type Ⅱ collagen immunohistochemical staining and SEM scanning.ResultshUCMSCs of P3 generation highly expressed the mesenchymal cell marker CD29 and CD105,while hardly expressed endothelial cells of CD34 and hematopoietic cell markers.The type Ⅱ collagen composite glycosaminoglycan scaffold presented white porous foam like,the porosity was (91.8±2.17)%,the average pore diameter was 110-230 μm,which was homogeneously distributed and had interpenetration.The scaffold showed good hydrophilicity with the water absorption expansion rate of (213.71±1.31)%.The scaffold staining of toluidine blue,safranin O and type Ⅱ collagen was positive.The cartilage-like tissues were observed,and gradually increased in the surface of cell-scaffold complex along with culture,which were positive in Toluidine blue,safranin O and type Ⅱ collagen staining,the electronic microscopic observation displayed that the cells were actively proliferated in the scaffold,closely adhered with the materials,the cartilage-like cells and a large number of peripheral collagen fibers with zigzag connection could be seen.ConclusionCompositing hUCMSCs and type Ⅱ collagen composite glycosaminoglycan scaffold could construct tissue-engineering cartilage in vitro without induction,which lays a certain experimental foundation for the repair of cartilage damage.
human umbilical cord mesenchymal stem cells;seed cells;glycosaminoglycan;scaffold;tissue-engineering cartilage
国家自然科学基金资助项目(81360274);第57批博士后科学基金面上资助项目(2015M572718);云南省应用基础研究自筹经费项目(2014F2106);成都军区昆明总医院院管项目(2012YG12)。作者简介:蔡第心(1986-),住院医师,在读博士,主要从事骨与软骨组织工程研究。△
,E-mail:xuyongqingkm@163.net。
R318
A
1671-8348(2016)21-2890-04
2016-01-27
2016-04-14)
论著·基础研究doi:10.3969/j.issn.1671-8348.2016.21.003

