各期慢性肾脏病患者腰椎定量CT骨密度与骨代谢指标的关系
杨 洁 康建国 吕艳伟 程晓光 王晓飞 李 欣 张利平 付 晨 丁致民
(北京积水潭医院肾内科,北京 100035)
·其他·
各期慢性肾脏病患者腰椎定量CT骨密度与骨代谢指标的关系
杨洁康建国1吕艳伟2程晓光3王晓飞李欣张利平付晨丁致民
(北京积水潭医院肾内科,北京100035)
目的分析慢性肾脏病(CKD)1~5D期患者腰椎骨密度(BMD)与钙磷代谢、25羟维生素D〔25(OH)D〕和骨转换生化标志物的关系。方法CKD患者142例,根据估算肾小球滤过率(eGFR)及是否透析分为CKD1~5D期,腰椎定量CT(QCT)测定患者BMD,检测血白蛋白(ALB)、钙(Ca)、磷(P)、25(OH)D、全段甲状旁腺激素(iPTH)、碱性磷酸酶(ALP)、总I型前胶原氨基端延长肽(tPINP)、I型胶原羧基端肽β特殊序列(β-CTX)、骨钙素(OC),分析QCT-BMD与骨代谢相关指标关系。结果BMD值、血ALB、Ca、ALP、25(OH)D在CKD1~5D各期之间均无统计学差异(P>0.05)。<70岁组,CKD5~5D期患者P高于CKD1~4期;CKD4~5D期患者tPINP高于CKD1~3期;CKD4~5期患者β-CTX高于CKD1~3期,CKD5D期患者高于CKD1~3及5期;CKD4~5期患者OC、iPTH均高于CKD1~3期,CKD5D期患者高于CKD1~5期(P<0.05)。≥70岁组,CKD5D期患者血P高于CKD1~5期;CKD5期患者tPINP、OC均高于CKD1~4期,CKD5D期高于CKD1~5期;CKD5~5D期患者β-CTX高于CKD1~4期;CKD5期患者iPTH高于CKD1~4期,CKD5D期患者高于CKD2~3期(P<0.05)。BMD值与eGFR、Ca、P、25(OH)D及骨转换生化标志物无相关性(P>0.05)。eGFR与P、tPINP、β-CTX、OC、iPTH呈负相关(P<0.01)。多因素Logistic回归分析CKD骨质疏松或CKD-MBD伴低BMD的独立危险因素为年龄(≥70岁),性别(女性)和血钙水平(高钙血症)。结论维持正常血钙对于CKD骨质疏松或低BMD非常重要。
慢性肾脏病;骨密度;骨转换生化标志物
慢性肾脏病-矿物质和骨异常(CKD-MBD)是由于慢性肾脏病(CKD)导致的矿物质及骨代谢异常综合征,CKD-MBD中骨的异常主要包括骨转运异常、矿化异常和骨量的异常,表现为骨折、骨痛、身高变矮等。骨活检是诊断CKD-MBD的金标准,但临床实际操作困难。本研究应用腰椎定量CT(QCT)测量CKD不同分期患者腰椎骨密度(BMD),探讨各期CKD患者BMD与骨代谢相关指标的关系。
1 对象和方法
1.1对象2013年1月至2015年10月我院确诊的CKD患者142例。排除标准:(1)接受过甲状旁腺切除术;(2)严重肝脏疾病;(3)恶性肿瘤晚期;(4)骨肿瘤或骨先天发育异常;(5)除外严重血液系统疾病如多发性骨髓瘤、白血病、淋巴瘤等;(6)长期卧床不起;(7)一年内新发骨折;(8)重度营养不良。
1.2研究方法
1.2.1一般资料收集人口学资料、相关病史(高血压、糖尿病、肝脏疾病、肿瘤等)。
1.2.2QCT 扫描方案与技术采用东芝64排CT(Aquilion 64)及Mindways公 司 的 QCT骨密度测量系统,CT 扫描参数:电压 120 kV,电流125 mA,床高90 cm,扫描时间0.5 s,螺距0.938,重建视野(field of view,FOV)40 cm。扫描时QCT校准体模放在患者的腰部。测量方法:CT扫描图像传到QCT分析工作站,由技术人员通过Mindways软件逐一测量L1~4中未骨折椎体的后取均值。需排除明显骨质破坏区,如果椎体大部骨质破坏则排除破坏椎体。全部病例的腰椎 CT 图像由有经验的放射科医师读片。
1.2.3总Ⅰ型前胶原氨基端延长肽(tPINP)、Ⅰ型胶原羧基端肽β特殊序列(β-CTX)、骨钙素(OC)、全段甲状旁腺激素(iPTH)、25羟基维生素D〔25(OH)D〕的测定清晨空腹抽取静脉血,室温放置30~60 min后,3 000 r/min离心10 min,分离血清进行检测。采用罗氏电化学发光免疫分析仪E601进行检测,配套试剂及校准品。采用双抗体夹心法检测iPTH(1~84氨基酸),正常参考范围15~65 pg/ml。
1.2.4血清钙(Ca)、磷(P)、白蛋白(ALB)、碱性磷酸酶(ALP)、肌酐(SCr)检测清晨空腹抽取静脉血,采用日本HITACH7600全自动生化分析仪,MTB比色法测定总Ca,磷钼酸紫外法测定P,溴甲酚绿法测定ALB,速率法测定ALP,酶法测定SCr。
1.3诊断标准
1.3.1CKD定义及分期采用2002年K/DOQI慢性肾脏病临床实践指南的分期标准〔1〕,分为CKD1~5期,CKD5D期为CKD5期接受规律血液透析超过1年的患者。采用2009CKD-EPI(非黑人)公式计算估算肾小球滤过率(eGFR)。
1.3.2骨质疏松或CKD-MBD伴低BMD定义QCT测定BMD<80 mg/cm3作为骨质疏松的诊断标准〔2〕。其中CKD1~2期及CKD3期iPTH在正常范围,若BMD降低,称为骨质疏松;CKD3~5D期伴BMD降低,称为CKD-MBD伴低BMD〔3〕。
1.3.3CKD3~5D期血Ca分期应用校正钙进行分期,校正钙(mmol/L)计算公式=测定血总Ca(mmol/L)+〔40-血ALB(g/L)〕×0.025。校正钙<2.10 mmol/L为低钙血症,2.10~2.50 mmol/L为血钙达标,>2.50 mmol/L为高钙血症〔3〕。
1.3.4CKD3~5D期血P分期CKD3~5期,血P<0.87 mmol/L为低磷血症,0.87~1.45 mmol/L为血P达标,>1.45 mmol/L为高磷血症;CKD5D期,血P<1.13 mmol/L为低磷血症,1.13~1.78 mmol/L为血P达标,>1.78 mmol/L为高磷血症〔3〕。
1.3.5CKD3~5D期iPTH分期CKD3期,iPTH靶目标为35~70 pg/ml;CKD4期,靶目标为70~110 pg/ml;CKD5-5D期,靶目标为150~300 pg/ml〔1〕,与靶目标对比分为高组及低组。
1.3.6血清25(OH)D分期25(OH)D <15 ng/ml为缺乏,15 ng/ml≤25(OH)D<30 ng/ml为不足,25(OH)D≥30 ng/ml为最佳状态〔3〕。

2 结 果
2.1一般情况142例CKD患者进入本研究,平均年龄(65.61±13.35)岁,体重指数(BMI)(24.29±3.67)kg/m2。CKD各期之间比较,年龄有统计学差异(P<0.05),性别无统计学差异(P>0.05),女性患者中仅4例(6.6%)为非绝经期妇女,见表1。主要的基础肾脏病:高血压肾损害45例(31.7%),糖尿病肾病35例(24.8%),原发性肾小球疾病27例(19.0%),肾小管间质疾病21例(14.8%),其他14例。

表1 CKD1~5D期患者一般资料比较
2.2CKD各期BMD、骨矿物质代谢和BMT的比较因年龄在CKD1~5D期之间差异有统计学意义,分为<70岁组、≥70岁组对观察指标行分组比较:两组BMD、血清ALB、Ca、ALP、25(OH)D在CKD1~5D各期之间均无统计学差异(P>0.05)。<70岁组,CKD5~5D期患者P均高于CKD1~4期;CKD4~5D期患者tPINP均高于CKD1~3期;CKD4~5期患者β-CTX均高于CKD1~3期,CKD5D期高于CKD1~3及5期;CKD4~5期患者OC、iPTH均高于CKD1~3期,CKD5D期高于CKD1~5期(P<0.05)。≥70岁组,CKD5D期患者P高于CKD1~5期;CKD5期患者tPINP、OC均高于CKD1~4期,CKD5D期高于CKD1~5期;CKD5~5D期患者β-CTX均高于CKD1~4期;CKD5期患者iPTH均高于CKD1~4期,CKD5D期高于CKD2~3期(P<0.05),见表2。
CKD1~5D期骨质疏松或伴低BMD患病率分别为31.82%(7/22),36.00%(9/25),50.00%(15/30),27.78%(5/18),22.22%(6/27),37.50%(6/16),χ2=5.483,P=0.360,无统计学差异。CKD3~5D期:钙达标比例分别为90.00%(27/30),88.89%(16/18),82.14%(23/28),76.47%(13/17);高钙血症比例分别为3.33%(1/30),5.56%(1/18),7.14%(2/28),17.64%(3/17);血磷达标比例分别为86.67%(26/30),77.77%(14/18),28.57%(8/28),41.18%(7/17);高磷血症比例分别为0(0/30),16.67%(3/18),60.71%(17/28),47.06%(8/17);iPTH达靶目标的比例为65.00%(13/20),6.67%(1/15),39.29%(11/28),23.53%(4/17);iPTH低于靶目标的比例为25.00%(5/20),80.00%(12/15),39.29%(11/28),35.29%(6/17)。观察人群25(OH)缺乏的比例为64.79%(92/122),其不足者为19.72%(28/122),25(OH)达最佳状态仅1.41%(2/122)。
2.3相关性分析BMD值与eGFR、钙磷值无相关性,25(OH)D与BMD、eGFR、钙磷相关性均无统计学意义(P>0.05)。eGFR与P、tPINP、β-CTX、OC、iPTH呈负相关;P与tPINP、β-CTX、OC、iPTH呈正相关;ALP与tPINP、β-CTX、OC、iPTH呈正相关;tPINP与β-CTX、OC、iPTH呈正相关;β-CTX与OC、iPTH呈正相关;OC与iPTH呈正相关(P<0.01),见表3。

表2 CKD1~5D期BMD、骨矿物代谢比较
与CKD1期比较:1)P<0.05;与CKD2期比较:2)P<0.05;与CKD3期比较:3)P<0.05;与CKD4期比较:4)P<0.05;与CKD5期比较:5)P<0.05;与CKD5D比较:6)P<0.05
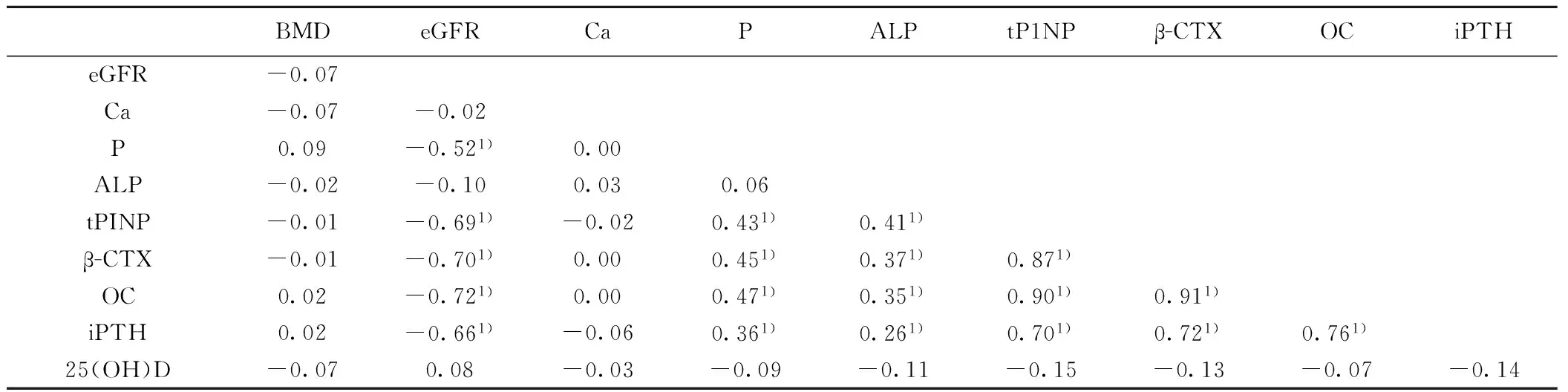
表3 BMD与eGFR、骨矿物代谢相关性分析(r值)
1)P<0.01
2.4CKD骨质疏松或CKD-MBD伴低BMD影响因素的Logistics回归分析CKD3~5D期BMD<80 mg/cm3即CKD骨质疏松或CKD-MBD伴低BMD为因变量,年龄、性别、CKD分期、血钙分期(低钙血症、血钙达标、高钙血症)、血磷分期(低磷血症、血磷达标、高磷血症)、iPTH分期(达靶目标,高于靶目标,低于靶目标)、25(OH)D分期(缺乏、不足、最佳状态)、骨转换生化标志物(ALP、tPINP、β-CTX、OC、iPTH)为自变量,经多因素Logistic回归分析,CKD骨质疏松或CKD-MBD伴低BMD的独立危险因素为年龄(≥70岁),性别(女性)和血钙水平(高钙血症)。年龄≥70岁组CKD患者出现低BMD的风险是年龄<70岁组10.544倍(95%CI:3.675~30.249)。女性CKD患者出现低BMD的风险是男性的4.081倍(95%CI:1.531~10.873)。与血钙达标组相比,高钙血症组中CKD患者出现低BMD的风险是血钙达标组的15.725倍(95%CI:1.911~129.435);低钙血症组OR点估计值为2.244>1,但低钙血症与钙达标组的风险无统计学差别(P>0.05)。其他因素均与CKD-MBD伴低BMD无统计学意义(P>0.05)。见表4。

表4 CKD骨质疏松或CKD-MBD伴低BMD的多因素logistic回归分析结果
3 讨 论
2009年的KDIGO CKD-MBD指南指出:骨质疏松的定义对于CKD1~3期成年人是适用的,对于CKD3期以后的患者,BMD低者称为“CKD-MBD伴低BMD”,是CKD的常见并发症之一。在普通人群中,BMD可以强烈预测骨折发生风险,对于有CKD-MBD证据的CKD3~5期患者,BMD并不能很好预测CKD3~5期且伴有低BMD患者的骨折风险〔3〕。QCT测定的是椎体松质骨的体积BMD,受上述因素影响很小〔2〕。目前关于骨质疏松骨折的研究绝大多数都是依据双能X线骨密度仪(DXA)测定的BMD而建立,而血管钙化是CKD-MBD的一个重要组成部分,应用QCT检查可以减少因CKD-MBD血管钙化引起的BMD测量偏差。美国有研究依据DXA测定的BMD值调查显示CKD3期骨质疏松的患病率女性为85.1%,男性为57.5%,CKD4期骨质疏松的患病率女性为33.8%,男性为11%〔4〕。而目前我国还缺乏CKD合并骨质疏松的流行病学调查数据。
CKD患者骨折患病率显著高于普通人群,有研究显示即使在矫正年龄、性别、种族因素后,CKD5D期患者髋关节骨折发病率仍高于普通人群 17倍〔5〕,CKD3~4期患者髋关节骨折的风险约为eGFR>60 ml/min者的2倍〔6〕。是否可以认为随着肾功能下降BMD逐渐下降骨折风险增高?美国有研究也证实,控制了性别、年龄和体重因素后并没有发现肾功能下降与BMD下降之间的关系〔7〕,本文与此相符,这提示在普通人群中骨质疏松共同的发病因素以外,CKD骨质疏松或CKD-MBD伴低BMD还存在其自身特有的高危因素。本研究根据QCT测定的BMD值,去除了血管钙化对DXA-BMD测定的可能影响后显示,高钙血症是CKD-MBD伴低BMD的独立危险因素。钙磷代谢紊乱是CKD患者常见并发症,CKD患者由于钙摄入不足、活性维生素D的缺乏影响钙的吸收,以及骨骼对PTH脱钙作用的抵抗,常常出现低钙血症,肾脏对磷的排泄减少引起高磷血症,钙磷代谢紊乱引起甲状旁腺功能亢进,为对抗低钙高磷血症及甲状旁腺功能亢进,广泛给予口服含钙的磷结合剂,而且配合低蛋白饮食的酮酸制剂也常规搭配了钙剂,活性维生素D及其类似物的广泛使用,以及高钙透析液的使用,这些由于治疗“矫枉过正”带来的高钙血症发生率增加。本文结果提示在治疗CKD-MBD患者时,纠正低钙血症,防止高钙血症,维持正常血钙对于改善CKD骨质疏松或低BMD有非常重要的意义。
维生素D通过调节肠道和肾脏对钙磷的吸收、骨钙的转移来调控钙磷的生理平衡,调节骨骼矿化和生长,维生素D状态是防治骨质疏松的基础环节。有研究发现维生素D缺乏与白蛋白尿和eGFR降低的年度发病率增高相关〔8〕。25(OH)D是评估维生素D状态普遍采用的指标,本研究发现25(OH)D水平低下是CKD各期的普遍现象,25(OH)D与BMD值并无明显相关性。在普通人群中分析二者相关性也并不一致〔9〕。
骨活检可以明确骨转换状态,是诊断CKD-MBD的金标准,但因实际操作困难、复杂、有创性等多种原因,国内开展很少。临床常使用骨转换生化标志物判断骨转换的情况:目前多以iPTH作为高转运性骨病和低转运性骨病的预测指标;ALP通过水解磷脂释放无机磷,使局部磷浓度增加,促进骨矿化,有利于骨形成,是目前常用的评价骨形成的指标;tPINP反映了Ⅰ型胶原的合成和转换,90%以上的骨基质由I型胶原组成,I型前胶原分子由成骨细胞合成,tPINP升高提示I型胶原合成加快,骨形成活跃;OC是由非增殖期的成骨细胞特异合成并分泌的非胶原蛋白,能直接反映成骨细胞活性,特别是新形成的成骨细胞的活性,是成骨细胞功能或骨质矿化的特殊标志物;β-CTX是破骨细胞在骨吸收过程中降解产生的特异性产物,是反映骨吸收的指标〔10〕。本研究显示,随着肾功能下降,尤其是进入CKD4~5D期,反映骨形成指标的tPINP、OC,反映骨吸收的β-CTX,反映骨转运的iPTH均进行性升高,相对年轻组表现的CKD分期更为提前,提示在CKD4~5D期骨形成、吸收即骨转换过程活跃。
多项研究分析BMD与骨转换生化标志物的相关性结果并不一致〔11〕,本研究亦没有得出二者明显相关的结论;QCT作为非创伤性检查,操作方便,二者结合动态观察可以监测病情的进展和疗效的判断。
1National Kidney,Foundation.K/DOQI clinical practice guidelines for chronic kidney disease:evaluation,classification,and stratification〔J〕.Am J Kidney Dis,2002;39(2 Suppl 1):S1-266.
2程晓光,余卫.定量CT骨密度测量技术的进展与临床应用〔J〕.中国医学影像学杂志,2011;19(12):881-3.
3中华医学会肾脏病学分会.慢性肾脏病矿物质和骨异常诊治指导〔G〕.2013年9月.
4Sidney Klawansky,Eugene Komaroff,Paul F,etal.Relationship between age,renal function and bone mineral density in the US population 〔J〕.Osteoporos Int,2003;14(7):570-6.
5Coco M,Rush H.Increased incidence of hip fractures in dialysis patients with low serum parathyroid hormone 〔J〕.Am J Kidney Dis,2000;36:1115-21.
6Nickolas TL,McMahon DJ,Shane E.Relationship between moderate to severe kidney disease and hip fracture in the United States 〔J〕.J Am Soc Nephrol,2006;17:3223-32.
7Hsu CY,Cummings SR,McCulloch CE,etal.Bone mineral density is not diminished by mild to moderate chronic renal insufficiency〔J〕.Kidney Int,2002;61(5):1814-20.
8Damasiewicz MJ,Magliano DJ,Daly RM,etal.Serum 25-hydroxyvitamin D deficiency and the 5-year incidence of CKD〔J〕.Am J Kidney Dis,2013;62(1):58-66.
9李朦.血清25-羟维生素D和雌激素水平与骨密度相关性的临床研究〔J〕.国际检验医学杂志,2013;34(22):3043-5,3054.
10阙文君,冯正平.骨转换生化标志物的研究进展〔J〕.中国骨质疏松杂志,2014;20(5):575-9.
11江建青,林珊,郑振峰,等.各期慢性肾脏病患者骨代谢生化指标与骨密度的相关性〔J〕.中华肾脏病杂志,2009;25(8):619-23.
〔2016-03-11修回〕
(编辑徐杰)
Relationship between spinal bone mineral density measured by quantitative CT and bone metabolism related index in the patients with chronic kidney disease
YANG Jie,KANG Jian-Guo,Lü Yan-Wei,et al.
Department of Nephrology,Beijing Jishuitan Hospital,Beijing 100035,China
ObjectiveTo analyze the relationship between spinal bone mineral density and calcium and phosphorus metabolism,25 hydroxyvitamin D〔25(OH)D〕,and biochemical markers of bone turnover(BMT)in patients with chronic kidney disease(CKD).Methods142 CKD patients were divided into stages CKD1~5D according to the eGFR and dialysis.The spinal BMD was measured by quantitative CT(QCT),serum calcium(Ca),phosphorus(P),25(OH)D,intact parathyroid hormone(iPTH),alkaline phosphatase(ALP),total procollagen type I propeptides(tPINP),β-crosslaps(β-CTX),osteocalcin(OC)were tested.ResultsIn the group(<70 years old),the levels of serum phosphorus in stages CKD5~5D were increased compared with that of stages CKD1~4,the levels of tPINP in stages CKD4~5D were increased compared with those of stages CKD1~3;the levels of β-CTX in stages CKD4~5 were increased compared with those of stages CKD1~3,and it was increased in stage CKD5D compared with those of stages CKD1~3 and 5;the levels of OC and iPTH in stages CKD4~5 were increased compared with those of stages CKD1~3,and it was increased of stage CKD5D compared with that of stages CKD1~5(P<0.05).In another group(≥70 years old),the level of serum phosphorus in stage CKD5D was increased compared with that of stages CKD1~5;the levels of tPINP and OC in stage CKD5 were increased compared with those of stages CKD1~4,and they were increased in stage CKD5D compared with those of stages CKD1~5;the levels of β-CTX in stages CKD5~5D were increased compared with those of stage CKD1~4;the level of iPTH in stage CKD5 was increased compared with that of stages CKD1~4,and it was increased of stage CKD5D compared with that of stages CKD1~3 and 5(P<0.05).BMD values versus eGFR,Ca,P,25(OH)D and BMT showed no correlation(P>0.05).The eGFR versus serum phosphorus,tPINP,β-CTX,OC and iPTH showed negatively correlation(P<0.01).According to the multi-factor logistic regression analysis,the independent risk factors of osteoporosis in CKD/CKD-MBD with low BMD were advanced age(≥70),gender(female)and blood calcium level(hypercalcemia).ConclusionsThere is great important clinical significance to maintain normal blood calcium in CKD with osteoporosis and low BMD.
Chronic kidney disease;Bone mineral density;Biochemical marker of bone turnover
10.3969/j.issn.1005-9202.2016.14.078
国家自然科学基金青年科学基金项目(81400923)
杨洁(1978-),女,主治医师,主要从事慢性肾脏病研究。
R692
A
1005-9202(2016)14-3518-05;
1首都医科大学教学医院北京电力医院骨科
2北京积水潭医院临床流行病学研究室3北京积水潭医院放射科

