非透析的慢性肾脏病患者肱踝脉搏波传导速度的影响因素
谢 瑜 罗惠民
(云南省第一人民医院肾内科,云南 昆明 650032)
非透析的慢性肾脏病患者肱踝脉搏波传导速度的影响因素
谢瑜罗惠民
(云南省第一人民医院肾内科,云南昆明650032)
目的观察非透析的慢性肾脏病(CKD)患者肱踝脉搏波传导速度的改变及影响因素。方法选取CKD非透析患者376例(其中非糖尿病患者232例,糖尿病患者144例),健康对照组为同期健康体检人群33例,留取空腹血标本检测尿素氮、肌酐、尿酸、胱抑素C(CysC)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、空腹血糖(FPG)。并以动脉硬化诊断仪检测肱踝脉搏波传导速度(baPWV)。应用简化MDRD公式计算肾小球滤过率(GFR),根据CKD分期将非糖尿病患者和糖尿病患者各分为五组:CKD1期(GFR≥90 ml/min);CKD2期(GFR 60~89 ml/min);CKD3期(GFR 30~59 ml/min);CKD4期(GFR 15~29 ml/min);CKD5期(GFR<15 ml/min)。结果①糖尿病患者组及非糖尿病患者组患者的收缩压、脉压、肱踝脉搏波传导速度明显高于对照组(P<0.005),CKD1~5期,糖尿病组baPWV均明显高于非糖尿病组及健康对照组。②随着GFR降低,糖尿病组及非糖尿病组baPWV呈现显著的逐级增长的趋势(P<0.001)。③多因素逐步回归分析显示收缩压、舒张压、eGFR、CysC是baPWV的独立决定因素。结论①非透析的CKD患者中糖尿病患者baPWV高于非糖尿病患者及健康对照人群,其动脉硬化发生时间早;②随着肾损伤的加重,baPWV亦呈现显著的逐级增长的趋势,baPWV是非透析的CKD患者动脉硬化的有效预测指标;③eGFR、收缩压、舒张压是非透析的CKD患者动脉硬化主要的独立影响因素;CysC也是非透析的CKD动脉硬化的独立影响因素,但其水平对大血管病变的影响及其机制还应进行进一步的研究。
慢性肾脏病;非透析;动脉僵硬度;肱踝脉搏波速度
慢性肾脏病(CKD)发病率持续升高,成为严重影响人类健康的疾病之一,给社会、家庭经济均带来了沉重的负担。CKD患者是发生心血管疾病(CVD)的高危人群〔1〕,患者死亡的重要原因是由于动脉硬化所导致的,其中动脉粥样硬化(AS)是最常见的类型,动脉弹性功能的减退已经成为CVD危险的重要标志〔2〕。因此早期发现血管病变,评估大动脉僵硬度至关重要。近年来越来越多地采用脉搏波传导速度(PWV)尤其是肱踝脉搏波传导速度(baPWV)检测技术筛查CVD高危人群。目前有关CKD非透析患者动脉弹性功能的研究,尤其是糖尿病患者与非糖尿病患者大动脉弹性功能的比较研究较少。以baPWV作为检测大动脉僵硬度的指标,通过研究比较CKD 1~5 期非透析患者的baPWV,并对糖尿病患者与非糖尿病患者的动脉弹性功能进行比较研究,进一步明确动脉弹性功能的减退与CKD病变严重程度之间的关系,并初步阐明可能的影响因素,为临床采取有效的干预措施提供依据。
1 对象及方法
1.1研究对象收集2010年1月至2012年9月我院肾内科及内分泌科住院的非透析CKD患者376例。排除标准:①严重心律失常患者;②3个月内有急性心肌梗死、心力衰竭、脑血管意外、恶性肿瘤等病情危重住院患者;③原发性高血压,高血压肾病患者;④重症感染患者;⑤服用雌激素、糖皮质激素及避孕药患者;⑥双臂内瘘手术者;⑦免疫性疾病者。其中非糖尿病患者232例,平均年龄(43.92±14.91)岁,男107例,女125例,体重指数(BMI,24.16±8.63)kg/m2;糖尿病患者144例,平均年龄(47.35±10.47)岁,男79例,女65例,BMI(24.75±4.01)kg/m2,另选33例健康对照者,平均年龄(46.30±15.42)岁,男19例,女14例,BMI(22.56±3.03)kg/m2。三组间性别(χ2=3.513;P=0.173)、年龄(F=2.938;P=0.054)、BMI(F=1.383;P=0.252)无差异。
1.2CVD的危险因素本研究中所采用的心血管危险因素项:①年龄:>60岁;②性别:男性;③超重:体重指数(BMI)>28 kg/m2;④血脂异常:总胆固醇(TC)≥6.22 mmol/L;低密度脂蛋白胆固醇(LDL-C)≥4.14 mmol/L;高密度脂蛋白胆固醇(HDL-C)<1.04 mmol/L;⑤高血压:收缩压(SBP)≥140 mmHg,舒张压(DBP)≥90 mmHg;⑥糖尿病;⑦吸烟史。
1.3研究方法
1.3.1一般资料收集在清晨空腹状态下测量血压、身高、体重、计算BMI。
1.3.2生化指标检测研究对象禁食12 h后于次日早晨空腹抽取静脉血,检测TC、甘油三酯(TG)、LDL-C、HDL-C、空腹血糖(FPG)、尿素氮、血肌酐、尿酸、胱抑素C(CysC)。
1.3.3baPWV的检测应用VP-1000型全自动动脉硬化测定仪(日本欧姆龙公司)检测。
1.4统计学方法采用SPSS17.0软件行t检验、单因素方差分析及χ2检验;多因素分析采用多元线性回归。
2 结 果
2.1三组一般情况及baPWV的多变量比较分析发现非糖尿病患者组及糖尿病患者组患者的SBP、脉压(PP)、baPWV明显高于健康对照组(P<0.005),并且糖尿病组患者BMI、SBP、PP、FPG、baPWV亦明显高于非糖尿病组患者(P<0.005),见表1。三组间baPWV存在差异(P<0.05),从CKD1期~5期,糖尿病组患者baPWV都明显高于非糖尿病组患者及健康对照组人群(P均<0.05),在非糖尿病组,CKD1期的患者baPWV与同期的健康对照组人群类似,无统计学差异(P=0.886),而从CKD2期开始,非糖尿病组患者baPWV就明显高于健康对照组(P均<0.01)。见表2。糖尿病组与非糖尿病组在CKD1~CKD5期之间年龄、肾小球滤过率(GFR)、SBP、PP、baPWV存在差异,在两组病例中都可以发现随着CKD进展,肾脏损伤的加重,baPWV呈现显著的上升趋势,经ANOVA分析发现,年龄、SBP、PP也同时随CKD分期的进展而增加(P<0.001)。见表2。
2.2不同GFR患者组间一般情况和baPWV的比较三组间年龄、eGFR、SBP、DBP、PP、baPWV、CysC存在差异,随着肾损伤的加重,CKD的进展,从CKD1期到5期,baPWV呈现显著的逐级增长的趋势(P<0.001),见表3。此外,对于CKD患者,任何CVD危险因素的存在以及糖尿病的存在都与升高的baPWV密切相关(P<0.001),见表4。

表1 三组一般情况比较±s)

表2 糖尿病及非糖尿病组CKD1~5期组间一般情况及baPWV的比较±s)
与非糖尿病组同期组比较:1)P<0.05;与健康对照组比较:2)P<0.05;与本组前CKD分期比较:3)P<0.05
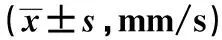
表3 三组组间一般情况及baPWV的比较
2.3所有患者baPWV及其影响因素的相关分析及多元逐步回归分析通过线性相关分析显示baPWV与血清尿素氮、肌酐水平、CysC、SBP、DBP、PP正相关,而与eGFR、身高呈负相关,与BMI、血脂水平、24 h尿蛋白定量水平无明显相关,进一步行多因素逐步回归分析结果,见表5、表6。通过多因素逐步回归分析显示SBP、DBP、eGFR、CysC是baPWV的独立决定因素。
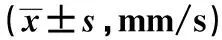
表4 三组患者不同心血管危险因素存在下baPWV的比较
与其他CKD分期比较:1)P<0.01

表5 baPWV与各变量的相关分析
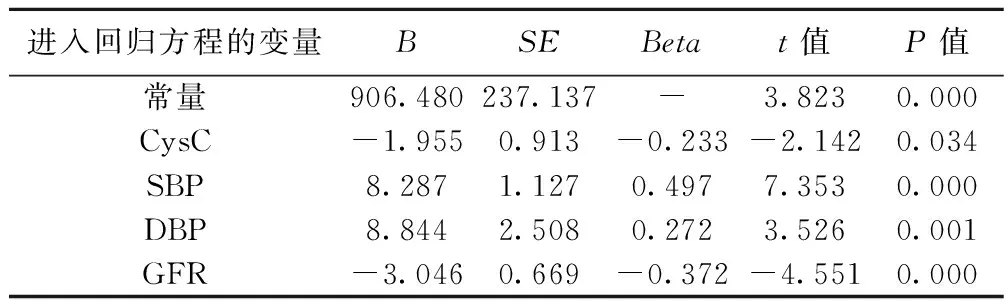
表6 baPWV的多因素线性回归模型分析
3 讨 论
高血压、贫血、蛋白尿、钙磷代谢紊乱、内皮功能异常、糖代谢异常、血脂异常以及长期微炎症状态等是CKD患者普遍存在的等一系列心血管危险因素,使心血管疾病成为CKD患者的主要死亡原因,即使在早期CKD患者中,CVD的危险也显著增加〔3,4〕。肾脏疾病早期评估计划(KEEP)表明,CKD患者发生非致死性或致死性心血管事件的危险远远大于肾脏病自身进展的危险。第二次美国国家健康与营养调查显示轻到中度的肾功能减退与随后的心血管疾病死亡独立相关〔5〕。动脉硬化,一种以斑块形成和血管闭塞为主要特征的内膜疾病在早期慢性肾脏病患者中即可出现,是CKD患者众多易发心血管疾病的因素中最主要的因素之一,动脉硬化会导致心脏后负荷的增加,冠脉灌注压的降低,从而引发高血压、左心室肥厚和心肌灌注的下降,这也是慢性肾脏病患者CVD发病率和死亡率异常升高的主要原因,因此早期发现动脉硬化,评估动脉僵硬度有着重要的意义。PWV是用于评估动脉该弹性功能以及动脉僵硬度的无创性指标,对终末期肾脏病患者发心血管事件和主动脉粥样硬化的危险因素能进行有效预测〔6〕,能够早期发现血管病变,脉搏波速度的升高也提供了早于临床症状和体征的动脉硬化证据,研究中选择baPWV作为观察指标是因为人体动脉血管树不同节段对年龄增长的反应不尽相同〔7,8〕,测量baPWV就包括了弹性动脉和肌性动脉,比传统的颈股动脉脉搏波传导速度(cfPWV)更能全面和客观的评价动脉硬化情况,其次是baPWV与主动脉PWV具有绝佳的相关性〔9,10〕,是估计动脉僵硬度的简单、无创、重复性好、可靠性高的方法。
动脉硬化与高龄、糖尿病、CKD密切相关,任何类型的动脉硬化及钙化均导致血管顺应性的下降,其中糖尿病是CKD的重要危险因素之一,但在非透析的CKD患者中,糖尿病患者与非糖尿病患者相比,动脉硬化是否发生得更早?研究证实CKD患者baPWV水平高于健康对照人群,而同时糖尿病患者baPWV水平明显高于与其相匹配的非糖尿病患者,也证实了在CKD患者中糖尿病患者的动脉硬化发生时间早,明显高于非糖尿病患者及健康对照人群,然而如前所述,CKD病患者因心血管事件造成的死亡占总死亡比例的50%以上,患者死亡的重要原因就是由于动脉硬化所导致的,这进一步证实糖尿病是ESRD患者病死率增加的重要危险因素,这与既往研究结果一致〔11~13〕。因此对于CKD患者,尤其是糖尿病患者,早期发现动脉硬并进行干预治疗,对于降低心血管疾病发病率具有重要意义。
本研究表明随着肾功能的进展,血压的升高,血管结构及功能发生改变,动脉中层结构发生紊乱,动脉壁增厚,弹力纤维退化,随着CKD分期级别升高,baPWV呈现显著的阶梯式升高,因此,对于慢性肾脏病患者,肾功能下降除影响到了肾脏本身外,还导致了大动脉僵硬度的增加,其所表现出的baPWV的升高,进一步预示着CVD的高发。
本文证实eGFR是非透析的CKD患者baPWV的独立影响因素,这与国内外的研究结果相一致,既往研究提示,即使肾功能轻度受损(血肌酐100~200 μmol/L)也是导致动脉硬化和冠状血管疾病的危险因素,并且独立于高血压、糖尿病、白蛋白尿之外〔14〕。郭太林等〔15〕研究亦证实eGFR下降与PWV升高密切相关,肾功能减退是动脉硬化的独立危险因素。Blacher等〔16〕对712例轻到中度肾功能减退(血肌酐均<300 μmol/L)并且接受降压治疗的高血压患者的一个交叉对照横断面研究发现PWV值和血肌酐水平呈正相关。Chen等〔17〕对145例3~5期CKD患者baPWV的研究发现baPWV作为动脉硬化的一个标志,与中到重度CKD患者肾功能进一步下降进展到开始透析或死亡有着独立的联系,因此利用baPWV筛查CKD患者可能有助于确定肾功能快速进展到透析或死亡的高危人群。在CKD患者,eGFR是影响baPWV值的独立危险因素,提示CKD患者肾功能减退程度与动脉硬化程度密切相关,baPWV 是评估CKD患者动脉粥样硬化程度的重要临床指标。在CKD患者中,除了传统的心血管疾病危险因素外,还有一些其他因素参与了动脉硬化的发生,比如容量负荷过重、肾素-血管紧张素系统的激活、钙磷代谢紊乱、营养不良、感染、尿毒症毒素等〔18~22〕,这就解释了本研究中发现任何传统的危险因素的存在均与baPWV的升高相关(P<0.001),但经过多元回归分析后却发现传统的危险因素不是baPWV 的独立决定因素,因此CVD患者的baPWV除与CVD的传统危险因素相关外还与CKD 特有的蛋白尿、肌酐清除率下降等危险因素相关,大动脉僵硬度在CKD患者CVD发病过程中起着重要作用,肾功能的下降会引起动脉粥样硬化的进展,并加快通过传统危险因素的独特血流动力学的代谢机制而导致肾功能的进一步受损,同时由于传统危险因素也是导致baPWV升高的重要因素,因此早期积极控制传统心血管危险因素有助于延缓动脉硬化的发生。
血压是影响baPWV的重要因素,高血压患者长期的血压升高可导致血管壁长期处于高压力状态,从而使正常的血管壁结构和功能发生改变,导致动脉硬化的发生。本研究发现baPWV与SBP、DBP水平呈明显正相关,经多元回归分析发现SBP以及DBP是baPWV患者CKD的独立影响因素,因此在CKD患者中,SBP、DBP、PP的测量是评估大动脉僵硬度的间接、有效及便捷的方法,很好的控制血压水平对于降低baPWV值,减轻血管重构、降低心血管事件的发生率具有重要的意义。
研究发现非透析的CKD患者baPWV与CyscC水平呈正相关。CysC是半胱氨酸蛋白酶抑制剂家族的一员,是一种非糖基化的碱性蛋白产物,人体内所有的有核细胞都能产生,几乎全部由肾小球滤过,且被肾小管分解代谢而不被肾小管重吸收和分泌。Menon等〔23〕对一组美国老年人进行了超过10年的随访,结果发现CysC与心血管死亡风险呈线性关系,此外CysC还与心血管死亡、心肌梗死的发生风险升高有关,CysC是一个强有力的心血管疾病预测因子,Madero等〔24〕对2 468名老年人CysC与动脉硬化的研究,检测PWV和CysC,结果发现PWV可能是CysC与心血管危险因素的接入点,本研究经多元回归分析证实CysC独立于其他因素与baPWV相关,这表明CysC是非透析的CKD动脉硬化的独立影响因素。Odaira等〔25〕对2 904名肾功能正常及轻度肾损害(CKD1~2期)的中年人CysC水平及baPWV的研究发现CysC与baPWV呈现明显的正相关,反映了动脉硬化水平,是CVD的独立危险因素,血清CysC与GFR密切相关,随年龄而增长,可以反映GFR的轻微变化,是反映肾功能减退的一个灵敏的指标,这可能是其与baPWV正相关并由此导致的与大血管病变相关联的原因之一,但刘丽特等〔26〕对156例糖尿病患者CysC与大血管病变的研究发现去除肾功能的影响后血清CysC水平仍与患者的大血管病变存在关联,提示血清CysC可能存在独立于肾功能影响之外的与大血管病变的相关性,参与炎症反应可能是高血清CysC水平增加大血管病变风险的重要原因之一,因此CysC所反映的高同型半胱氨酸的致血管损伤作用,参与大血管病变的炎症过程以及其所反映的轻度肾功能减退可能是其增加大血管病变的风险的原因,但CysC水平对大血管病变的影响及具体机制还有待扩大样本量进行进一步的研究,以便将其作为一个预测大血管病变的指标应用于CKD病患者,有助于早期发现大血管病变并评估其病变程度。总之,非透析的CKD患者,随着肾损伤的加重,bpPWV呈现显著的逐级增长的趋势,提示baPWV能反映CKD患者血管病变的严重程度,CKD患者独有的eGFR下降、蛋白尿、容量负荷过重、肾素-血管紧张素系统的激活、钙磷代谢紊乱、尿毒症毒素等以及传统的CVD危险因素等都可能导致baPWV的升高,即动脉硬化的进展。baPWV作为一个无创的动脉硬化检测指标,能正确反映动脉弹性及动脉硬化的程度,对非透析的CKD患者开展baPWV的检测,评估动脉僵硬度,早期发现动脉硬化改变并进行干预,对降低心血管事件的发生率及改善患者的预后具有重要的意义。
1US Renal Data System.Mortality and Causes of Death in USRDS:2002 Annual Data Report.Atlas of end-stage renal disease in the Uniteds tates〔J〕.Am J Kindney Dis,2003;41(4):v-ix,s7-254.
2Pecoits-Filho R,Stenvinkel P,Marchlewska A,etal.A functional variant of the myeloperoxidase gene is associated with cardiovascular disease in end-stage renal disease patients〔J〕.Kidney Int Suppl,2003;(84):S172-6.
3Govindarajan G,Saab G,Whaley-Connell A.Outcomes of carotid revascularization in patients with chronic kidney disease〔J〕.Adv Chronic Kidney Dis,2008;15(4):347-54.
4Essig M,Escoubet B,de Zuttere D,etal.Cardiovascular remodelling and extracellular fluid excess in early stages of chronic kidney disease〔J〕.Nephrol Dial Transplant,2008;23(1):239-48.
5Muntner P,He J,Hamm L,etal.Renal insufficiency and subsequent death resulting from cardiovascular disease in the United States〔J〕.J Am Soc Nephrol,2002;13(3):745-53.
6Safar ME,Blacher J,Protogerou A,etal.Arterial stiffness and central hemodynamics in treated hypertensive subjects according to brachial blood pressure classification〔J〕.J Hypertens,2008;26(1):130-7.
7McDonald DA.Regional pulse-wave velocity in the arterial tree〔J〕.J Appl Physiol,1968;24(1):73-8.
8Heijden-Spek JJ,Staessen JA,Fagard RH,etal.Effect of age on brachial artery wall properties differs from the aorta and is gender dependent:a population study〔J〕.Hypertension,2000;35(2):637-42.
9Tsuchikura S,Shoji T,Kimoto E,etal.Brachial-ankle pulse wave velocity as an index of central arterial stiffness〔J〕.J Atheroscler Thromb,2010;17(6):658-65.
10Sugawara J,Hayashi K,Yokoi T,etal.Brachial-ankle pulse wave velocity:an index of central arterial stiffness〔J〕?J Hum Hypertens,2005;19(5):401-6.
11Racki S,Zaputovic L,Vujicic B,etal.Comparison of survival between diabetic and non-diabetic patients on maintenance hemodialysis:a single-centre experience〔J〕.Diabetes Res Clin Pract,2007;75:169-75.
12Aoun S,Blacher J,Safar M,etal.Diabetes mellitus and renal failure:ef fects on large artery stiffness〔J〕.J Hum Hypertens,2001;15:693-700.
13Shoji T,Emoto M,Shinohara K,etal.Diabets mellitus,aortic stiffness,and cardiovascular mortality in end-stage renal disease〔J〕.J Am Soc Nephrol,2001;12(10):2117-24.
14Mann JF,Gerstein HC,Dulau-Florea I,etal.Cardiovascular risk in patients with mild renal insufficiency〔J〕.Kidney Int Suppl,2003;(84):S192-6.
15郭太林,朱鹏立,等.非透析慢性肾脏病患者肾小球滤过率的评估值与动脉硬化的相关性〔J〕.中国动脉硬化杂志,2012;20(10):911-4.
16Blacher J,Asmar R,Djane S,etal.Aortic pulse wave velocity as a marker of cardiovascular risk in hypertensive patients〔J〕.Hypertension,1999;33(5):1111-7.
17Chen SC,Chang JM,Liu WC,etal.Brachial-ankle pulse wave velocity and rate of renal function decline and mortality in chronic kidney disease〔J〕.Clin J Am Soc Nephrol,2011;6(4):724-32.
18Sarnak MJ,Levey AS.Cardiovascular disease and chronic renal disease:a new paradigm〔J〕.Am J Kidney Dis,2000;35(4 Suppl 1):S117-31.
19Tycho Vuurmans JL,Boer WH,Bos WJ,etal.Contribution of volume overload and angiotensin Ⅱ to the increased pulse wave velocity of hemodialysis patients〔J〕.J Am Soc Nephrol,2002;13(1):177-83.
20Blacher J,Demuth K,Guerin AP,etal.Influence of biochemical alterations on arterial stiffness in patients with end-stage renal disease〔J〕.Arterioscler Thromb Vasc Biol,1998;18(4):535-41.
21London GM,Marchais SJ,Guerin AP,etal.Inflammation,arteriosclerosis,and cardiovascular therapy in hemodialysis patients〔J〕.Kidney Int Suppl,2003;(84):S88-93.
22Zoccali C,Mallamaci F,Tripepi G.Novel cardiovascular risk factors in end-stage renal disease〔J〕.J Am Soc Nephrol,2004;15(Suppl 1):S77-80.
23Menon V,Shlipak MG,Wang X,etal.Cystatin C as a risk factor for outcomes in chronic kidney disease〔J〕.Ann Intern Med,2007;147(1):19-27.
24Madero M,Wassel CL,Peralta CA,etal.Health ABC Study Cystatin C associates with arterial stiffness in older adults〔J〕.J Am Soc Nephrol,2009;20(5):1086-93.
25Odaira M,Tomiyama H,Matsumoto C,etal.Association of serum cystatin C with pulse wave velocity,but not pressure wave reflection,in subjects with normal renal function or mild chronic kidney disease〔J〕.Am J Hypertens,2010;23(9):967-73.
26刘丽特,黄国良,游捷.2型糖尿病患者血清胱抑素C与大血管病变的关系〔D〕.福州:福建医科大学,2009.
〔2014-12-09修回〕
(编辑安冉冉/曹梦园)
10.3969/j.issn.1005-9202.2016.14.081
罗惠民(1962-),男,主任医师,主要从事肾脏病防治及发病机制研究。
谢瑜(1977-),女,硕士,主治医师,主要从事肾脏病临床及防治研究。
R692
A
1005-9202(2016)14-3526-05;

