犬股骨髁种植体挤压植入动物模型的建立
左艳萍, 汪永跃, 王路明, 马新扬
(1西安医学院口腔医学系, 西安 710021; 2四川大学华西口腔医学院种植科; 3西安医学院第二附属医院口腔科)
犬股骨髁种植体挤压植入动物模型的建立
左艳萍1, 汪永跃2, 王路明3, 马新扬1
(1西安医学院口腔医学系, 西安710021;2四川大学华西口腔医学院种植科;3西安医学院第二附属医院口腔科)
摘要:目的模拟临床种植体挤压植入术,建立松质骨挤压动物模型。方法以犬股骨髁松质骨为挤压部位,挤压组选择敲击挤压法,进行逐级挤压、备洞,对照组种植窝不进行挤压,挤压组和对照组都植入与种植窝直径相同的圆柱状纯钛种植体。实验动物按照术后不同观察时期(1周、2周、4周、12周)分组、取材,进行影像学(骨小梁排列)以及骨形态计量学(骨小梁面积百分比)观察。结果成功建立了松质骨挤压的动物模型,手术过程顺利,术后伤口愈合良好,术区无感染、软组织裂开等并发症,样本符合观察要求。X线影像显示挤压组受到挤压的骨小梁围绕种植体弯曲排列,挤压组骨小梁形态计量学参数骨小梁面积百分比大于对照组,随着愈合时间的延长,挤压组与对照组趋于一致。结论本实验动物模型设计合理,科学易行,可以为种植义齿骨挤压技术的深入研究提供参考,骨挤压技术在一定程度上可以改善种植体周骨质条件,提高种植体初期稳定性。
关键词:种植体;松质骨;骨挤压;动物模型
种植窝骨结构是种植义齿赖以生存的根基,牙槽骨骨密度降低或骨质疏松有可能会影响种植体的初期稳定性甚至造成种植失败。骨挤压技术,是指在种植手术过程中,使用不同型号的与种植窝相匹配的挤压器逐级挤压牙槽窝,利用松质骨的弹性扩大种植窝,避免常规备洞造成骨量缺失,最终使种植体顺利植入的方法,此方法经临床证实可以提高种植体的初期稳定型[1,2]。建立科学易行的松质骨挤压动物模型,应用骨挤压技术植入种植体,通过X线影像以及组织形态学的观察,探索松质骨挤压后愈合过程中的影像学、组织学等表现,探讨骨挤压技术对种植体初期稳定性的影响,为骨挤压技术的使用和改进提供实验依据和理论支持。
1材料和方法
1.1植入体和挤压器
植入体选用自行设计加工的圆柱状纯钛种植体,直径长度规格为3.0/8 mm,4.2/8 mm。表面处理过程:①去污:石油醚超声振荡去油,再经一系列的有机溶剂超声振荡去污,最后经去离子水超声振荡;②烘干机烘干;③喷砂:使用普通喷砂机,以压缩空气带动氧化铝以7 kg的压力进行表面粗糙化,粒度20目到40目;④重复步骤①和②。
挤压器使用自行设计加工的敲击型骨挤压器,材料为不锈钢合金。挤压端直径长度规格分别为:3.0/8 mm,3.6/8 mm,4.2/8 mm。敲击端直径长度规格为10/80 mm。植入体和挤压器见图1。

图1 种植体和挤压器Figure 1 Implants and osteotomes
1.2常规手术器械
种植机及手机分别使用法国SATELEC(赛特力)牙种植机及配套手机。钻针包括直径分别为2.0 mm、3.0 mm的先锋钻和球钻。术中使用的外科器械有:巾钳,手术刀,平镊,齿镊,脉镊,拉钩,组织剪,骨膜剥离器,线剪,针持。
1.3实验动物和试剂
实验动物为普通成年杂种犬(共12只),体重10-15 kg,适应性饲养1周后进行实验。根据术后时间对实验动物进行分组:1周组,2周组,4周组,12周组。每组3只实验动物,同侧股骨髁植入两枚种植体,其中一个挤压组(种植窝挤压程度1.2 mm),一个对照组(种植窝不挤压)。
实验用试剂包括3%戊巴比妥钠溶液,医用碘伏,75%乙醇,0.9%氯化钠注射液,注射用青霉素钠(80万单位),维生素C注射液(2.5 ml,1 g),盐酸肾上腺素注射液(1 mg),盐酸利多卡因注射液(5 ml)等。
1.4种植手术
术前准备:普通成年杂种犬,健康,性别随机,试养1周后进入动物实验。种植体:①术前清洗:丙酮溶液超声振荡15 min→75%乙醇超声振荡15 min→蒸馏水超声振荡15 min;②消毒:高温高压蒸汽灭菌消毒。术中器械全部经过高温高压蒸汽灭菌消毒。
麻醉和固定:下肢外侧区域备皮,暴露表浅静脉,碘伏,酒精局部消毒后行静脉注射质量分数为3%的戊巴比妥钠溶液进行全身麻醉,麻醉剂量为1 ml/kg。将麻醉后的成年犬以侧卧位固定于手术台上。
手术过程:以洗手液进行常规外科洗手,再以碘伏擦拭,酒精脱碘,穿手术衣,戴手套,随机选择一侧进行术区备皮。①暴露骨面:常规消毒,铺巾,暴露术区(股骨髁内侧),局部皮下注射盐酸利多卡因注射液(5 ml),顺着长骨方向切开术区皮肤,分离皮下组织,肌肉,血管,直至暴露股骨髁骨面,使用骨膜剥离器剥开骨膜,确认两个种植位点。 ②备洞:先锋钻定位,两个种植位点相隔距离不小于5 mm。球钻去除表层骨皮质。麻花钻逐级备洞,沿种植体拟植入方向钻入所需深度,生理盐水术中冷却。备两个直径均为3.0 mm,长度为8.0 mm的种植窝。以生理盐水冲洗种植窝。 ③挤压:敲击骨挤压器,顺其中一个种植窝向下直至所需深度,轻柔旋转后取出,更换下一级挤压器。按3.6/8.0 mm、4.2/8.0 mm 进行挤压,到位后生理盐水冲洗种植窝。另外一个种植窝不做挤压,作为对照组。 ④植入:两个种植体窝分别植入3.0/8.0 mm, 4.2/8 mm种植体各一枚。⑤关闭创口,分层缝合。手术过程见图2。
1.5护理
术中密切观察实验动物心跳及呼吸,保证呼吸道通畅。术中补液:静脉滴注生理盐水250 ml。术中使用抗生素:静脉滴注青霉素钠80万U(用生理盐水稀释)以及维生素C注射液2.5 ml。术后3 d肌注青霉素钠80万U/d,维生素C注射液2.5 ml/d。
1.6取材
在不同观察时间(术后1,2,4,12周)对实验犬进行处死。方法为肌注氯胺酮或速眠新注射液,再静脉推注空气100 ml。实验动物处死后,手术刀切开手术部位(一侧股骨髁)处皮肤,使用组织剪,齿镊,手术刀分离皮下组织,暴露术区股骨髁,在股骨髁上端距离种植体约2 cm骨干处用骨锯锯断,取下带有种植体的股骨髁,用小刀片分离粘连于骨面的软组织,生理盐水冲洗,浸泡于10%福尔马林溶液中(使用量杯,按照40%多聚甲醛∶蒸馏水=1∶9的体积比例配制10%福尔马林溶液)。对侧取材方法相同。取材后骨块样本见图3。
1.7X线影像观察
样本修整:由于每侧股骨髁植入了两枚种植体,为了避免照片时由于投照距离不同而产生的误差,对样本进行适当的修整,修整种植体连线两侧的骨块边缘使之与种植体连线平行,相距1 cm,投照时投照方向与之垂直。因此保证了两枚种植体投照距离的一致。
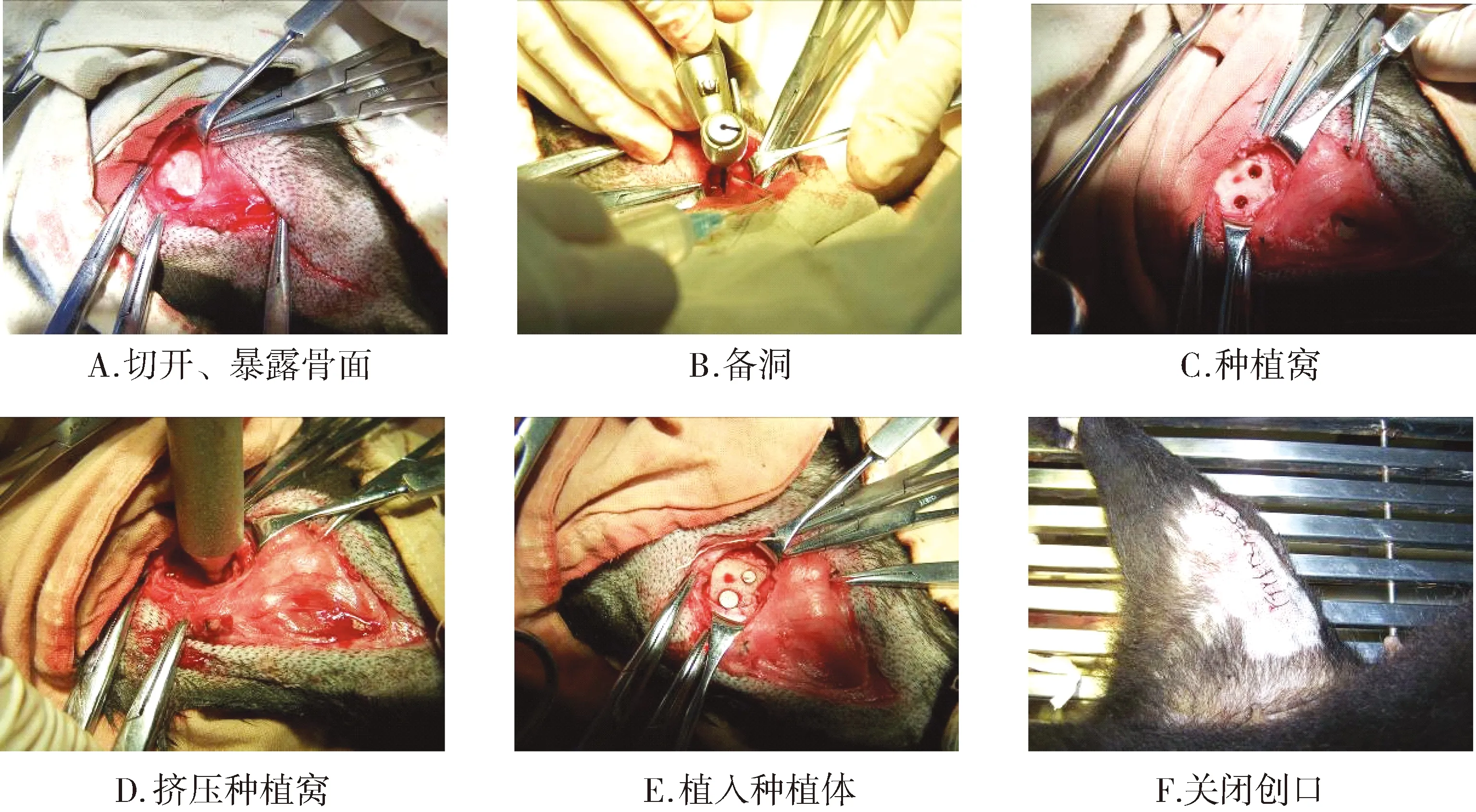
图2 犬股骨髁松质骨种植挤压实验手术过程Figure 2 The procedure of dog femur compressing implant surgery

图3 犬股骨髁松质骨种植挤压骨块样本Figure 3 Sample of dog femur of compressing implant surgery
标本X线图像采集:将样本置于数码高频牙片机(Trophy公司,法国)的感应端(sensor)之上,使投照方向与种植体连线平面垂直摄片(曝光时间0.1 s,距离3 cm),采集数码牙片并储存。
图像观察:采用ACDsee v9.0软件放大储存的X线图像,观察种植体周骨小梁细微排列情况。
1.8骨组织形态计量学观察
制作种植体周松质骨不脱钙骨切片(Masson染色),置于光学显微镜下观察,选定视野,调节显微镜焦距至图像最清晰,启动Osteomeasure软件进行骨组织形态参数的测量,根据基本参数计算获得骨小梁面积百分数。
2结果
2.1一般情况
手术过程顺利,术后伤口愈合良好,术区无感染、软组织裂开等并发症。样本取材后种植体与骨质结合良好,无松动、脱落等。
2.2X线影像表现
所有种植体与骨组织接触紧密,种植体周围无放射透光区,没有种植体周围炎的表现。松质骨受挤压后种植体与周围骨质紧密连接,种植窝松质骨骨小梁排列致密。挤压组形成围绕种植体周类似于天然固有牙槽骨的高密度影像。受到挤压的骨小梁围绕种植体弯曲排列,而随着愈合时间的延长,骨小梁排列趋于正常(见图4)。
2.3骨小梁面积百分数比较
骨小梁面积百分比(%Tb.Ar)为骨小梁面积(Tb.Ar)除以整体松质骨面积(T.Ar)得到。在术后1周、2周和4周时,挤压组的骨小梁面积百分比明显高于对照组,但到第12周,对照组和挤压组的骨小梁面积百分比趋于一致(见图5)。用LSD法对两样本均数进行比较,差异无统计学意义(P>0.05)。
3讨论
3.1实验动物及实验部位的选择
以往种植手术的实验动物模型通常选择猴、犬、猪等实验动物的下颌骨作为手术部位,拔牙后经过3个月的愈合期在缺牙区植入种植体,主要用来观察种植体-骨界面的愈合及结合情况,通常用于对种植体材料、表面处理以及对种植体不同外形设计间进行比较的研究[3]。而本实验主要目的在于观察种植挤压术对种植体周松质骨挤压后,骨小梁排列的情况以及随愈合过程的变化,而犬的下颌骨高度有限且骨皮质较厚,松质骨含量少,不适合用于松质骨的观察。另外,本实验种植窝的预备过程中要使用自行设计的骨挤压器对种植窝周围的松质骨进行不同程度的逐级挤压,将下颌骨作为手术部位,可能会增加手术的难度,降低可操作性。
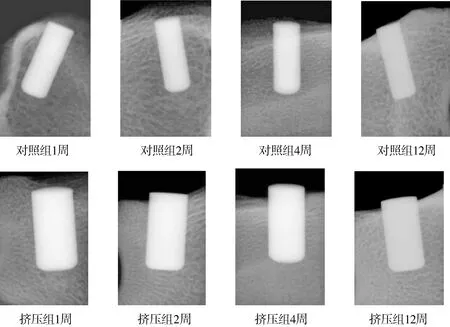
图4 犬股骨髁松质骨种植挤压术后X线影像Figure 4 X-ray images of dog femur after compressing implant surgery

图5 犬股骨髁松质骨种植挤压术后骨小梁面积百分比变化Figure 5 Changes of percentage of trabecular bone area of dog femur after compressing implant surgery
本实验旨在观察松质骨挤压后的愈合过程,因此需要选择一个松质骨丰富且易于实验操作的实验动物及部位。由于对观察时间进行了分组,最长观察时间为3个月,因此所选的实验动物也应易于饲养。本实验建立的挤压模型模拟种植体植入手术,种植体具有一定规格,因此所选择的实验部位的术区应足够大,松质骨的量足够多。犬的股骨为长骨,其骨干较细,骨髓腔宽大,其外层主要由皮质骨构成,松质骨量很少,不足以满足常规种植体的植入要求。而股骨髁处体积膨大,皮质骨薄而松质骨比较丰富,在临床及科研中常用于松质骨骨折愈合方面的研究[4,5]。另外,用于本实验视野也易于暴露,股骨髁内侧骨面平坦,便于备洞、植入等操作。股骨髁内侧皮下组织较薄,无重要解剖结构,易于解剖到达股骨髁表面,创伤小,且术后不影响进食,因此成为本实验比较理想的手术部位。
3.2挤压方式的选择
目前对于骨压缩动物模型的建立,通常选用兔、犬等实验动物的下颌骨作为压缩部位,在下颌骨内植入带有外置调节装置的骨压缩器,通过对外置装置的控制对下颌骨进行一定频率的压缩。而本实验主要是想观察种植挤压术对种植体周松质骨的挤压,因此挤压方式、挤压程度都与此类的挤压模型不符。
临床种植手术通常采用的挤压方式有螺旋式挤压和敲击式挤压,以螺旋挤压居多。螺旋挤压主要通过挤压器或种植体体部的螺纹,在种植手术中以一定的扭矩对种植窝骨壁产生挤压所用[6]。敲击式挤压通过在敲击过程中挤压器的楔入作用对种植窝骨壁产生一定的侧向挤压力,还可用于上颌窦提升术中,使用轻敲的方法在不破坏上颌窦封闭性的前提下提升上颌窦水平高度,增加窦嵴距和骨质密度,改善受植床的植入条件[7,8]。
本实验选用其中的敲击挤压法,使用不带螺纹的挤压器以及规格配套的柱状种植体,便于设计加工,可以减少由于加工过程而造成的实验误差。后续实验可以考虑设计螺旋挤压方式进行更加接近于临床种植植入术的动物实验研究。
3.3挤压程度选择及误差的控制
常规ITI,F-2等多种系统种植体体部螺纹的高度都为0.3 mm。种植备洞后,植入自攻型螺纹种植体,依靠0.3 mm的螺纹对种植窝壁产生一定程度的挤压,从而获得良好的初期稳定性。临床种植挤压术中根据不同患者的骨质条件,2.0 mm以内的挤压通常是可以实现的,此次实验我们设计了1.2 mm的挤压程度,挤压程度较大有利于观察与对照组之间的差异性。
我们在手术过程中严格按照无菌操作原则,模拟临床种植外科手术,在进行挤压组和对照组种植体的植入术时,选择实验动物的相同植入部位,尽量减少了因植入部位不同而造成的测量误差,增加了不同愈合时间组间的可比性。
3.4种植体的设计,制作与表面处理
种植体设计为圆柱状,旨在观察挤压后的骨质变化,因此无基桩连接结构,种植体实际上起维持挤压备洞后空间的作用。在种植体的加工方面,为了减少材料因素引起的一些不良界面反应对观察结果的影响,按照常规种植体的加工处理方法,采用生物相容性较好的纯钛作为种植体的加工材料。在表面处理上,采用了去脂、喷砂等方法,术前进行超声清洗,高压灭菌,最大限度地减少了不良界面反应发生的可能性。
3.5挤压器的设计
本实验选择敲击挤压法,挤压器的设计按照前述种植体的规格以及逐级挤压的原则,下端的挤压端与种植体的形态,规格配套设计,并标有8 mm的刻度线,以便于敲击挤压时敲击深度的控制。种植体以及挤压器挤压端的形态在下端为略带弧形的凸面,目的是便于种植体与挤压器的就位以及挤压器挤压时的方向控制。挤压器的上端为直径1 cm,高度8 cm的敲击端,有足够的宽度及高度便于握持和敲击。挤压器的材料选择强度较大的不锈钢合金,以便于承受较大的敲击力并对骨质产生稳定的挤压作用。挤压端设计为光滑表面。
3.6结果分析
本实验通过对X线图像的观察发现,松质骨受挤压后种植体与周围骨质紧密连接,种植窝松质骨骨小梁排列致密。挤压组形成围绕种植体周类似于天然固有牙槽骨的高密度影像。受到挤压的骨小梁围绕种植体弯曲排列,而随着愈合时间的延长,骨小梁排列趋于正常。
骨小梁面积百分比(%Tb.Ar)为骨小梁面积(Tb.Ar)除以整体松质骨面积(T.Ar)得到,在一定程度上可以表达骨质和骨量的情况。从折线图中可以看到挤压组骨小梁面积百分数在4周内显著高于对照组,但可能由于实验样本量有限,差异无统计学意义。
本实验结果表明,骨挤压技术在一定时期内能够提高种植窝周松质骨的骨密度,可能有益于提高种植体的初期稳定性。
参考文献:
[1]刘夏青,李英.骨挤压技术在低密度种植床的应用[J].中国药物与临床,2014,14(10):1379-1380.
[2]张晓东,杨永勤,石飒飒,等.骨挤压后种植体愈合期稳定性变化的趋势[J].中国组织工程研究,2015,19(16):2551-2556.
[3]Salata LA,Burgos PM,Rasmusson L,etal.Osseointegration of oxidized and turned implants in circumferential bone defects with and without adjunctive therapies:an experimental study on BMP-2 and autogenous bone graft in the dog mandible[J].Int J Oral Max Surg,2007,36(1):62-71.
[4]Demirel M,Dereboy F,Ozturk A,etal.Arthroscopically assisted intra-articular lateral femoral condyle fracture surgery[J].Arthroscopy,2006,22(6):690.e1-4.
[5]时宏富,蔡贤华,汪国栋,等.股骨髁冠状面骨折的分型与治疗[J].中华创伤骨科杂志,2007,9(2):118-121.
[6]Beer A,Gahleitner A,Holm A,etal.Adapted preparation technique for screw-type implants:explorativeinvitropilot study in a porcine bone model[J].Clin Oral Implan Res,2007,18(1):103-107.
[7]Calvo-Guirado JL,Saez-Yuguero R,Pardo-Zamora G.Compressive osteotomes for expansion and maxilla sinus floor lifting[J].Med Oral Patol Oral,2006,11(1):E52-55.
[8]Ferrigno N,Laureti M,Fanali S,etal.Dental implants placement in conjunction with osteotome sinus floor elevation:a 12-year life-table analysis from a prospective study on 588 ITI implants[J].Clin Oral Implan Res,2006,17(2):194-205.
基金项目:陕西省教育厅科学研究计划资助项目(14JK1618);陕西省科技厅社发攻关基金资助项目(2016SF-148)
作者简介:左艳萍,女,1981-06生,硕士,副教授,E-mail:410457604@qq.com
收稿日期:2016-03-15
中图分类号:R782
文献标志码:A
文章编号:1007-6611(2016)07-0593-05
DOI:10.13753/j.issn.1007-6611.2016.07.003
Establishment of dog femur compressing model in implant surgery
ZUO Yanping1, WANG Yongyue2, WANG Luming3,MA Xinyang1
(1DepartmentofStomatology,Xi’anMedicalUniversity,Xi’an710021,China;2DepartmentofDentalImplants,WestChinaHospitalofStomatology,SichuanUniversity;3DepartmentofStomatology,SecondAffiliatedHospitalofXi’anMedicalUniversity)
Abstract:ObjectiveTo establish a rational animal model simulating clinical implant surgery using squeezing technique. MethodsThe cancellous bone in condyles of dog femur was chosen as the experimental position. The implant holes in experimental groups were prepared using knocking and squeezing technique, while the holes were not compressed in control groups. All the implant holes were inserted with the corresponding implants. The samples were taken at the different observation time(at 1,2,4,12 week after operation)to observe X-ray image(permutation of trabecular bone) and measure morphologic parameters(%Tb.Ar).ResultsAn animal model of cancellous bone was successfully established. The process of operation went smoothly and the wound healed well without complications such as infection and soft tissue split. The samples met the requirements of the observation. X-ray image showed that the compressed trabecular bone was arranged around the implant. The %Tb.Ar increased after being compressed, and the difference between experimental group and control group grew down gradually along with the extending of healing time.ConclusionThis animal model design is proved to be reasonable and feasible, which can be fully used to provide the reference for further studies of bone squeezing technique in implant surgery. The cancellous bone shows apparently better after being compressed,and the clinical implant surgery using squeezing technique is in favor of obtaining primary stabilities of implants.
Key words:implant;cancellous bone;bone compressing;animal model

