阻断白介素-3减轻脓毒血症小鼠的炎症反应
许白叶,张静,王清海,梁世山,陈真,王海岛
(1.福建医科大学附属泉州第一医院 儿科,福建 泉州 362000;2.福建泉州医学高等专科学校,福建 泉州 362000)
论著
阻断白介素-3减轻脓毒血症小鼠的炎症反应
许白叶1,张静2,王清海1,梁世山1,陈真1,王海岛1
(1.福建医科大学附属泉州第一医院 儿科,福建 泉州 362000;2.福建泉州医学高等专科学校,福建 泉州 362000)
摘要:目的探究阻断白介素-3(IL-3)对脓毒性小鼠炎症反应的作用及其潜在机制。方法小鼠盲肠结扎穿孔手术(CLP)后,分为野生型小鼠组和IL-3缺陷型小鼠组,每组13只,连续7 d观察和记录小鼠的死亡数。另取野生型小鼠和IL-3缺陷型小鼠,每组20只,分为3组进行实验:①组小鼠分别在CLP后0、12和24h进行临床症状评分和体温测量;另在24h测血压,采血,用于测定干扰素-α(IFN-α)、白介素-1β(IL-1β)和白介素-6(IL-6)水平;②组小鼠分别在CLP后0、6、12和24 h采血并在24 h取材(肝、肺),用于测定中性粒细胞、单核细胞总数及病理、免疫组织化学分析;③组小鼠分别在CLP后0和24h采血并收集支气管肺泡灌洗液用于蛋白总量和生化指标[天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)]的测定。结果与野生型小鼠组比较,CLP后IL-3缺陷型小鼠的存活率和体温升高(P<0.05),血压良好,临床症状评分下降(P<0.05)。此外,与野生型小鼠组比较,CLP后IL-3缺陷型小鼠炎症细胞因子IFN-α、IL-1β和IL-6水平降低(P<0.05);肺和肝组织中的中性粒细胞和单核细胞总数降低(P<0.05);支气管肺泡灌洗液中的总蛋白和血生化指标(AST、ALT)也降低(P<0.05)。结论 阻断IL-3能够减轻脓毒性小鼠的炎症反应,提高脓毒性小鼠的存活率。
关键词:脓毒血症;盲肠结扎穿孔手术;中性粒细胞;单核细胞;支气管肺泡灌洗液;干扰素-α
脓毒血症是指由病原微生物感染引起的并对宿主产生危害及不可控的全身炎症反应综合征(sys temic inflammatory response syndrome,SIRS),导致多个器官衰竭,具有发病率高、病情发展迅速、临床死亡率高(30%~70%)的特点,全球每年有超过1 800万例的严重脓毒血症患者。
盲肠结扎穿孔手术(cecal ligation and puncture,CLP)最广泛用于啮齿类动物实验性脓毒血症模型,目前被认为是脓毒血症研究的黄金标准[1-4]。由于盲肠是病原菌感染的内在来源,CLP后,穿孔的盲肠将导致病原菌性腹膜炎,并且引发混合的肠原杆菌转移至血液循环系统。脓毒血症发病初期,菌血症会激活全身性炎症反应,随后出现脓毒性休克,多器官功能损伤,最后导致死亡。脓毒血症在临床上仍然具有很大挑战,其潜在的病理生理特性还不清楚。
白介素-3(Interleukin-3,IL-3),又称多集落刺激因子,是白细胞介素家族重要成员之一,主要由活化的T细胞、巨噬细胞和骨髓基质干细胞产生,IL-3不仅介导白细胞的产生,增殖和生长,还能促进骨髓基质细胞的定向分化与增殖,并在炎症反应中起着重要作用。白细胞和中性粒细胞等骨髓基质细胞能够产生肿瘤坏死因子-α(Interferon-α,IFN-α)、白介素-1β(Interleukin-1β,IL-1β)和白介素-6 (Interleukin-6,IL-6),这些细胞因子是脓毒性休克的标志性炎症因子[5-7]。研究表明,大多数脓毒性休克与炎症细胞因子增多密切相关,包括IFN-α、IL-1和IL-6[8-9]。尽管炎症细胞因子与脓毒血症有关,但IL-3在脓毒血症中的作用仍不清楚。
本研究旨在通过盲肠结扎穿孔手术建立小鼠脓毒血症模型,阐述IL-3在脓毒血症中的作用及其潜在机制,尤其是IL-3对脓毒性小鼠炎症反应的影响,为临床治疗脓毒血症提供理论依据。
1 材料与方法
1.1动物
品系为Balb/c的IL-3基因敲除小鼠,4周龄,购买于北京维通利华实验动物技术有限公司(合格证号2014621553276679)。IL-3基因敲除:通过IL-3基因组文库构建一个替换型载体替换IL-3的第4个外显子(80bp)。采用电穿孔法将此打靶载体转入Balb/c小鼠胚胎干细胞(embryonic stem cell,ES细胞),经过筛选得到阳性克隆的ES细胞,并植入假孕的Balb/c小鼠子宫内,发育得到杂合子的IL-3基因敲除小鼠。小鼠的性成熟期约为35d,妊娠期约20d。雄雌鼠各1只合笼饲养,繁育出的子代为野生型IL-3+/+、杂合子型IL-3+/-和突变纯合子型IL-3-/-3种表型。剪取小鼠尾巴末端约0.6 cm,根据QIAGEN说明书提取DNA,聚合酶链反应(polymerase chain reaction,PCR)鉴定子代小鼠的基因型。野生型IL-3+/+小鼠作为对照组,突变纯合子型IL-3-/-小鼠作为实验组,雄性,8~12周龄,体重27~29g。小鼠饲养在无菌的笼盒内,每笼5只,动物房温度控制在20~25℃,12h昼/夜循环照明,动物可自由摄取高压灭菌的水和食物,适应性饲养1周。所有动物实验符合国家实验动物保护和使用健康指南,所有的动物实验操作都遵守动物福利。
1.2试剂与仪器
红细胞裂解液(美国,BioLegend),磷酸盐缓冲溶液(phosphatebuffersaline,PBS),anti-CD115(AF598,美国eBioscience公司),anti-Ly-6G(1A8,美国Bio Legend公司),生物素标记的二抗(美国Vector Laboratories lnc公司),二氨基联苯胺(Diaminobenzidine,DAB)(美国Dako公司),丙氨酸转氨酶(alanine transaminase,ALT) 或天冬氨酸转氨酶(aspartate transaminase AST)活性测定试剂盒(美国Sigma公司),Bio-Rad蛋白测定试剂盒(美国Bio-Rad公司),酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)试剂盒(美国BD Bioscience公司),酶标仪(Model450,美国Bio-Rad Laboratories公司),BX-51光学显微镜(日本,Olympus公司),温度感应器(TH212型号,北京鸿鸥成运科技有限公司),血压测定仪(无创尾动脉血压测定仪,RBP-1型号,澳大利亚,ADInstruments),冷冻切片机(CM1950,德国LEICA公司)。Image-Pro Plus 5.0形态学分析软件(美国,Media Cybernetics公司)。
1.3方法
1.3.1PCR检测PCR反应引物由上海生物工程有限公司合成。引物1:CTCCAGATCGTTAAGGTGG A位于替换的基因片段,用于检测突变型;引物2:GACCCTCTCTGAGGAATAAG位于IL-2基因敲除区域,用于检测野生型;引物3:GTAGGTGGAAATTCTA GCAT作为通用引物。反应条件:94℃预变性3min,94℃变性30s,64℃退火45s,72℃延伸45 s,共35个循环,72℃继续延伸2 min。取PCR产物5μl于1.2%琼脂糖凝胶上进行电泳分析,由引物1和3检测出的条带位于500bp处,为纯合子小鼠;由引物2 和3检测出的条带位于324bp处,为野生型小鼠。2条带均存在的为杂合子小鼠。
1.3.2小鼠CLP模型的建立所有实验动物术前8h禁食,可自由饮水。手术前,动物常规腹部消毒,异氟烷持续麻醉,取腹部皮肤正中切开约2 cm,打开腹腔轻轻提出盲肠,小心分离其远端与大肠系膜,避免损伤肠系膜血管。如盲肠内有粪便,可轻轻将其挤向与之相连的结肠。在盲肠远端1/2处用无菌可吸收的7号手术缝合丝线紧紧结扎,避免形成肠梗塞,用20号无菌注射针头在已结扎盲肠远端中央处贯通穿刺2次,形成4个穿刺孔,轻轻挤出少量肠内物以防止穿刺孔闭合,将盲肠推向腹腔,闭腹,逐层缝合。假手术:仅分离盲肠末端,不进行结扎穿刺,其他所有手术操作一样。所有动物均在术后背部皮下注射1 ml生理盐水,行液体复苏治疗。整个实验过程在室温环境下进行,术后小鼠自由饮食饮水。
1.3.3实验分组①动物生存实验。随机选取野生型和IL-3缺陷型(IL-3-/-)的Balb/c小鼠各13只,分为野生型组(WT组)和IL-3缺陷型组(IL-3-/-组)。两组实验动物行CLP手术造模,CLP手术方法参考文献[10]。首次造模后连续观察7 d,记录小鼠死亡数。②病理组织学与蛋白分析。另选取野生型和IL-3缺陷型的Balb/c小鼠各20只,分为两组:野生型CLP组(WT组)和IL-3缺陷型CLP组(IL-3-/-组)。以前述方法造模,造模后按照以下时间点进行病理组织学与蛋白分析。实验操作:a.0、12和24h的临床症状评分和体温测量;0和24 h测血压;24 h后采血,用于后续炎症细胞因子的测定(每组7~8只)。b.0、6、12和24 h眼眶采血;24 h后取材(肝、肺),用于后续炎症细胞总数测定、病理及免疫组织化学分析(每组6只)。C.0和24h麻醉下眼眶采血和支气管肺泡灌洗后,收集灌洗液和血清做后续的蛋白总量和生化指标的测定(每组6只)(0h作为CLP手术前的时间)。
1.3.4血生化指标测定①炎症细胞计数。将眼眶取血以1∶10稀释比放入红细胞裂解液中除去红细胞,与台盼蓝1∶1混合,血细胞计数板进行细胞计数。②血清生化指标测定。取5μl血清加入到96孔平底板中,ALT或AST测试缓冲液调整体积为50μl,加入100μl反应混合液,37℃孵育,酶标仪450 nm波长处测定吸光度,根据吸光度计算酶的活力。方法参考AST或ALT活性测定试剂盒说明书。
1.3.5动物形态学检测①体温测量。将温度感应器插入麻醉状态的小鼠直肠内1.5~2.0 cm,温度感应器头部涂抹凡士林以减少对动物的伤害,待温度稳定后记录每只小鼠的体温数据,平行测3次。②血压测定。采用尾袖法(tail-cuff plethysmograph,TCP)测定小鼠的血压。小鼠放在37℃热板上,以保持小鼠尾部温度适宜,连接血压测定仪,每只动物连续测5次,取其平均值作为每只动物的收缩压值。③临床症状评分。根据如下标准对每个小鼠进行临床症状评分:a.外表:正常,0分;缺乏理毛行为,1分;被毛杂乱,2分;弯腰弓背,3分;眼睛半闭合,4分。b.行为(无攻击性):正常,0分;沉郁,1分;少动孤立,2分;焦躁不安或非常平静,3分。c.行为(攻击性):警觉,0分;无警觉感,3分。d.呼吸症状:呼吸正常,0分;呼吸微弱,1分;呼吸率降低并行腹式呼吸,2分;明显的腹式呼吸并发绀,3分。e.脱水状态:正常,0分;脱水,5分。临床症状总分越高表明动物身体状况越差。
1.3.6生理功能指标检测①苏木精-伊红染色法(hematoxylin-eosin staining,HE)与免疫组织化学法。野生型(WT)和IL-3缺陷型(IL-3-/-)的Balb/c小鼠分别在CLP后24h取出肺和肝组织,切一小块放入盛有最佳切削温度(opti-mum cutting temperature, OCT)包埋剂的包埋盒中,包埋盒缓慢地放入预冷的异戊烷液面上,直至OCT包埋剂凝固,取出放入-80℃冰箱冷冻保存。取出冷冻的组织块,切片机切6μm厚的薄片,放入预冷丙酮中固定10 min。将固定好的切片放入PBS中洗涤,HE染色,乙醇脱水,二甲苯透明,封片,镜检。另取组织切片,用磷酸盐缓冲溶液Twen-20(phosphate buffer solution twen-20,PBST)洗涤后,经5%BSA室温孵育封闭1 h,加入anti-CD115和anti-Ly-6G 4℃过夜,加入生物素标记的二抗,二氨基联苯胺显色,苏木精复染、封片、镜检、拍照。BX-51光学显微镜和Image-Pro Plus 5.0形态学分析软件观察并数据分析。②ELISA测定炎症细胞因子。CLP后24h收集血液分离出血清,适当稀释后ELISA试剂盒分析IFN-α、IL-1β和IL-6含量。③支气管肺泡灌洗液总蛋白测定。小鼠在1%戊巴比妥钠(50 mg/kg)麻醉下,眼科剪切开颈部皮肤,钝性分离,暴露气管,气管上剪一小口,14 G针头插入,橡皮筋扎紧,注射器吸取1 ml PBS缓冲液接上针头,来回抽吸,直至肺部变白。Bio-Rad蛋白测定试剂盒测定支气管肺泡灌洗液总蛋白。
1.4统计学方法
采用SPSS 17.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,生存资料数据行Kaplan-Meier计算和Log-rank test分析。两两多重比较用Turkey检验,两组比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1子代小鼠基因型鉴定
其中IL-3-/-有1条带,大小为500 bp,IL-3+/-有2条带,分别为500和324 bp,野生型有1条带为324bp。见图1。
2.2阻断IL-3对CLP诱导小鼠死亡率的影响
野生型和IL-3缺陷型小鼠CLP手术后,连续观察7d,记录小鼠死亡数,结果显示,野生型组小鼠手术后第1天死亡1只,第2天死亡3只,第3天死亡1只,第5天死亡1只,第6天死亡1只,存活率46%(6/13)。IL-3缺陷型小鼠手术后第3天死亡2只,第6天死亡1只,存活率76%(10/13)。经Logrank test分析,IL-3缺陷型小鼠存活率高于野生型小鼠,脓毒性小鼠的生存率明显提高(χ2=4.182,P= 0.040)。见图2。
2.3阻断IL-3对CLP小鼠行为、体温和血压的影响
小鼠CLP手术后0、12和24 h的临床评分、体温,并0和24h血压结果中,IL-3缺陷型小鼠CLP手术后12和24 h的临床评分分别为(5.41±3.95)和(6.63±3.56)分,与野生型小鼠的临床评分[(18.44± 4.70)和(21.02±5.28)分]比较,分别降低70.88%和68.47%(t=6.005和6.392,P=0.000);体温分别为(35.77±3.60)和(36.18±1.79)℃,与野生型小鼠的体温[(28.90±4.32)和(27.57±2.18)℃]比较,升高23.78%和 31.25%(t=3.455和 8.634,P=0.004和 0.000)。野生型小鼠和IL-3缺陷型小鼠CLP手术后0h的血压分别为(95.58±2.84)和(95.81±5.12)mmHg;CLP手术后24h,IL-3缺陷型小鼠的血压为(91.56± 6.06)mmHg,野生型小鼠血压低于测量范围。见图3。
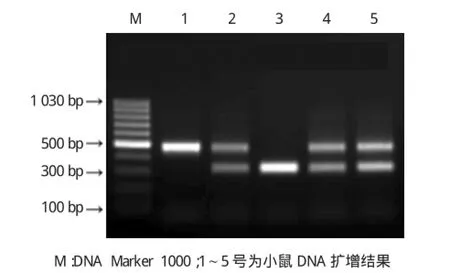
图1 子代IL-3小鼠PCR鉴定结果

图2 CLP术后两组小鼠生存曲线
2.4阻断IL-3对CLP小鼠肺和肝组织炎症反应的影响
CLP手术后24 h,IL-3缺陷型小鼠支气管肺泡灌洗液的总蛋白含量为(0.34±0.28)mg/ml,与野生型小鼠[(0.81±0.18)mg/ml]比较,下降57.82%(t= 3.990,P=0.001);而CLP手术后0 h,IL-3缺陷型小鼠和野生型小鼠支气管肺泡灌洗液的总蛋白含量分别为(0.32±0.06)和(0.28±0.13)mg/ml,差异无统计学意义(t=0.720,P=0.483)。IL-3缺陷型小鼠CLP手术后24 h,血清中的AST和ALT分别为(1.66± 0.33)IU/ml和(18.86±5.77)IU/ml,比野生型小鼠AST[(2.28±0.62)UI/ml]和ALT[(32.02±15.82)IU/ml]降低27.15%和41.11%(t=2.490和2.211,P=0.026和0.044);而CLP手术后0 h,IL-3缺陷型小鼠的AST[(0.61±0.39)IU/ml]和ALT[(9.34±4.80)IU/ml]与野生型的AST[(0.34±0.10)IU/ml]和ALT[(12.93± 4.58)IU/ml]比较,差异无统计学意义(t=1.931和1.529,P=0.074和0.149)。见表1。
表1 阻断IL-3对CLP小鼠肺和肝组织炎症反应的影响 (n=6±s)
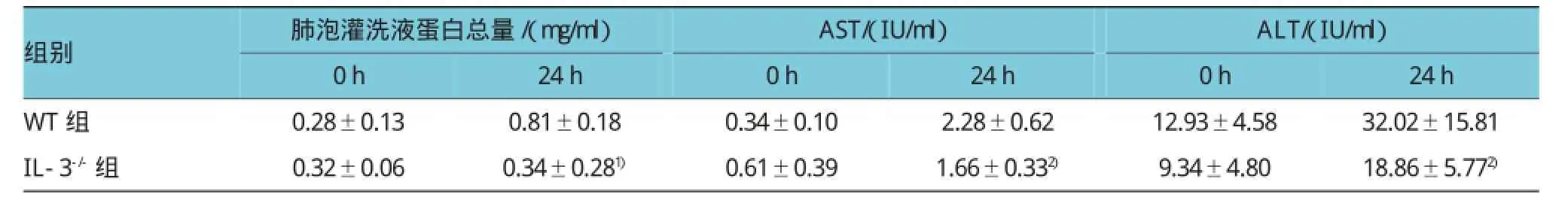
表1 阻断IL-3对CLP小鼠肺和肝组织炎症反应的影响 (n=6±s)
注:1)与WT组比较,P<0.01;2)与WT组比较,P<0.05
组别肺泡灌洗液蛋白总量/(mg/ml)AST/(IU/ml)ALT/(IU/ml)24h WT组 0.28±0.13 0.81±0.18 0.34±0.10 2.28±0.62 12.93±4.58 32.02±15.81 IL-3-/-组 0.32±0.06 0.34±0.281) 0.61±0.39 1.66±0.332) 9.34±4.80 18.86±5.772)0h 24h 0h 24h 0h
HE染色表明,CLP手术后1d,野生型小鼠的肺组织出现明显的间质性肺炎病理学特征,肺泡壁增宽,毛细血管充血扩张,严重的可见炎症细胞浸润和肺泡上皮细胞脱落,肺组织损伤严重;IL-3缺陷型小鼠肺组织结构清晰,炎症细胞浸润较少,肺组织损伤较轻。野生型小鼠的肝组织颜色变浅,发生水肿,肝细胞坏死,细胞核裂解,溶解,细胞体积膨胀,细胞膜不完整,肝组织损伤严重;IL-3缺陷型小鼠的肝组织结构清晰,肝细胞较完整。见图4。
2.5阻断IL-3对CLP小鼠炎症细胞的影响
为检测IL-3对组织和血液中炎症细胞的影响,小鼠CLP手术后0、6、12和24 h采血并在24 h安乐死取肺和肝组织,测定血液中的炎症细胞,并行肺以及肝组织的免疫组织化学染色,结果表明,CLP手术后24 h,IL-3缺陷型小鼠血液中的中性粒细胞和单核细胞分别为(7.23±3.79)×105/ml和(0.60± 0.28)×105/ml,与野生型小鼠[(13.22±6.86)×105/ml和(1.37±0.65)×105/ml]比较,分别降低1.83和2.29倍(t=3.213和3.063,P=0.015和0.008)。此外,野生型小鼠的单核细胞在CLP手术后0和24 h分别(0.52±0.42)×105/ml和(1.37±0.65)×105/ml,差异有统计学意义(t=3.072,P=0.008)。见表2。
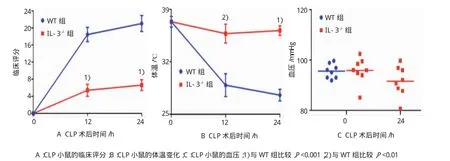
图3 阻断IL-3对CLP小鼠行为、体温和血压的影响
免疫组织化学染色结果表明,小鼠CLP手术后24 h后,野生型小鼠肺和肝组织存在大量的中性粒细胞和单核细胞聚集,肺组织的单核细胞和中性粒细胞分别为(5.25±1.79)×106和(1.80±0.87)× 106;肝组织的单核细胞和中性粒细胞分别为(1.23± 0.36)×106和(5.44±4.56)×107;而IL-3缺陷型小鼠肺组织的单核细胞和中性粒细胞分别为(3.44± 0.99)×106和(1.03±1.00)×106;肝组织的单核细胞和中性粒细胞分别为(0.56±0.32)×106和(1.59± 1.63)×107,两组比较IL-3缺陷型小鼠中性粒细胞和单核细胞数量减少(t=2.493、2.594、3.940和2.253,P=0.026、0.021、0.002和0.041)。见表3和图5~7。
2.6阻断IL-3对CLP小鼠炎症细胞因子表达的影响
ELISA检测结果表明,野生型小鼠组中,IL-1β、IL-6和 IFN-α 分别为(412.84±243.23)pg/ml、(37.94±24.49)ng/ml和(139.71±114.18)pg/ml。IL-3缺陷型小鼠组中,IL-1β、IL-6和IFN-α分别为(22.61±6.68)pg/ml、(7.22±5.00)ng/ml和(23.17± 26.95)pg/ml,与野生型小鼠组比较,分别下降95%、81%和83%(t=4.536、3.475和2.810,P=0.001、0.004 和0.014)。见表4和图8。
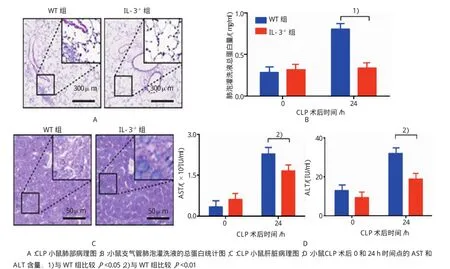
图4 阻断IL-3对CLP小鼠肺和肝组织炎症反应的影响
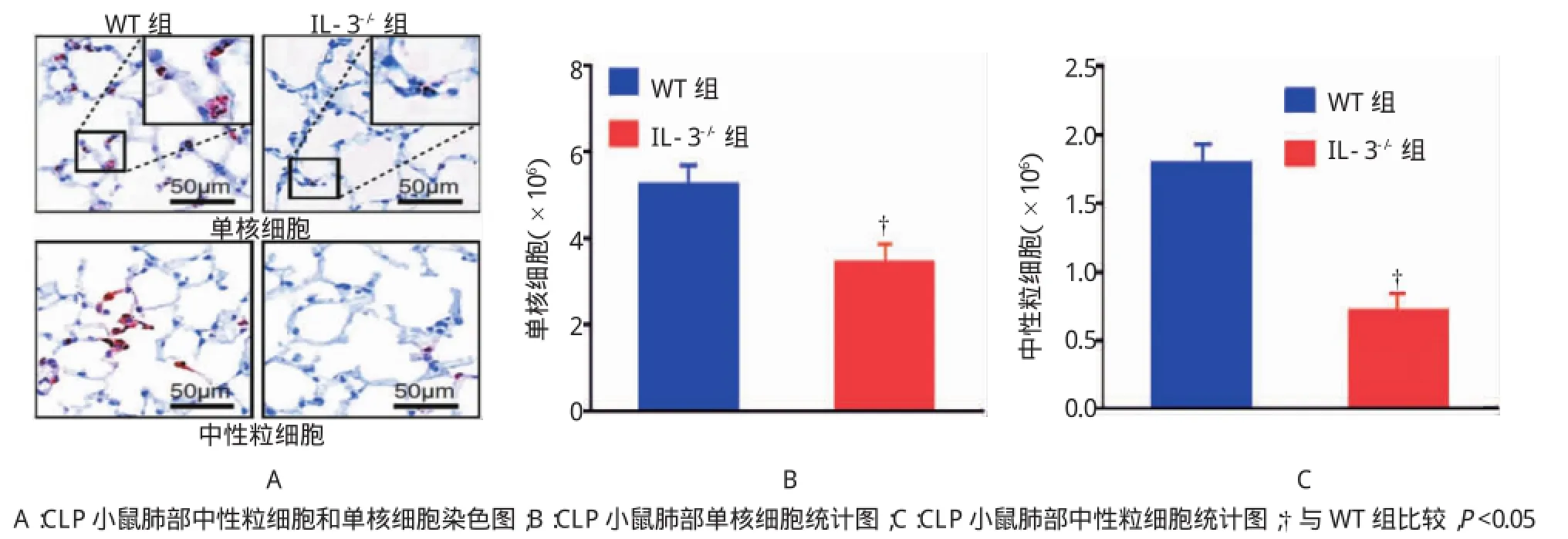
图5 阻断IL-3对CLP小鼠肺组织炎症细胞的影响
表2 两组CLP术后血液中性粒细胞及单核细胞比较 (n=6,×105/ml±s)
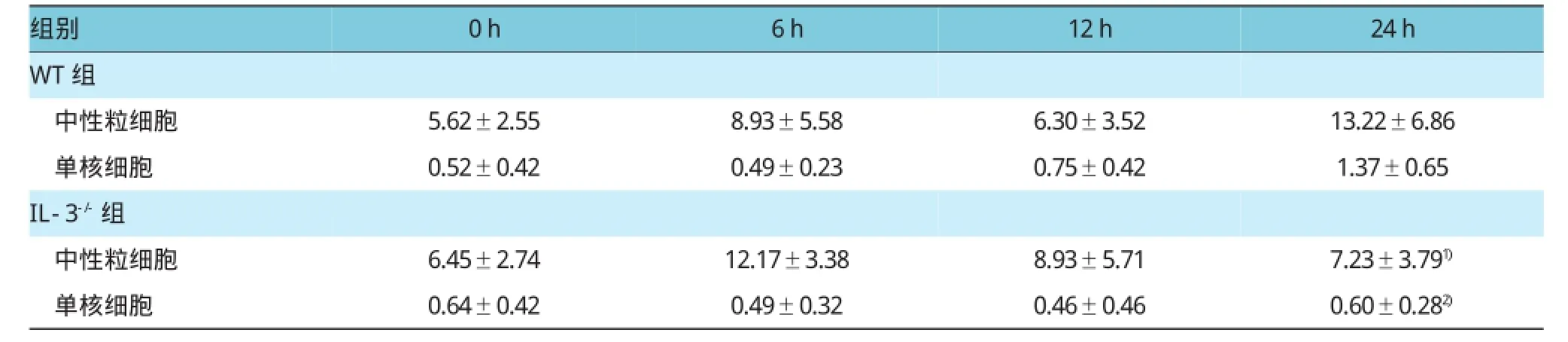
表2 两组CLP术后血液中性粒细胞及单核细胞比较 (n=6,×105/ml±s)
注:1)与WT组比较,P<0.05;2)与WT组比较,P<0.01
组别0h 6h 12h 24h WT组中性粒细胞 5.62±2.55 8.93±5.58 6.30±3.52 13.22±6.86单核细胞0.52±0.42 0.49±0.23 0.75±0.42 1.37±0.65 IL-3-/-组中性粒细胞 6.45±2.74 12.17±3.38 8.93±5.71 7.23±3.791)单核细胞 0.64±0.42 0.49±0.32 0.46±0.46 0.60±0.282)
表3 两组CLP术后24 h肺及肝组织炎症细胞比较 (n=6,×106±s)
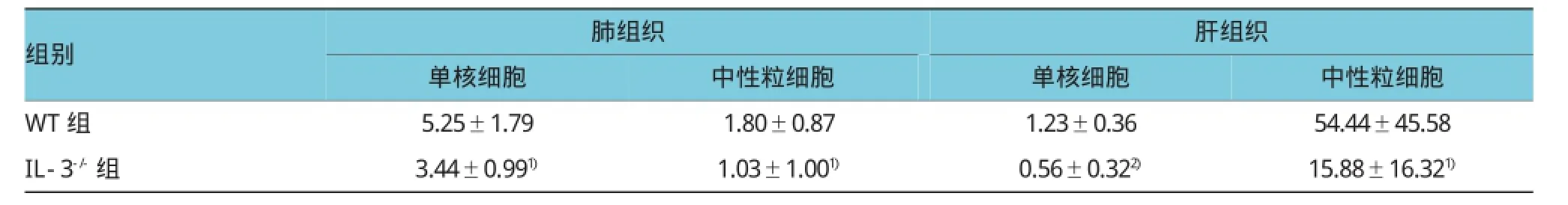
表3 两组CLP术后24 h肺及肝组织炎症细胞比较 (n=6,×106±s)
注:1)与WT组比较,P<0.05;2)与WT组比较,P<0.01
组别肺组织肝组织中性粒细胞WT组 5.25±1.79 1.80±0.87 1.23±0.36 54.44±45.58 IL-3-/-组 3.44±0.991) 1.03±1.001) 0.56±0.322) 15.88±16.321)单核细胞中性粒细胞单核细胞
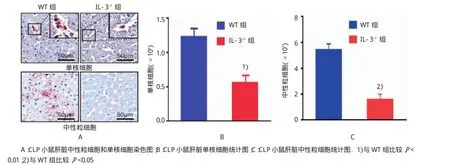
图6 阻断IL-3对CLP小鼠肝组织炎症细胞的影响
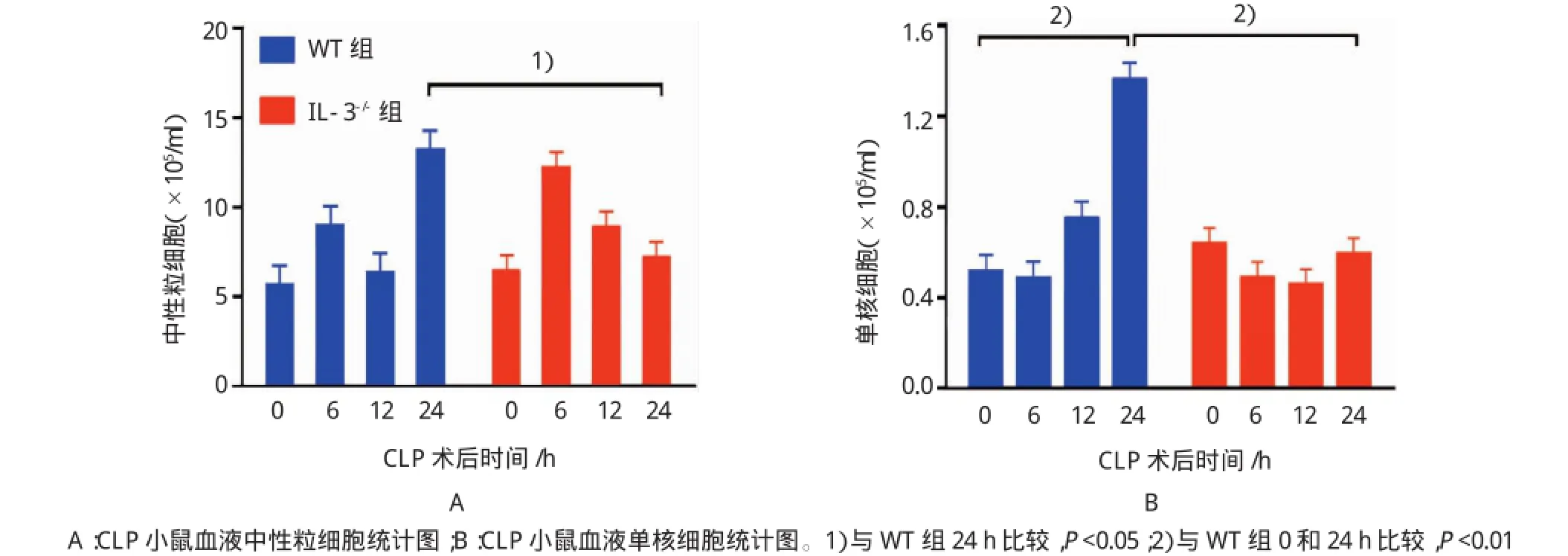
图7 阻断IL-3对CLP小鼠血液中炎症细胞的影响
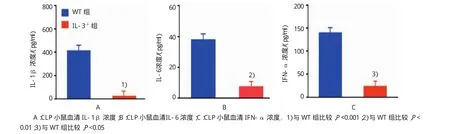
图8 阻断IL-3对CLP小鼠炎症细胞因子表达的影响
表4 两组CLP后24 h血清炎症细胞因子含量比较(n=6±s)
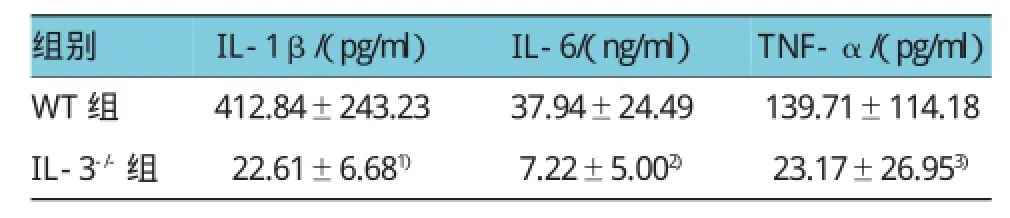
表4 两组CLP后24 h血清炎症细胞因子含量比较(n=6±s)
注:1)与WT组比较,P<0.001;2)与WT组比较,P<0.01;3)与WT组比较,P<0.05
组别TNF-α/(pg/ml)WT组 412.84±243.23 37.94±24.49 139.71±114.18 IL-3-/-组 22.61±6.681) 7.22±5.002) 23.17±26.953)IL-1β/(pg/ml)IL-6/(ng/ml)
3 讨论
脓毒血症是由感染引起的,具有免疫与炎症反应的高发病率和死亡率疾病。炎症反应往往伴随着炎症细胞的激活和多种炎症细胞因子的产生和释放。许多研究表明,脓毒血症与大量的炎症细胞因子(IFN-α、IL-1和IL-6)产生有关。这些炎症细胞因子产生似乎代表着不受控制的强烈炎症反应。据研究报道,给予这些炎症细胞因子可以模仿产生许多脓毒性休克症状,包括不良的心血管反应[8,11]。给予抗细胞因子,如IFN-α抗体能够提高严重脓毒性休克动物和人的成活率[12-13]。本研究表明,IL-3缺陷型小鼠组CLP手术后小鼠的存活率和临床症状表现出明显的改善,提示IL-3参与脓毒血症的发病机制。WEBER等[14]研究发现,给予健康的野生型小鼠IL-3,可以使其炎症细胞数增加,等同野生型CLP小鼠。相反,给予IL-3受体拮抗剂(Anti-CD123)能够减少野生型CLP小鼠的炎症细胞数并提高其生存率。研究报告表明,脓毒血症患者中的IL-3浓度很高,并伴有高死亡风险[15]。这些研究表明IL-3通过与其受体结合,可以促进炎症细胞的产生,提高脓毒性小鼠的成活率。
本研究中笔者还发现,与野生型小鼠比较,敲除IL-3能够降低小鼠肺和肝组织中的单核细胞和中性粒细胞以及血液中炎症细胞因子IL-1β、IL-6和IFN-α的表达水平。这提示当机体发生感染,IL-3会促进单核细胞和中性粒细胞及免疫细胞等产生,而这些细胞会释放出大量的炎症细胞因子。脓毒血症是免疫系统对感染或组织损伤发生的一种过度反应,产生大量的细胞因子,导致大量的免疫细胞募集。这些细胞又会释放出更多的细胞因子,从而又招募更多的免疫细胞,形成一个恶性循环。这些细胞因子和免疫细胞并不会阻止初始的感染,而是攻击机体的组织和器官,导致器官衰竭和死亡。RAUCH等[16]研究表明,IL-3由脾脏、胸腺和淋巴结中的B细胞产生,IL-3能导致多种白细胞的产生和增殖,从而释放出大量的细胞因子(被称为细胞因子风暴)。另有研究显示,CLP术后,小鼠产生IL-3的T细胞和B细胞数不同,但嗜碱性细胞与肥大细胞数相差不大,这表明IL-3在炎症初期对嗜碱性细胞和肥大细胞的产生及功能没有影响[17-19]。本研究也表明,CLP术后野生型小鼠的肺和肝组织积累着比IL-3缺陷型小鼠更多的单核细胞和中性粒细胞,并且支气管灌洗液中的蛋白也明显增多。这说明IL-3促进脓毒血症中的炎症反应。ANNANE[20]和WARD 等[21]报道,IL-3还会导致脓毒血症中的脓毒性休克。
综上可知,IL-3可以通过增强炎症反应促进脓毒血症的发生,而阻断IL-3能够减轻炎症反应,改善脓毒血症的成活率,这为IL-3成为临床上治疗脓毒血症的靶点提供研究基础。
参考文献:
[1]RITTIRSCH D,HOESEL L M,WARD P A.The disconnect between animal models of sepsis and human sepsis[J].J Leukoc Biol, 2007,81(1):137-143.
[2]DEITCH E A.Rodent models of intra-abdominal infection[J]. Shock,2005,24(1):19-23.
[3]DYSON A,SINGER M.Animal models of sepsis:why does preclinical efficacy fail to translate to the clinical setting[J].Crit Care Med,2009,37(1):30-37.
[4]BURAS J A,HOLZMANN B,SITKOVSKY M.Animal models of sepsis:setting the stage[J].Nat Rev Drug Discov,2005,4(10): 854-865.
[5]ANGUS D C,POLL T.Severe sepsis and septic shock[J].N Engl J Med,2013,369(21):2063.
[6]HOTCHKISS R S,MONNERET G,PAYEN D.Sepsis-induced immunosuppression:from cellular dysfunctions to immunotherapy [J].Nat Rev Immunol,2013,13(12):862-874.
[7]DEUTSCHMAN C S,TRACEY K J.Sepsis:current dogma and new perspectives[J].Immunity,2014,40(4):463-475.
[8]CASEY L C,BALK R A,BONE R C.Plasma cytokine and endotoxin levels correlate with survival in patients with the sepsis syndrome[J].Ann Intern Med,1993,119(8):771-778.
[9]高戎,徐建如,李仁奇,等.人参皂苷Rg5对脓毒血症大鼠急性肺损伤的保护作用[J].现代生物医学进展,2013,13(11):2062-2064.
[10]RITTIRSCH D,HUBER-LANG M S,FLIERL M A,et al.Immunodesign of experimental sepsis by cecal ligation and puncture[J].Nat Protoc,2009,4(1):31-36.
[11]TAKAO K,MIYAKAWA T.Genomic responses in mouse models greatly mimic human inflammatory diseases[J].Proc Natl A-cad Sci USA,2015,112(4):1167-1172.
[12]ABRAHAM E,WUNDERINK R,SILVERMAN H,et al.Effi-cacy and safety of monoclonal antibody to human tumor necrosis factor alpha in patients with sepsis syndrome.A randomized, controlled,double-blind,multicenter clinical trial[J].TNF-alpha MAb Sepsis Study Group JAMA,1995,273(12):934-941.
[13]BOSMANN M,WARD PA.The inflammatory response in sepsis[J]. Trends Immunol,2013,34(3):129-136.
[14]WEBER G F,CHOUSTERMAN B G,HE S,et al.Nterleukin-3 amplifies acute inflammation and is a potential therapeutic target in sepsis[J].Science,2015,347(6227):1260-1265.
[15]WEBER G F,CHOUSTERMAN B G,HE S,et al.Inflammatory factor IL-3 may play essential role in development of sepsis[J]. Science,March 2015.DOI:10.1126/science.aaa4268
[16]RAUCH P J,CHUDNOVSKIY A,ROBBINS C S,et al.Innate response activator B cells protect against microbial sepsis[J]. Science,2012,335(6068):597-601.
[17]JAMUR MC,OLIVER C.Origin,maturation and recruitment of mast cell precursors[J].Front Biosci,2011,3:1390-1406.
[18]VOEHRINGER D.Basophil modulation by cytokine instruction[J]. Eur J Immunol,2012,42(10):2544-2550.
[19]RONNBERG E,JOHNZON C F,CALOUNOVA G,et al.Mast cells are activated by staphylococcus aureus in vitro but do not influence the outcome of intraperitoneal S[J].Aureus Infection In Vivo Immunology,2014,143(2):155-163.
[20]ANNANE D,BELLISSANT E,CAVAILLON J M.Septic shock[J]. Lancet,2005,365(9453):63-78.
[21]WARD P A.New approaches to the study of sepsis[J].EMBO Mol Med,2012,4(12):1234-1243.
(申海菊编辑)
中图分类号:R 459.7
文献标识码:A
DOI:10.3969/j.issn.1005-8982.2016.13.006
文章编号:1005-8982(2016)13-0028-09
收稿日期:2015-12-02
Blockade of IL-3 ameliorates sepsis-induced inflammation in mice
Bai-ye Xu1,Jing Zhang2,Qing-hai Wang1,Shi-shan Liang1,Zhen Chen1,Hai-dao Wang1
(1.Department of Pediatrics,Quanzhou First Hospital Affiliated to Fujian Medical University,Quanzhou,Fujian 362000,China;2.Quanzhou Medical College,Quanzhou,Fujian 362000,China)
Abstract:Objective To investigate the effect of blockade of IL-3 on sepsis-induced inflammation in mice and explore its underlying mechanism.Methods Mice in WT group(n=13)and IL-3-/-group(n=13)were observed and mortality was recorded up to 7 days after cecal ligation and puncture(CLP).In addition,more mice were randomly assigned to WT group(n=20)and IL-3-/-group(n=20)after CLP,each group was divided into 3 subgroups for study.In the first subgroup,clinical score assessment and body temperature measurement were conducted at 0,12 and 24 h after CLP;blood pressure was measured and blood was collected to determine the levels of IFN-α,IL-1β and IL-6 by ELISA at 24 h after CLP.In the second subgroup,blood was collected to determine the total number of neutrophils and monocytes at 0,6,12 and 24 h after CLP,and lungs and liver were harvested for histopathological analysis at 24 h after CLP.In the third subgroup,blood and bronchoalveolar lavage fluid(BALF)were collected to determine total protein content and enzyme activity(AST and ALT)at 0 h,24 h after CLP.Results The survival,body temperature and blood pressure of septic mice in the IL-3-/-group were significantly improved after CLP compared with mice in the WT group(P<0.05).The clinical score of the septic mice in the IL-3-/-group significantly decreased compared with the WT group(P<0.05).In addition,the levels of IL-2 and IFN-γ in the IL-3-/-group significantly decreased compared with the WT group(P<0.05).The total number of neutrophils and monocytes inthe lung and liver tissues of the IL-3-/-group significantly decreased,and the total protein content of BALF and enzyme activity of serum AST and ALT also significantly decreased in the IL-3-/-group compared with the WT group(P<0.05).Conclusions Blockade of IL-3 can improve survival of septic mice through alleviation of sepsis-induced inflammation.
Keywords:sepsis;cecal ligation and puncture;neutrophil;monocyte;blood and bronchoalveolar lavage fluid;interferon-α

