缺氧对乳鼠耳蜗螺旋神经节神经元外向电流的影响及其环磷酸腺苷、环磷酸鸟苷含量变化的研究*
王艳萍,朱贺,刘欢,马克涛,司军强,李丽
[石河子大学医学院 生理学教研室(新疆地方与民族高发病教育部重点实验室),新疆 石河子 832000]
论著
缺氧对乳鼠耳蜗螺旋神经节神经元外向电流的影响及其环磷酸腺苷、环磷酸鸟苷含量变化的研究*
王艳萍,朱贺,刘欢,马克涛,司军强,李丽
[石河子大学医学院 生理学教研室(新疆地方与民族高发病教育部重点实验室),新疆 石河子 832000]
摘要:目的观察缺氧时间对体外培养的耳蜗螺旋神经节神经元(SGNs)外向电流的影响及其细胞内第二信使环磷酸腺苷(cAMP)、环磷酸鸟苷(cGMP)含量变化。方法体外原代培养新生1~3d SD大鼠SGNs并进行免疫荧光鉴定。用膜片钳全细胞记录模式观察缺氧外液灌流SGNs时,外向电流的变化趋势和特点。用酶联免疫吸附实验检测缺氧5、15和20min时SGNs内cAMP和cGMP的浓度变化。结果①酶解分离可获得生存状态良好的神经元,经免疫荧光鉴定为SGNs。②当电压钳制在-60mV时,急性缺氧增强SGNs外向电流,主要增强0~+60mV电压区间的激活电流幅度。缺氧5min时,+60mV激活电流幅度从(971.2±50.3)pA增强到(2361.0±207.4)pA,差异有统计学意义(P<0.01)。随后出现下降趋势,11~15 min时,增强的电流幅度与对照组基础电流比较,差异无统计学意义(P>0.05)。③分别检测缺氧5、15和20min后SGNs中cAMP和cGMP的含量变化。缺氧5min组与正常对照组比较,cAMP浓度升高,差异有统计学意义(P<0.01)。缺氧15min组与正常对照组比较,cAMP浓度变化差异无统计学意义;缺氧20min组与正常组对照组比较,cAMP浓度水平下降(P<0.01)。cGMP浓度随着缺氧时间的延长,总体呈下降趋势,但在20min后有部分回升(缺氧15minvs缺氧20min,P<0.01)。结论在SGNs急性缺氧损伤过程中,外向电流增强,增强幅度随缺氧时间变化先升后降,推测在短期缺氧时细胞通过降低兴奋性,影响听觉信息的传导,且该过程与胞内第二信使cAMP和cGMP浓度的改变相关。
关键词:缺氧;SGNs;环磷酸腺苷;环磷酸鸟苷
听觉障碍是指听觉系统中的传音、感音、听神经和/或其各级听觉中枢发生病变,导致听功能出现障碍,而发生不同程度的听力下降[1]。围生期窒息缺氧导致脑的缺氧缺血性损害是影响新生儿听力的高危因素[2]。耳蜗及听觉中枢对缺氧极为敏感,当缺氧、缺血时首先累及耳蜗组织,使耳蜗产生类似于脑缺氧时兴奋性氨基酸受体过度激动而引起的神经中毒。有研究表明,缺氧、缺血可造成耳蜗内毛细胞下传入神经树突末梢肿胀、变性、空泡样变[3]。另外听觉中枢因缺氧引起损伤可压迫血管,从而影响耳蜗的供血,造成耳蜗功能异常[4]。在感觉神经性听力障碍发生过程中,听觉传导通路中各级神经元的损害是其重要因素。螺旋神经节神经元(spiral ganglion neurons,SGNs)是位于蜗轴螺旋管内、听觉传导通路的第一级神经元,起着将声音的机械信号转变成化学冲动传送到神经节,再由中枢轴突组成的听觉神经束将信号进一步向上一级的听觉中枢传递的作用。本实验的前期研究发现,急性缺氧可增强SGNs的外向电流,且该电流可能主要为大电导钙激活钾(large conductance Ca2+-activated K+-channel,BKCa)电流。本实验通过建立体外SGNs缺氧模型[5],进一步研究缺氧时电流的变化特点及造成电流变化的胞内机制。
1 材料与方法
1.1实验动物
选用出生1~3 d的新生Sprague Dawley乳鼠,动物标准为清洁级,雌雄不拘,新疆自治区疾病控制中心动物饲养科提供,许可证编号:SCXK新2003-0001。动物使用遵守医院伦理委员会要求。
1.2主要实验材料及仪器
达尔伯克必需基本培养基(dulbecco's minimum essential medium,DMEM)/F12培养基、0.25%胰酶、Ⅰ型胶原酶、胎牛血清、青链霉素、B27神经细胞生长添加剂(B27 NeuroMix)购自美国Gibco公司,环磷酸腺苷(cyclic adenosine monophosphate,cAMP)和环磷酸鸟苷(cyclic guanosine monophosphate,cGMP)的酶联免疫吸附剂测定(enzyme linked immunosorbent assay,ELISA)试剂盒为美国BioVison公司产品,其余试剂均为国产分析纯试剂。Axon 700B放大器购自美国Axon公司,P-97拉制仪购自美国Sutter公司,生物电信号记录计算机(Axoscope 10.2软件)购自美国Axon公司。
1.3SGNs的分离与培养
取出生0~3 d的新生Sprague Dawley乳鼠,75%酒精浸泡消毒3~5 min,麻醉后断头处死,沿正中线矢状剪开皮肤及颅骨,去除顶骨及脑组织,分离双侧颞骨,浸入预冷(4℃)的D-Hanks液(含100u/ml青霉素+100 u/ml链霉素)中。从耳蜗底部开始,用显微镊轻轻拨开蜗底还未骨化的组织,充分暴露听泡。取出膜迷路,仔细剥除螺旋韧带及基底膜后,将含有螺旋神经节的蜗轴螺旋管组织迅速移入1 ml含有0.125%Ⅰ型胶原酶和0.125%胰酶的已高压的Eppendorf离心管中。在37℃温箱内温育17 min,超净台上用移液枪移除部分消化液上清,加入300μl种植培养液(90%DMEM/F12,10%胎牛血清,100 u/ml青霉素,已复温)3min终止消化。将终止消化的细胞悬液轻轻吹打20次,放入离心机,1 000 r/min离心8min。弃上清液,加入1ml细胞种植培养液轻轻吹打50次制成细胞混悬液。取一小滴SGNs混悬液,用细胞计数板在光学显微镜下进行单位面积内神经元计数。以密度为1×106/ml种植在预先用0.05%多聚赖氨酸包被过爬片的6孔板中。将培养皿置于37℃、5%二氧化碳CO2细胞培养箱中培养。实验时选取培养8 h的SGNs,此时细胞活性最好。用神经Ⅲ类β-微管蛋白单克隆抗体(neuronal classⅢβ-tubulin,TUJ1)为特异性标记物鉴别神经元。
1.4急性缺氧模型制备
在室温条件下(22~25℃)对培养的SGNs标本,使用多管灌流给药系统持续灌注无糖低氧的生理盐溶液(physiological saline solution,PSS)(20%CO2和80%氮气N2混合气体充分饱和,pH值=6.5)5~15min。
1.5全细胞膜片钳记录
在室温条件下(22~25℃)使用Axon 700B放大器进行全细胞膜片钳实验。记录电极尖端直径约为1μm,电极阻抗约为3~5MΩ。电极内液成分是:氯化钾KCl 140.0 mmol/L,二水氯化镁MgCl2·2H2O 2.0 mmol/L,氯化钙CaCl21.2 mmol/L,乙二醇双(2-氨基乙基醚)四乙酸10.0mmol/L,4-羟乙基哌嗪乙磺酸10.0 mmol/L,以氢氧化钾(KOH)将pH值调至7.3,渗透压300mOsm/L。细胞外液成分:氯化钠NaCl 137.0mmol/L,磷酸氢二钠Na2HPO40.2mmol/L,氯化钾KCl 5.4mmol/L,磷酸二氢钾KH2PO40.4mmol/L,氯化镁MgCl21.0 mmol/L,氯化钙CaCl21.2 mmol/L,4-羟乙基哌嗪乙磺酸10.0 mmol/L。通过微操纵器使记录电极的尖端接触到神经元后,给予负压形成G欧封接。补偿电极电容后,给予瞬时较强负压或者电刺激击破细胞膜形成全细胞膜片钳记录模式。待电流稳定5 min后开始记录。膜电流用5或10 kHz (3dB)低频滤过。生物电信号通过PC计算机记录。采样间隔为10、20或100μs。
1.6酶联免疫吸附法
用缺氧外液灌流培养细胞造成缺氧模型,在不同时间点,用胰酶消化,离心收集细胞。取适量磷酸缓冲盐溶液重悬细胞,超声波处理细胞悬液,使细胞急剧震荡破裂,再将细胞置入-20℃冰箱冷冻,反复3次,使细胞进一步破碎。将标本置于2~8℃温度下1 500 r/min离心10 min,收集上清液备用。按照cAMP和cGMP的ELISA试剂盒说明书进行测定。
1.7统计学方法
采用SPSS 17.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间比较用方差分析,若方差齐则两两比较用配对t检验,P<0.05为差异有统计学意义。
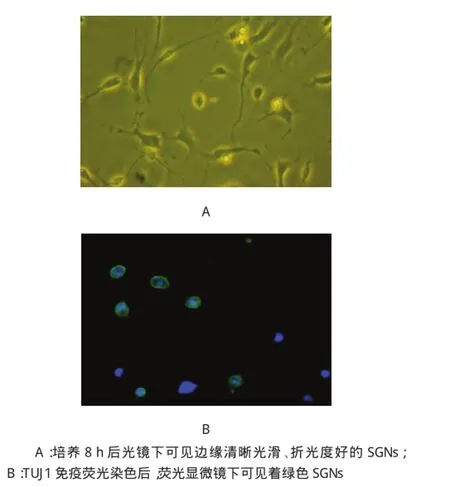
图1 SGNs培养与鉴定 (×400)
2 结果
2.1SGNs培养与免疫荧光鉴定
大约在接种8h后耳蜗SGNs贴壁。镜下可见形态不一的细胞,贴壁的SGNs细胞胞体多呈椭圆形,有的呈球形,边缘清晰光滑,折光性好,周边可见明显光晕,胞体两侧未见突起生长。培养至24h后,大部分细胞长出突起,背景细胞中可见神经胶质细胞和成纤维细胞等。但是其形态却大不一样,SGNs由之前的椭圆形延伸出突起,突起长度仅有胞体的1~2倍。神经胶质细胞的突起伸出较短一些,胞体呈梭形,突起伸出后靠近胞体部分稍宽,进而逐渐变细。另一些为成纤维细胞,胞体稍大,多呈不规则形,多边形或者星型,且分裂速度较快,光泽度不高。TUJ1免疫荧光染色后,荧光显微镜下可见神经元胞体和突起均呈绿色,背景下可见少许非特异性染色,未见其他背景细胞着色(见图1)。
2.2SGNs外向电流随缺氧时间的变化
钳制电压-60 mV,随着缺氧时间的延长,激活的SGNs外向电流先增强后逐渐减弱。其中缺氧致5min时,外向电流幅度增强最大,+60 mV电流幅度与对照组基础电流比较由(971.2±50.3)pA增加到(2361.0±207.4)pA,差异有统计学意义(n=6,t= 4.430,P=0.007)。5min以后增强幅度呈下降趋势,缺氧11~15 min,缺氧对外向电流的增强作用基本消失。+60mV电流幅度为(1024.6±232.2)pA,与正常对照组比较差异无统计学意义(n=6,t=1.030,P= 0.350)。随着缺氧时间的延长,SGNs外向电流逐渐增大,5min时外向电流最大。(见图2)。
2.3酶联免疫吸附法
使用自制灌流系统,将预充20%CO2和80%N2混合气体充分饱和的PSS持续灌流培养的SGNs。缺氧5、15和20 min时,SGNs中cAMP的浓度分别为(278.39±0.69)、(220.37±1.05)和(174.40± 0.26)pg/ml(见表1)。缺氧5min时,SGNs内cAMP浓度明显升高,20min后明显下降(见图3)。缺氧5、15 和20 min时cGMP的浓度分别为(2.49±0.05)、(2.30±0.09)和(3.83±0.15)pmol/ml(见表2);缺氧后SGNs内cGMP浓度总体呈下降趋势,20 min时,其浓度有部分回升(见图4)。缺氧5min时,cAMP浓度出现增加(缺氧5 min vs对照组,t=57.533,P= 0.000),15 min时cAMP浓度与对照组水平比较,差异无统计学意义(t=0.441,P=0.865),20min后继续下降(缺氧20minvs对照组,t=44.584,P=0.000)。5和15 min时,cGMP浓度下降(缺氧5和15 minvs对照组,t=21.698和23.302,P=0.000),20 min时又出现升高现象(缺氧15minvs缺氧20min,t=17.816,P=0.000)。
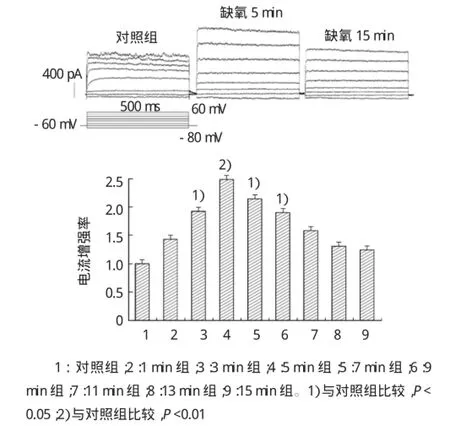
图2 SGNs外向电流随缺氧时间的变化
表1 不同缺氧时间下SGNs内cAMP浓度的变化(n=6,pg/ml±s)
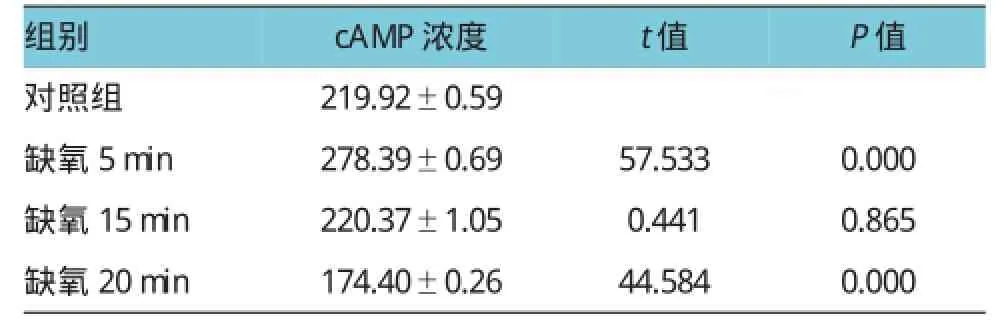
表1 不同缺氧时间下SGNs内cAMP浓度的变化(n=6,pg/ml±s)
注:方差分析F=1249.126,P=0.000;t、P值:与对照组比较
组别P值对照组 219.92±0.59缺氧5min 278.39±0.69 57.533 0.000缺氧15min 220.37±1.05 0.441 0.865缺氧20min 174.40±0.26 44.584 0.000 cAMP浓度t值
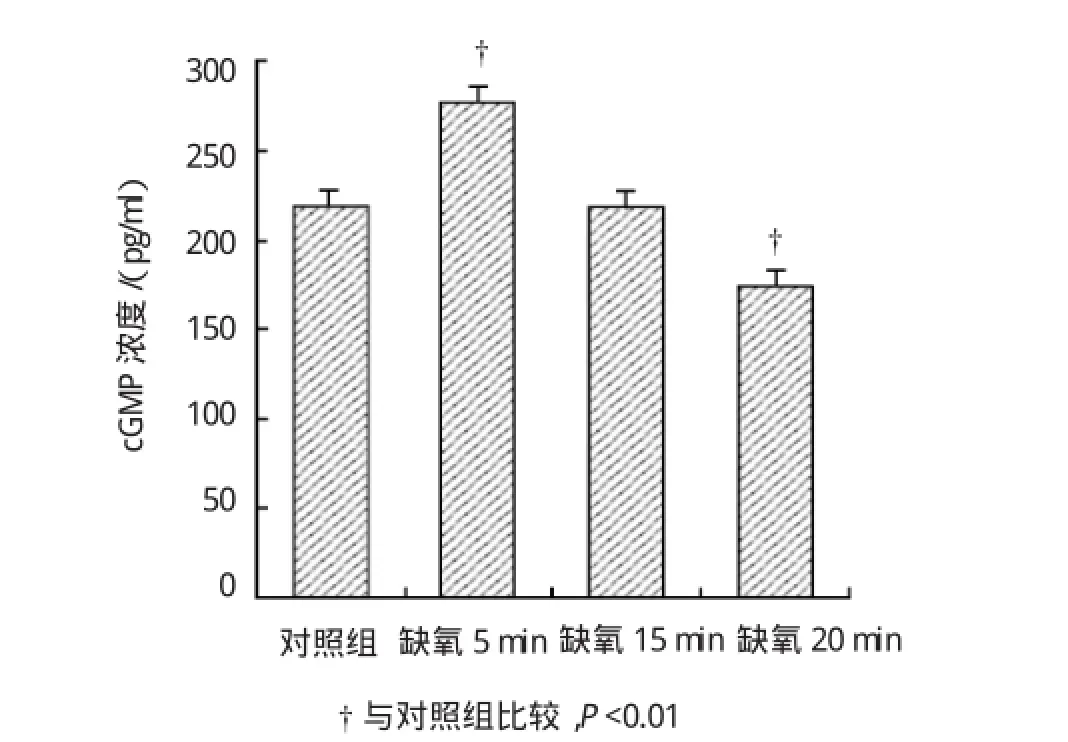
图3 不同缺氧时间对SGNs内cAMP浓度的影响
表2 不同缺氧时间下SGNs内cGMP浓度的变化(n=6,pmol/ml±s)
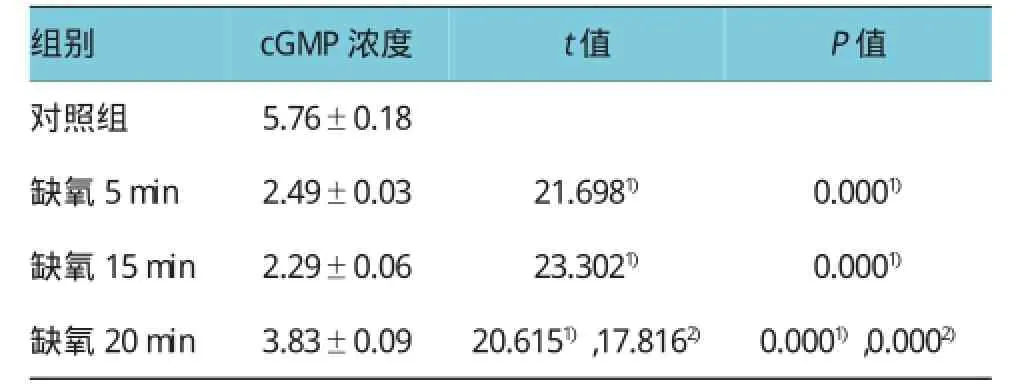
表2 不同缺氧时间下SGNs内cGMP浓度的变化(n=6,pmol/ml±s)
注:方差分析F=210.937,P=0.000;1)与对照组比较;2)与缺氧15min比较
组别P值对照组 5.76±0.18缺氧5min 2.49±0.03 21.6981) 0.0001)缺氧15min 2.29±0.06 23.3021) 0.0001)缺氧20min 3.83±0.09 20.6151),17.8162) 0.0001),0.0002)cGMP浓度t值
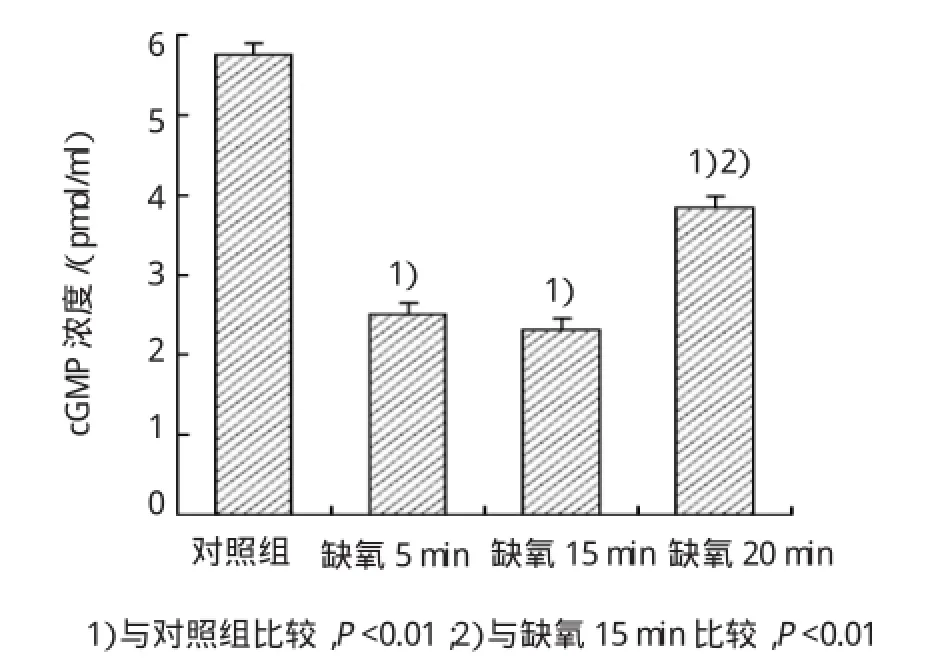
图4 不同缺氧时间对SGNs内cGMP浓度的影响
3 讨论
在听觉系统中,很多听力丧失都与缺血、缺氧有关。新生儿缺氧,包括新生儿窒息、呼吸暂停、难产、持续机械通气史等,子宫内缺氧和分娩时间过长都会影响新生儿的听觉器官,引起耳蜗,脑干或者皮质可逆或不可逆的变化[6]。研究表明,缺氧是导致听力障碍的一个相当明确的危险因素[7]。本研究利用免疫荧光技术、电生理膜片钳全细胞记录技术、酶联免疫吸附法等研究缺氧对耳蜗SGNs电流的影响。研究结果显示,本实验中分离培养的SGNs生长状态良好,经免疫荧光检测确定为SGNs,能满足后续实验要求。膜片钳实验证实急性缺氧增加SGNs的外向电流,且该外向电流的增强作用随缺氧时间变化而改变。胞内第二信使cAMP和cGMP水平在急性缺氧过程中发生变化,cAMP的浓度随着缺氧时间的延长,出现先升高后降低的趋势。cGMP浓度随着缺氧时间的延长,总体呈下降趋势,但在20 min后有部分回升,可能与钾离子通道的开放有关,从离子通道方面进一步阐释缺氧对听力的影响。
由于耳蜗特殊的生理结构和位置,SGNs位于耳蜗骨螺旋板与蜗轴相接处的Rosenthal隧道中,位置较深,分离难度较大。因此,笔者选用出生后1~3d的乳鼠进行培养。此时的乳鼠颞骨尚未骨化,在镜下用显微镊即可从分离出的基底膜上剥离SGNs。如果大鼠>5 d,其颞骨开始部分骨化,在分离SGNs时可能会将蜗轴螺旋管遗留在蜗轴螺旋管内,影响取材的数量[8]。所以原代培养耳蜗SGNs是有一定难度的。培养的SGNs一般4~6h即可贴壁,8 h贴壁较牢固。同时本实验中应用细胞免疫荧光技术进行细胞的鉴定。鉴定结果表明,荧光显色可见胞体呈圆形或者椭圆形,核着蓝色且较大。本实验成功培养出原代SGNs,且培养的神经元能满足后续细胞实验的基本需要。
本研究中的电生理实验结果显示,急性缺氧时,外向电流发生一个时间相关性变化,缺氧5 min时,外向电流增强幅度最大,10~15 min时逐渐回降至基础水平。本实验前期研究结果初步分析该增强的电流成分可能主要是BKCa电流[9]。有研究证实,BKCa通道参与细胞的氧化应激过程[10]。缺氧对不同种属、不同部位、不同种类细胞的BKCa电流影响不尽相同。在豚鼠耳蜗螺旋动脉[11]、大鼠大脑皮层神经元[12]中缺氧增强BKCa电流,但是在小鼠前庭核神经元[13]、大鼠颈动脉体细胞[14]及足细胞[15]中抑制BKCa电流。LIU等[16]应用内面向外式膜片钳技术,证实缺氧引起BKCa电流变化是通过胞内机制完成的。BKCa通道除可以被胞内Ca2+和去极化电压激活以外,还可以通过胞内磷酸化调节。有研究显示,围产期缺氧可增强成年小鼠肺动脉中cAMP介导的BKCa通道电流[17]。另外,腺苷可以增大海马神经元BKCa电流幅值[18]。缺氧早期Ca2+内流,随着缺氧的时间增加,更多的Ca2+流向细胞内,加上内质网内钙的释放,造成钙离子超载[19],一些兴奋性神经递质产生,通过与神经元胞外G蛋白偶联受体结合,激活胞内第二信使通路,进而激活下游的蛋白激酶,使BKCa通道发生磷酸化,通道开放。
实验结果表明,BKCa通道受细胞内腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)、三磷酸鸟苷调控[20-21]。本实验为从胞内机制进一步观察和解释SGNs外向电流变化的原因,分别检测胞内第二信使cAMP和cGMP的含量。cAMP由ATP经腺苷酸环化酶(Adenylatecvclase,Ac)转化而来,又在磷酸二酯酶(Phosphodiesterases,PDE)的催化下不断水解成AMP。其含量的稳定主要依靠Ac与PDE之间的平衡。本实验中cAMP浓度变化的可能机制为:糖氧剥夺时,细胞产生应激反应,Ac等迅速合成cAMP致其增高,随后ATP耗竭,酶系统受抑等因素使Ac下降[22]。另一方面,由于缺氧导致细胞内环境改变,使ATP合成原料不足,影响cAMP的浓度。随着cAMP浓度的下降,对BKCa通道的磷酸化程度降低,出现该电流先升后降的现象。有研究显示,缺氧时间可影响神经元钾通道的开放频率,进而使神经元的兴奋性产生变化[11]。通道开放频率的改变与第二信使密切相关。cAMP与其他两种第二信使cGMP、Ca2+密切相关,其相互间错综复杂的关系有助于扩大细胞内信号通路激活路径[23-24]。本实验结果中,cGMP 与cAMP的浓度变化不尽相同,随着缺氧时间的延长,先出现一个明显的下降,随后在缺氧20 min时回升,虽然cGMP也与BKCa通道的开放相关,但是其浓度变化与cAMP的浓度变化相反。有资料表明,cAMP和cGMP在细胞内的浓度常互相消长[25],其引起的生物学效应也常常相反[26]。该过程是胞内复杂的信号通路的联系变化,需要笔者进一步研究。但是可以推测,缺氧可以通过胞内第二信使影响通道的开放,进而影响神经细胞的兴奋性。加快细胞受损凋亡的过程,进一步使SGNs损伤,造成永久性听力丧失。
参考文献:
[1]姜鑫,胡永国,朱莹.新生儿听力障碍危险因素的研究进展 [J].保健医学研究践,2014,11(6):73-74.
[2]COLELLA-SANTOS M F,HEIN T A,de SOUZA G L,et al. Newborn hearing screening and early diagnostic in the NICU[J]. BioMed Research International,2014,9:1-11.
[3]王丽萍,王苹,杜波,等.缺氧对体外培养耳蜗螺旋神经节细胞及神经纤维的影响[J].临床耳鼻咽喉头颈外科杂志,2008,22(22): 1040-1042.
[4]OLIVETTO E,SIMONI E,GUARAN V,et al.Sensorineural hearing loss and ischemic injury:development of animal models to assess vascular and oxidative effects[J].Hear Res,2015,327: 58-68.
[5]李新芝,司军强,张忠双,等.急性缺氧增强豚鼠小脑前下动脉平滑肌细胞外向电流并抑制缝隙连接 [J].生理学报,2011,63(6): 533-539.
[6]WIDZISZOWSKA A,NAMYSLOWSKI G.Assessment of hearing organ activity in a group of neonates with central nervous system impairment[J]Int JPediatr Otorh-inol Aryngol,2011,75(10): 1280-1284.
[7]ABU-SHAHEEN A,AL-MASRI M,EL-BAKRI N,et al.Prevalence and risk factors of hearing loss among infants in Jordan: initial results from universal neonatal screening[J].Int J Audiol, 2014,53(12):915-920.
[8]高可雷,李鹏,蒋海燕,等.大鼠内耳解剖结构及其取材技术[J].中华耳科学杂志,2015,13(1):18-23.
[9]王艳萍,朱贺,马克涛,等.急性缺氧对SD乳鼠耳蜗螺旋神经节细胞钾通道的影响[J].中华耳鼻咽喉头颈外科杂志,2015,50(10): 823-828.
[10]NECKÁR J,BORCHERT G H,HLOUSKOVÁ P,et al.Brief daily episode of normoxia inhibits cardioprotection conferred by chronic continuous hypoxia.Role of oxidative stress and BKCa channels[J].Curr Pharm Des,2013,19(39):6880-6889.
[11]李新芝,司军强,张忠双,等.急性缺氧增强豚鼠小脑前下动脉平滑肌细胞外向电流并抑制缝隙连接[J].生理学报,2011,63(6): 533-539.
[12]李小刚,董为伟,范生尧,等.缺氧对大鼠大脑皮层神经元钙激活性钾通道的影响[J].卒中与神经疾病,2002,9(4):195-197.
[13]XIE H,ZHANG Y Q,PAN X L,et al.Decreased calcium-activated potassium channels by hypoxia causes abnormal firing in the spontaneous firing medial vestibular nuclei neurons[J].Eur Arch Otorhinolaryngol,2014,8:31.
[14]ROSS F A,RAFFERTY J N,DALLAS ML,et al.Selective expression in carotid body type I cells of a single splice variant of the large conductance calcium-and voltage-activated potassium channel confers regulation by AMP-activated protein kinase[J].J Biol Chem,2011,286(14):11929-11936.
[15]ZHANG R,SUN H,LIAO C,et al.Chronic hypoxia in cultured human podocytes inhibits BKCa channels by upregulating its β4-subunit[J].Biochem Biophys Res Commun,2012,420(3): 505-510.
[16]LIU H J,EDWARD M,GABRIEL G,et al.Haddad.O2 deprivation inhibits Ca2+-activated K+channels via cytosolic factors in mice neocortical neurons[J].the Journal of Clinical Investigation, 1999,104(5),DOI:10.1172/JCI7291.
[17]MARINO M,BÉNY J L,PEYTER A C,et al.Perinatal hypoxia enhancescyclicadenosinemonophosphate-mediatedBKCa channel activation in adult murine pulmonary artery[J].J Cardiovasc Pharmacol,2011,57(2):154-165.
[18]李巷,康慧聪,刘晓艳,等.腺苷对原代培养的大鼠海马神经元大电导钙激活钾通道的作用[J].华中科技大学学报(医学版),2012, 41(3):264.
[19]KANG D,WANG J,HOGAN JO.et al.Increase in cytosolic Ca2+produced by hypoxia and other depolarizing stimuli activates a non-selective cation channel in chemoreceptor cells of rat carotid body[J].J Physiol,2014,592(9):1975-1992.
[20]WU B N,CHEN C F,HONG Y R,et al.Activation of BKCa channels via cyclic AMP-and cyclic GMP-dependent protein kinases y eugenosedin-A in rat basilar artery myocytes[J].Br J Pharmacol,2007,152(3):374-385.
[21]LORCA R A,PRABAGARAN M,ENGLAND S K,et al.Functional insights into modulation of BKCa channel activity to alter myometrial contractility[J].Frontiers in Physiology,2014,DOI: 10.3389/fphys.2014.00289
[22]GAURI H N,HOWARD M P,SARAH L M.Neuroprotective signaling pathways are modulated by adenosine in the anoxia tolerant turtle[J].J Cereb Blood Flow Metab,2011,31(2):467-475.
[23]CHINTAMANI N J,DANIELLE N M,PATTI S,et al.Control of vascular smooth muscle cell growth by connexin 43[J].Front Physiol,2012,3:220.
[24]ZACCOLO M,MOVSESIAN M A.cAMP and cGMP signaling cross-talk:role of phosphodiesterases and implications for cardiac pathophysiology[J].Circ Res,2007,100(11):1569-1578.
[25]NISHIYAMAM,HOSHINOA,TSAIL,etal.Cyclic AMP/GMP-dependent modulation of Ca2+channels Sets the polarity of nerve growth-coneturning[J].Nature,2003,423(6943): 990-995.
[26]KOBAYASHI T,NAGASE F,HOTTA K,et al.Crosstalk between second messengers Predicts the motility of the growth cone[J].Sci Rep,2013,3:3118.
(童颖丹编辑)
中图分类号:R 764.4
文献标识码:A
DOI:10.3969/j.issn.1005-8982.2016.13.003
文章编号:1005-8982(2016)13-0012-06
收稿日期:2015-11-18
*基金项目:国家自然科学基金(No:81260159、31460264、81460098、81560175);石河子大学科学技术研究发展计划优秀青年项目(No:2013ZRKXYQ-YD20)
[通信作者]李丽,E-mail:lily7588@163.com
Effect of hypoxia on outward current and change in content of cAMP and cGMP in cochlear spiral ganglion neurons*
Yan-ping Wang,He Zhu,Huan Liu,Ke-tao Ma,Jun-qiang Si,Li Li
[Department of Physiology,Medical College of Shihezi University(the Key Laboratory of Xinjiang Endemic and Ethnic Diseases),Shihezi,Xinjiang 832000,China]
Abstract:Objective To observe the effect of hypoxia time on outward current in spiral ganglion neurons (SGNs)culturedin vitroand changes in the intracellular second messenger systems.Methods SGNs of 1-3 d neonatal Sprague Dawley rats were cultivatedin vitroand identified by immunofluorescence.Whole-cell patch clamp technique was used to record the variation trends and characteristics of outward current in SGNs perfused with hypoxic external solution.The changes in concentrations of cAMP and cGMP in SGNs were detected by enzyme-linked immunosorbent assay at 5,15 and 20 min of hypoxia.Results Good neurons could be isolated by enzyme which were identified by immunofluorescence to be SGNs.Acute hypoxia mainly enhanced outward current at 0-(+60)mV with the holding potential of-60 mV.At 5 min of hypoxia,the ampli-tude of outward current was increased from(971.2±50.3)pA to(2361.0±207.4)pA at+60 mV(P<0.01);then tended to decline.From 11 to 15 min of hypoxia,the increasing amplitude of outward current had no significant difference from the base current in the control group(P>0.05).Compared with the control group,the concentration of cAMP in SGNs significantly increased in the 5-min hypoxia group(P<0.01),but was not statistically different in the 15-min hypoxia group(P>0.05);however,the concentration of cAMP decreased in the 20-min hypoxia group(P<0.01).The concentration of cGMP was totally in a downward trend with prolonged hypoxia time,but partially went up after 20 min(15-min hypoxia group vs 20-min hypoxia group,P<0.01).Conclusions In the process of acute hypoxia injury in SGNs,outward current increases and the enhancing amplitude increases at first and then decreases along with hypoxia time.So we deduced the conduction of auditory information is influenced by reduced excitability in short-term hypoxia of SGNs,which is related to the change in the concentrations of intracellular second messengers cAMP and cGMP.
Keywords:acute hypoxia;SGN;cyclic adenosine monophosphate;cyclic guanosine monophosphate

