日本囊对虾(Marsupenaeus japonicus)组织蛋白酶D基因克隆及表达分析
张曼 ,程光平,苏永全,徐伊桦,冯文荣,王军,宋晓红,毛勇
(1. 广西大学 动物科学技术学院 广西高校水生生物健康养殖与营养调控重点实验室,广西 南宁 530005;2. 厦门大学 海洋与地球学院,福建 厦门 361005)
日本囊对虾(Marsupenaeus japonicus)组织蛋白酶D基因克隆及表达分析
张曼1,2,程光平1,苏永全2*,徐伊桦2,冯文荣2,王军2,宋晓红2,毛勇2
(1. 广西大学 动物科学技术学院 广西高校水生生物健康养殖与营养调控重点实验室,广西 南宁 530005;2. 厦门大学 海洋与地球学院,福建 厦门 361005)
摘要:组织蛋白酶D是溶酶体天冬氨酸蛋白酶家族的主要成员,广泛参与动物机体细胞内蛋白质的降解过程,对维持细胞稳态和正常代谢具有重要的作用。为研究组织蛋白酶D在甲壳动物非特异性免疫和幼体发育过程中的作用,本研究采用RACE技术首次克隆得到日本囊对虾组织蛋白酶D基因cDNA序列,命名为MjCatD,其中开放阅读框长为1 161 bp,编码386个氨基酸残基。序列分析和同源建模显示该基因编码的蛋白含有保守的N-糖基化位点、天冬氨酸蛋白酶签名序列、酶活化位点和非消化性组织蛋白酶D的特征序列,并且呈保守的双叶形结构。同源性比较和系统进化分析发现,MjCatD与斑节对虾、美洲螯龙虾和脊尾白虾相似性较高,并且与它们紧密聚为一支。实时荧光定量PCR结果显示,MjCatD基因在日本囊对虾多个组织中均有表达,其中肝胰腺中表达量最高。在白斑综合征病毒(white spot syndrome virus, WSSV)感染后3~24 h日本囊对虾肝胰腺中MjCatD的表达量逐渐下降,而在48 h急剧上调至最高表达量并且与对照组差异极显著(P<0.01)。此外,MjCatD基因在幼体发育不同阶段中也表现出明显的变化趋势。以上研究表明,MjCatD基因可能参与日本囊对虾先天免疫反应和幼体发育过程。
关键词:日本囊对虾;组织蛋白酶D;基因克隆;基因表达
1引言
日本囊对虾(Marsupenaeusjaponicus),隶属于节肢动物门(Arthropoda)、甲壳纲(Crustacea)、十足目(Decapoda)、游泳亚目(Natantia)、对虾科(Penaeidae)、囊对虾属(Marsupenaeus),是我国重要的海产经济虾类。然而,近年来日本囊对虾养殖深受病害的困扰,尤其是白斑综合征病毒(white spot syndrome virus,WSSV)严重影响了相关产业的持续健康发展并造成了巨大的经济损失[1]。
组织蛋白酶是真核细胞溶酶体中参与蛋白降解和抗原呈递的蛋白酶超家族,根据活性位点里氨基酸残基的不同可大致分为3类:半胱氨酸蛋白酶、天冬氨酸蛋白酶和丝氨酸蛋白酶[2—3]。组织蛋白酶D是天冬氨酸蛋白酶家族的主要成员,通常以前酶原的形式合成于粗面内质网,然后转移至高尔基体进行多次蛋白质水解切割,最后得到分子量约为40 kDa的活性酶[4]。
组织蛋白酶D广泛存在于各种生物体中,属于酸性溶酶体内切蛋白酶,能够水解胞内蛋白和多肽,维持细胞稳态[5]。在人和哺乳动物中,组织蛋白酶D参与激活酶原和生长因子、大脑抗原呈递、表皮分化及细胞凋亡等多种机体生理活动[6]。近年来对水产动物组织蛋白酶D的报道主要集中在硬骨鱼类,发现其还与免疫应答、卵泡发育和成熟及胚胎发育等有着一定的关联[7—9]。而组织蛋白酶D在低等无脊椎动物如甲壳动物中的研究较少,仅在斑节对虾(Penaeusmonodon)、美洲螯龙虾(Homarusamericanus)和脊尾白虾(Palaemoncarinicauda)等3个物种中发现[10—11],目前尚未见到日本囊对虾组织蛋白酶D基因的研究报道。
本研究采用RACE技术成功获得日本囊对虾组织蛋白酶D(MjCatD)基因cDNA序列,并对其进行生物信息学和三维结构分析。通过实时荧光定量PCR初步研究了WSSV感染后MjCatD基因在日本囊对虾肝胰腺中的表达特征及其在幼体发育不同阶段的表达变化,为进一步探索日本囊对虾组织蛋白酶D生物学功能提供依据。
2材料与方法
2.1实验材料及取样
攻毒实验用日本囊对虾采自福建省东山县赤山茂鑫水产有限公司的养殖基地,体长(8.72±0.59)cm,体质量(7.88±1.28)g,蓄养于2.5 m×2 m×1.5 m水泥池,期间持续充气和正常投喂,日换水1/4体积。随机挑选个体均匀、活力强的虾,经巢式PCR检测确定无病毒后用于感染实验。新鲜WSSV病毒悬液(108粒子/μL)由国家海洋局第三海洋研究所杨丰研究员提供,实验前用0.9%无菌生理盐水稀释104倍。实验组和对照组日本囊对虾均为50尾,前者每尾在第4腹节部位注射100 μL病毒稀释液(约106个拷贝),后者每尾注射等体积的0.9 %无菌生理盐水。注射前随机取4尾健康对虾抽取血淋巴,800×g,4℃离心 5 min收集血淋巴细胞,同时收集肝胰腺、鳃、肠、胃、眼柄、心和肌肉等组织样品;注射后实验组和对照组分别于3 h、6 h、12 h、24 h、48 h和72 h取肝胰腺,每个时间点取样3尾。以上组织迅速置于液氮保存备用,用于 RNA 的提取。
日本囊对虾亲虾捕自台湾海峡南部(福建东山)自然海域,体长(18.72±0.75)cm,体质量(80.63±8.34)g。适应性暂养1周后,挑选1尾已经交配、性腺发育良好且附肢完整的健康日本囊对虾为实验用亲虾,以镊烫法摘除单侧眼柄并逐日提高水温至25℃,5~7 d后移至单独的产卵池。产卵池水温保持27~28℃,待受精卵孵化出无节幼体,按育苗标准流程进行日常管理。从蚤状幼体开始投喂饵料:蚤状幼体至仔虾第10天(P10)每隔4 h投喂一次虾片,P10后改投喂粒径合适的福星牌颗粒饲料。育苗期间,分别取4期(N)无节幼体、1期(Z1)、2期(Z2)、3期(Z3)蚤状幼体、1期(M1)、2期(M2)、3期(M3)糠虾幼体,以及第1天至第17天(P1、P2、P3、P4、P5、P8、P11、P14、P17)仔虾样品,迅速置于液氮保存,用于 RNA 的提取。
2.2实验方法
2.2.1总RNA提取及cDNA的合成
提取日本囊对虾各组织总RNA,微量紫外分光光度计与1% TAE琼脂糖凝胶电泳检测RNA质量和完整度。用于基因扩增的cDNA第一链的合成参照孙田田等[12]的方法制备。
2.2.2 cDNA克隆及序列测定
根据3种已知虾类CatD基因序列的保守区域设计简并引物CatD-F1/R1(表1),以稀释10倍的日本囊对虾肝胰腺cDNA为模板进行中间片段扩增。PCR产物经回收纯化和克隆后送至深圳华大基因公司测序。以获得的MjCatD部分序列为模板,分别设计5′和3′-RACE引物CatD-5′、CatD-3′(表1),合成5′和3′-RACE cDNA模板,分别使用特异性引物和通用引物配对,扩增目的基因并测序。
2.2.3生物信息学分析
用DNAStar软件中的SeqMan程序去除重叠序列并进行序列拼接;用BLAST(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行核苷酸序列和推导氨基酸序列的同源性比对;ORF finder(http://www.ncbi.nlm.nih.gov/projects/gorf/orfig.cgi)分析开放阅读框并预测氨基酸序列;以Expasy程序(http://web.expasy.org/protparam/)在线预测蛋白质理化性质,用SignalP 4.1程序(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽序列,以SMART软件(http://smart.embl-heidelberg.de/smart/set_mode.cgi?NORMAL=1)预测蛋白质功能结构域,用NetNGlyc l.0软件(http://www.cbs.dtu.dk/services/NetNGlyc/)预测可能存在的糖基结合位点,用ClustalW对氨基酸序列进行多重序列比对。运用MEGA 4.0的邻接法构建系统进化树,Bootstrap设置重复500次计算各分支的置信度;Swiss-model(http://beta.swissmodel.expasy.org/)工具在线模拟蛋白质三维结构,应用PyMOL 1.5软件查看模型与标注[13]。

表1 实验所用引物
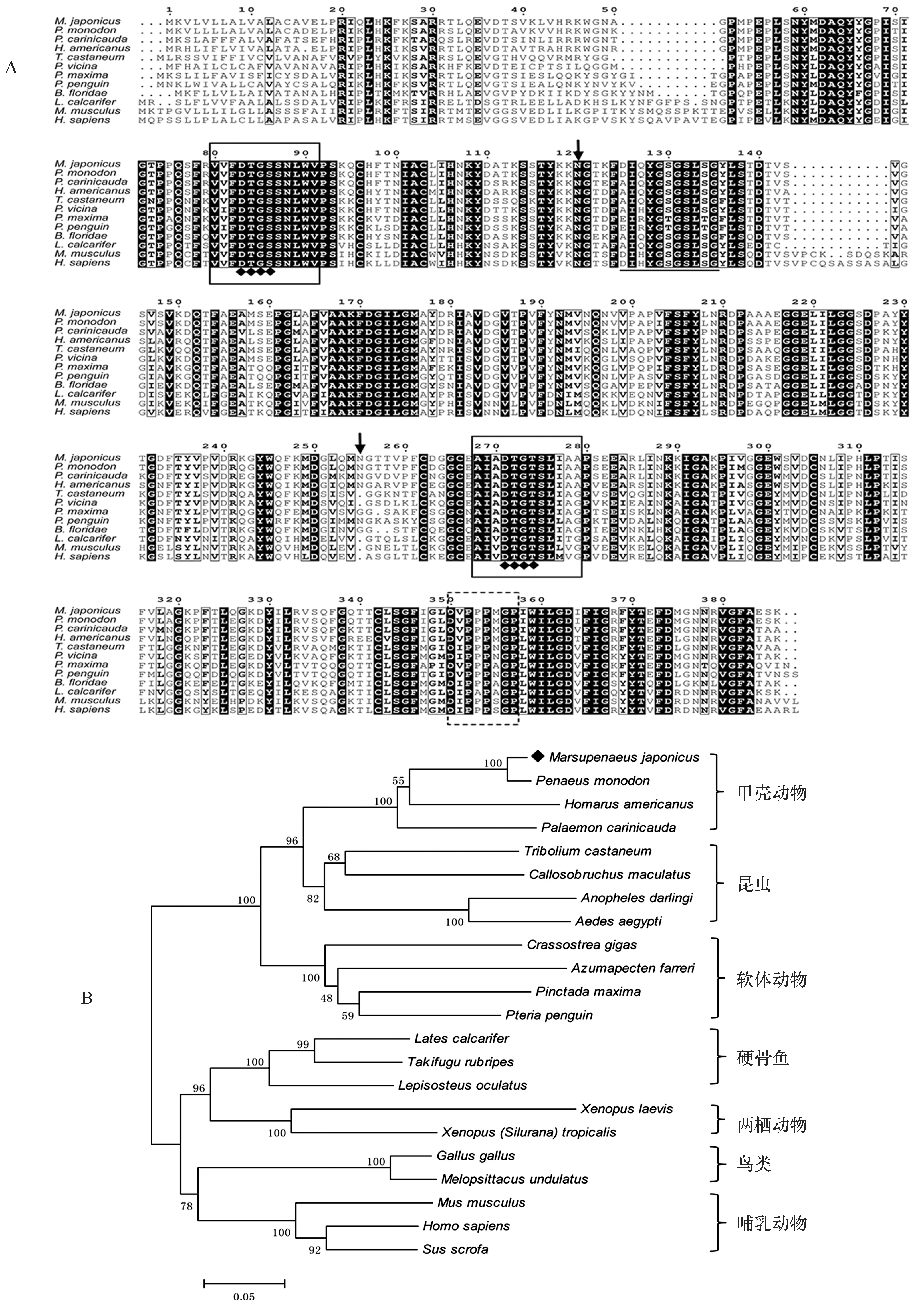
图2 日本囊对虾MjCatD序列同源性分析Fig.2 Homology analysis of MjCatD sequenceA. MjCatD氨基酸序列与其他物种CatD氨基酸序列比对。一致的氨基酸残基用黑底白字表示,结构保守性氨基酸残基以粗体黑字加方框表示;2个天冬氨酸蛋白酶签名序列由实框标出,其中的催化基序用菱形(◆)表示;酶活化位点用下划线表示;非消化性组织蛋白酶D特征序列由虚框标出;2个N-糖基化位点用黑色箭头标注。 B. 基于CatD氨基酸序列构建的系统进化树(NJ树)。根据多序列比对结果,MEGA4.0软件以邻位相连法构建系统进化树。标尺长度为0.05,设置重复500次计算各分支的置信度,日本囊对虾CatD用菱形(◆)表示A.Multiple alignments of amino acid sequence of MjCatD with other species. Shading indicated residues that are identical (black background-white lettered) whereas black letter in black box indicates higher levels of amino acid similarity. Two solid boxed area represent the aspartyl protease signature sequence and the catalytic motif is marked with ◆. The active site is underlined. The characteristic sequence of non-digestive cathepsin Ds is enclosed by a dashed box. Two N-glycosylation sites are represented by the black arrow. B. Phylogenetic tree (NJ) based on CatD amino acid sequences. The tree is constructed by the neighbor-joining (NJ) algorithm using the MEGA 4.0 program based on the multiple sequence alignments. The scale bar corresponds to 0.05 estimated amino-acid substitutions per site. The reliability of the branching is tested by bootstrap re-sampling (500 pseudo-replicates). The ca-thepsin D from M. japonicus is marked with ◆
2.2.4MjCatD基因的表达分析
根据获得的MjCatD cDNA序列设计一对qRT-PCR特异性引物CatD-RT-F/R(表1),以日本囊对虾β-actin(AB055975.1)作为内参基因,设计引物β-actin-F/R(表1)。参照SYBR®Premix Dimer EraserTM(TaKaRa)试剂盒的操作说明进行实时荧光定量PCR反应,所有扩增均在ABI 7900实时PCR仪上进行。反应体系(20 μL)为:SYBR®Premix Dimer EraserTM(2×)10 μL,引物(10 μmol/L)各0.6 μL,ROX Reference DyeⅡ(50×)0.4 μL,cDNA模板 2 μL,ddH2O 6.4 μL。反应程序采用3步法,即升温95℃ 30 s;40个循环:95℃ 5 s,55℃ 30 s,72℃ 30 s;熔解曲线分析:95℃ 15 s,60℃ 15 s,95℃ 15 s。反应结束后,确认扩增曲线和熔解曲线,进而判断PCR反应的特异性。
每个组织样品重复3次,同时设置阴性对照。数据处理采用2-△△Ct法,用SPSS11.0软件对不同样本的表达量进行配对t检验,差异性显著分析结果以P值表示,P<0.05为显著差异,P<0.01为显著极差异。
3实验结果
3.1MjCatD基因序列特征分析
RACE扩增产物拼接后,获得日本囊对虾CatD基因的部分cDNA序列,命名为MjCatD(GenBank登录号:KF900154)。MjCatD序列共1 325 bp,包括完整开放阅读框(ORF)1 161 bp,部分5′非编码区域(UTR)43 bp和部分3′UTR(121 bp)。其中,ORF编码386个氨基酸,理论分子量和等电点分别为42.0 KDa和6.23,包含信号肽(Met1-Glu17)、前体域(Leu18-Arg45)和成熟域(Gln64-Lys386)3部分(图1A)。进一步分析显示MjCatD成熟肽的理论分子量和等电点分别为34.9 KDa和5.12,不稳定指数为39.94,是一种稳定蛋白。
MjCatD一级结构包含2个N-糖基化位点(Asn120和Asn255)、2个天冬氨酸蛋白酶签名序列(-80VVFDTGSSNLWV91-,-268AIADTGTSLIAA279-)和1个酶活化位点(-125DIQYGSGSLSG135-)(图1A)。基于同源建模,以猪胃蛋白酶(2psg.1.A)X-射线结构为模板,日本囊对虾CatD呈现出高度保守的双叶形结构,其中在酶活化位点两侧各自环绕着1个保守的催化基序(-83DTGS86-,-271DTGT274-),并且1个以聚脯氨酸环空间结构形式存在的非消化性组织蛋白酶D特征序列(-350DVPPPMGP357-)也分布在酶活化位点附近[14](图1B)。
3.2MjCatD基因序列同源性分析
通过与斑节对虾(P.monodon,ABQ10738.1)、脊尾白虾(P.carinicauda,AGJ03549.1)、美洲海螯虾(H.americanus,ACV53024.1)、赤拟谷盗(Triboliumcastaneum,XP_966517.1)、鼎突多刺蚁(Polyrhachisvicina,AEC03508.1)、大珠母贝(Pinctadamaxima,AEI58896.1)、企鹅珍珠贝(Pteriapenguin,AEI58895.1)、文昌鱼(Branchiostomafloridae,XP_002599971.1)、尖吻鲈(Latescalcarifer,ABV59077.1)、小家鼠(Musmusculus,NP_034113.1)和人(Homosapiens,NP_001900.1)CatD蛋白的同源比对结果显示,日本囊对虾CatD较为保守,与其他物种的CatD有较高的同源性(图2A)。MjCatD与斑节对虾的同源性最高(97%),其次是脊尾白虾和美洲螯龙虾,同源性依次为87%、83%,而与脊椎动物如硬骨鱼类、两栖动物、鸟类和哺乳动物的一致性较低,仅为55%~57%。
将上述物种与四纹豆象(Callosobruchusmaculatus,ACO56332.1)、达氏按蚊(Anophelesdarlingi,ETN60836.1)、埃及伊蚊(Aedesaegypti,XP_001657556.1)、长牡蛎(Crassostreagigas,XP_011440854.1)、栉孔扇贝(Azumapectenfarreri,ACL13150.1)、红鳍东方魨(Takifugurubripes,NP_001072052.1)、斑点雀鳝(Lepisosteusoculatus,XP_006642526.1)、非洲爪蟾(Xenopuslaevis,BAC57431.1)、原鸡(Gallusgallus,NP_990508.1)的CatD蛋白和MjCatD进行系统进化分析,结果显示组织蛋白酶D可分为脊椎动物和无脊椎动物两大类群:脊椎动物类群包括硬骨鱼类、两栖动物、鸟类和哺乳动物,无脊椎动物类群则由甲壳动物、昆虫类和软体动物组成。MjCatD首先与斑节对虾、脊尾白虾和美洲螯龙虾等甲壳动物的CatD基因聚类,再与昆虫类、软体动物相聚,说明它们进化关系较近,随后与脊椎动物聚合(图2B)。
3.3MjCatD基因的表达分析
3.3.1MjCatD基因在不同组织中的表达
以β-actin为内参基因,对日本囊对虾肝胰腺、肌肉、肠、血淋巴细胞、鳃、心脏、眼柄和胃等8个组织中的MjCatD基因进行相对表达量分析,如图3所示,MjCatD基因在8个组织中均有不同程度的表达,其中在肝胰腺的相对表达量最高,其次为血淋巴细胞,在鳃、肌肉、胃、肠和心脏中也有一定量的表达,在眼柄中的表达水平最低。
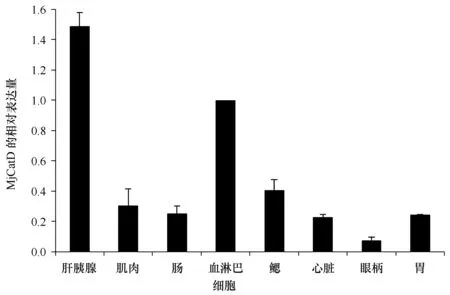
图3 MjCatD基因在日本囊对虾不同组织中的表达情况Fig.3 Expression characterization of MjCatD in various tissues of M.japonicus以β-actin为内参基因,血淋巴细胞的表达量为校正样进行数据分析,柱状图代表平均值±标准差Kuruma shrimp β-actin served as an internal control to calibrate the cDNA template for all the samples. Tissue mRNA expression values were presented relative to that of the haemocyte. The bars indicated the means ± SE
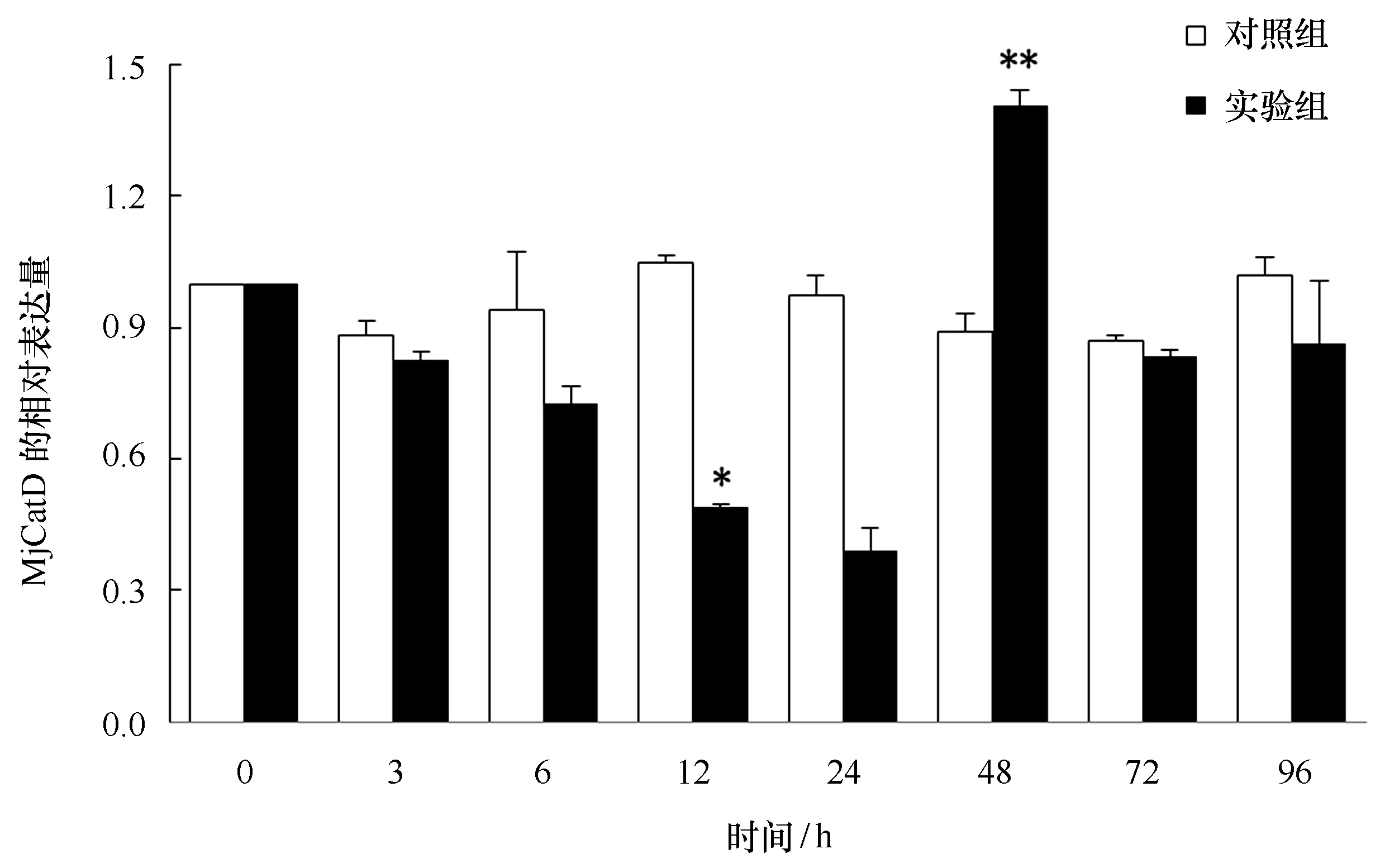
图4 日本囊对虾肝胰腺MjCatD基因在WSSV感染不同时间相对表达量的变化Fig.4 The relative expression of MjCatD gene in the hepatopancreas of M. japonicus infected by WSSV at different time以β-actin为内参基因,柱状图代表平均值±标准差。同一时间,与对照组相比,*代表组间差异显著(P<0.05),**代表组间差异极显著(P<0.01)Kuruma shrimp β-actin served as an internal control to calibrate the cDNA template for all the samples. The bars indicated the means ± SE. The significant differences of MjCatD expression between the challenged groups and the con-trol were indicated by asterisks (*: P<0.05; **: P<0.01)
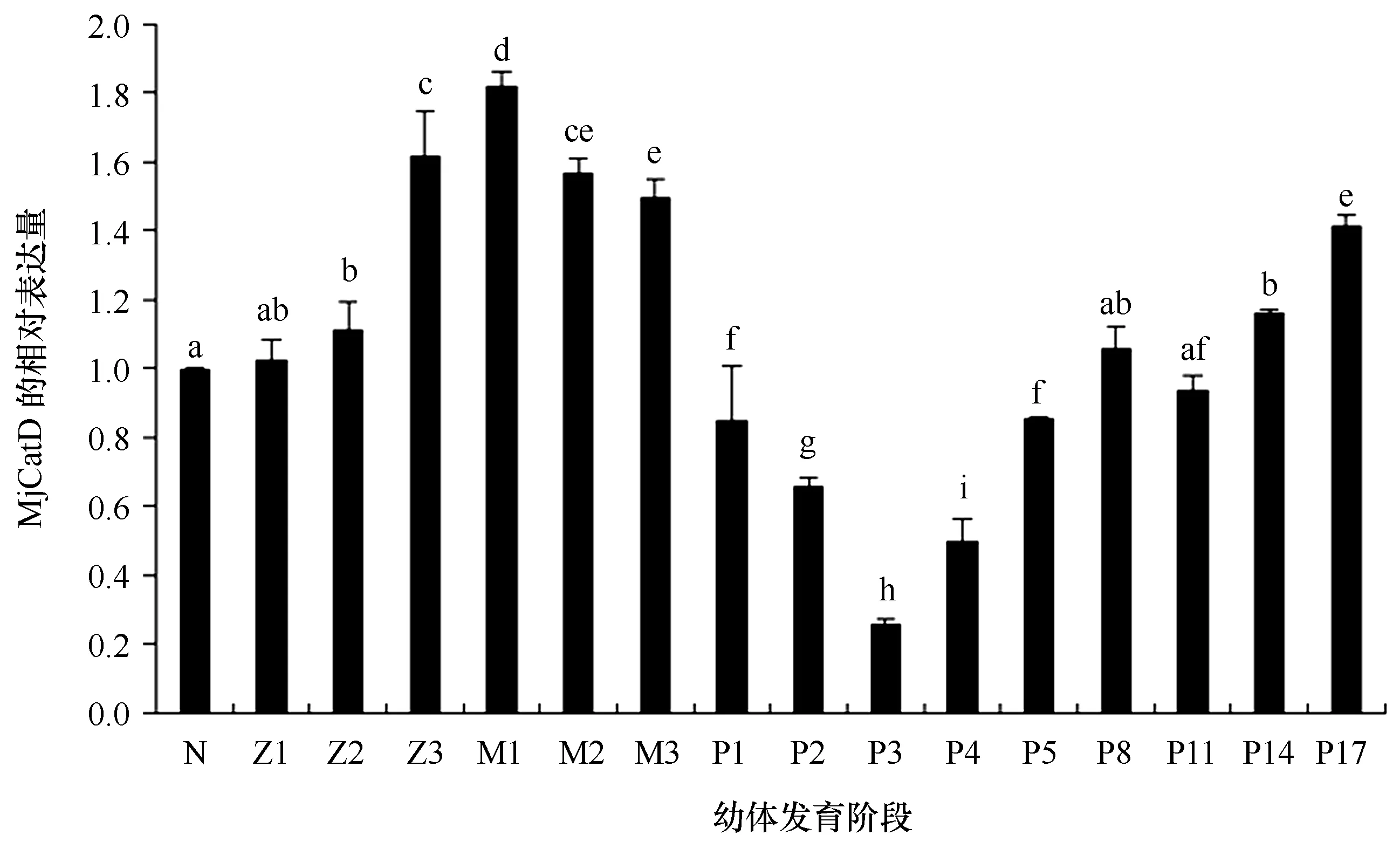
图5 日本囊对虾MjCatD基因在不同幼体发育阶段相对表达量的变化Fig.5 The relative expression of MjCatD gene at different stages of larval development in M. japonicus以β-actin为内参基因,无节幼体的表达量为校正样进行数据分析,柱状图代表平均值±标准差。不同字母代表组间差异显著(P<0.05),相同字母代表组间差异不显著(P>0.05)。N:无节幼体;Z1~Z3:蚤状幼体1~3期;M1~M3:糠虾幼体1~3期;P1~P17:仔虾第1~17天Kuruma shrimp β-actin served as an internal control to calibrate the cDNA template for all the samples. The mRNA expression value in each development stage was presented relative to that of the nauplius. The bars indicated the means ± SE. Statistical significance was represented by different letters (P<0.05), whereas same letters indicated no significant differences (P>0.05). N: nauplius; Z1-Z3: zoea 1-3; M1-M3: mysis 1-3; P1-P17: postlarvae 1-17
3.3.2MjCatD基因在WSSV感染后的表达变化
日本囊对虾在感染WSSV后,肝胰腺中MjCatD基因的表达时序变化见图4,与对照组相比,实验组在感染早期(0~24 h)表达量逐渐降低并在24 h降至最低点,之后在48 h表达量急剧升高,达到最大值并且与对照组差异极显著(P<0.01),感染后期(72~96 h)基因表达量恢复至正常水平。对照组MjCatD基因总体表达变化趋势较为平缓,均无明显显著变化。
3.3.3MjCatD基因在幼体发育阶段的表达变化
MjCatD基因在日本囊对虾不同幼体发育阶段的表达量差异明显,如图5所示,MjCatD mRNA从无节幼体开始表达,到Z1开口摄食后,MjCatD mRNA的相对表达量逐步增高,然后在P1到P3阶段有明显的下调;而后,从P4开始MjCatD mRNA的相对表达量呈现出显著升高的趋势,并且P8至P17时期表达量维持在较高水平。
4讨论
本研究首次克隆得到日本囊对虾CatD基因序列,完整开放阅读框全长1 161 bp,编码386个氨基酸。序列特征和同源性分析显示,CatD在从无脊椎动物到脊椎动物的进化上较为保守,MjCatD与已知3种虾类的CatD高度相似,由信号肽、前体域和成熟域3个部分组成,并且具有天冬氨酸蛋白酶典型的2个签名序列、1个酶活化位点、1个非消化性组织蛋白酶D特征序列和双叶形空间结构,是天冬氨酸蛋白酶家族新成员[10—11,14]。研究表明组织蛋白酶D在胞浆中合成后,会被糖基化然后通过内质网-高尔基体转移途径定位到溶酶体,N-糖基化位点在此过程中起关键作用[15]。本文通过比较发现,MjCatD的第1个N-糖基化位点(Asn120)在各物种间非常保守,第2个N-糖基化位点(Asn255)与斑节对虾、脊尾白虾、美洲螯龙虾和企鹅珍珠贝一致,而在其他物种中缺失或被替代,糖基化位点保守程度的差异可能与其在糖基化过程中发挥作用的不同有关[7]。
组织蛋白酶D是一种内切蛋白酶,能够降解蛋白以清除多余的胞内蛋白,广泛存在于真核生物的几乎所有细胞[16—17]。荧光定量PCR结果表明,日本囊对虾MjCatD基因在8种组织中均有表达,组织分布的广泛性说明其对维持机体细胞稳态及正常代谢的重要性。此外,日本囊对虾肝胰腺和血淋巴细胞中的MjCatD基因表达量较高,这与脊尾白虾组织蛋白酶D组织表达情况相似[11],考虑到上述两种组织在虾类非特异性免疫中的重要作用[18],MjCatD基因的高表达量表明它可能与免疫响应密切相关。
随后的WSSV感染实验显示,肝胰腺中MjCatD基因表现出先降低后显著上升,然后恢复的趋势。WSSV经肌肉注射侵入机体后,主要经血液循环侵染到其他组织器官,然后在这些部位感染细胞进行增殖[19],其约在22~24 h完成整个繁殖周期,并且病毒基因组复制速率在12~24 h达到最高[20]。在这段时间中,一些宿主细胞的能量代谢可能被病毒调节并利用[20—21],受此影响MjCatD基因的表达受到抑制,表达水平逐渐降低。然而,伴随着肝胰腺受到病毒感染程度的加深以及新病毒粒子的不断装配释放[22],越来越多的细胞裂解死亡并最终导致宿主体内激发大规模的免疫响应。与脊尾白虾EcCatD的表达变化相同[11],WSSV刺激后48 h MjCatD表达水平显著上调,考虑到CatD在抗原呈递、细胞凋亡等过程中的重要作用[23—24],推测MjCatD很可能直接参与了机体免疫防御过程。随着时间的推移,MjCatD基因表达量在72 h和96 h恢复至正常水平。MjCatD基因在日本囊对虾感染WSSV后的表达变化预示其可能在抗病毒免疫中发挥着重要作用,但具体的作用机制还需深入研究。
诸多研究表明组织蛋白酶D不仅参与先天免疫响应,还在机体生长发育过程中具有重要作用。在金头鲷(Sparusaurata)和草鱼(Ctenopharyngodonidella)的胚胎发育时期,组织蛋白酶D表达量均呈上升趋势,研究认为它可能通过介导细胞程序性死亡参与机体发育[8—9]。本研究选取无节幼体、蚤状幼体、糠虾幼体和仔虾等4个发育阶段,对MjCatD基因在日本囊对虾幼体发育过程中的作用进行研究。发现在早期发育时期即从无节幼体到糠虾幼体阶段,MjCatD基因表达量显著上升,且维持在较高的表达水平。由于此阶段日本囊对虾幼体外部形态发生较大变化,细胞增殖生长及代谢速率达到最高水平,存在着强烈的能量转换[25],推测MjCatD mRNA表达的上调与幼体形态发育和旺盛的细胞代谢有关。经历早期快速发育时期后,日本囊对虾在仔虾第一周时食性和消化系统发生改变,发育速率也降至较低水平,生长放缓[25—27],相应的MjCatD基因表达量显著下调。随后,日本囊对虾在P8~P10左右时期由浮游生活转为底栖生活,期间需要寻找合适的栖息地,与之相适应的重要生理结构也在快速发育,故在生活习性的转变过程中需要消耗大量能量,机体新陈代谢速率较快[26,28]。由此,本阶段MjCatD基因的高量表达可能与生活习性转变和形态发育有关,同时也是应对仔虾后期高耗能的一种适应策略。
综上所述,MjCatD作为一种重要的溶酶体天冬氨酸蛋白酶,推测其参与了日本囊对虾先天免疫反应和幼体发育过程,并且发挥重要作用。本实验结果为研究组织蛋白酶D在虾类免疫和生长发育中的作用奠定了一定的基础,但关于其在这两种过程中的具体作用机制仍待进一步探讨。
参考文献:
[1]Liu Haipeng, Söderhäll K, Jiravanichpaisal P. Antiviral immunity in crustaceans[J]. Fish & Shellfish Immunology, 2009, 27(2): 79-88.
[2]Honey K, Rudensky A Y. Lysosomal cysteine proteases regulate antigen presentation[J]. Nature Reviews Immunology, 2003, 3(6): 472-482.
[3]Hsing L C, Rudensky A Y. The lysosomal cysteine proteases in MHC class Ⅱ antigen presentation[J]. Immunological Reviews, 2005, 207(1): 229-241.
[4]Liaudet-Coopman E, Beaujouin M, Derocq D, et al. Cathepsin D: newly discovered functions of a long-standing aspartic protease in cancer and apoptosis[J]. Cancer Letters, 2006, 237(2): 167-179.
[5]曾广智, 谭宁华, 贾锐锐, 等. 组织蛋白酶及其抑制剂研究进展[J]. 云南植物研究, 2005, 27(4): 337-354.
Zeng Guangzhi, Tan Ninghua, Jia Ruirui, et al. Cathepsins: structures, functions and inhibitors[J]. Acta Botanica Yunnanica, 2005, 27(4): 337-354.
[6]张志林, 肖蓉, 李庆伟. 组织蛋白酶D的功能多样性[J]. 中国生物化学与分子生物学报, 2014, 30(7): 647-654.
Zhang Zhilin, Xiao Rong, Li Qingwei. Diversified functions of cathepsin D[J]. Chinese Journal of Biochemistry and Molecular Biology, 2014, 30(7): 647-654.
[7]Choi K M, Shim S H, An C M, et al. Cloning, characterisation, and expression analysis of the cathepsin D gene from rock bream (Oplegnathusfasciatus)[J]. Fish & Shellfish Immunology, 2014, 40(1): 253-258.
[8]Carnevali O, Centonze F, Brooks S, et al. Molecular cloning and expression of ovarian cathepsin D in seabream,Sparusaurata[J]. Biology of Reproduction, 1999, 61(3): 785-791.
[9]Dong Zhongdian, Zhang Jiao, Ji Xiangshan, et al. Molecular cloning, characterization and expression of cathepsin D from grass carp (Ctenopharyngodonidella)[J]. Fish & Shellfish Immunology, 2012, 33(5): 1207-1214.
[10]Rojo L, Sotelo-Mundo R, García-Carreo F, et al. Isolation, biochemical characterization, and molecular modeling of American lobster digestive cathepsin D1[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2010, 157(4): 394-400.
[11]段亚飞, 刘萍, 李吉涛, 等. 脊尾白虾(Exopalaemoncarinicauda)组织蛋白酶D基因的克隆及其表达分析[J]. 海洋与湖沼, 2013, 44(3): 599-605.
Duan Yafei, Liu Ping, Li Jitao, et al. Cloning and expression of cathepsin D gene inExopalaemoncarinicauda[J]. Oceanologia et Limnologia Sinica, 2013, 44(3): 599-605.
[12]孙田田, 苏永全, 洪婧妮, 等. 真蛸热休克蛋白90基因(HSP90)的克隆及表达[J]. 水产学报, 2012, 36(9): 1367-1375.
Sun Tiantian, Su Yongquan, Hong Jingni, et al. Molecular cloning and feature analysis of heat shock protein 90 (HSP90) fromOctopusvulgaris[J]. Journal of Fisheries of China, 2012, 36(9): 1367-1375.
[13]Schwede T, Kopp J, Guex N, et al. SWISS-MODEL: an automated protein homology-modeling server[J]. Nucleic Acids Research, 2003, 31(13): 3381-3385.
[14]Xiao Rong, Zhang Zhilin, Wang Hongyan, et al. Identification and characterization of a cathepsin D homologue from lampreys (Lampetrajaponica)[J]. Developmental & Comparative Immunology, 2015, 49(1): 149-156.
[15]Fortenberry S C, Schorey J S, Chirgwin J M. Role of glycosylation in the expression of human procathepsin D[J]. Journal of Cell Science, 1995, 108(5): 2001-2006.
[16]Margaryan N V, Kirschmann D A, Lipavsky A, et al. New insights into cathepsin D in mammary tissue development and remodeling[J]. Cancer Biology & Therapy, 2010, 10(5): 457-466.
[17]Masson O, Prébois C, Derocq D, et al. Cathepsin-D, a key protease in breast cancer, is up-regulated in obese mouse and human adipose tissue, and controls adipogenesis[J]. PLoS One, 2011, 6(2): e16452.
[18]Gross P S, Bartlett T C, Browdy C L, et al. Immune gene discovery by expressed sequence tag analysis of hemocytes and hepatopancreas in the Pacific White Shrimp,Litopenaeusvannamei, and the Atlantic White Shrimp,L.setiferus[J]. Developmental & Comparative Immunology, 2001, 25(7): 565-577.
[19]朱建中, 陆承平. 对虾白斑综合征病毒射阳株的分离及其在螯虾体内的动态分布[J]. 南京农业大学学报, 2002, 25(3): 75-79.
Zhu Jianzhong, Lu Chengping. Isolation and dynamic distribution of white spot syndrome virus Sheyang strain in crawfishes[J]. Journal of Nanjing Agricultural University, 2002, 25(3): 75-79.
[20]Chen I T, Aoki T, Huang Y T, et al. White spot syndrome virus induces metabolic changes resembling the warburg effect in shrimp hemocytes in the early stage of infection[J]. Journal of Virology, 2011, 85(24): 12919-12928.
[21]Chang P S, Lo C F, Wang Y C, et al. Identification of white spot syndrome associated baculovirus (WSBV) target organs in the shrimpPenaeusmonodonbyinsituhybridization[J]. Diseases of Aquatic Organisms, 1996, 27(2): 131-139.
[22]Zhang Man, Mao Yong, Wang Jun, et al. Molecular characterization and expression analysis of a novel dual-CRD C-type lectin in kuruma shrimp (Marsupenaeusjaponicus)[J]. Acta Oceanologica Sinica, 2015, 34(2): 74-83.
[23]Zuzarte-Luis V, Montero J A, Kawakami Y, et al. Lysosomal cathepsins in embryonic programmed cell death[J]. Developmental Biology, 2007, 301(1): 205-217.
[24]Cho J H, Park I Y, Kim H S, et al. Cathepsin D produces antimicrobial peptide parasinⅠfrom histone H2A in the skin mucosa of fish[J]. The FASEB Journal, 2002, 16(3): 429-431.
[25]Laubier-Bonichon A, Van Wormhoudt A, Sellos D. Croissance larvaire contrlée dePenaeusjaponicusBate. Enzymes digestives et changements de régimes alimentaires[C]// Proceedings of the 3rd Meeting of the I.C.E.S. Working Group on Mariculture. Brest, France, 1977: 131-145.
[26]Lemos D, Hernndez-Cortés M P, Navarrete A, et al. Ontogenetic variation in digestive proteinase activity of larvae and postlarvae of the pink shrimpFarfantepenaeuspaulensis(Crustacea: Decapoda: Penaeidae)[J]. Marine Biology, 1999, 135(4): 653-662.
[27]Ribeiro F, Jones D. Growth and ontogenetic change in activities of digestive enzymes inFenneroPenaeusindicuspostlarvae[J]. Aquaculture Nutrition, 2000, 6(1): 53-64.
[28]Mourente G, Medina A, Gonzlez S, et al. Variations in lipid content and nutritional status during larval development of the marine shrimpPenaeuskerathurus[J]. Aquaculture, 1995, 130(2/3): 187-199.
收稿日期:2015-12-15;
修订日期:2016-03-31。
基金项目:国家现代农业虾产业技术体系专项(CARS-47);广西自然科学基金项目(2015GXNSFBA139066)。
作者简介:张曼(1986—),女,山东省禹城市人,讲师,主要从事甲壳动物非特异性免疫研究。E-mail:sdyczm@163.com *通信作者:苏永全,博士生导师,教授,主要从事海洋生物遗传育种研究。E-mail:yqsu@xmu.edu.cn
中图分类号:Q95
文献标志码:A
文章编号:0253-4193(2016)08-0052-10
Molecular cloning and expression analysis of cathepsin D from kuruma shrimp (Marsupenaeus japonicus)
Zhang Man1,2, Cheng Guangping1, Su Yongquan2, Xu Yihua2, Feng Wenrong2, Wang Jun2,Song Xiaohong2, Mao Yong2
(1.GuangxiCollegesandUniversitiesKeyLaboratoryofAquaticHealthyBreedingandNutritionRegulation,CollegeofAnimalScienceandTechnology,GuangxiUniversity,Nanning530005,China; 2.CollegeofOceanandEarthSciences,XiamenUniversity,Xiamen361102,China)
Abstract:Cathepsin D is the principal member of lysosomal aspartic proteinase family which participates in various degradations of intracellular protein and plays important roles in normal metabolism for the maintenance of cellular homeostasis. In this current study, the cDNA sequence of kuruma shrimp (Marsupenaeus japonicus) cathepsin D (MjCatD) was cloned for the first time through RACE technology, including a 1 161 bp open reading frame encoding 386 amino acids. Both sequence analysis and homology modeling revealed that the deduced protein of MjCatD contained well conserved N-glycosylation site, aspartic proteinase signature sequence, active site and the characteristic sequence of non-digestive cathepsin D, as well as presented a conserved bilobal structure. MjCatD shared high similarity with those from Penaeus monodon, Homarus americanus, Palaemon carinicauda, and clustered together with above three cathepsin Ds. Real-time quantitative PCR demonstrated that MjCatD was ubiquitously expressed in all the examined tissues, predominantly in hepatopancreas. After challenging with white spot syndrome virus (WSSV), the expression level of MjCatD in the hepatopancreas was gradually down regulated during 3 h to 24 h, then very significantly increased (P<0.01) and peaked at 48 h compared to the control. MjCatD also showed obvious changes during different larval stages. These findings indicated that MjCatD may play key roles in the innate immune response and larval development of kuruma shrimp.
Key words:Marsupenaeus japonicus; cathepsin D; gene cloning; gene expression
张曼,程光平,苏永全,等. 日本囊对虾(Marsupenaeusjaponicus)组织蛋白酶D基因克隆及表达分析[J].海洋学报,2016,38(8):52-61, doi:10.3969/j.issn.0253-4193.2016.08.006
Zhang Man, Cheng Guangping, Su Yongquan, et al. Molecular cloning and expression analysis of cathepsin D from kuruma shrimp (Marsupenaeusjaponicus) [J]. Haiyang Xuebao,2016,38(8):52-61, doi:10.3969/j.issn.0253-4193.2016.08.006

