海洋球石藻(Emiliania huxleyi)通用表达载体的构建与电转化
王薛婷,郭强强,蔡艺钦,陈志福,李健,刘静雯*
(1.集美大学 食品与生物工程学院,福建 厦门361021)
海洋球石藻(Emiliania huxleyi)通用表达载体的构建与电转化
王薛婷1,郭强强1,蔡艺钦1,陈志福1,李健1,刘静雯1*
(1.集美大学 食品与生物工程学院,福建 厦门361021)
摘要:海洋球石藻Emiliania huxleyi是一种全球广泛分布的真核浮游植物,该种不仅是海洋碳、硫循环和全球气候变化的重要指示物种,而且能够产生丰富的次级代谢生物活性物质,在生物技术领域也具有很好的应用前景。本文通过分析氨苄青霉素、卡那霉素、G418、氯霉素、链霉素、新生霉素及嘌呤霉素等7种常用抗生素对海洋球石藻生长的影响,确定G418可作为该藻阳性转化藻株的抗性筛选试剂,其对应的抗性基因neo则作为该藻表达载体构建中的抗性筛选标记。在此基础上克隆了绿色荧光蛋白基因gfp、抗性标记基因neo及E. huxleyi BOF92内源性岩藻黄素-叶绿素a/c结合蛋白基因的启动子fcp,以pUC18为基础载体,构建了pUC18-fcp-gfp和pUC18-fcp-neo两个重组表达载体,以电转化方法共转化球石藻细胞并结合选择性固体培养基筛选,成功获得了被转化的球石藻细胞。海洋球石藻遗传转化系统的建立为进一步开展该种相关的基础生物学研究及其在生物技术领域的应用奠定了基础。
关键词:海洋球石藻;通用表达载体;neo标记基因;电转化
1引言
海洋微藻是海洋生物的重要饵料来源之一,具有种类多、繁殖快、数量大等特点,是海洋生物资源的重要组成部分。许多海洋微藻能够产生丰富的次级代谢活性物质,可用于食品、医药、能源及化工领域,特别是有些海洋微藻细胞中总脂类的含量可高达80%(干质量),在脂类生物活性物质及能源开发利用中具有很好的前景和优势[1—4]。微藻遗传工程是操纵微藻代谢通路的强有力工具,利用基因工程改造微藻生物代谢途径,可大大提高目标活性物质的合成和积累[5—8]。
海洋球石藻Emilianiahuxleyi是一种全球广泛分布且具有重要生态功能的真核微型浮游植物。其独特的生物矿化作用和高产DMSP能力已成为影响全球碳、硫生物地化循环及气候变化的一个关键物种[9]。除此之外,该种还能够产生丰富的次级代谢生物活性物质,在生物技术研究领域具有广阔的应用前景。如,能有效合成和累积Ω-3长链多元不饱和脂肪酸二十二碳六烯酸(DHA),具有防止心血管疾病等药理功能;能够合成大量聚酮类化合物,具有良好的抗菌、抗虫、抗肿瘤等生物学活性[10—11]。
自然海域中,某些海洋球石藻E.huxleyi能够被其特异的dsDNA病毒感染,且病毒感染和裂解被确认是终止该藻赤潮的一个重要因素。海洋球石藻E.huxleyiCCMP1516及其特异性裂解病毒EhV86的全基因组测序注释结果显示,该藻拥有类似于其他生物完整的鞘脂类物质生物合成途径;而令人惊奇的是,EhV86基因组中存在编码一系列可能参与宿主鞘脂类合成途径的多种酶的基因[12—14]。病毒与宿主基因组间可能通过基因横向转移而共享这些代谢酶并可能在一定程度上掌控了宿主鞘脂类代谢,大量合成、积累病毒新型鞘脂类物质并诱导宿主细胞凋亡[15—16]。然而,尽管病毒与宿主具有非常相似的鞘脂类代谢调控系统,但病毒与宿主基因组中同源基因表达的酶在鞘脂类代谢途径中并不具有完全同源的功能[13,16]。病毒基因组中这些酶在宿主鞘脂类代谢途径中的确切位置及功能目前尚不清楚。基于海洋球石藻E.huxleyi及其特异性病毒的全基因组已被全部测序和注释,通过建立该藻的遗传转化系统,可从分子水平深入研究病毒与宿主间复杂的相互作用关系,特别是病毒介导的宿主鞘脂类代谢调控机制;同时,在此基础上可以采用基因工程技术改造球石藻鞘脂类合成代谢途径的关键环节,以期通过病毒介导的鞘脂类代谢过程合成新型的鞘脂类活性物质。目前,有关海洋球石藻E.huxleyi遗传转化系统的研究国内外尚未见报道。
本研究以海洋球石藻E.huxleyiBOF92(Eh-BOF92)为材料,通过抗生素抗性基因筛选、启动子及标记基因的克隆,构建用于海洋球石藻的通用表达载体,建立适合该藻的电转化方法及固体培养基筛选方法,构建该藻的遗传转化系统,为进一步开展海洋球石藻E.huxleyi相关的基础生物学研究及其在生物技术领域的应用奠定基础。
2材料与方法
2.1实验材料
2.1.1海洋球石藻
实验用海洋球石藻E.huxleyi为Eh-BOF92株系,分离自挪威海域,由挪威卑尔根大学生物系Gunnar Bratbak教授赠送并保存于本实验室。
2.1.2菌种和试剂
Top10大肠杆菌(本实验室保存),pUC18基础载体、pMD-19T(TaKaRa公司产品),pGFP载体(携带绿色荧光蛋白gfp基因,由中国海洋大学潘克厚教授赠送),pSELECT质粒(携带抗性基因neo,购自厦门泰京生物科技有限公司)。
氨苄青霉素、卡那霉素、G418、氯霉素、链霉素、新生霉素、嘌呤霉素、G418、X-gal(鹭隆生物科技有限公司),ExTaq○R Hot Start Version试剂盒,限制性内切酶(BamH Ⅰ、PstⅠ、SacⅠ、EcoR Ⅰ、XbaⅠ)、T4DNA连接酶、rTaq酶、DNA marker(TaKaRa公司产品);质粒提取试剂盒、DNA凝胶回收试剂盒;MES(2-N-吗啉代-乙磺酸)、Hepes(4-羟乙基哌嗪乙磺酸)(上海生工BBI分装);甜菜碱为美国Sigma公司产品;琼脂糖为西班牙进口分装;MES-NaOH缓冲液(2-N-吗啉代-乙磺酸-氢氧化钠缓冲液,0.5 mol/L,pH5.5);Hepes (4-羟乙基哌嗪乙磺酸)电极缓冲液(0.080 mol/L KCl,0.005 mol/L CaCl2,0.2 mol/L甘露醇,0.2 mol/L山梨酸,0.01 mol/L Hepes,pH 7.2),球石藻固体培养基所用琼脂糖为Sigma Aldrich产品;PCR引物合成及基因测序均由英俊捷基(广州)贸易有限公司完成。
2.2实验方法
2.2.1微藻生长及抗生素筛选
液体培养采用70%海水配置的f/2-Si培养基,固体培养采用70%海水配置的f/50培养基[17],琼脂糖浓度为1.5%(Sigma Aldrich)。培养条件为:温度16℃,光照强度40 μmol/(m2·s),光周期为14L∶10D(光∶暗)。
将对数期的藻种接种于50 mL的三角瓶中,接种量为20 mL,起始细胞密度约为1×104cell/mL,然后加入不同浓度的抗生素(表1),抗生素浓度梯度由多次预实验确定,每个浓度设置3个平行组,培养条件同上。每24 h取样一次,每次取样200 μL,用卢氏碘液固定样品,血球计数板计数细胞密度。
2.2.2引物设计
基于抗生素筛选实验结果,G418作为球石藻适宜抗性筛选标记,其对应的抗性基因为neo。分别根据质粒pSELECT和pGFP中的neo和gfp基因序列设计特异引物,根据E.huxleyiCCMP1516全基因组信息(http://genome.jgi-psf.org/Emihu1.home.html)查找球石藻基因组中岩藻黄素-叶绿素a/c结合蛋白基因的启动子序列,设计特异性引物。利用PLACE 数据库(http://www.dna.affrc.go.jp/PLACE/)和PlantCARE数据库(http://bioniformatics.psb.ugent.be/webtools/plantcare/html/)对E.huxleyi内源性fcp启动子序列中的顺式作用元件、增强子和阻遏因子等进行预测和分析。分别以质粒pSELECT,pGFP及Eh-BOF92基因组为模板扩增抗性基因neo、报告基因gfp和启动子基因fcp。采用CTAB法提取海洋球石藻基因组DNA[18]。采用GeneDoc软件和Primer Premier 5.0软件设计引物,本研究所用引物见表2。
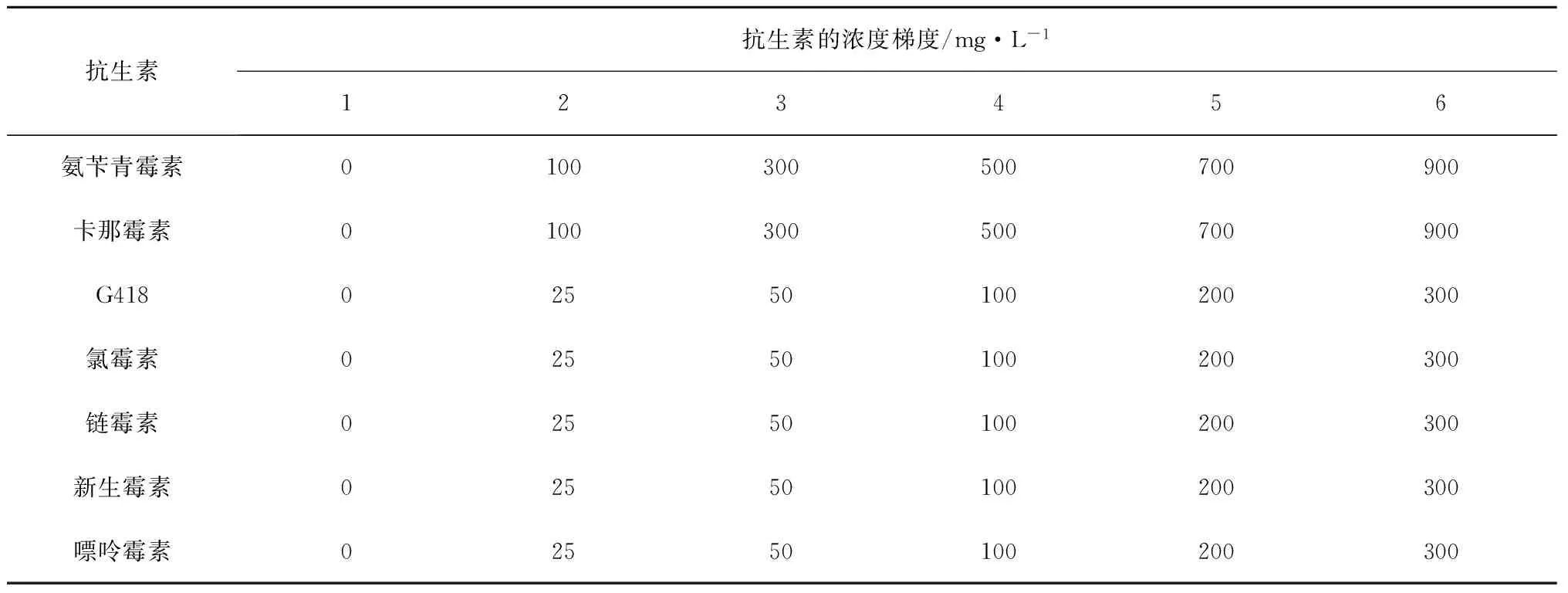
表1 液体培养基中7种抗生素的实验浓度
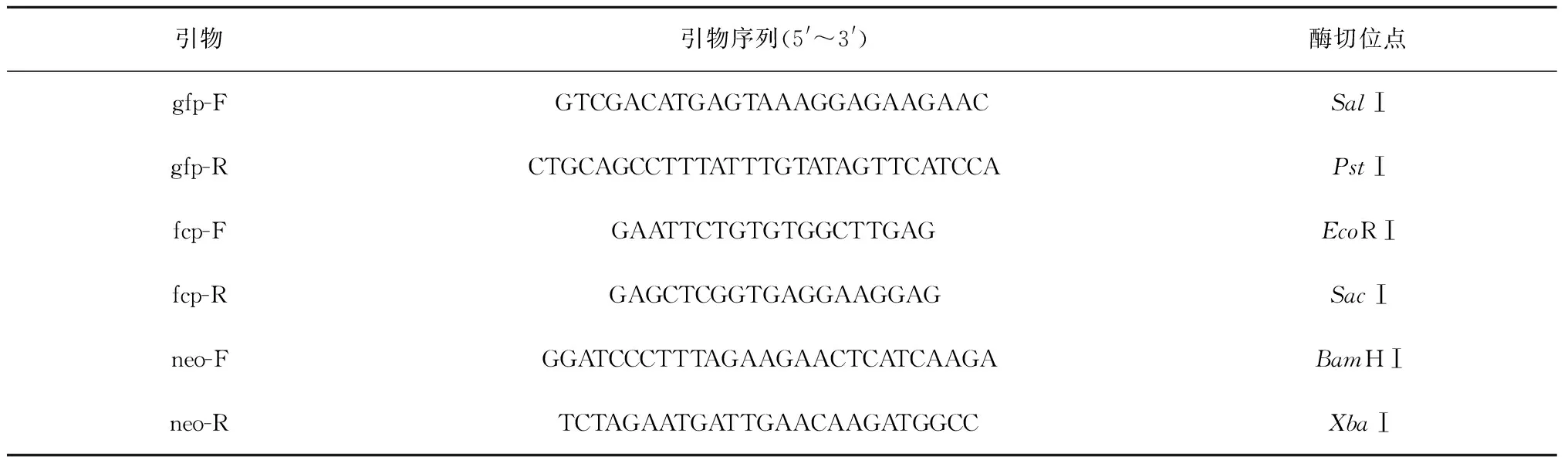
表2 本实验所用引物
2.2.3Neo, gfp及fcp基因的扩增
所有PCR反应均分别在25 μL反应体系中进行。Neo/gfp基因(无菌ddH2O 17.2 μL,rTaq DNA聚合酶0.3 μL,模板1 μL,引物F和R各1 μL,dNTP 2 μL,10×PCR缓冲液2.5 μL)的扩增条件为:94℃预变性5 min,94℃ 30 s,58℃/52℃ 30 s,72℃ 60 s,扩增30个循环,72℃延伸10 min;启动子fcp基因(无菌ddH2O 11.05 μL,rTaq DNA聚合酶0.3 μL,模板1 μL,引物F和R各1 μL,dNTP 2 μL,10×PCR缓冲液2.5 μL,5% DMSO 5 μL,5 mol/L Betaine 1.25 μL)的扩增条件为:94℃预变性5 min,94℃ 30 s,56℃ 30 s,72℃ 60 s,扩增30个循环,72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测。采用TIANGEN通用DNA纯化试剂盒回收各段PCR产物,连接到载体pMD19-T(16℃,8 h)。采用热激法转化大肠杆菌TOP10感受态细胞,经蓝白斑筛选、质粒小抽、PCR及双酶切验证、测序。
2.2.4双元表达载体的构建
以pUC18为基础载体,重组表达载体pUC18-fcp-gfp和pUC18-fcp-neo的构建过程如图1a、1b所示。用质粒PCR和双酶切方法验证载体构建成功后分别提取质粒pUC18-fcp-neo和pUC18-fcp-gfp进行共转化。
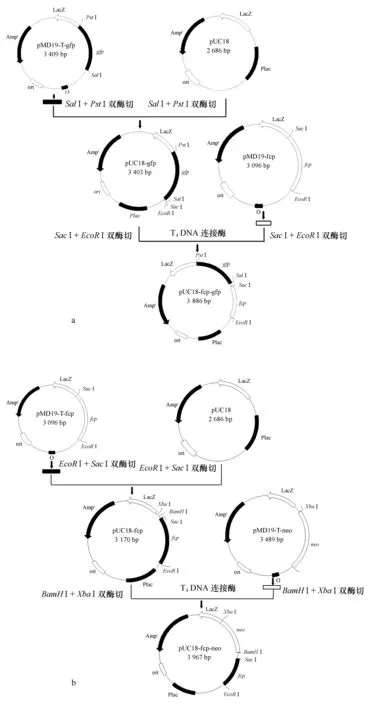
图1 双元表达载体pUC18-fcp-gfp(a)和pUC18-fcp-neo(b)的构建过程图Fig.1 Construction of plasmids pUC18-fcp-gfp (a) and pUC18-fcp-neo (b)
2.2.5重组质粒的电转化及阳性藻株的筛选
采用电转化方法进行共转化(电转仪为美国BTX,ECM830)。离心收集处于对数生长期的藻液100 mL(1 500×g,4℃,5 min),将收集的细胞沉淀重悬于5 mL MES-NaOH缓冲液中,置于16℃培养箱反应2 h,离心,弃废液,用Hepes电极缓冲液洗涤细胞1次,离心,弃废液。将细胞重新悬于Hepe缓冲液中,调整藻细胞密度为5×107cells/mL,再加入上述两种重组质粒充分混匀(重组质粒的终浓度均分别为10 μg/mL),用1 mL宽口吸头充分混匀,冰浴15 min,以备电击。吸取100 μL混合液,加入到0.2 cm冰浴的点击杯中。根据临界电场强度计算海洋球石藻细胞的临界电场强度[19],结果得出:球石藻理论临界电场强度约为1 333~4 444 V/cm,因此电场强度范围设置为1 600~4 000 V/cm,变化梯度为200 V/cm;电击时间范围为1.0~4.0 ms,变化梯度为1.0 ms,最终确定最佳电场强度和电击时间,提高转化效率。电击后的样品冰浴10 min,然后转移到10 mL不含G418抗生素的培养基中,静止恢复培养24 h(连续光照),再向培养基中加入抗生素G418(终浓度为100 μg/mL)继续培养1周左右,于倒置荧光显微镜下观察细胞转化情况(日本Olympus,BX51)。低速离心浓缩细胞,涂布于含有G418(终浓度为100 μg/mL)抗性的f/50固体选择性培养基中(设置野生型对照组),倒置平板进行培养,观察微藻克隆的生长情况。
3结果
3.1海洋球石藻Eh-BOF92对各种抗生素的敏感性
综合分析本研究所用的7种抗生素对海洋球石藻Eh-BOF92生长影响结果如图2所示。不同浓度的氨苄青霉素、卡那霉素及链霉素对海洋球石藻生长均无明显抑制作用,表明该藻对上述3种抗生素不敏感;而不同浓度的氯霉素和新生霉素对海洋球石藻生长均有一定程度的抑制作用,且随浓度的增加抑制作用增强,当浓度大于等于100 μg/mL时,细胞停止生长,可见球石藻Eh-BOF92对氯霉素和新生霉素有一定的敏感性;不同浓度的嘌呤霉素和G418对球石藻Eh-BOF92生长均具有显著的抑制作用,但抑制程度不同,当浓度大于等于25 μg/mL时,在含嘌呤霉素的培养基中培养至第10天致使细胞彻底死亡,而在含G418的培养基培养至第3天即可导致细胞全部死亡,可见球石藻Eh-BOF92对G418的抑制作用非常敏感,因此G418可作为该藻阳性转化藻株的抗性筛选试剂,其对应的抗性基因neo则作为该藻表达载体构建中的抗性筛选标记。
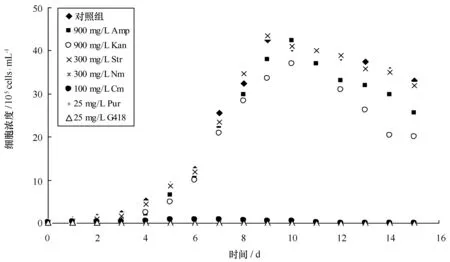
图2 7种抗生素对海洋球石藻E. huxleyi BOF92生长的影响Fig.2 Effects of seven antibiotics on the growth of E. huxleyi BOF92
3.23种功能元件的PCR扩增结果
分别以pSELECT质粒、pGFP质粒和海洋球石藻E.huxleyiBOF92基因组为模板,PCR扩增及测序验证获得的目的基因片段大小分别为:neo/797 bp、gfp/717 bp和fcp/483 bp(图3),测序验证结果正确。

图3 3种功能元件neo, fcp和gfp基因克隆的琼脂糖凝胶电泳Fig.3 Agarose gel electrophoresis of neo, fcp and gfp genes cloninga. M 为 100 bp DNA 分子量标记,泳道1为 neo (797 bp) 基因的PCR产物;b. M 为 100 bp DNA 分子量标记,泳道1为 gfp(717 bp) 基因的PCR产物; c. M 为100 bp DNA分子量标记, 泳道1为 fcp(483 bp) 基因的PCR产物a. M represents 100 bp DNA Ladder Marker, line 1 PCR product of neo(797 bp); b. M represents 100 bp DNA Ladder Marker, line 1 PCR product of gfp(717 bp); c. M represents 100 bp DNA Ladder Marker, line 1 PCR product of fcp(483 bp)
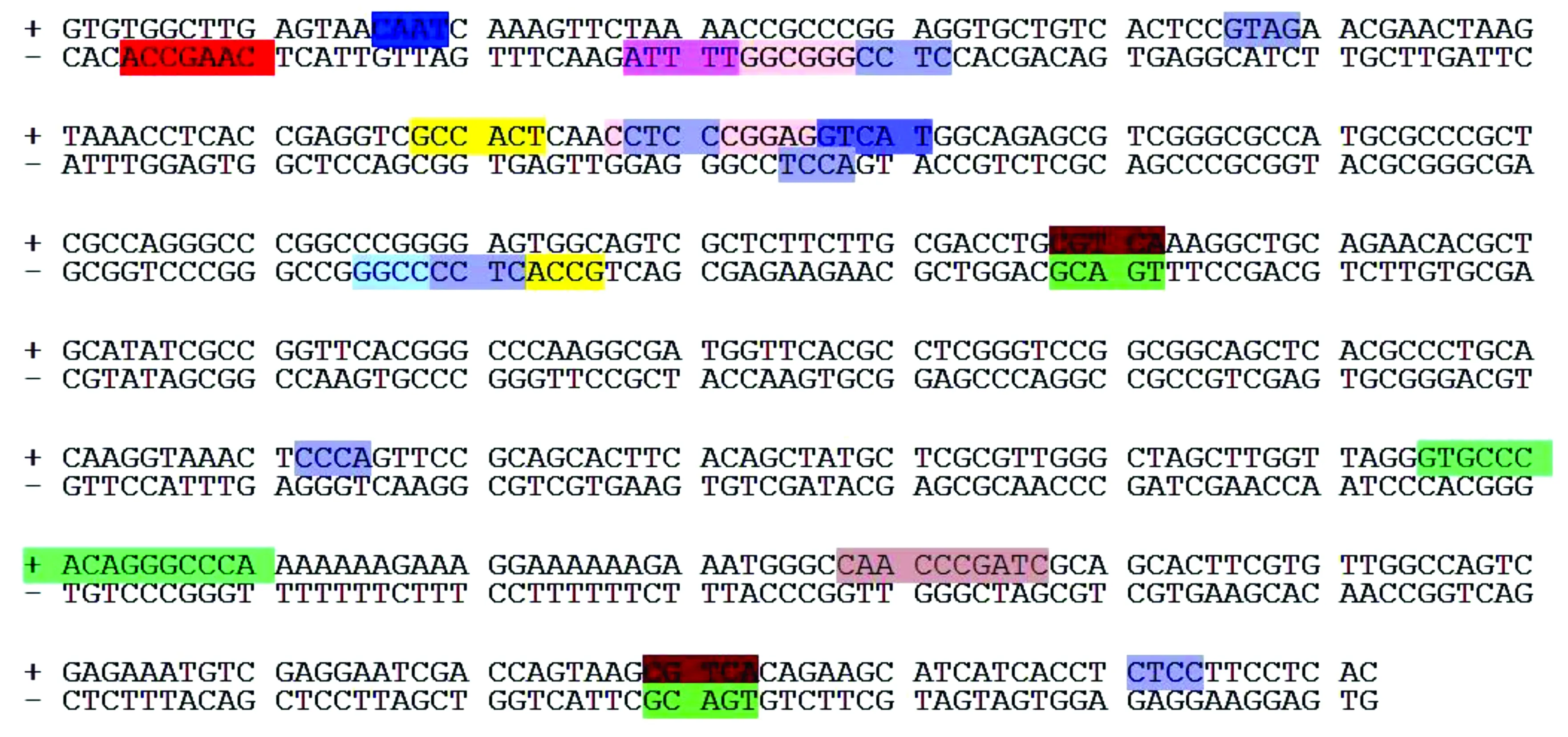
图4 海洋球石藻E. huxleyi BOF92 fcp启动子基因预测结果Fig.4 Prediction results of the promoter fcp gene in E. huxleyi BOF92
3.3海洋球石藻Eh-BOF92内源性fcp启动子序列的分析
利用在线生物信息学软件对Eh-BOF92内源性fcp启动子483 bp序列中的顺式作用元件、增强子和阻遏因子等进行了预测分析(图4)。该启动子序列含有丰富的顺式作用元件,除含有基本的顺式作用元件TATA-box和CAAT-box外,还包含有光响应顺式作用元件MNF1、Sp1以及MeJA响应能力相关的顺式作用元件CGTCA-motif和TGACG-motif[20—21],胚乳表达需要的顺式作用元件Skn-1-motif[20],胚乳表达相关的顺式作用元件GCN4-motif[22],分生组织表达相关的顺式作用元件CAT-box[23],生理节奏控制相关的顺式作用元件Circadian[24],此外还存一些未命名的顺式作用元件如CCCCGG和CTCC等。大量启动子顺式作用元件的存在,说明本研究所选择的Eh-BOF92内源性fcp启动子序列具有潜在的强启动子活性,可用于调控内源或外源基因的表达。
3.4海洋球石藻双元真核表达载体成功构建确认
分别将构建的重组质粒pUC18-fcp-gfp(图1a)和pUC18-fcp-neo(图1b)转化大肠杆菌感受态细胞Top10,经过PCR和双酶切鉴定,结果表明双元重组表达载体构建成功(图5a,5b)。
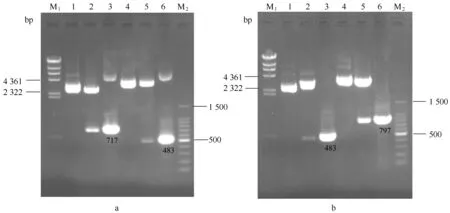
图5 重组质粒pUC18-gfp-fcp(a)和pUC18-fcp-neo(b)双酶切产物的琼脂糖凝胶电泳Fig.5 Agarose gel electrophoresis of the digest products of the recombinant plasmids pUC18-fcp-gfp (a) and pUC18-fcp-neo (b)M1为λ-Hind Ⅲ 酶切片段分子量标记;M2为100 bp DNA 分子量标记. 泳道1分别为重组质粒pUC18-gfp (a) 和pUC18-fcp (b) ;泳道2分别为Sal Ⅰ+Pst Ⅰ双酶切重组质粒pUC18-gfp后的产物(a) 和Sac Ⅰ+EcoR Ⅰ双酶切重组质粒pUC18-fcp后的产物 (b);泳道3分别为以重组质粒pUC18-gfp为模板(a) 和的以重组质粒pUC18-fcp为模板(b)的PCR产物;泳道4分别为重组质粒pUC18-fcp-gfp (a) 和重组质粒pUC18-fcp-neo (b);泳道5分别为Sac Ⅰ+EcoR Ⅰ双酶切重组质粒pUC18-fcp-gfp和BamH Ⅰ+Xba Ⅰ双酶切重组质粒pUC18-fcp-neo后的产物;泳道6分别为以重组质粒pUC18-fcp-gfp为模板(a)和重组质粒pUC18-fcp-neo为模板(b)的PCR产物M1 representsλ-Hind Ⅲ digest DNA Marker; M2 represents 100 bp DNA Ladder Marker. line 1 pUC18-gfp (a) and pUC18-fcp recombinant plasmids; line 2 pUC18-gfp/Sal Ⅰ+Pst Ⅰ and pUC18-fcp/Sac Ⅰ+EcoR Ⅰ; line 3 PCR product of the pUC18-gfp (a) and pUC18-fcp (b) recombinant plasmids; line 4 pUC18-fcp-gfp (a) and pUC18-fcp-neo(b) recombinant plasmids; line 5 pUC18-fcp-gfp / Sac Ⅰ+EcoR Ⅰ (a) and pUC18-fcp-neo / BamH Ⅰ+Xba Ⅰ (b) ; line 6 PCR products of the pUC18-fcp-gfp (a) and pUC18-fcp-neo (b) recombinant plasmids

图6 海洋球石藻E. huxleyi BOF92电击转化培养1周后于光学显微镜下的观察结果Fig.6 The microscopical photographs of E. huxleyi BOF92 by electroporation and culturing for one weeka.光学显微镜观察结果;b.荧光显微镜观察结果(480 nm) a. Light microscopical photograph; b. fluorescent microscopical photograph(480 nm)
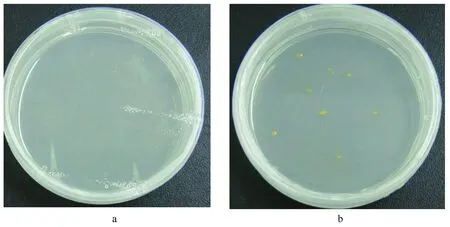
图7 野生型(a)和转化的海洋球石藻E. huxleyi BOF92(b)在含有G418(100 g/mL)选择性固体培养基上的筛选生长结果Fig.7 The cultures of wild-type (a) and transgenic E.huxleyi BFO92 cells (b) streaked on the G418 (100 g/mL) containing medium after electroporation 20 days (f/50 medium)
3.5电击法成功转化海洋球石藻BOF92
本文参考Muto等的方法[19],对海洋球石藻的电转化条件进行摸索。将构建好的含有抗性基因neo的质粒pUC18-fcp-neo和含有报告基因gfp的质粒pUC18-fcp-gfp共转化海洋球石藻细胞,将电击后的E.huxleyi细胞置于不含抗生素G418的液体培养基中,在连续光照条件下培养24 h,经过一段时间恢复后再向培养液中加入G418(终浓度为100 μg/mL)继续培养1周,于倒置荧光显微镜下观察转化情况。结果显示E.huxleyi培养液中存在发绿色荧光的藻细胞(图6),说明转化组的藻细胞中同时含有gfp基因和neo基因并实现了瞬时表达。将在选择性液体培养基中生长的藻细胞离心(1 300×g,4℃,2 min)浓缩后(8×107cells/mL),取1 mL涂布到固体选择性培养基上(G418终浓度为100 μg/mL),于16℃培养,1周后可见白色阳性藻克隆的形式,3周后形成具有色素的藻克隆(图7)。
4讨论
选择标记是微藻遗传转化系统的关键元素之一。常用于微藻筛选转化子的选择压力试剂有氯霉素、G418、卡那霉素、潮霉素等,但不同的海洋真核微藻对各种抗生素的敏感性不同。例如杜氏盐藻对链霉素、卡那霉素、潮霉素和G418不敏感,而对氯霉素高度敏感[25];椭圆小球藻对氯霉素、链霉素、卡那霉素不敏感,对潮霉素较敏感,而对G418表现出高度敏感性[26];金藻对潮霉素、G418和氯霉素有点敏感,对腐草霉素家族的Zeocin最为敏感[27]。目前人们已在许多模式藻株中进行抗生素敏感性研究,建立了一些模式藻株的选择标记基因。其中适用于莱茵衣藻的有氨基葡萄糖苷腺苷转移酶基因addA、乙酰乳酸合成酶基因Als、核糖体蛋白S14基因及氨基糖苷磷酸转移酶基因aphVⅢ等[28—31];适用于三角褐指藻的有氯霉素乙酰转移酶基因cat、诺尔丝菌素乙酰转移酶基因nat、链丝菌素乙酰转移酶基因Sat-I、shble蛋白基因及草铵膦基因bar等[32—35]。目前,有关海洋球石藻E.huxleyi基因工程选择标记筛选的研究国内外尚未见报道,基于上述已有的研究报道,本研究选择了常见的7种抗生素用于海洋球石藻生长抗性的筛选。G418是一种氨基糖苷类抗生素,其通过影响80S核糖体功能而阻断蛋白质的合成,对原核和真核等生物细胞都有毒性。在真核微藻遗传转化系统中,携带有抗性基因neo的转基因藻株具有G418抗性[36]。本研究结果显示,海洋球石藻对G418和嘌呤霉素均高度敏感,但嘌呤霉素价格昂贵、毒性较强且目前尚未报道其作为基因工程藻株的选择标记使用。因此,从抗生素对细胞的敏感程度、所使用抗生素的剂量、经济效益以及细胞对抗生素的耐受程度等方面综合考虑,我们选择G418作为海洋球石藻基因工程藻株的选择标记,其抗性基因neo可以作为构建海洋球石藻真核表达载体的选择标记基因。绿色荧光蛋白gfp基因作为报告基因已广泛用于各种海藻遗传工程及亚细胞定位研究[37—38],与其他报告基因相比,gfp结构稳定,对细胞的生理毒害小且保留时间较长。本研究结果显示在转化的球石藻细胞中gfp基因至少在培养的7 d左右仍能有效表达,因此gfp基因可作为球石藻基因工程藻株构建中一种良好的报告基因。
一个强的启动子是真核微藻遗传转化系统的必要元件,以确保外源基因高效转录。硅藻的内源性岩藻黄素-叶绿素a/c结合蛋白与高等植物和绿藻类的叶绿素a/b结合蛋白(CAB)的功能相同,主要在转录水平调控基因的表达。三角褐指藻内源性岩藻黄素-叶绿素a/c结合蛋白基因启动子fcp在硅藻及其他几种海洋微藻中都能有效促使基因高效表达,如在三角褐指藻遗传转化系统中,采用内源性fcp强启动子能够融合sat-I、nptⅡ、uidA和gfp等蛋白并稳定表达外源基因[3,33,39—40]。fcp启动子序列同源性比对发现,不同真核微藻来源的fcp序列具有较高的同源性和保守性,说明来源于不同真核微藻的fcp启动子序列具有类似的功能。Eh-BOF92内源性启动子fcp序列含有丰富的顺式作用元件如TATA-box和CAAT-box,说明该内源性fcp启动子序列具有潜在的强启动子活性,可用于调控内源或外源基因的表达(图4)。通过电击法对Eh-BOF92细胞进行电转化,控制光照周期14L∶10D(光∶暗)条件下进行培养。在外界选择压力G418的作用下,Eh-BOF92转化组细胞内源性fcp启动子调控neo基因的表达从而确保阳性细胞株正常生长。在G418选择性液体和固体培养基上可以筛选到阳性藻株的生长,表明neo及gfp基因在球石藻细胞内实现了瞬时的稳定表达,Eh-BOF92内源性fcp启动子能够高效转录外源基因。
合适的转化方法也是外源基因能否在真核微藻细胞内稳定表达的关键因素之一。目前已经建立了许多转化真核微藻细胞的方法,主要有玻璃珠法、农杆菌转染法、基因枪法、超声波转化法和电击转化法等。电击转化法作为真核微藻遗传转化常用方法之一,已成功运用于多种微藻,如莱茵衣藻、小球藻、普通小球藻、红藻和雨生红球藻等[3]。一般情况下,电击转化微生物、植物和动物细胞时使用环状或超螺旋质粒能够获得更高的转化效率,而使用线性化质粒转化能够提高外源基因整合到宿主细胞基因组中的几率,更易获得稳定转化子,但线性化质粒转化效率极低且更易被细胞内的核酸酶消化。真核微藻电击转化时高纯度质粒有利于获得较高的转化效率。研究发现,环状质粒转化后,外源基因能够在细胞内瞬时表达,也存在整合到基因组中的几率,但大部分携带外源基因的环状质粒会随着细胞的分裂而稀释,导致质粒丢失。本研究采用高纯度的环状质粒进行转化,转化后第7天在荧光显微镜下观察到发绿色荧光的藻细胞,并在选择性固体培养基上培养3周左右长出具色素的藻克隆(图7),说明该环状质粒至少能在该藻细胞内存在近一个月以上,或也有少量质粒整合到了基因组上。另外,如何将外源基因和筛选标记基因同时导入微藻细胞,在操作上有两种策略可以选择:一是外源基因与筛选标记基因一起构建在同一个载体上[41];另一个策略是将外源基因和筛选标记基因分别构建在不同载体上,然后两种质粒以共转化方式转化微藻[34]。我们比较了单转化和共转化,发现两者之间的转化效率没有明显差别,同时考虑到将来在构建转基因藻株时,如果将将众多元件同时克隆在一个启动子下游,可能会影响外源基因的整合与表达,因此本研究选择了双元载体共转化方法。
电场强度是影响电击转化效率的重要因素之一。电场强度过高或过低都未能获得较高的转化效率,原因是在单位电击距离内,电压过高对细胞伤害较大,影响细胞存活率;电压过低则不易在细胞膜表面产生短暂的可恢复小孔,外源基因很难进入细胞。针对本实验材料Eh-BOF92优化或的电转化条件为:电场强度为2 000 V/cm、电击时间为2 ms/次、共电击2次时,转化效率达到0.07%。在1 000 V/cm,2 ms的电击条件下转化莱茵衣藻细胞壁缺失的突变体细胞,获得了1 000个转化子/106个细胞的高转化效率[42]。相比之下,球石藻转化效率比莱茵衣藻低很多,原因可能是由于本实验用的球石藻Eh-BOF92细胞表面覆含丰富的球石粒而导致细胞膜未能与质粒DNA充分接触。尽管在电击转化之前采用MES-NaOH缓冲液处理细胞表面,但反应时间过短或过长都将影响转化效率高低。反应时间过短,球石藻表面的球石粒处理不彻底导致外源基因很难与细胞膜接触而难于穿过细胞膜;反应时间过长则影响细胞活性,导致细胞死亡而使转化效率较低。此外,由于球石藻E.huxleyi生活史中具有二倍体和单倍体世代,两个不同时期的细胞大小存在差异也可能是导致转化效率较低的原因。细胞大小存在差异将导致理论电场强度不同,最终将影响转化效率较低。本文虽然是一个初步的研究,但作为具有重要生态学意义和生物技术应用前景的一种重要的海洋微藻,建立并进一步优化该海洋球石藻的遗传转化系统将为后续一系列科学研究提供了良好的基础。
参考文献:
[1]Bellou S, Baeshen M N, Elazzazy A M, et al. Microalgal lipids biochemistry and biotechnological perspectives[J]. Biotechnol Adv, 2014, 32(8): 1476-1493.
[2]De Morais M G, Vaz Bda S, de Morais E G, et al. Biologically active metabolites synthesized by microalgae[J]. Biomed Res Int, 2015, 2015:835761.
[3]Qin S, Jiang P, Tseng C K. Molecular biotechnology of marine algae in China[J]. Hydrobiologia, 2004, 512(1/3): 21-26.
[4]Niu Y F, Yang Z K, Zhang M H, et al. Transformation of diatomPhaeodactylumtricornutumby electroporation and establishment of inducible selection marker[J]. BioTech Rap Dis, 2012, doi: 10.2144/000113881.
[5]Radakovits R, Eduafo P M, Posewitz M C. Genetic engineering of fatty acid chain length inPhaeodactylumtricornutum[J]. Metab Eng, 2011, 13(1): 89-95.
[6]Qin S, Lin H Z, Jiang P. Advances in genetic engineering of marine algae[J]. Biotechnol Adv, 2012, 30(6): 1602-1613.
[7]Hlavova M, Turoczy Z, Bisova K. Improving microalgae for biotechnology-from genetics to synthetic biology[J]. Biotechnol Adv, 2015, 33(6): 1194-1203.
[8]Xue J, Niu Y F, Huang T, et al. Genetic improvement of the microalgaPhaeodactylumtricornutumfor boosting neutral lipid accumulation[J]. Metab Eng, 2015, 27: 1-9.
[9]Joassin P, Delille B, Soetaert K, et al. Carbon and nitrogen flows during a bloom of the coccolithophoreEmilianiahuxleyi: modelling a mesocosm experiment[J]. J Marine Syst, 2011, 85(3/4): 71-85.
[10]Sayanova O, Haslam R P, Calerón M V, et al. Identification and functional characterisation of genes encoding the omega-3 polyunsaturated fatty acid biosynthetic pathway from the coccolithophoreEmilianiahuxleyi[J]. Phytochemistry, 2011, 72(7): 594-600.
[11]Read B A, Kegel J, Klute M J, et al. Pan genome of the phytoplanktonEmilianiaunderpins its global distribution[J]. Nature, 2013, 499(7457): 209-213.
[12]Evans C, Pond D W, Wilson W H. Changes inEmilianiahuxleyifatty acid profiles during infection withE.huxleyivirus 86: physiological and ecological implications[J]. Aquat Microb Ecol, 2009, 55(3): 219-228.
[13]Michaelson L V, Dunn T M, Napier J A. Viraltrans-dominant manipulation of algal sphingolipids[J]. Trends Plant Sci, 2010, 15(12): 651-655.
[14]Wilson W H, Schroeder D C, Allen M J, et al. Complete genome sequence and lytic phase transcription profile of aCoccolithovirus[J]. Science, 2005, 309(5737): 1090-1092.
[15]Liu X H, Zheng T L, Cai Y X, et al. Cloning, expression and characterization of serine palmitoyltransferase (SPT)-like gene subunit (LCB2) from marineEmilianiahuxleyivirus (Coccolithovirus) [J]. Acta Oceanologica Sinica, 2012, 31(6): 127-138.
[16]Vardi A, Van Mooy B A S, Fredricks H F, et al. Viral glycosphingolipids induce lytic infection and cell death in marine phytoplankton[J]. Science, 2009, 326(5954): 861-865.
[17]Laguna R, Romo J, Read B A, et al. Induction of phase variation events in the life cycle of the marine coccolithophoridEmilianiahuxleyi[J]. Appl Environ Microbiol, 2001, 67(9): 3824-3831.
[18]Sambrook J, Russell D W. 分子克隆实验指南[M]. 3版. 黄培堂, 译. 北京: 科学出版社, 2002.
Sambrook J, Russell D W. Molecular Cloning: A Laboratory Manual[M]. 3rd ed. Huang Peitang,Trans. Beijing: Science Press, 2002.
[19]Muto M, Fukuda Y, Nemoto M, et al. Establishment of a genetic transformation system for the marine pennate diatomFistuliferasp. strain JPCC DA0580-a high triglyceride producer[J]. Mar Biotechnol, 2013, 15(1): 48-55.
[20]余爱丽, 赵晋锋, 王高鸿, 等. 两个谷子CIPK基因在非生物逆境胁迫下的表达分析[J]. 作物学报, 2016, 42(2): 295-302.
Yu Aili, Zhao Jinfeng, Wang Gaohong, et al. Expression analysis of twoCIPKgenes under abiotic stress in foxtail millet[J]. Acta Agronomica Sinica, 2016, 42(2): 295-302.
[21]郑晓瑜, 郭晋艳, 张毅, 等. 植物非生物胁迫诱导启动子顺式作用元件的研究方法[J]. 植物生理学报, 2011, 47(2): 129-135.
Zheng Xiaoyu, Guo Jinyan, Zhang Yi, et al. Research methods of cis-acting elements in plant abiotic stress inducible promoters[J]. Plant Physiology Journal, 2011, 47(2): 129-135.
[22]Cheng S J, Wang Z Y, Hong M M. Rice bZIP protein, REB, interacts with GCN4 motif in promoter ofWaxygene[J]. Science in China Series C: Life Sciences, 2002, 45(4): 352-360.
[23]张积森, 林清凡, 方静平, 等. 甘蔗SPSⅢ启动子区ATCT-motif和CAT-box元件的酵母单杂交报告载体构建[J]. 福建师范大学学报(自然科学版), 2013, 29(1): 86-89.
Zhang Jisen, Lin Qingfan, Fang Jingping, et al. Construction of yeast one-hybrid reporter vector for screening the binding proteins of ATCT-motif and CAT-box inSPSⅢ promoter[J]. Journal of Fujian Normal University (Natural Science Edition), 2013, 29(1): 86-89.
[24]许家辉, 朱娜, 温超, 等. 龙眼LEAFY同源基因启动子的克隆与序列分析[J]. 果树学报, 2011, 28(4): 689-693.
Xu Jiahui, Zhu Na, Wen Chao, et al. Cloning and sequence analysis ofLEAFYgene promoter from longan (Dimocarpuslongan)[J]. Journal of Fruit Science, 2011, 28(4): 689-693.
[25]耿德贵, 王义琴, 李文彬, 等. 杜氏盐藻基因工程选择标记的研究[J]. 生物技术, 2001, 11(5): 1-3.
Geng Degui, Wang Yiqin, Li Wenbin, et al. Study on selective marker ofDunaliellasalinagenetic engineering[J]. Biotechnology, 2001, 11(5): 1-3.
[26]陈颖, 李文彬, 张利明, 等. 小球藻对5种常用基因工程抗生素的敏感性研究[J]. 海洋与湖沼, 1999, 30(5): 500-505.
Chen Ying, Li Wenbing, Zhang Liming, et al. Study on sensitivities ofChlorellaEllipsoideato 5 antibiotics in genetic engineering[J]. Oceanologia et Limnologia Sinica, 1999, 30(5): 500-505.
[27]曹军平, 费志清, 刘必谦, 等. 金藻基因工程选择标记的研究[J]. 海洋科学, 2001, 25(7): 6-8.
Cao Junping, Fei Zhiqing, Liu Biqian, et al. Study on the selectable marker forDicrateriainornatagene engineering[J]. Marine Sciences, 2001, 25(7): 6-8.
[28]Cerutti H, Johnson A M, Gillham N W, et al. A eubacterial gene conferring spectinomycin resistance onChlamydomonasreinhardtii: integration into the nuclear genome and gene expression[J]. Genetics, 1997, 145(1): 97-110.
[29]Kovar J L, Zhang J, Funke R P, et al. Molecular analysis of the acetolactate synthase gene ofChlamydomonasreinhardtiiand development of a genetically engineered gene as a dominant selectable marker for genetic transformation[J]. Plant J, 2002, 29(1): 109-117.
[30]Nelson J A, Savereide P B, Lefebvre P A. TheCRY1 gene inChlamydomonasreinhardtii: structure and use as a dominant selectable marker for nuclear transformation[J]. Mol Cell Biol, 1994, 14(6): 4011-4019.
[31]Sizova I, Fuhrmann M, Hegemann P. A streptomyces rimosus aph VⅢ gene coding for a new type phosphotransferase provides stable antibiotic resistance toChlamydomonasreinhardtii[J]. Gene, 2001, 277(1/2): 221-229.
[32]Hallmann A, Rappel A. Genetic engineering of the multicellular green algaVolvox: a modified and multiplied bacterial antibiotic resistance gene as a dominant selectable marker[J]. Plant J, 1999, 17(1): 99-109.
[33]Slavskaia L A, Lippmerier J C, Kroth P G, et al. Transformation of the diatomPhaeodactylumtricornutum(bacillariophyceae) with a variety of selectable marker and reporter genes[J]. J Phycol, 2000, 36(2): 379-386.
[34]Apt K E, Kroth-Pancic P G, Grossman A R. Stable nuclear transformation of the diatomPhaeodactylumtriconutum[J]. Mol Gen Genet, 1996, 252(5): 572-579.
[35]郑国庭, 姜鹏, 秦松, 等. 三角褐指藻(Phaeodactylumtricornutum)通用转化载体的构建[J]. 生物学杂志, 2012, 29(4): 8-11.
Zheng Guoting, Jiang Peng, Qin Song, et al. Construction of a transformation vector for diatomPhaeodactylumtricornutum[J]. Journal of Biology, 2012, 29(4): 8-11.
[36]Paludan K, Duch M, Jørgensen P, et al. Graduated resistance to G418 leads to differential selection of cultured mammalian cells expressing theneogene[J]. Gene, 1989, 85(2): 421-426.
[37]Miyagawa A, Okami T, Kira N, et al. Research note: high efficiency transformation of the diatomPhaeodactylumtricornutumwith a promoter from the diatomCylindrothecafusiformis[J]. Phycol Res, 2009, 57(2): 142-146.
[38]Watanabe S, Ohnuma M, Sato J, et al. Utility of a GFP reporter system in the red algaCyanidioschyzonmerolae[J]. J Gen Appl Microbiol, 2011, 57(1): 69-72.
[39]Li F C, Qin S, Jiang P, et al. The integrative expression ofGUSgene driven by FCP promoter in the seaweedLaminariajaponica(Phaeophyta) [J]. J Appl Phycol, 2009, 21(3): 287-293.
[40]Miyagawa-Yamaguchi A, Okami T, Kira N, et al. Stable nuclear transformation of the diatomChaetocerossp.[J]. Phycol Res, 2011, 59(2): 113-119.
[41]Ladygin V G. Efficient transformation of mutant cells ofChlamydomonasreinhardtiiby electroporation[J]. Process Biochem, 2004, 39(11): 1685-1691.
[42]Falciatore A, Casotti R, Leblanc C, et al. Transformation of nonselectable reporter genes in marine diatoms[J]. Mar Biotechnol, 1999, 1(3): 239-251.
收稿日期:2015-12-11;
修订日期:2016-03-03。
基金项目:国家自然科学基金(41576166);福建省科技重点项目(2015Y0039);厦门市南方海洋研究中心项目(14GZP71NF35)。
作者简介:王薛婷(1991—),女,山西省临汾市人,主要从事海洋微生物分子生物学研究。E-mail:xuetingw1991@163.com *通信作者:刘静雯(1965—),女,山西省太原市人,教授,主要从事海洋微生物资源开发利用研究。E-mail:ljwsbch@163.com, jwliu@jmu.edu.cn
中图分类号:Q78
文献标志码:A
文章编号:0253-4193(2016)08-0103-12
Construction of expression vector and transformation via electroporation in coccolithophore Emiliania huxleyi
Wang Xueting1, Guo Qiangqiang1, Cai Yiqin1, Chen Zhifu1, Li Jian1, Liu Jingwen1
(1.CollegeofFoodandBioengineering,JiMeiUniversity,Xiamen361021,China)
Abstract:The marine coccolithophore Emiliania huxleyi is a eukaryotic microalga species crucial to the study of global biogeochemical cycles and climate modeling and also much of interest to those in biotechnology due to the capable of abundant bioactive metabolites production. Here, seven different kinds of antibiotics including ampicillin, kanamycin, G418, chloramphenicol, streptomycin, novobiocin and puromycin were used for the screening of antibiotic resistance. G418 was chosen most suitable selective antibiotics and the corresponding resistance gene “neo” as the marker for E. huxleyi genetic system. The promoter of the endogenic fucoxanthin chlorophyll a/c-binding protein gene “fcp” was cloned from E. huxleyi BOF92 strain. A construct was made containing the green fluorescent protein reporter gene “gfp” and screened G418 resistance gene “neo”. The resultant recombinant transformation vectors pUC18-fcp-gfp and pUC18-fcp-neo were co-transferred into E. huxleyi by electroporation. Transformants were obtained upon G418 selection. The results presented the new genetic transformation system for E. huxleyi, providing additional genetic resource with potential for exploring basic biological questions and biotechnological applications.
Key words:Emiliania huxleyi; vector construction; neo marker gene; electroporation
王薛婷,郭强强,蔡艺钦,等. 海洋球石藻(Emilianiahuxleyi)通用表达载体的构建与电转化[J].海洋学报,2016,38(8):103—114, doi:10.3969/j.issn.0253-4193.2016.08.011
Wang Xueting, Guo Qiangqiang, Cai Yiqin, et al. Construction of expression vector and transformation via electroporation in coccolithophoreEmilianiahuxleyi[J]. Haiyang Xuebao,2016,38(8):103—114, doi:10.3969/j.issn.0253-4193.2016.08.011

