泥蚶HDAC1基因cDNA全长、内含子克隆及时空表达特征分析
任付真,姚韩韩,董迎辉,周小龙,林志华*
(1. 上海海洋大学 水产与生命学院,上海 201306;2.浙江万里学院 生物与环境学院 浙江省水产种质资源高效利用技术研究重点实验室,浙江 宁波 315100)
泥蚶HDAC1基因cDNA全长、内含子克隆及时空表达特征分析
任付真1,2,姚韩韩2,董迎辉2,周小龙1,林志华2*
(1. 上海海洋大学 水产与生命学院,上海 201306;2.浙江万里学院 生物与环境学院 浙江省水产种质资源高效利用技术研究重点实验室,浙江 宁波 315100)
摘要:HDAC1作为HDACs家族中重要成员,可使组蛋白去乙酰化进而调节基因表达,在细胞分化和胚胎早期发育中起重要作用。本文利用SMART RACE技术克隆得到泥蚶HDAC1(Tg-HDAC1)基因的cDNA全长序列,并对其内含子进行扩增及不同组织、不同发育时期的定量表达。结果发现:Tg-HDAC1基因的cDNA序列全长为2 275 bp,开放阅读框(ORF)1 587 bp,编码528个氨基酸;Tg-HDAC1蛋白序列与斑马鱼、鸡、小鼠等的相似性都在80%以上,表明该蛋白氨基酸序列在物种进化过程中具有保守性;在Tg-HDAC1基因中扩增出13个内含子,均存在于开放阅读框中,且都遵循GT-AG原则;荧光定量PCR(qRT-PCR)分析结果显示,Tg-HDAC1基因在成体血液、内脏团、外套膜、鳃、斧足和闭壳肌6个组织中均有表达,而在足中的表达量最高,且与其余5组织中的表达量有极显著差异(P<0.01),说明它对该组织生长具有重要作用。不同发育时期的表达差异结果表明,Tg-HDAC1基因在担轮幼虫期表达量最高,显著高于其他发育时期(P<0.05)。
关键词:泥蚶;组蛋白去乙酰化酶1(HDAC1);基因克隆;内含子;表达分析
1引言
组蛋白去乙酰化酶1(Histone deacetylase 1, HDAC1)是HDACs家族中重要的一类蛋白酶,在几乎所有细胞的细胞核中均有表达,对细胞分化和胚胎发育起重要作用[1]。迄今HDAC1基因已在线虫(Caenorhabditiselegans)[2]、果蝇(Drosophilamelanogaster)[3]、斑马鱼(Daniorerio)[4]等模式生物中进行了大量研究。在脊椎动物中,Taunton等[5]发现第一个哺乳动物的组蛋白去乙酰化酶;Sun等[6]纯化和鉴定了鸡的HDAC1蛋白;Ye等[7]、柳小春等[8]证明HDAC1基因与猪的主要分割性状及生长、胴体性状相关。近几年,有关藏羚羊[9]、鸭[10]、牙鲆(Paralichthysolivaceus)[11]中HDAC1基因结构和功能研究也相继被报道,而在海洋贝类中未见相关报道。
泥蚶(Tegillarcagranosa)是一种广温广盐性滩涂贝类,具有独特的口感风味和较高的营养价值、经济价值,深受江、浙、闽等地沿海居民喜爱。目前,关于泥蚶功能基因的研究主要集中在免疫相关基因的克隆与表达分析上,如小热休克蛋白基因[12]、血红蛋白基因[13]、基质金属蛋白酶组织抑制因子3基因[14]等,而与生长、繁殖等主要经济性状相关基因报道较少,已见泥蚶生长因子受体结合蛋白2基因[15]与Smad1/5基因[16]的克隆及时空表达研究。本研究首次克隆获得泥蚶Tg-HDAC1基因的cDNA全长和所有内含子序列,并用qRT-PCR技术对其在成贝不同组织、不同发育时期的表达进行分析,旨在探索HDAC1基因在生长、发育过程中的调控作用,为开展泥蚶分子标记辅助育种奠定基础。
2材料与方法
2.1实验材料
泥蚶成贝采自宁波甬盛水产种业有限公司,活体解剖取血液、内脏团、外套膜、鳃、足和闭壳肌6个组织,液氮速冻后分装入冻存管中,置于-80℃超低温冰箱中保存,用于总RNA、DNA提取。通过亲贝催产、人工授精和早期培育,获得2-4细胞期、囊胚期、原肠胚期、担轮幼虫期、D形幼虫期、壳顶幼虫期、眼点幼虫期及稚贝期9个不同发育时期的样品,液氮速冻后存于-80℃超低温冰箱中。
2.2实验方法
2.2.1Tg-HDAC1基因cDNA全长克隆
用Trizol法提取泥蚶闭壳肌总RNA,NanoVue微量紫外分光光度计检测RNA纯度和浓度,1.0%琼脂糖凝胶检测RNA质量。按照SMARTTMRACE cDNA Amplication Kit(Clontech)说明反转录合成RACE cDNA第一条链。根据本实验室泥蚶454转录组文库注释信息,初步筛查到Tg-HDAC1基因cDNA部分序列,分别设计5′-RACE和3′-RACE特异性引物GSP1和GSP2(表1),根据Advantage 2 Polymerase Kit说明,采用touch down PCR,扩增Tg-HDAC1基因的cDNA全长。PCR产物用1.0%琼脂糖凝胶电泳检测、割胶纯化,纯化产物连接到pMD18-T(TaKaRa)载体,并将重组质粒转化到大肠杆菌DH5α(TaKaRa)中,经菌液PCR鉴定后阳性克隆送华大基因公司测序。
2.2.2Tg-HDAC1基因序列及进化分析
测序结果利用NCBI的BLAST(http://www.ncbi.nlm.nih.gov/BLAST/)对Tg-HDAC1基因编码的氨基酸进行功能域与结构域的预测,用ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)程序搜索开放阅读框;DNAMAN 软件进行氨基酸序列、蛋白质基本理化性质预测分析;采用SignalP4.1(http://www.cbs.dtu.dk/services/SignalP)预测该蛋白信号肽区域;NetPhos2.0工具(http://www.cbs.dtu.dk/services/NetPhos/)预测氨基酸磷酸化位点;ExPASy ProtScale(http://web.expasy.org/protscale/)在线分析蛋白质疏水性;蛋白质跨膜区用TMHMM 软件(http://www.cbs.dtu.dk/services/TMHMM)进行预测分析;Swiss Model软件(http://swissmodel.expasy.org/workspace/)进行蛋白质高级结构预测;据NCBI上公布的其他物种HDAC1的氨基酸序列,利用ClustalW进行氨基酸多序列比对;用MEGA 6.0软件中NJ(neighbor joining)法做进化分析。
2.2.3Tg-HDAC1基因内含子的克隆
用酚-氯仿法[17]提取6颗泥蚶闭壳肌基因组DNA,据已获得Tg-HDAC1基因的mRNA序列,设计特异性的引物(表1)利用Mastercycler ProS 梯 度 PCR 仪进行普通PCR扩增。PCR反应程序为:94℃ 5 min;94℃ 45 s,Tm45 s,72℃ 1 min,35个循环;72℃ 10 min。通过PCR产物割胶纯化、克隆测序获取该基因内含子的核苷酸序列。
2.2.4Tg-HDAC1基因 mRNA在泥蚶不同组织、不同发育时期的表达分析
用Trizol法提取泥蚶6个组织(血液、内脏团、外套膜、鳃、斧足和闭壳肌,n=3)和9个发育时期样品(成熟卵子、2-4细胞、囊胚、原肠胚、担轮幼虫、D形幼虫、壳顶幼虫、眼点幼虫及稚贝,n>500)总RNA,按照反转录试剂盒说明书反转录合成cDNA。根据cDNA 全长序列及内含子的位置设计引物REAL-HDAC1-F和REAL-HDAC1-R(表1),以18sRNA 基因为内参,利用ABI 7500Fast进行Tg-HDAC1基因在成贝不同组织定量表达,每个样本取3个平行检测。荧光定量PCR反应条件:95℃ 20 s;95℃ 3 s,60℃ 15 s,72℃ 10 s,40个循环。采用相对值2-ΔΔCt法对该基因的相对表达量进行分析,SPSS 20.0软件进行数据统计分析。
3结果
3.1Tg-HDAC1基因cDNA序列分析
Tg-HDAC1基因cDNA序列全长为2 275 bp(Genbank登录号:KP250871 ),其中5′非编码区(5′-UTR)26 bp,开放阅读框(ORF)1 587 bp,编码528个氨基酸,3′非编码区(3′-UTR)662 bp。3′-UTR存在1个终止密码子TAA,加尾信号AATAAA及polyA尾巴,其中加尾信号AATAAA与polyA尾巴相距246 bp(图1)。
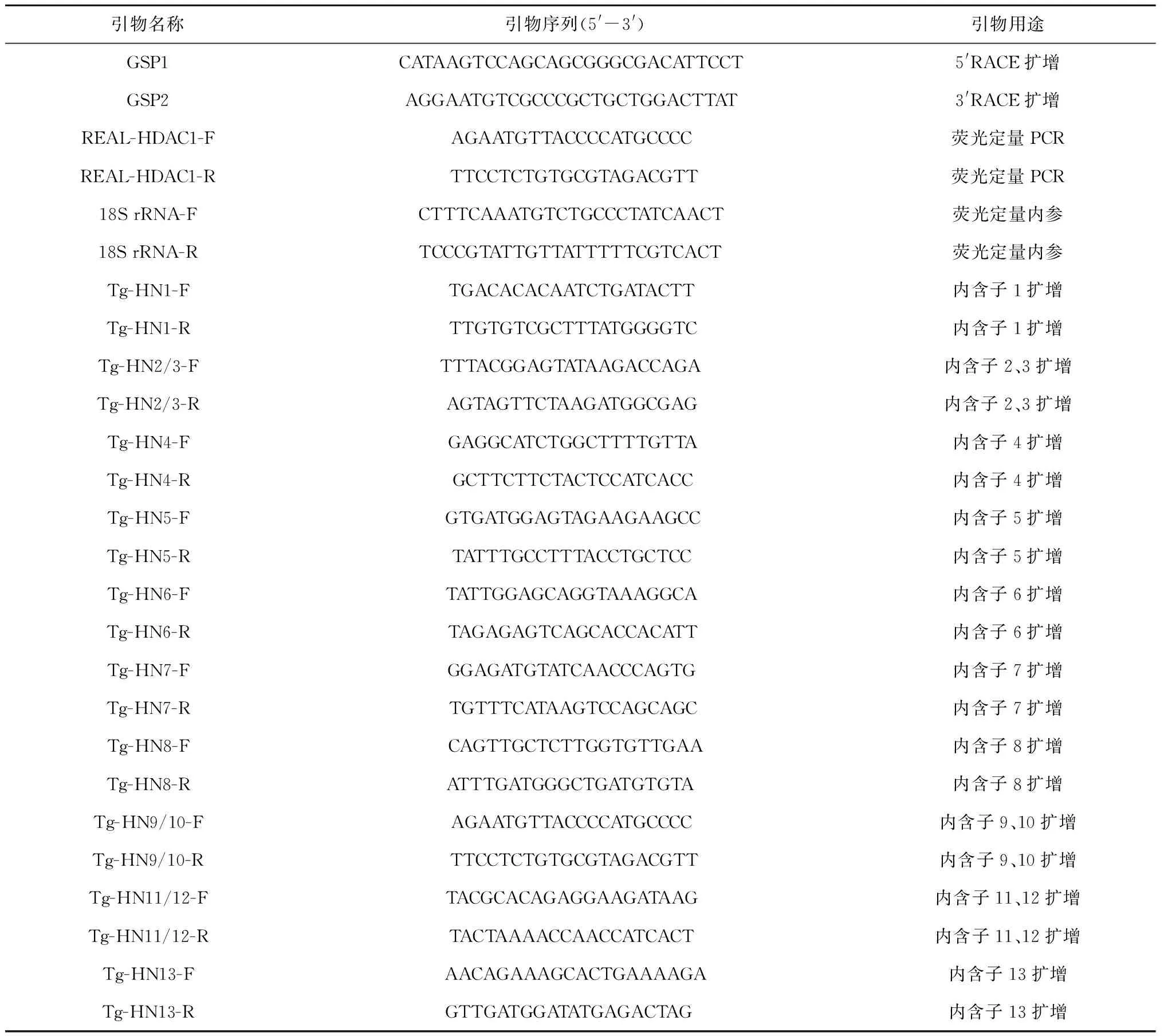
表1 实验所用引物汇总

图1 Tg-HDAC1基因的cDNA全长序列与推导的氨基酸序列Fig.1 The full-length cDNA sequence of HDAC1 gene and deduced amino acid sequence in T.granosa方框区域分别代表基因的起始密码子、终止密码子与加尾信号,*代表蛋白翻译结束,下划线部分表示polyA尾巴,灰色阴影部分为HDAC1超家族保守区域,代表金属Zn结合位点The letters boxes are the start codon, the stop codon and the polyadenylation signal sequence. The* represents the end of the protein translation,and the underlined part is polyA. The conserved domain is shaded gray, is Zn binding site
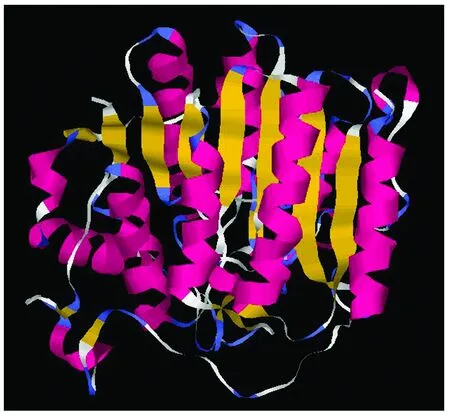
图2 Tg-HDAC1蛋白的高级结构预测图Fig.2 The prediction of protein tertiary structure of Tg-HDAC1α-螺旋为深红色;β-折叠为黄色;转角为淡蓝色;其他残基的颜色为白色Red represents the alpha-helix, yellow represents the beta-sheet, blue represents the turn, other residues is white
DNAMAN软件分析显示,Tg-HDAC1蛋白分子量为59.91 kDa,理论等电点pI=5.65;在线软件SignalP 4.1、TMHMM分析发现Tg-HDAC1基因编码的蛋白质无明显的信号肽区域和跨膜区域;ExPASy ProtScale预测显示组成该蛋白的氨基酸中亲水性氨基酸占主导,表现为亲水性;软件预测表明,Tg-HDAC1蛋白包含丝氨酸、苏氨酸及酪氨酸磷酸化位点个数分别为25、10、11;NCBI Blast分析序列的功能域和结构域显示该蛋白包含HDAC保守结构域,并在保守序列含有金属Zn结合位点。
用Swiss Model软件预测表明,Tg-HDAC1蛋白由17个α-螺旋和17个β-折叠片组成,β-折叠片基本平行排列(图2),此排列方式或许对维持蛋白的稳定性具有作用。
3.2Tg-HDAC1基因与其他物种的同源比对及系统进化分析
氨基酸序列比对结果表明,Tg-HDAC1蛋白序列与斑马鱼、鸡、小鼠等脊椎动物同源性都在80%以上,表现出高度的保守性(图3)。用MEGA6.0软件构建系统进化树显示,泥蚶和无脊椎动物紫色球海胆亲缘关系最近,其次为头索动物门文昌鱼。人、猕猴、牛、藏羚羊及鼠高等动物聚在一起,再与鸟纲的鸡、两栖纲的非洲爪蟾、鱼纲的斑马鱼形成脊椎动物的一大分支(图4)。

图3 不同物种HDAC1氨基酸序列比对Fig.3 Amino acid sequence alignment of HDAC1 between T. granosa and other speciesTg:泥蚶;Xl:非洲爪蟾;Sp:紫色球海胆;Mm:小鼠;Bt:牛;Hs:人;Ph:藏羚羊;Gg:鸡;Dr:斑马鱼;Ma:猕猴;Rn:褐家鼠;Bf:文昌鱼Tg:Tegillarca granosa;Xl:Xenopus laevis;Sp:Strongylocentrotus purpuratus;Mm:Mus musculus;Bt:Bos taurus;Hs:Homo sapiens;Ph:Pantholops hodgsonii;Gg:Gallus gallus;Dr:Danio rerio;Ma:Macaca mulatta;Rn:Rattus norvegicus;Bf: Branchiostoma floridae
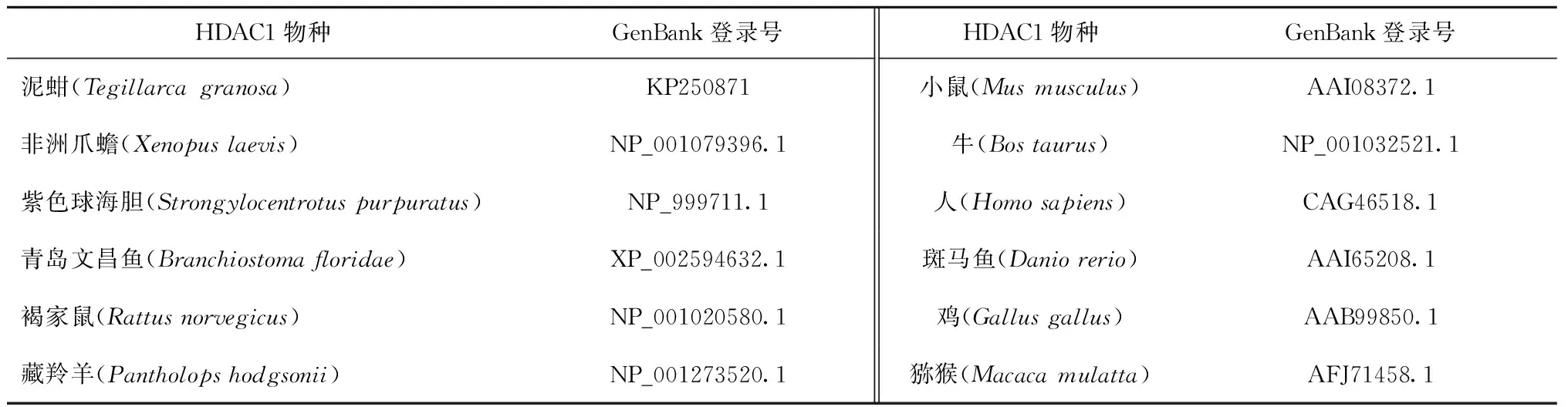
HDAC1物种GenBank登录号HDAC1物种GenBank登录号泥蚶(Tegillarcagranosa)KP250871小鼠(Musmusculus)AAI08372.1非洲爪蟾(Xenopuslaevis)NP_001079396.1牛(Bostaurus)NP_001032521.1紫色球海胆(Strongylocentrotuspurpuratus)NP_999711.1人(Homosapiens)CAG46518.1青岛文昌鱼(Branchiostomafloridae)XP_002594632.1斑马鱼(Daniorerio)AAI65208.1褐家鼠(Rattusnorvegicus)NP_001020580.1鸡(Gallusgallus)AAB99850.1藏羚羊(Pantholopshodgsonii)NP_001273520.1猕猴(Macacamulatta)AFJ71458.1
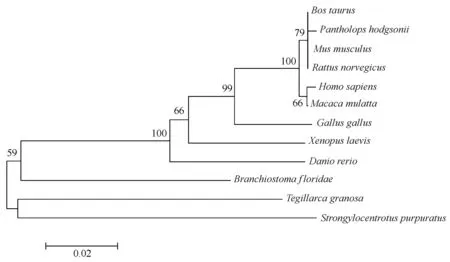
图4 利用MEGA6.0 NJ法构建的HDAC1系统进化树Fig.4 Phylogenetic tree of HDAC1 amino acid sequences by NJ method using MEGA6.0 software
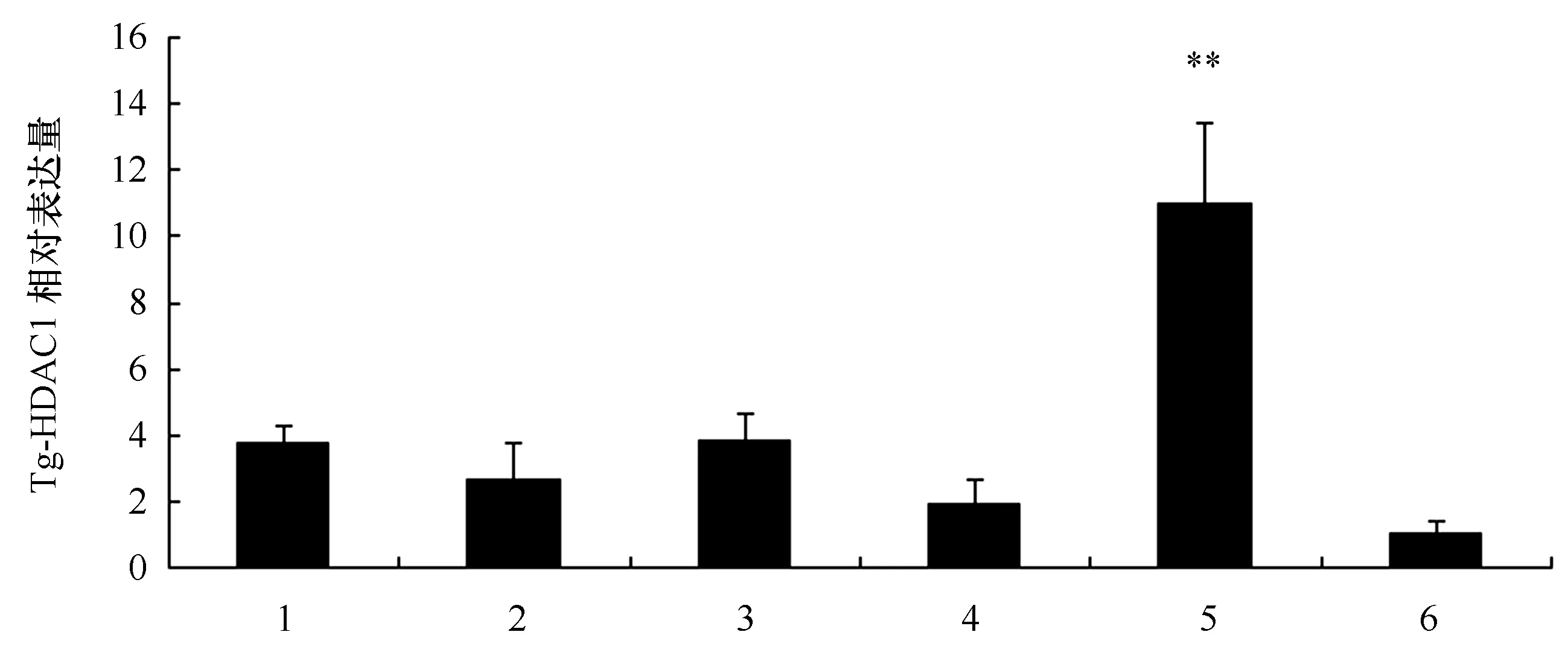
图5 泥蚶不同组织中Tg-HDAC1基因表达差异性分析(n=3)Fig.5 Analysis of expression difference of Tg-HDAC1 gene in different tissues of T. granosa (n=3)1.内脏团;2.外套膜;3.闭壳肌;4.血液;5.斧足; 6.鳃;**代表差异极显著(P<0.01)1. Visceral mass; 2.mantle; 3.adductor muscle; 4.blood 5.foot ; 6.gill;** represents very significant differences(P<0.01)
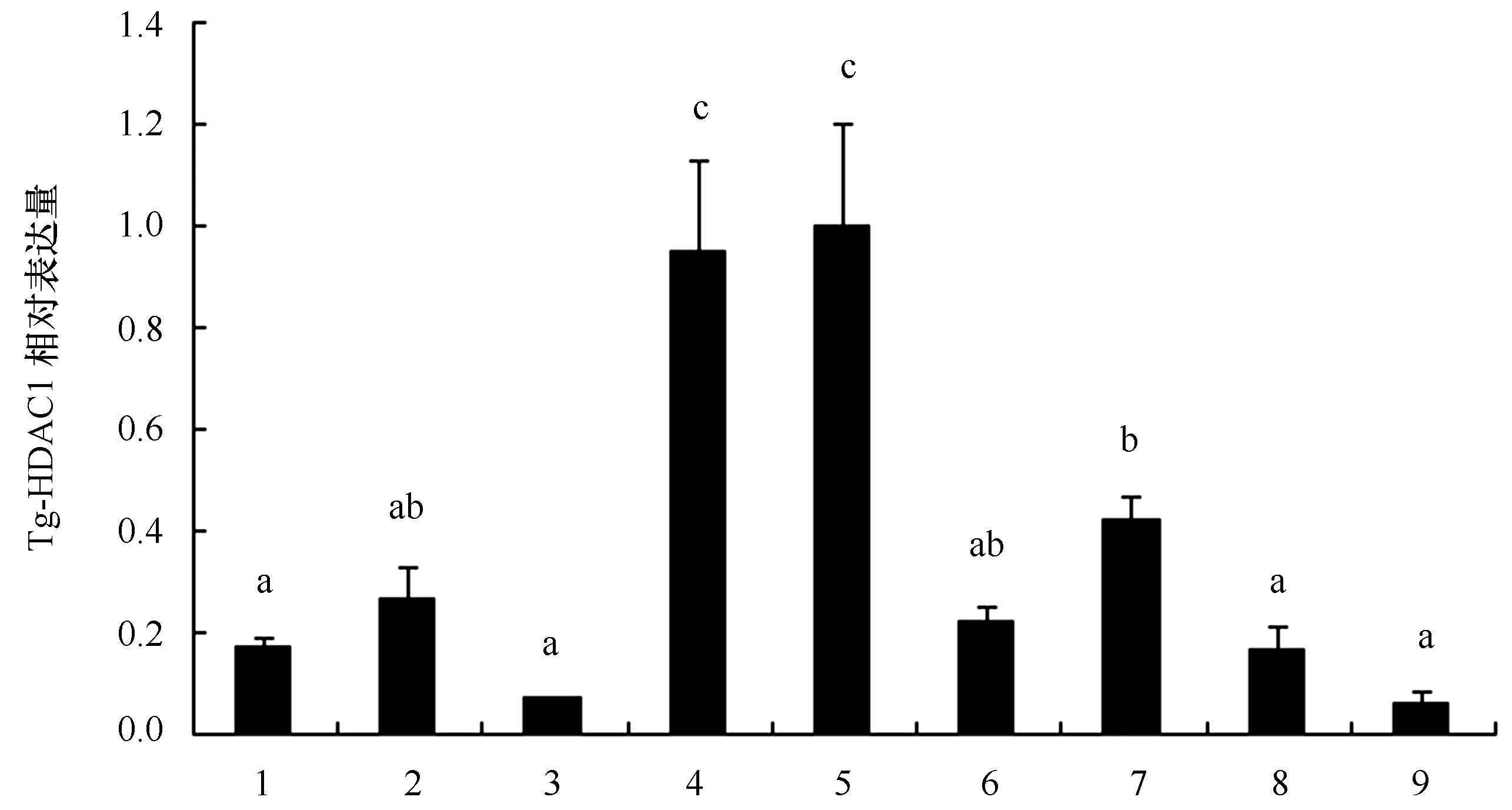
图6 Tg-HDAC1基因不同发育时期表达差异性分析Fig.6 Analysis of expression difference of Tg-HDAC1 gene in different developmental stages of T. granosa1.成熟卵子;2.2-4细胞;3.囊胚;4.原肠胚;5.担轮幼虫;6.D形幼虫;7.壳顶幼虫;8.眼点幼虫;9.稚贝;不同字母代表差异显著(P<0.05)1. Mature eggs; 2. 2-4 cells; 3.blastula; 4. Gastrulae; 5. trochophore; 6. D-shaped larva;7. umbo larvae; 8. eyebot larva;9. juvenile clams, different letters represent significant differences, P<0.05

图7 Tg-HDAC1基因结构图Fig.7 Genomic DNA structure of Tg-HDAC1 gene外显子、内含子分别用方框和线条标示,E代表外显子,I代表内含子。方框上的数字代表每个外显子的碱基数,线条下方的数字代表内含子的碱基数The box and the lines represent the exons and introns respectively.The letter E and I indicates the exon and introns. The number on the box and below the line represent the size of each exon and introns
3.3泥蚶不同组织与不同发育时期Tg-HDAC1表达差异性分析
用qRT-PCR技术检测了Tg-HDAC1基因在泥蚶6个组织的表达情况。结果显示,Tg-HDAC1基因在各个组织中均有不同程度的表达,其中斧足中表达量相对最高,与其余各组织间存在极显著性差异(P<0.01)(图5)。
Tg-HDAC1基因在泥蚶的9个发育时期均有不同程度的表达,从成熟卵子呈逐步升高的趋势,而在原肠胚和担轮幼虫时期的表达量最高,显著高于其他发育时期(P<0.05),在眼点幼虫和稚贝时期表达量显著性降低(P<0.05)(图6)。
3.4Tg-HDAC1基因内含子序列分析
克隆得到Tg-HDAC1基因的全部内含子序列,且外显子与内含子结合处序列遵循-AT/GT-原则,即都属于GT-AG-内含子。Tg-HDAC1基因共有14个外显子,13个内含子,序列总长度为10 499 bp。其中9号外显子最长为168 bp,13号外显子最短,为32 bp,其余外显子长度在72~165 bp之间;1号内含子最长,为1 293 bp,12号内含子最短,为193 bp,其余内含子长度在203~926 bp之间(图7)。
4讨论
组蛋白乙酰化主要由组蛋白乙酰化酶(HATs)与组蛋白去乙酰化酶(HDACs)催化完成,与基因表达调控密切相关[18]。HDACs有4大类18个亚型,目前研究主要集中在HDAC1[19]。本实验成功获得Tg-HDAC1 基因的cDNA全长序列,其编码的氨基酸序列与鸡、小鼠等脊椎动物的HDAC1蛋白具有高度同源性,聚类结果也表明,泥蚶与无脊椎动物如紫色球海胆、文昌鱼亲缘关系较近,与脊椎动物亲缘关系较远,这与系统形态学上的分类基本一致。NCBI Blastx分析显示,Tg-HDAC1 蛋白包含HDAC保守结构域,推测该区域是HDAC1调控组蛋白去乙酰化程度的关键区域[20]。
内含子是指断裂基因中的非编码区序列,在编码蛋白质前被去除。一直以来,研究者们对基因功能的研究主要集中在编码序列,而对内含子序列的研究较少。高通量技术的出现,使得许多物种的基因组序列逐渐呈现,内含子序列占基因组序列的绝大部分,且与许多重要功能相关,因此发现和深入挖掘其与基因功能的相关性就显得非常必要。近年来,已开展了一些动物内含子与性状的相关性研究,如在猪的脂肪性脂肪酸结合蛋白(A-FABP)基因内含子1发现了与其肉质性状相关的SNP多态位点[21];牛HDAC1基因内含子10~11中存在SNP多态位点与其屠宰性状相关[22];鲶鱼(Suckermouthcatfishes)生长激素基因内含子在物种系统发育中具有重要作用[23]等。有关海洋贝类内含子的研究也有报道,如包永波[24]搜索了海湾扇贝(Argopectenirradias)超氧化物歧化酶(SOD)基因部分内含子区域的SNP位点;郭慧慧[25]克隆并分析了栉孔扇贝(Chlamysfarreri)转化生长因子β家族基因中内含子SNP位点与生长性状的相关性;李璐[26]克隆并分析了合浦珠母贝(Pinctadamartensii)α-淀粉酶基因的内含子结构特征。本研究成功克隆得到Tg-HDAC1 8 224 bp内含子序列,序列分析表明,所获得的内含子核苷酸序列均符合“以GT开头,以AG结尾”的规则,这是真核生物RNA正确剪切所必需的识别位点。在不同物种中,有些基因的内含子数目是高度可变的,如淀粉酶基因在果蝇中没有内含子或数目极少,但在凡纳对虾(PenaeusvannameiBoone)中却发现有9个内含子[27],这可能是在长期物种进化过程中形成的。HDAC1基因内含子数目在不同物种中略有差异,如在人、猴和牛等脊椎动物中包含14个内含子,在鼠、非洲爪蟾及斑马鱼等中却发现有13个内含子,而在泥蚶Tg-HDAC1基因中扩增出13个内含子,均存在于开放阅读框中,与其他物种差异不大。
HDAC1基因在早期胚胎发育中有重要的调节作用[1],敲除该基因或使其碳末端发生突变都会导致小鼠早期胚胎发育异常[28]。HDAC1基因还参与牙鲆冠状幼鳍、鳍条、肠道等多种器官的发育调控以及变态阶段眼睛移动的过程[11]。在泥蚶中,检测发现Tg-HDAC1基因在不同发育时期均有表达,而原肠胚、担轮幼虫期表达量显著高于其他时期,这两个时期是胚胎组织、器官形成的重要时期,细胞分裂快速,生命活动旺盛,可能需要更多的Tg-HDAC1基因来调节胚胎发育过程。眼点幼虫与稚贝时期各组织、器官构建已基本完成,基因表达量较低。
有研究显示,HDACs和HATs以重塑染色质的
方式直接或间接地结合于MyoD或MEF2基因的调控序列,影响MyoD或MEF2及其下游基因的表达,进而调节肌肉的生肌过程[29]。Tg-HDAC1基因组织表达结果发现,其在泥蚶斧足中表达量显著地高于其他组织。斧足是泥蚶主要的运动器官[30],Tg-HDAC1基因的高表达可能与其富含肌肉、生肌活动较为频繁有关。另外,斧足占据泥蚶软体部的很大部分,Tg-HDAC1基因的高表达推测其对软体部生长具有重要调节作用,可作为泥蚶生长相关的重要候选基因。
参考文献:
[1]王中伟. HDAC1基因在牛卵母细胞和早期克隆胚胎发育中的作用[D]. 长春: 吉林大学, 2011.
Wang Zhongwei. Function of HDAC1 gene during the development of bovine oocytes and cloned embryos[D]. Changchun: Jilin University, 2011.
[2]Dufourcq P, Victor M, Gay F, et al. Functional requirement for histone deacetylase 1 inCaenorhabditiselegansgonadogenesis[J]. Mol Cell Biol, 2002, 22(9): 3024-3034.
[3]Mannervik M, Levine M. The Rpd3 histone deacetylase is required for segmentation of theDrosophilaembryo[J]. Proc Natl Acad Sci U S A, 1999, 96(12): 6797-6801.
[4]Nambiar R M, Henion P D. Sequential antagonism of early and late Wnt-signaling by zebrafishcolgatepromotes dorsal and anterior fates[J]. Dev Biol, 2004, 267(1): 165-180.
[5]Taunton J, Hassig C A, Schreiber S L. A mammalian histone deacetylase related to the yeast transcriptional regulator Rpd3p[J]. Science, 1996, 272(5260): 408-411.
[6]Sun Jianming, Chen Houyu, Moniwa M, et al. Purification and characterization of chicken erythrocyte histone deacetylase 1[J]. Biochemistry, 1999, 38(18): 5939-5947.
[7]Ye X, Robinson J A B, Jiang Z, et al. Polymorphisms of histone deacetylase 1 and 3 genes and fatty acid binding protein 3 and 4 genes and their associations with economic traits in swine[C]//Proceedings of the 7th World Congress on Genetics Applied to Livestock Production. Montpellier, France: Institut National de la Recherche Agronomique (INRA), 2002.
[8]柳小春, 肖调义, 何伟光, 等. 猪生长及胴体性状3个相关基因座遗传效应[J]. 中国农业科学, 2009, 42(2): 742-747.
Liu Xiaochun, Xiao Tiaoyi, He Weiguang, et al. Genetic effect of three loci related with growth and carcass traits in swine[J]. Scientia Agricultura Sinica, 2009, 42(2): 742-747.
[9]刘芳, 格日力. 藏羚羊组蛋白去乙酰化酶1基因编码区的克隆与序列分析[J]. 兽类学报, 2011, 31(4): 396-403.
Liu Fang, Ge Rili. Cloning and sequencing of HDAC1 coding cDNA sequence from Tibetan antelope (Pantholopshodgsonii)[J]. Acta Theriologica Sinica, 2011, 31(4): 396-403.
[10]何桦, 刘贺贺, 王浩瀚, 等. 鸭HDAC1基因编码区的分子克隆及生物信息分析[J]. 中国畜牧杂志, 2013, 49(9): 6-10.
He Hua, Liu Hehe, Wang Haohan, et al. Cloning and bioinformatics analysis of HDAC1 gene encoding region of duck[J]. Chinese Journal of Animal Science, 2013, 49(9): 6-10.
[11]李慧, 徐义平, 鲍宝龙. 牙鲆胚后发育阶段HDAC1基因的空间表达[J]. 上海海洋大学学报, 2014, 23(5): 641-648.
Li Hui, Xu Yiping, Bao Baolong. Different expression pattern of HDAC1 before and during the process of metamorphosis inParalichthysolivaceus[J]. Journal of Shanghai Ocean University, 2014, 23(5): 641-648.
[12]Bao Yongbao, Wang Qing, Liu Haoming, et al. A small HSP gene of bloody clam (Tegillarcagranosa) involved in the immune response againstVibrioparahaemolyticusand lipopolysccharide[J]. Fish & Shellfish Immunology, 2011, 30(2): 729-733.
[13]汪青, 林志华, 包永波, 等. 泥蚶(Tegillarcagranosa)血红蛋白基因(Tg-HbIIA)克隆、分析及免疫表达研究[J]. 海洋与湖沼, 2012, 43(1): 88-94.
Wang Qing, Lin Zhihua, Bao Yongbo, et al. Clone and analysis of hemoblobin gene (Tg-HbIIA) and immune expression research inTegillarcagranosa[J]. Oceanologia et Limnologia Sinica, 2012, 43(1): 88-94.
[14]李佩芬, 林志华, 包永波. 泥蚶基质金属蛋白酶组织抑制因子3基因的克隆及镉免疫表达研究[J]. 水产学报, 2015, 39(3): 336-344.
Li Peifen, Lin Zhihua, Bao Yongbo. A novel tissue inhibitor of metalloproteinase 3 in blood clamTegillarcagranose: molecular cloning and immune-related research of Cd[J]. Journal of Fisheries of China, 2015, 39(3): 336-344.
[15]董迎辉, 项翔, 姚韩韩, 等. 泥蚶(Tegillarcagranosa)生长因子受体结合蛋白2(GRB2)基因的克隆与表达分析[J]. 海洋与湖沼, 2013, 44(4): 937-943.
Dong Yinghui, Xiang Xiang, Yao Hanhan, et al. Cloning and expression of GRB2 gene from the blood clamTegillarcagranosa[J]. Oceanologia et Limnologia Sinica, 2013, 44(4): 937-943.
[16]钱雪骏, 董迎辉, 姚韩韩, 等. 泥蚶Smad1/5基因cDNA全长克隆及时空表达特征分析[J]. 水产学报, 2015, 39(9): 1302-1312.
Qian Xuejun, Dong Yinghui, Yao Hanhan, et al. Cloning and spatiotemporal expression analysis of Smad1/5 gene in the blood clamTegillarcagranosa[J]. Journal of Fisheries of China, 2015, 39(9): 1302-1312.
[17]Sambrook J, Russell D W. Molecular cloning: a laboratory manual[M]. 3rd ed. New York: Cold Spring Harbor Laboratory Press, 2001.
[18]Kouzarides T. Histone acetylases and deacetylases in cell proliferation[J]. Curr Opin Genet Dev, 1999, 9(1): 40-48.
[19]Witt O, Deubzer H E, Milde T, et al. HDAC family: what are the cancer relevant targets?[J]. Cancer Lett, 2009, 277(1): 8-21.
[20]Hoxha E, Lambers E, Xie Hehuang, et al. Histone deacetylase 1 deficiency impairs differentiation and electrophysiological properties of cardiomyocytes derived from induced pluripotent cells[J]. Stem Cells, 2012, 30(11): 2412-2422.
[21]Gao Yan, Zhang Yonghong, Zhang Shumin, et al. Association ofA-FABPgene polymorphism in intron 1 with meat quality traits in Junmu No. 1 white swine[J]. Gene, 2011, 487(2): 170-173.
[22]杨颖. HDAC1基因多态位点与肉牛部分经济性状的相关性分析[D]. 南宁: 广西大学, 2012.
Yang Ying. Study of the HDAC1 gene SNP and its correlation with partical economic traits in cattle[D]. Nanning: Guangxi University, 2012.
[23]Schmidt R C, Bart Jr H L, Nyingi D W, et al. Phylogeny of sucker mouth catfishes (Mochokidae:Chiloglanis) from Kenya: the utility of Growth Hormone introns in species level phylogenies[J]. Molecular Phylogenetics and Evolution, 2014, 79: 415-421.
[24]包永波. 海湾扇贝超氧化物歧化酶家族基因结构、表达和多态性分析[D]. 青岛: 中国科学院海洋研究所, 2009.
Bao Yongbo. Superoxide dismutase multigene family in bay scallopArgopectenirradians: gene structures, expression and polymorphism[D]. Qingdao: The Institute of Oceanology, Chinese Academy of Sciences, 2009.
[25]郭慧慧. 栉孔扇贝TGF-β/Smad信号通路基因的克隆、表达分析及生长性状相关SNP位点筛查[D]. 青岛: 中国海洋大学, 2012.
Guo Huihui. TGF-β/Smad signaling pathway genes: molecular cloning, expression analysis and SNPs associated with growth traits in Zhikong scallop (Chlamysfarreri)[D]. Qingdao: Ocean University of China, 2012.
[26]李璐. 合浦珠母贝α-淀粉酶基因结构、SNP筛选、生长关联与生态响应研究[D]. 上海: 上海海洋大学, 2013.
Li Lu. Genomic structure, SNP screening, growth association and ecological response of α-amylase gene in the pearl oysterPinctadafucata[D]. Shanghai: Shanghai Ocean University, 2013.
[27]Sellos D Y, Van Wormhoudt A. Structure of the of α-amylase genes in crustaceans and molluscs: evolution of the exon/intron organization[J]. Biologia, Bratislava, 2002, 57(S11): 191-196.
[28]Montgomery R L, Davis C A, Potthoff M J, et al. Histone deacetylases 1 and 2 redundantly regulate cardiac morphogenesis, growth, and contractility[J]. Genes & Development, 2007, 21(14): 1790-1802.
[29]McKinsey T A, Zhang Chunli, Olson E N. Control of muscle development by dueling HATs and HDACs[J]. Curr Opin Genet Dev, 2001, 11(5): 497-504.
[30]常亚青. 贝类增养殖学[M]. 北京: 中国农业出版社, 2007.
Chang Yaqing. Mollusc Culture[M]. Beijing: China Agriculture Press, 2007.
收稿日期:2015-10-23;
修订日期:2016-04-06。
基金项目:国家现代贝类产业技术体系项目(CARS-48);浙江省自然科学基金重点项目(LZ12C19001); 浙江省重大科技专项(2012C12907-4);国家水产种质资源平台项目(2015DKA30470)。
作者简介:任付真(1988-),女,山东省定陶县人,主要从事海洋贝类分子遗传研究。E-mail:renpiaoyu@126.com *通信作者:林志华(1965-),研究员。E-mail:zhihua9988@126.com
中图分类号:S917.4
文献标志码:A
文章编号:0253-4193(2016)08-0073-10
cDNA, introns cloning and spatiotemporal expression analysis of HDAC1 gene in Tegillarca granosa
Ren Fuzhen1,2,Yao Hanhan2,Dong Yinghui2,Zhou Xiaolong1,Lin Zhihua2
(1.CollegeofFisheriesandLifeSciences,ShanghaiOceanUniversity,Shanghai201306,China;2.KeyLaboratoryofAquaticGermplasmResourceofZhejiang,CollegeofBiological&EnvironmentalSciences,ZhejiangWanliUniversity,Ningbo315100,China)
Abstract:As an important member of HDACs family, HDAC1 can regulate gene expresstion and play a crucial role in cell differentiation and early embryonic development. Tg-HDAC1 cDNA was cloned by SMART RACE technique and then the bioinformatics, expression analysis, and intron amplification of Tg-HDAC1 were carried out in Tegillarca granosa. The full length of Tg-HDAC1 cDNA was 2 275 bp, containing a complete 1 587 bp ORF encoding 528 amino acids. The homologous similarity between the blood clam and other species, such as Danio rerio, Gallus gallus, Mus musculus, was more than 80%, which indicate that HDAC1 is relatively conserved in the evolution. Thirteen introns of Tg-HDAC1 were amplified in ORF, which all of them follow the principle of GT-AG. The results of six tissue-specific expression by real time PCR showed that Tg-HDAC1 gene expressed in all tissues, and the expression of foot were significantly higher than other tissues(P<0.01), which suggest that the gene play an important role in the course of foot growth. The relative expression in different stages revealed that the expression of Tg-HDAC1 gradually increased with the process of the development, and showed the highest in trochophore stage (P<0.05).
Key words:Tegillarca granosa; HDAC1; gene cloning; intron; expression analysis
任付真,姚韩韩,董迎辉,等. 泥蚶HDAC1基因cDNA全长、内含子克隆及时空表达特征分析[J].海洋学报,2016,38(8):73—82, doi:10.3969/j.issn.0253-4193.2016.08.008
Ren Fuzhen,Yao Hanhan,Dong Yinghui, et al. cDNA, introns cloning and spatiotemporal expression analysis of HDAC1 gene inTegillarcagranosa[J]. Haiyang Xuebao,2016,38(8):73—82, doi:10.3969/j.issn.0253-4193.2016.08.008

